胰腺导管腺癌典型及变异影像与病理对照
陆建平, 边云
胰腺导管腺癌典型及变异影像与病理对照
陆建平, 边云
胰腺癌; 胰腺导管腺癌; 体层摄影术, X线计算机;磁共振成像; 病理学
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是最具有侵袭性的人类恶性肿瘤之一,占外分泌胰腺肿瘤的80%~90%,进展隐匿、临床症状出现晚、生长迅速。各种影像学检查成为检出PDAC最主要的手段,充分认识它的各种影像学表现尤为重要。目前,以疾病为中心的多学科、多种技术联合的医疗模式给影像科医生带来了前所未有的机遇。然而,检查设备的高端化、多样化,分子病理学的飞跃发展,对影像医生的诊断也提出了更高的挑战,影像医生不仅需要从病理学角度深刻掌握PDAC的影像特征,更需要从临床多学科角度对疾病做出全面评估。本文基于我院大量的PDAC标本及相关病理学特征,就PDAC的各种影像学表现做一详述,旨在提高对该病全面、深刻的认识。
PDAC的典型影像学表现与病理相关性
1.肿块的形态、边界和大小
PDAC肉眼观为灰白色、实性、质硬的类圆形肿块,肿块无包膜,向周围浸润、与周围组织分界欠清;当肿块导致周围阻塞性炎症时,使得无论肉眼还是影像都很难辨别出肿瘤实际的边界。胰头部肿块因为空间狭窄,很容易造成梗阻性黄疸,所以发现时体积一般不大,而胰体尾部肿块发现时通常较胰头部肿块更大。影像上肿瘤表现为无包膜、边界欠清楚的类圆形肿块,胰周脂肪层不规则或消失(图1)。
2.肿块内部特征
PDAC主要由三种成分组成:一是肿瘤细胞,二是肿瘤间质,三是残留的正常胰腺组织。其中肿瘤间质主要成分为纤维母细胞、胶原纤维和炎症细胞(淋巴细胞和组织细胞)。通常肿瘤周围的胶原纤维排列稀疏,其内散在分布淋巴细胞和肿瘤细胞,而肿瘤中心的胶原纤维排列紧密,其内有数量不等的肿瘤细胞和大量纤维母细胞。肿瘤细胞在T1WI上呈低信号,在T2WI上呈相对高信号,平扫CT呈等或低密度;肿瘤间质在T1WI和T2WI上均呈低信号,平扫CT呈低密度;残留正常胰腺组织MRI和CT与正常胰腺组织的信号、密度相同。所以,PDAC的影像学表现取决于三者的比例。通常PDAC肿块在MRI上整体表现为T1WI信号低于正常胰腺组织,T2WI信号与正常胰腺组织接近或略高[1],在CT上表现为低或等密度(图2、3)。PDAC显著的促结缔组织增生和间质纤维化的生物学行为导致即便肿块体积较大,其内部也极少出现出血坏死和囊变,但可见局部黏液分泌,使得部分肿块T2WI呈较高信号,或者在CT上表现为更低密度区(图4)。
由于胰腺完全由动脉供血,因此增强后对比剂通过毛细血管的充盈遍布整个胰腺,正常胰腺显著强化,相对于正常胰腺组织,PDAC表现为乏血供,增强后动脉期(尤其是动脉晚期)表现为相对低信号或低密度,而肿块内部或边缘由于炎性反应,血管通透性增加,疏松排列的胶原纤维以及残留的正常胰腺组织,所以随着增强时间的延迟(门脉期或延迟期)肿瘤整体表现为逐渐强化,病灶周边有时表现更加明显,甚至超过周围正常的胰腺(图2、3)。
2.间接征象
间接征象包括:胰腺轮廓的改变,瘤体上游胰腺实质的萎缩,上游胰管和/或胆总管的扩张,肿瘤导致的局部潴留囊肿或假性囊肿。这些间接征象十分重要,有时在影像上尚无明确占位时即可出现,甚至是诊断PDAC的重要线索[2]。
胰腺轮廓的改变:胰腺为后腹膜脏器,位置深在,<2cm的小胰癌较难发现,肿块发现时大部分已突出于胰腺轮廓外,表现为胰腺局部的隆起(图5a、b)。
瘤体上游胰腺实质的萎缩:胰头、颈、体部胰腺癌由于肿瘤导致胰管阻塞,胰管内压力增高,胰腺血供和排泄受阻,导致胰体尾部梗阻性慢性胰腺炎,进而出现胰腺实质萎缩(图5a、b)。
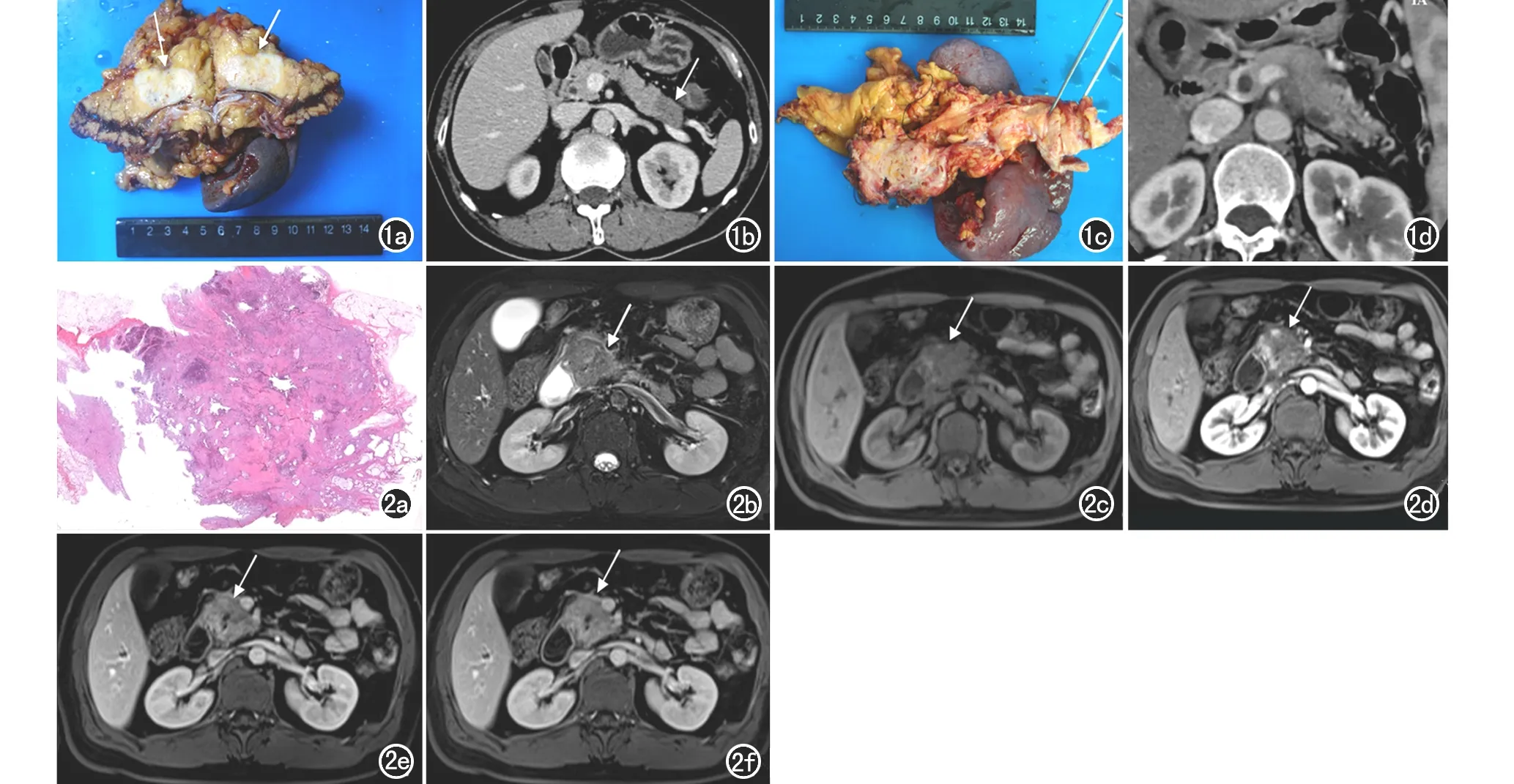
图1 PDAC的大体形态、边界影像与病理对照。a) 胰腺肿块切除大体图示胰尾部一枚肿块,肿块无包膜、灰白色、实性、边界欠清(箭); b) 图a对应胰腺实质期横轴面CT图像,可见胰尾部边界欠清的低密度肿块(箭); c) 胰腺肿块切除大体图示胰尾部呈灰白色,周围炎症致肿块边界模糊,无法分辨; d) 图c对应胰腺实质期横轴面CT图像,可见胰尾部边界模糊的低密度肿块,周围可见低密度炎性渗出区。 图2 以排列疏松的胶原纤维为主要成分的PDAC影像与病理对照。 a) 为胰头部肿块HE染色图,可见实体肿瘤内含有大量疏松排列的胶原纤维,胶原纤维内散在肿瘤细胞和大量淋巴细胞(×1,HE);b)胰腺横轴面T2WI示胰头部一枚类圆形、边界欠清的稍高信号影(箭);c) 胰腺横轴面T1WI示胰头部肿块呈低信号;d)增强扫描动脉期示病灶内部稍强化(箭);e)随着时间推移对比剂逐渐充盈,病灶强化程度较动脉期明显(箭);f)增强扫描延迟期示肿块几乎呈等信号(箭)。
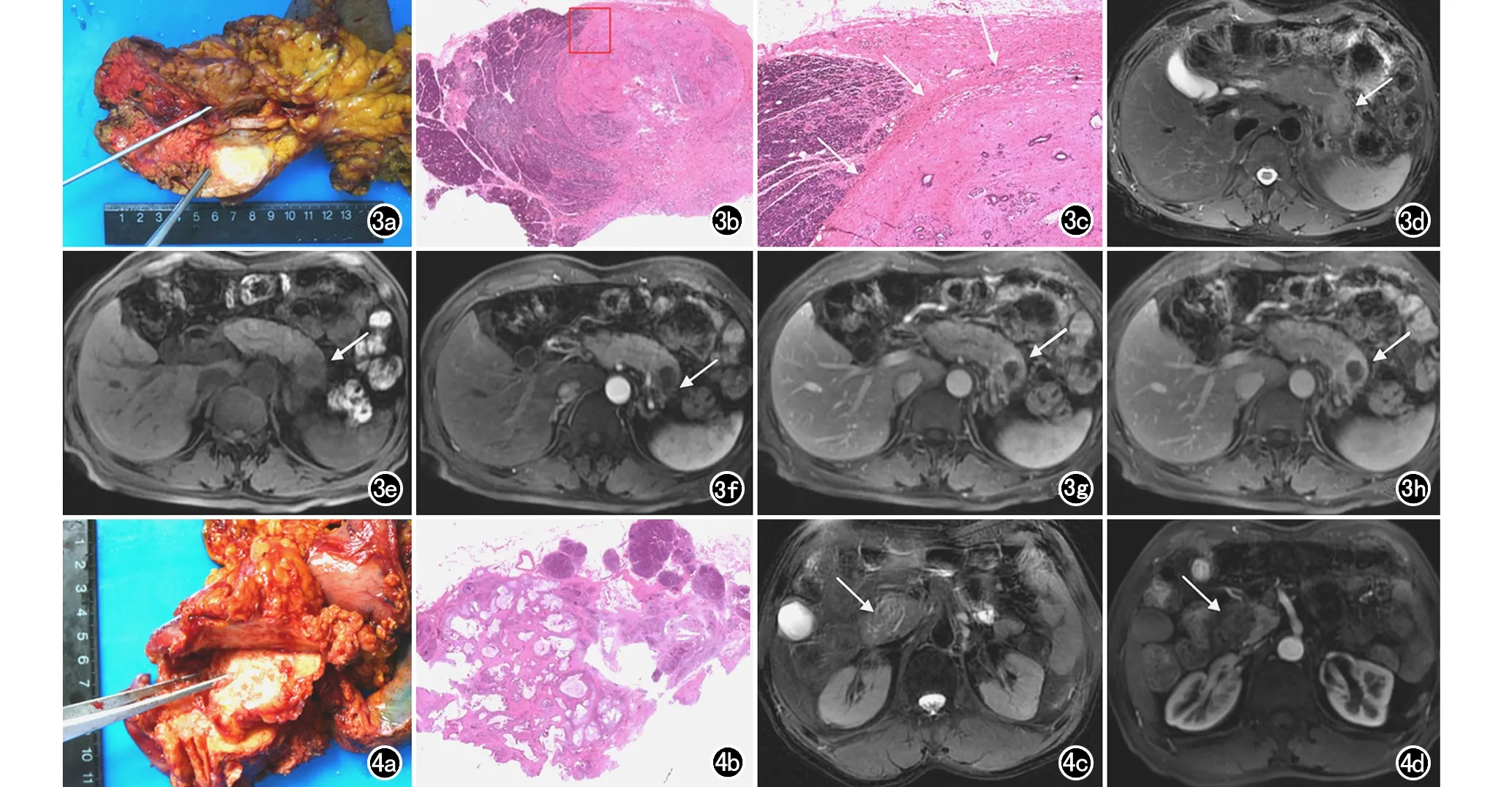
图3 肿瘤周围排列疏松的胶原纤维和大量炎细胞浸润导致环形强化的影像与病理对照。a) 大体图示胰尾部一枚灰白色、类圆形肿块; b) HE染色图可见肿块周围由排列稀疏的胶原纤维和淋巴细胞构成,肿块中心由排列致密的胶原纤维、纤维母细胞和肿瘤细胞构成(×1,HE);c) 为图b红框放大图,可见排列稀疏的胶原纤维和淋巴细胞(箭)(×2,HE); d) 胰腺横轴面T2WI示胰尾部一枚类圆形、边界欠清的稍高信号影(箭); e) 胰腺横轴面T1WI平扫示肿块呈低信号(箭); f) 动脉期示肿块强化不明显(箭); g) 胰腺实质期示肿块边缘轻度强化,中心无明显强化(箭); h) 延迟期示肿块边缘强化明显,中心无明显强化(箭)。图4 黏液丰富的PDAC影像与病理对照。a) 胰头部肿块的大体图像,其内可见较多黏液产生; b) 胰头部肿块的HE染色图,镜下可见肿块细胞内大量黏液分泌(×1,HE); c) 胰腺横轴面T2WI示胰头部一枚类圆形、边界欠清的较高信号影肿块(箭); d) 胰腺增强实质期横轴面图像,示胰头部肿块强化不明显,呈低信号(箭)。
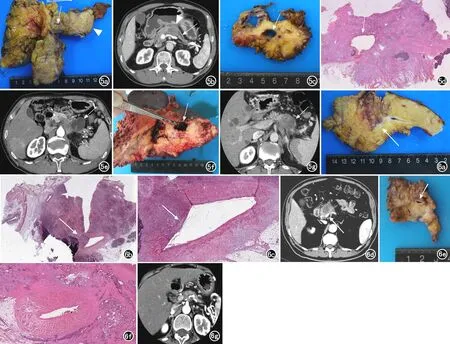
图5 PDAC的间接征象影像与病理对照。a) 胰体部肿块大体图像,可见胰体部肿块(箭头)突出于胰腺轮廓,同时导致胰体尾部萎缩,肿块上游胰管明显扩张(箭); b) 胰腺实质期横轴面CT图像,可见胰体部肿块(箭头)突出于胰腺轮廓,同时导致胰体尾部萎缩,肿块上游胰管明显扩张(箭); c)为胰体部肿块大体图像,可见胰体部一枚肿块导致局部潴留囊肿形成(箭),d)镜下可见囊肿内衬上皮细胞(箭);e)胰腺实质期横轴面图像可见胰体部低密度肿块及其附近液体密度潴留囊肿影(箭); f) 胰体部肿块大体图像,可见胰体灰白色肿块和附近充满血液的厚壁假性囊肿(箭); g) 胰腺实质期横轴面CT图像示胰体部低密度肿块和附近更低密度的假性囊肿影(箭)。 图6 PDAC可切除性评价的影像与病理对照。a) 胰头部肿块侵犯门静脉大体图; b)图a对应HE图,可见胰头部一枚肿块侵犯门静脉右侧壁(箭)(×1,HE); c) 图b门静脉局部放大图,可见门静脉壁大量肿瘤细胞浸润(箭)(×2,HE); d) 为其对应的胰腺实质期横轴面CT图像,可见胰头部肿块与门静脉接触<180°,影像判断为可切除; e) 胰颈部肿块大体图像,可见胰颈部一枚肿块侵犯腹腔动脉干(箭); f) 镜下可见腹腔动脉干旁大量肿瘤细胞(×1,HE); g) 为其对应的胰腺实质期横轴面CT图像,可见胰颈部肿块与腹腔动脉干接触<180°,影像判断为可能切除(箭)。
胰管和/或胆总管的扩张:PDAC不可避免地浸润到胆总管和/或胰管,引起两者梗阻扩张;位于胰头部的肿块,常引起两者同时扩张,出现典型的“双管征”;位于胰体尾部的肿块常引起上游胰管的扩张(图5a、b);位于钩突较下方或胰尾脾门附近的肿块可以无胰胆管扩张的表现。扩张的主胰管可表现为均匀扩张、串珠样扩张和不规则扩张。胆总管扩张表现为“软藤”样扩张。MDCT和磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)都可以非常好地显示胰胆管改变的特征。
肿瘤导致的局部潴留囊肿或假性囊肿:若肿块并发渗出性胰腺炎时可导致假性囊肿,胰管阻塞、胰液潴留导致潴留性囊肿,这些囊肿有时会导致忽视小肿块的存在,引起混淆或误诊(图5c~g)。
3.胰周血管改变及可切除性评价
近年来胰腺肿瘤外科迅速发展,手术治疗成为PC唯一有效的治疗手段[3]。肿瘤与血管之间的关系直接决定是否可以行手术切除,术前可切除性评价尤为重要,需结合横轴面平扫和多种三维后处理技术来评价血管与肿块之间的关系。美国腹部放射学会及美国胰腺协会制定的PDAC放射学结构化报告共识[4,5]认为评价的血管包括腹腔动脉干(celiac axis,CA)、肠系膜上动脉(superior mesenteric artery,SMA)、肝总动脉(common hepatic artery,CHA)、门静脉(portal vein,PV)、肠系膜上静脉(superior mesenteric vein,SMV)、腹主动脉(aortaventralis)和下腔静脉(postcava)。将每支血管与肿瘤的关系按照血管的种类和肿块的位置分别进行评价,并均划分为5个等级:1级,未接触;2级,接触范围≤180°且轮廓规则;3级,接触范围≤180°且轮廓不规则;4级,接触范围>180°且轮廓规则;5级,接触范围>180°且轮廓不规则。此外,还需要评价SMA第一分支、SMV第一引流支是否累及,CHA是否有变异及其与肿瘤间的关系,SMV内是否有栓塞和典型泪滴样改变,胰头周围、肝门部、肠系膜根部或左上腹是否有侧枝循环形成。肿块与胰周血管的关系需要通过多种三维后处理技术进行全面评价,MSCT主要的重建技术包括多平面重组(multi-planar reconstruction,MPR),最大密度投影(maximum intensity projection,MIP)、曲面重建(curved planar reconstruction,CPR)、容积再现(volume rendering,VR)。根据2015年美国国立综合癌症网络(NCCN)胰腺癌(pancreatic cancer,PC)临床实践指南(V2版)可切除性判断标准[6,7],将肿块是否可切除分为三个等级,分别为可切除、可能切除、不可切除(表1,图6)。

表1 2015年NCCN PC临床实践指南(V2版)可切除性判断标准
2.胰周淋巴结转移评价
PC术后淋巴结转移率高达56.0%~78.6%,即便是肿块直径<2 cm的小胰癌,其发生率也高达约50%[8]。一直以来影像学无法精确对淋巴结转移进行分期,但是影像图像对其诊断仍有一定的规律可循。日本胰腺病学会(JPS)将胰周淋巴结分为18组,每组淋巴结均与胰周血管伴行,具有明确的分布特征,胰头癌常发生6、8、13、14、17组淋巴结转移,胰体尾癌常发生8、9、10、11、18组淋巴结转移,并且研究表明第13组(胰十二指肠后组)为前哨淋巴结[9](图7)。在阅片时要根据胰腺肿块的位置,循着淋巴结分布路径仔细观察,当淋巴结表现为体积增大,密度不均匀,强化不均匀,内部有坏死、融合,边缘模糊[10]等特征时高度提示淋巴结转移。
3.胰周神经浸润评价
胰腺癌胰周神经浸润(perineural invasion,PNI)指肿瘤细胞包绕神经表面、侵犯神经外膜或进入神经束膜及以内,肿瘤细胞浸润神经鞘三层结构中的任意一层或肿瘤细胞包绕神经外周的1/3,均为神经侵犯[11](图8)。PNI在胰腺癌中的发生率高达80%~100%,是胰腺癌患者的独立预后指标[12,13]。近年来,虽然外科技术发展迅速,手术切除率显著提高,围手术期病死率和并发症发生率显著降低,但胰腺癌患者的远期预后并无明显改善,肿瘤复发仍然为影响疗效的重要因素之一,镜下系膜环缘神经浸润阳性发生率高达70%~100%,这些患者并未获得严格意义上的R0切除[14,15]。影像学对于PNI的诊断难度较高,Dal Pozza等[16]于1985年首次将MDCT运用于胰腺神经成像,此后较多学者对PNI的影像学评价进行了研究。PNI影像评价包括胰周六个神经丛,划分依据JPS胰周神经丛划分法(图4):①胰头神经丛第一部(PLX-1,来自腹腔神经节至钩突内上侧);②胰头神经丛第二部(PLX-2,来自SMA丛至钩突内上侧);③肝十二指肠韧带内神经丛(PLX-hdl);④肠系膜上动脉周围神经丛(PLX-sma);⑤右侧腹腔结神经丛(Rcg);⑥左侧腹腔结神经丛(Lcg)。上述6个神经丛按4个主要路径评价[17],PLX-1路径:门静脉后方自胰头到腹腔神经节;PLX-2路径:自胰十二指肠上后动脉(posterior superior pancreaticoduodenal artery,PIPDA)到肠系膜神经节;自胃十二指肠动脉(gastroduodenal artery,GDA)路径:自GDA到肝总动脉,最后止于腹腔神经节;肠系膜根部路径:小肠系膜或横结肠系膜(图9)。MSCT是诊断PNI最常用的方法,对PNI诊断的敏感度、特异度和准确率分别为100%、83.3%和94.6%[18]。这是因为胰周神经纤细,位置深在,走形不规则,只有通过薄层无间隔扫描和后期重建才可提高其可视化程度。PNI在MDCT上较为有价值的表现为在PNI受累途径所伴行的血管周围脂肪组织间隙变窄或消失,并伴有网状、束带状或不规则软组织[18]。相比MDCT,MRI对PNI的研究相对较少。
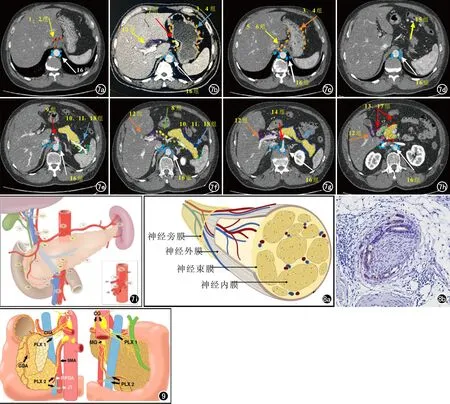
图7 日本胰腺病学会18组淋巴结分组在高分辨横轴面CT图像和大体解剖图像上的分布图(图7b为门脉期图像,其余均为动脉晚期CT图像);a)1贲门右组、2贲门左组、16主动脉旁组;b) 3胃小弯组、4胃大弯组、7胃左动脉周围组、12肝十二指肠韧带组、16主动脉旁组;c) 3胃小弯组、4胃大弯组、5胃网膜左、右动脉周围和幽门上组、6幽门下组、16主动脉周围;d) 15中结肠动脉周围、16主动脉周围;e) 9腹腔干周围组、10脾门组、11脾动脉周围组、16主动脉周围、18胰体下缘组;f) 8肝固有动脉周围组、10脾门组、11脾动脉周围组、12肝十二指肠韧带组、16主动脉周围、18胰体下缘组;g)12肝十二指肠韧带组、14肠系膜上动脉周围组、16主动脉周围、18胰体下缘组;h)12肝十二指肠韧带组、13胰十二指肠后组、16主动脉周围、17胰十二指肠前组;i)TNM分期中的8~18组淋巴结分组在大体解剖图像上的对应分布图。 图8 神经解剖和胰腺癌胰周神经浸润镜下表现。 a) 神经解剖示意图;b)肠系膜上动脉神经丛免疫组化CK19染色可见肿瘤细胞位于神经束膜和神经外膜之间的间隙。 图9 胰腺周围神经丛解剖和胰腺癌胰周神经浸润途径。CG:腹腔神经节;CHA:肝总动脉;GDA:胃十二指肠动脉;MG:肠系膜神经节;SMA:肠系膜上动脉;PLX1:胰头神经丛第一部;PLX2胰头神经丛第二部分;PIPDA十二指肠下后动脉;JT:空肠干 。
Zuo等[19]根据MRI胰周脂肪信号的改变将PNI分为3级,PNI 0级:胰周脂肪间隙无变化;PNI 1级:胰周脂肪间隙变窄或胰周血管间隙消失(包括CA、CHA、SMA、SMV、SA);PNI 2级:胰周脂肪间隙消失,胰外神经走行区域见不规则软组织块影。Hayano等[20]将磁共振扩散加权成像(diffusion magnetic resonance imaging,DWI)运用于PNI的诊断,该研究发现PNI的ADC值明显低于正常组织,能较好地诊断PNI。相关文献研究表明腹胰癌更易浸润PLX-I、PLX-II和PLX-sma,背胰癌更易浸润PLX-hdl和PLX-HCA[21],PNI和/或十二指肠侵犯者生存期较无PIN和/或十二指肠侵犯者明显缩短[22]。
4.胰周其它结构评价
肝脏为PDAC最常转移的脏器,影像常表现为动脉期无明显强化,门脉期和延迟期呈环形强化。MDCT的全容积扫描使得转移灶的检出率大大提高,动脉期及门脉期双期扫描对8~10 mm的肝转移灶的检出率为75%,延迟扫描可进一步提高<5 mm转移灶的检出率[23]。值得注意的是,有时小的囊性转移灶与肝脏小囊肿非常相似,易造成漏诊或误诊,此时DWI检查对此较有价值。PC的网膜转移一般表现为网膜和系膜粟粒样结节,腹膜不均匀增厚以及少量腹水均可提示此类转移。
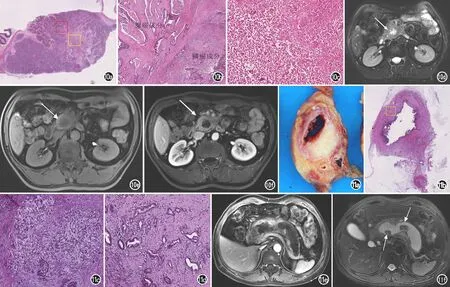
图10 胰腺腺鳞癌的影像与病理对照。a)胰腺腺鳞癌的HE染色图片,可见胰头部一枚肿块(×1,HE);b)为图a红框放大图像,可见肿块由鳞癌和腺癌两种成分组成(×20,HE);c)为图a黄框放大图像,可见肿块中心坏死区(×20,HE);d) 胰腺横轴面T2WI可见胰头部一枚类圆形、边界欠清的较高信号影,肿块中心可见高信号液体,为肿块内部坏死区(箭);e) 胰腺横轴面T1WI平扫图像示肿块呈低信号(箭),中心坏死区呈更低信号;f)实质期增强图像示实性成分强化,整个肿块呈环形强化(箭)。图11 胰腺黏液性非囊性癌的影像与病理对照。a)为位于胰尾部沿着主胰管垂直平面切下的大体标本,可见主胰管明显扩张,管壁不规则增厚,局部呈灰白色肿块,管腔内可见胶冻状黏液;b)为与图a对应的HE染色图像(×1,HE);c)为图b红框放大图像,可见肿块内侵袭的黏液成分(×20,HE);d)为图b黄框放大图像,可见肿块内导管腺癌成分(×20,HE);e) 胰腺横轴面T1WI实质期增强图像,可见整个胰腺主胰管显著扩张,胰腺实质萎缩,管壁不规则增厚并强化;f)T2WI图像示在显著扩张的主胰管内有两枚充盈缺损的结石影(箭)。
PDAC的变异类型影像与病理对照
PDAC的变异类型主要包括胰腺腺鳞癌、胰腺黏液性非囊性癌、胰腺肝样腺癌、髓样癌、印戒细胞癌、未分化癌、未分化癌伴破骨细胞样巨细胞。这类胰腺癌虽然属于PDAC的范畴,但因含有其它成分而使得肿瘤的影像学表现为非典型的各种特征,增加了PDAC的诊断难度。
世界卫生组织(WHO)2010年将腺鳞癌定义为胰腺外分泌部的鳞状细胞占肿瘤30%以上即可诊断为胰腺腺鳞癌,其中鳞癌成分越多,术后越易复发转移,预后越差[24]。腺鳞癌因其含有鳞状上皮成分,鳞癌倍增时间为腺癌一半,此外,鳞癌细胞多呈实性巢状排列,中央乏血供,易发生退行性变而出现坏死、囊变[25]。典型腺鳞癌CT表现为低密度肿块,其内可见低密度囊变区域,无分隔,MRI表现为病灶T1WI呈低信号,T2WI呈稍高信号,其内囊变区呈液体信号;增强后中心囊变区不强化,周围实性区域强化,出现“印戒样”改变,为该病的特征性影像学表现[26](图10)。

图12 胰腺未分化癌的影像与病理对照。 a) 胰腺横轴面CT平扫图像示胰头部一枚体积较大、分叶状低密度肿块,肿块密度欠均匀; b) 胰腺横轴面CT增强扫描动脉期示肿块周围轻度强化; c) 胰腺横轴面CT增强扫描实质期示肿块周围和中心出现斑片状强化影; d) 胰腺横轴面CT增强扫描延迟期示肿块强化程度较动脉期、实质期明显; e)为该肿块的HE染色图片,可见肿块内由大量巨细胞组成(×20,HE)。 图13 胰腺髓样癌的影像与病理对照。 a)横轴面T2WI图像示胰尾部一枚边界不清的肿块,呈稍高信号;b)T1WI示肿块呈低信号;c)实质期增强图像示肿块轻度强化,肿块旁可见高信号液体影; d)HE染色图示肿块内大量合体样细胞(×20,HE); e)免疫组化图示MSH6呈阳性表达(×20,HE)。 图14 外生型胰腺导管腺癌的影像与病理对照。 a)大体标本可见腹腔动脉干(白箭头)后方的灰白色肿块(白箭); b)HE染色图示腹腔动脉干(黑箭)后方可见大量肿瘤组织,而其前方可见正常胰腺组织(×1,HE);c)胰腺实质期横轴面CT图像示紧邻胰体后方的低密度软组织肿块影(箭),其邻近胰腺显示良好 。
胰腺黏液性非囊性癌,又称为“胶样癌”,为PDAC的一种罕见变异类型,预后较PDAC好。单纯胰腺黏液性非囊性癌大体可见肿瘤呈乳白色“奶酪”样改变,其间散在钙化;镜下可见界限较清楚的黏液池呈结节样分布,大部分黏液池结节内呈分隔状,结节周围有纤维间质包裹,黏液池内可见异形上皮细胞或腺样结构,细胞呈立方体或印戒样,呈簇状或散在分布于黏液池中[25]。因此,胰腺黏液性非囊性癌表现为以囊性为主的肿块,囊壁不规则增厚,囊腔内可见粗细不均的实性成分和分隔,增厚的囊壁、囊腔内分隔和实性成分T1WI呈等信号,T2WI呈稍高信号,增强后明显强化,扩散明显受限(图11)。值得注意的是,胰腺黏液性非囊性癌大多与肠型胰腺导管内乳头状黏液瘤(intraductal papillary mucious neoplasm,IPMN)并存,本院确诊的10例黏液性非囊性癌中,8例与肠型IPMN并存。
胰腺未分化癌为PDAC的罕见变异类型,占胰腺肿瘤的2%~7%,生长速度快,预后差;一般肿瘤体积较大,质软,坏死、囊变为该病的主要特征,巨细胞集中区域易发生出血;镜下可见多种分化不良的细胞,如单核多型大细胞、梭形细胞和巨细胞,偶可见单核巨细胞[24]。当未分化癌组织中出现非肿瘤性破骨样巨细胞则称为破骨细胞样巨细胞未分化癌,较单纯未分化癌预后好[23],在CT上常表现为囊实性肿块,边界尚清,包膜完整,内可见分隔;MRI上则表现为边界清楚的混杂信号影,若瘤内发生出血,则T1WI呈高信号;增强扫描动脉期和胰腺实质期肿块实性部分强化,囊性部分无明显强化(图12)。
髓样癌是2010版WHO胰腺肿瘤分类中新增加的PDAC变异类型,较PDAC更有癌家族史,主要特征为浸润性生长和合胞样增殖,预后较PDAC好。该型影像学表现与PDAC非常类似,只有病理才可确诊(图13)。
PDAC影像诊断难点和常见漏诊、误诊原因分析
1.不典型胰腺癌
当PDAC呈外生型生长时,影像上胰腺显示良好,并未显示明确肿块,仅表现为后腹膜围绕血管周围的肿块,肿块并未与胰腺相连,易误诊为后腹膜来源的其它肿瘤,此时需要通过多种重建技术并结合临床特征进行综合诊断(图14)。
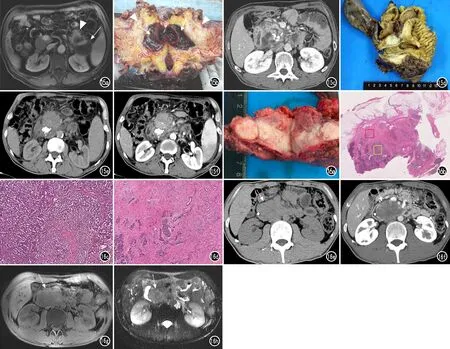
图15 胰腺癌误诊病例的影像与病理对照。 a)胰尾癌伴脾动脉瘤形成,横轴面T1WI胰腺实质期增强图像示胰尾低信号肿块周围环状强化(白箭头),肿块旁可见低信号动脉瘤影(白箭);b)为图15a病例对应大体图,可见胰尾部灰白色肿块(白箭头)和灰红色动脉瘤(白箭);c)肿块型胰腺炎误诊为胰腺癌,横轴面胰腺实质期增强CT图像示胰头部一枚低密度肿块,其内可见高密度钙化影、扩张的胰胆管和潴留囊肿影;d)为图15c病例对应大体图,可见胰头部一灰白色肿块; e)慢性胰腺炎癌变,横轴面CT平扫图像示胰头部一枚等低密度肿块,肿块内可见钙化影,钙化向十二指肠方向移位;f)与15e为同一病例,胰腺实质期增强图像示肿块呈中等强化。 图16 胰腺混合型导管-神经内分泌癌的影像与病理对照。a)胰腺混合型导管-神经内分泌癌大体图,胰头部可见一枚质韧、鱼肉状、灰红色肿块;b)为与图a对应的HE染色图(×1,HE);c)为图b黄框放大图像,可见肿块内神经内分泌肿瘤细胞(×20,HE);d)为图b红框放大图像,可见肿块内导管腺癌成分(×20,HE);e)胰腺横轴面CT平扫图像,可见胰头部一枚等密度肿块影(箭);f)胰腺横轴面CT增强实质期图像示肿块内部轻度不均匀强化(箭) ;g) 胰腺横轴面T1WI平扫图像,可见胰头部肿块呈等低信号(箭);h)胰腺横轴面T2WI平扫图像,可见胰头部肿块呈稍高信号(箭)。
2.胰腺癌与胰腺炎
当胰腺肿块阻塞主胰管,患者以急性胰腺炎为首发症状就诊时,此时影像上常表现为胰腺肿大、周围大量渗出,局部发生急性坏死、假性囊肿,甚至动脉瘤形成,这些表现往往掩盖了肿瘤本身,易误诊为急性胰腺炎(图15a、b)。
慢性胰腺炎从增生到不典型增生再发展到胰腺癌需要一个较长的病理过程,然而在慢性胰腺炎基础上形成的胰腺癌,由于广泛的胰腺实质钙化易导致误诊。慢性胰腺炎的特殊类型-肿块型胰腺炎与胰腺癌的鉴别诊断一直为胰腺疾病的诊断难点之一。肿块型胰腺炎的肿块内部含有较多的纤维组织成分,而PDAC肿块内成分主要为肿瘤细胞和纤维组织成分,因此两者平扫均呈低密度或T1WI低信号、T2WI稍高信号,动态增强可出现延迟强化。下述特征提示肿块型胰腺炎恶变:①肿块逐渐增大,钙化移位;②出现胰管明显截断征;③出现周围血管和脏器受侵;④出现淋巴结转移、肝脏转移;此外还需结合病史、实验室指标、黄疸轻重、病史长短、腹痛与黄疸出现的先后顺序进行综合判断(图15c~f)。
3.胰腺癌与混合癌
胰腺混合癌包括混合型导管-神经内分泌癌、混合型腺泡-神经内分泌癌、混合型腺泡-导管癌和混合型腺泡-导管-神经内分泌癌。肿瘤内部含有内、外分泌成分,并且每种成分比例不少于1/3~1/2[24]。因肿瘤含有腺泡和/或神经内分泌成分,这两种成分均会发生囊变,而且实性成分明显强化,增加了该类型肿瘤的诊断难度(图16)。
PC预后差,根治性手术切除是唯一可能治愈肿瘤的方法,无法行根治手术的患者也无法从手术中获益。因此,及时诊断以及准确的术前评价确定合适行手术治疗的患者是目前PC诊断的两大目标。然而,目前的影像学检查手段仍较难诊断早期胰腺癌和小胰癌,对于PC发生的淋巴转移和神经浸润的评价价值也较为有限,局灶性慢性胰腺炎对PC的诊断产生一定干扰,影像医生对PDAC罕见变异类型的影像学特征认识不足,这些均导致临床工作中仍有大量病例漏诊和误诊的病例存在,以上仍是我们今后努力研究的方向。
[1] 李兆申,陈汝福,胡先贵.整合胰腺肿瘤学[M].上海:上海科技出版社,2015:192-215.
[2] Yoon SH,Lee JM,Cho JY,et al.Small (≤20mm) pancreatic adenocarcinomas:analysis of enhancement patterns and secondary signs with multiphasic multidetector CT[J].Radiology,2011,259(2):442-452.
[3] 国家标准化委员会.胰腺癌诊断[M].北京:中国质监出版社,2011:1-13.
[4] Al-Hawary MM,Francis IR,Chari ST,et al.Pancreatic ductal adenocarcinoma radiology reporting template:consensus statement of the society of abdominal radiology and the american pancreatic association[J].Gastroenterology,2014,146(1):291-304.
[5] Al-Hawary MM,Francis IR,Chari ST,et al.Pancreatic ductal adenocarcinoma radiology reporting template:consensus statement of the Society of Abdominal Radiology and the American Pancreatic Association[J].Radiology,2014,270(1):248-260.
[6] 张太平,曹喆,赵玉沛.《2015年美国国立综合癌症网络胰腺癌临床实践指南(V2版)》外科相关部分解读[J].临床肝胆病杂志,2015,31(5):654-656.
[7] 李晓青,钱家鸣.《2015年美国国立综合癌症网络胰腺癌临床实践指南(V2版)》更新要点及临床路径[J].临床肝胆病杂志,2015,31(5):649-653.
[8] 焦新元,任建林,陈汝福.胰腺癌-新理论、新技术、新观点[M].北京:人民军医出版社,2010:108-114.
[9] Isaji S,Kawarada Y,Uemoto S.Classification of pancreatic cancer:comparison of Japanese and UICC classifications[J].Pancreas,2004,28(3):231-234.
[10] Harisinghani MG.Atlas of lymph node anatomy[M].New York (2013):Springer,2013:59-63.
[11] Liebig C,Ayala G,Wilks JA,et al.Perineural invasion in cancer:a review of the literature[J].Cancer,2009,115(15):3379-3391.
[12] 胡先贵,金钢.胰腺癌神经侵犯的机制、特点及手术方法[J].外科理论与实践,2009,14(5):485-487.
[13] 程鹏,金钢,胡先贵,等.胰腺癌神经丛微转移的双重免疫组化研究[J].中国普外基础与临床杂志,2010,17(10):1067-1070.
[14] Rau BM,Moritz K,Schuschan S,et al.R1 resection in pancreatic cancer has significant impact on long-term outcome in standardized pathology modified for routine use[J].Surgery,2012,152(3 Suppl 1):S103-111.
[15] 蒋奎荣,蔡宝宝,毅苗.胰腺全系膜切除在胰头癌行胰十二指肠切除术中的应用及意义[J].肝胆外科杂志,2014,22(1):12-15.
[16] Dal Pozzo G,Bozza A,Fargnoli R,et al.CT identification of coeliac ganglia[J].Eur J Radiol,1985,5(1):24-26.
[17] Deshmukh SD,Willmann JK,Jeffrey RB.Pathways of extrapancreatic perineural invasion by pancreatic adenocarcinoma:evaluation with 3D volume-rendered MDCT imaging [J].AJR,2010,194(3):668-674.
[18] Mochizuki K,Gabata T,Kozaka K,et al.MDCT findings of extrapancreatic nerve plexus invasion by pancreas head carcinoma:correlation with en bloc pathological specimens and diagnostic accuracy[J].Eur Radiol,2010,20(7):1757-1767.
[19] Zuo HD,Tang W,Zhang XM,et al.CT and MR imaging patterns for pancreatic carcinoma invading the extrapancreatic neural plexus (Part II):imaging of pancreatic carcinoma nerve invasion[J].World J Radiol,2012,4(1):13-20.
[20] Hayano K,Miura F,Amano H,et al.Correlation of apparent diffusion coefficient measured by diffusion-weighted MRI and clinicopathologic features in pancreatic cancer patients[J].J Hepatobiliary Pancreat Sci,2013,20(2):243-248.
[21] Wang X,Zhang H,Wang T,et al.The concept and controversy of retroperitoneal nerve dissection in pancreatic head carcinoma (Review)[J].Int J Oncol,2015,47(6):2017-2027.
[22] Chang ST,Jeffrey RB,Patel BN,et al.Preoperative multidetector CT diagnosis of extrapancreatic perineural or duodenal invasion is associated with reduced postoperative survival after pancreaticoduodenectomy for pancreatic adenocarcinoma:preliminary experience and implications for patient care[J].Radiology,2016,281(3):816-825.
[23] 缪飞.胰腺影像学[M].北京:人民卫生出版社,2015:233-273.
[24] Bosman FT,Carneiro F,Hruban RH,et al.World health organization classification of tumours.Pathology and genetics of tumours of the digestive system[M].(4ed)Lyon:IARC Press,2010:281-295.
[25] Campbell F,Verbeke CS.Pathology of the pancreas:a practical approach[M].London:Springer-Verlag London,2013:111-151.
[26] Ding Y,Zhou J,Sun H,et al.Contrast-enhanced multiphasic CT and MRI findings of adenosquamous carcinoma of the pancreas[J].Clin Imaging,2013,37(6):1054-1060.
R735.9; R814.42; R445.2
A
1000-0313(2017)09-0897-09
2017-08-02)
200433 上海,中国人民解放军海军军医大学第一附属医院(上海长海医院)影像医学科
陆建平(1959-),男,江苏太仓人,博士,主任医师,教授,博士生导师,主要从事胰腺疾病影像诊断与病理相关性研究工作。
10.13609/j.cnki.1000-0313.2017.09.002

