LC3蛋白在小鼠卵泡颗粒细胞中的表达及定位研究*
郭燕君, 徐 营, 刘胜兵, 侯 杰, 叶先才, 王志坚, 沈忠飞
(嘉兴学院医学院, 浙江 嘉兴 314001)
LC3蛋白在小鼠卵泡颗粒细胞中的表达及定位研究*
郭燕君, 徐 营, 刘胜兵, 侯 杰, 叶先才, 王志坚, 沈忠飞△
(嘉兴学院医学院, 浙江 嘉兴 314001)
目的: 探讨自噬相关蛋白微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3, LC3)在小鼠卵泡颗粒细胞中的表达及定位。方法: 昆明小鼠腹腔注射孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)前及注射后的第1、2、3、4、5天,采用免疫组织化学染色方法检测自噬相关蛋白LC3和凋亡相关蛋白cleaved caspase-3在卵泡中表达及共定位情况;促卵泡激素(follicle stimulating hormone,FSH)处理颗粒细胞后,Western blot检测LC3和cleaved caspase-3在颗粒细胞中的水平,免疫荧光方法对LC3在颗粒细胞中的亚细胞定位进行研究。结果: 在小鼠卵泡发育的各个阶段,LC3蛋白主要在颗粒细胞中表达;免疫荧光显示在闭锁卵泡的颗粒细胞中cleaved caspase-3和LC3的蛋白水平较高;在PMSG腹腔注射后第1、2天,颗粒细胞cleaved caspase-3和LC3-II的蛋白水平减少(P<0.05);在PMSG腹腔注射后第3、4、5天,颗粒细胞的cleaved caspase-3和LC3-II蛋白水平依次增加; LC3-II和cleaved caspase-3的蛋白水平具有相关性(r2=0.8299,P<0.05)。FSH处理后,LC3-II定位于颗粒细胞胞浆并呈点状分布。结论: LC3主要在卵泡颗粒细胞中表达,其表达具有细胞特异性和区域特异性,提示自噬在卵泡发育过程中主要在颗粒细胞中发生。卵巢颗粒细胞自噬和凋亡具有相关性,均呈促性腺激素依赖性。
颗粒细胞; 轻链蛋白3; Cleaved caspase-3; 卵泡发育
在哺乳动物卵巢中,仅有一小部分的卵泡完全成熟并排卵,大多数的卵泡最终将闭锁和死亡。虽然卵泡闭锁的过程在卵巢周期中重复发生,但是大多数细胞死亡的确切机制还没有完全阐述清楚。有研究发现卵泡闭锁与颗粒细胞凋亡相关[1]。但是,卵泡闭锁过程可能不是仅仅只有凋亡参与,已有研究显示在鹅和鹌鹑的窦状卵泡中观察到非凋亡形式的程序性细胞死亡(自噬和坏死样细胞死亡)现象[2-3]。
自噬是细胞内的降解系统,细胞内一部分胞质被一种具有双层膜结构的自噬体所包裹后,与溶酶体融合最终降解[4]。最开始自噬被认为是细胞对于饥饿和应激反应的一种自救反应[5],但是,后续很多研究显示自噬可以通过过度的自我消化和降解重要的细胞内组成结构来促进细胞死亡[6]。最近研究发现自噬可以被各种诱导凋亡的刺激激活[7]。特别是在人类卵泡颗粒细胞中,暴露于氧化型低密度脂蛋白中的内皮细胞可以通过自噬的方式发生凋亡性死亡[8]。由于颗粒细胞是在卵泡闭锁过程中的最先发生凋亡的细胞,所以自噬可能参与了卵泡发育的过程[9]。到目前为止,自噬参与卵泡发育和闭锁过程以及自噬诱导的具体机制还不清楚。本文从颗粒细胞凋亡的角度来探讨自噬在卵泡发育闭锁过程中的发生机制。
材料和方法
1动物
SPF级4周龄大小的健康雌性昆明小鼠,体重18~25 g,购自浙江省实验动物公共管理平台,实验动物许可证号为SCXK(浙)2014-0001。
2试剂仪器
孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)和牛血清白蛋白购于 Sigma;抗微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)兔多克隆抗体和cleaved caspase-3兔多克隆抗体购于Cell Signaling Technology;BCA试剂盒、生物素链接的II抗和β-actin抗体购于碧云天生物技术有限公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔II抗购于Santa Cruz Biotechnology;HTF、BIO-AMF2培养基由Gibco生产;Triton X-100购于北京索莱宝科技有限公司;DAB试剂盒购于北京中杉金桥生物技术公司;其它试剂为国产分析纯。3111型二氧化碳培养箱购于Thermo;荧光显微镜为Olympus产品;切片机购于Leica。
3方法
3.1动物处理 8周龄雌性昆明小鼠腹腔注射10 U PMSG诱导卵巢卵泡发育和闭锁。分别在PMSG注射前及注射后第1、2、3、4、5天颈椎脱臼法处死小鼠,将一侧卵巢脱水固定进行石蜡包埋后用于组织切片,另一侧卵巢无菌条件下分离小鼠卵巢颗粒细胞。
3.2颗粒细胞收集培养 分离一侧卵巢于无菌条件下分离小鼠卵巢颗粒细胞,HTF培养液清洗,体视显微镜下剥离卵巢周围脂肪和被膜,用1 mL注射器针头刺破卵泡,释放出颗粒细胞,1 500 r/min离心7 min,加入HTF培养液清洗2次后,弃上清,收集细胞用于Western blot实验。
3.3免疫组织化学染色 石蜡包埋的卵巢组织切片经过脱蜡、水化后,入10 mmol/L柠檬酸缓冲液中 30 min进行抗原修复。采用3% H2O2孵育30 min消除内源性过氧化物酶。5%牛血清白蛋白 孵育30 min封闭非特异性结合位点。洗涤,依次加抗LC3兔多克隆抗体(1∶300)和抗cleaved caspase-3兔多克隆抗体(1∶200)于4 ℃孵育过夜,去除切片上液体后,孵育生物素链接的II抗1 h(1∶2 000),洗涤,通过DAB染色观察链霉亲和素-过氧化物酶结合抗体复合物显色。HE复染后脱水封片,Olympus显微镜下摄像,用Image J软件分析计数。
3.4免疫荧光染色 颗粒细胞培养过夜,去掉未贴壁的细胞后分组,培养基去血清,采用细胞饥饿方式诱导细胞自噬,FSH组则另外添加100 μg/L促卵泡激素(follicle stimulating hormone, FSH)处理细胞。24 h后,用4%多聚甲醛室温固定细胞30 min,封闭液封闭2 h,加入LC3兔多抗(1∶500)4 ℃孵育过夜,PBS 洗3次,加入FITC标记的羊抗兔IgG (1∶5 000),37 ℃孵育1 h,PBS洗后DAPI染核30 s,用抗荧光淬灭液封片观察,Olympus荧光显微镜下摄像分析。
3.5Western blot实验检测蛋白水平 吸去收集的颗粒细胞上清液,PBS洗涤,1 500 r/min离心7 min后弃去上清,加入100 μL RIPA蛋白裂解液(含1 μL PMSF蛋白酶抑制剂),冰上静置20 min,12 000 r/min离心30 min,取部分上清,BCA试剂盒测定总蛋白浓度;取30 μg 蛋白100 ℃水浴 10 min 变性,120 V恒压电泳70 min后,200 mA转膜2 h,5% BSA封闭1 h,再分别加兔抗LC3多克隆抗体I抗(1∶5 000)、抗cleaved caspase-3兔多克隆抗体I抗(1∶1 000)及β-actinⅠ抗(1∶1 000)于4 ℃冰箱中过夜,TBS洗3次,TBST洗1次,然后分别加HRP标记的羊抗兔II抗(1∶5 000)室温孵育1.5 h,TBS洗3次,TBST洗1次,暗室中加ECL化学发光剂显影;Image Pro-Plug 6.0分析软件测定目的条带的光密度值,以目的条带的光密度值与β-actin条带的光密度值比值作为该目的蛋白的相对表达量。
4统计学处理
实验数据以均数±标准差(mean±SD)描述,应用SPSS 16.0软件建立数据库,检验数据的正态性后,进行单因素方差分析(one-way ANOVA),组间两两比较用LSD法。LC3-II和cleaved caspase-3的蛋白水平相关性采用Pearson相关性分析。以P<0.05为差异有统计学意义。
结 果
1自噬在卵巢卵泡细胞中的定位
LC3蛋白作为检测自噬的标志物被广泛使用。我们通过向未成熟昆明小鼠腹腔注射PMSG,免疫组织化学染色法检测LC3表达分析卵巢卵泡细胞中自噬的情况。免疫组化方法显示原始卵泡中LC3表达微弱。相比,初级卵泡和窦状卵泡颗粒细胞中LC3强烈表达。与此类似的是,在卵泡发育早期、中期和晚期窦状卵泡中,颗粒细胞显示LC3强烈表达(呈深棕黄色),但是,膜细胞中LC3则微弱表达。在卵泡发育的各个阶段,卵母细胞细胞质中LC3表达均为阴性,见图1。
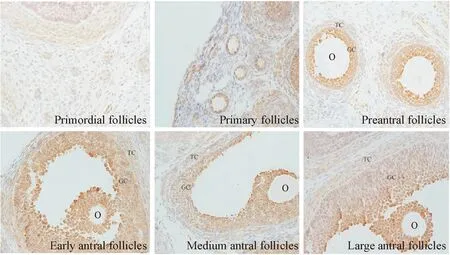
Figure 1. Immunolocalization of LC3 protein in the mouse ovarian follicles at different stages of development (×400). GC: granulosa cells; TC: thecal cells; O: oocytes.
图1小鼠卵巢不同发育阶段的卵泡中LC3定位表达情况
2卵泡发育和闭锁过程中颗粒细胞自噬和凋亡
由于自噬形成时胞浆型LC3即LC3-I会酶解掉一小段多肽,转变为自噬体膜型即LC3-II,因此,LC3-II/LC3-I比值的大小可估计自噬水平的高低。LC3-II表达高低是与自噬体的数量相关的。Cleaved caspase-3是凋亡性细胞死亡的最终途径,颗粒细胞凋亡水平可以通过检测cleaved caspase-3的蛋白水平来反映。在PMSG腹腔注射后第1、2天,颗粒细胞cleaved caspase-3的蛋白水平较没有注射PMSG组显著减少(P<0.05)。而且在PMSG腹腔注射后第3天,cleaved caspase-3的蛋白水平增加并维持到PMSG腹腔注射后第5天。在PMSG腹腔注射后第1、2天,颗粒细胞LC3-II的表达水平也显著减少(P<0.05),在PMSG腹腔注射后第3、4、5天的颗粒细胞LC3-II的表达水平增加。 LC3-II和cleaved caspase-3的蛋白水平具有相关性(P<0.05),见图2。
未成熟的昆明小鼠腹腔注射PMSG后,卵巢组织LC3免疫组化定位显示,在早期健康窦状卵泡和中期健康窦状卵泡颗粒细胞层中LC3蛋白表达呈弱阳性,而在早期和中期闭锁窦状卵泡的颗粒细胞层LC3蛋白表达呈强阳性,见图3。
3促性腺激素依赖的颗粒细胞自噬
从PMSG处理1 d的小鼠卵巢分离的未处理颗粒细胞较FSH处理组相比,cleaved caspase-3及LC3-II的蛋白水平均显著增加(P<0.05),见图4。图5显示LC3-I在颗粒细胞胞浆中散在表达,LC3-II在胞浆中呈点状表达在胞核的周围。LC3阳性细胞计数,胞浆中呈点状表达的颗粒细胞计算为自噬性细胞,非FSH处理组自噬性颗粒细胞比例为(84.2±1.2)%,FSH处理组为(61.5±1.3)%。
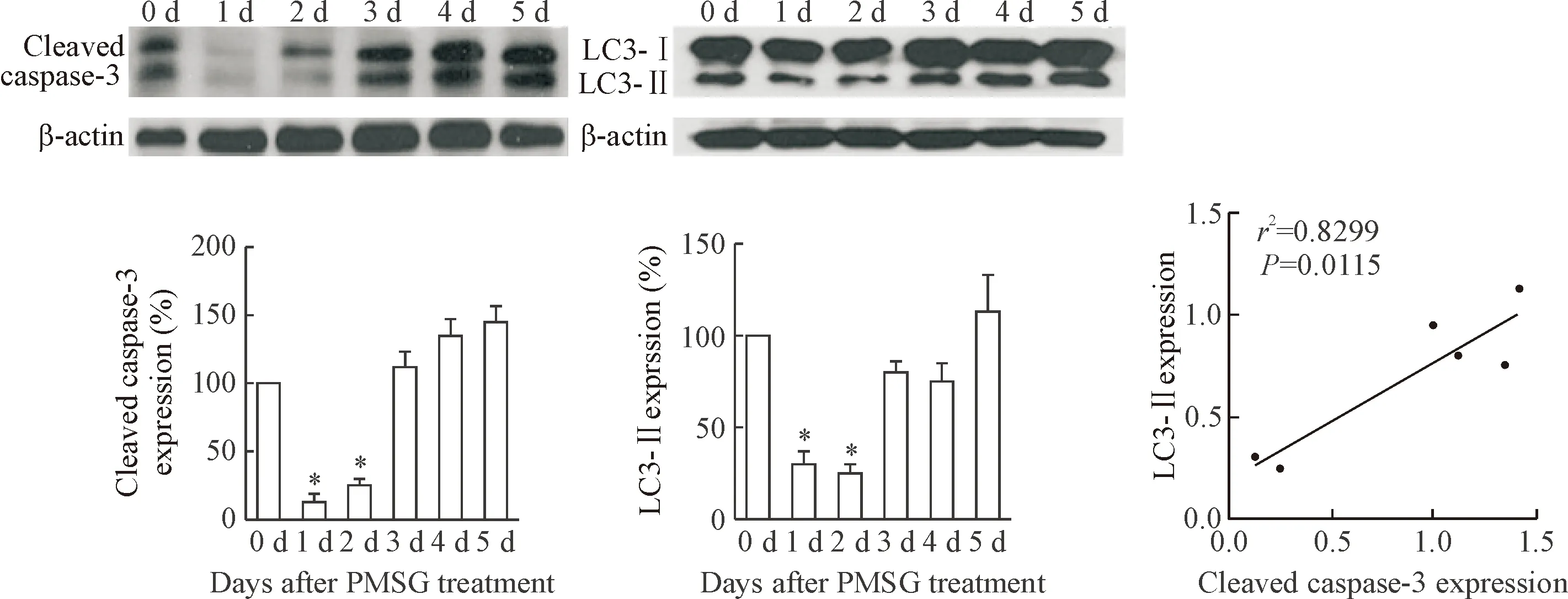
Figure 2. The protein levels of cleaved caspase-3 and LC3-II in the granulosa cells from immature mice at different times (0~5 d). Mean±SD.n=3.*P<0.05vs0 d.
图2小鼠卵巢不同发育阶段的卵泡中颗粒细胞cleavedcaspase-3和LC3-II蛋白的表达
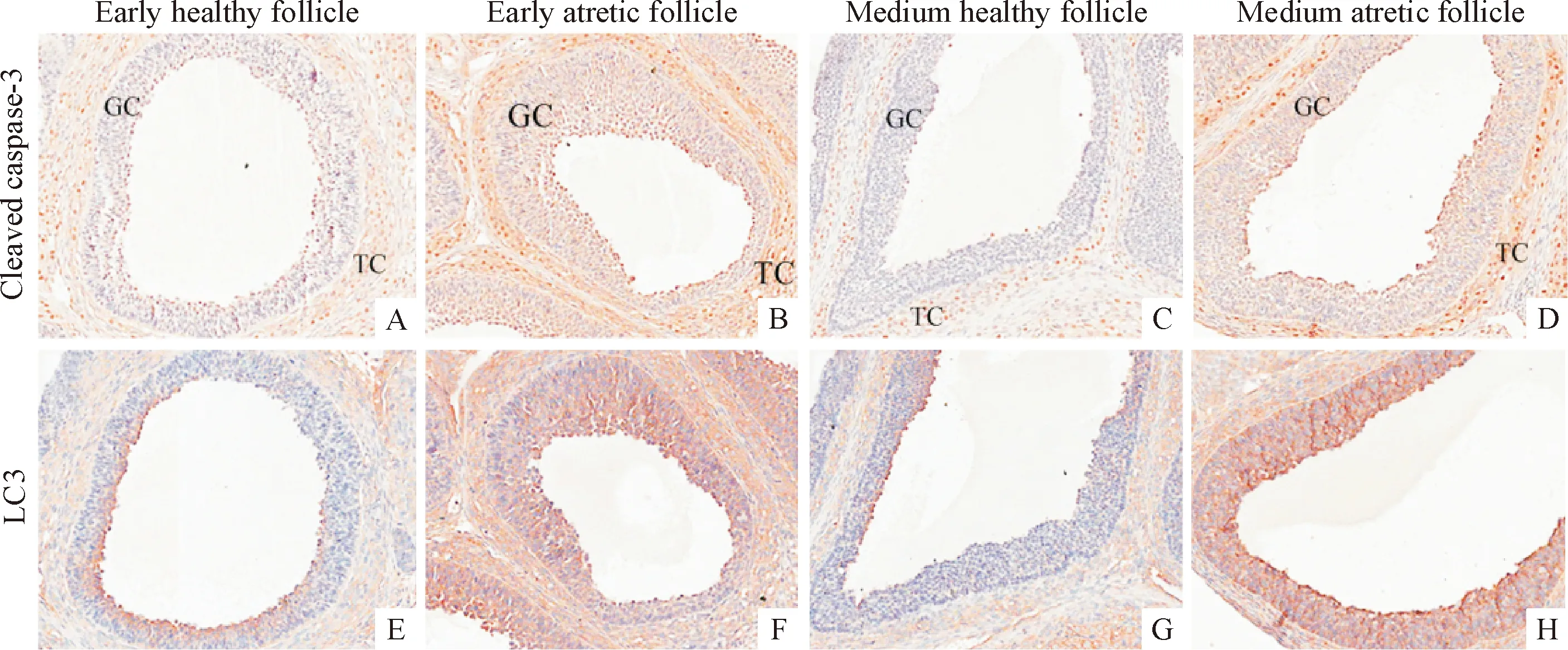
Figure 3. Colocalization of cleaved caspase-3 and LC3 proteins on adjacent sections of healthy (A, C, E, G) and atretic (B, D, F, H) follicles from immature mice (×200). GC: granulosa cells; TC: theca cells.
图3早期和中期健康有腔卵泡和闭锁卵泡中cleavedcaspase-3和LC3的表达情况
讨 论
细胞自噬是细胞受到刺激后,通过溶酶体途径降解细胞内物质,以实现细胞本身代谢需要和某些细胞器更新的过程[10]。自噬既可以作为一种防御机制清除胞质内受损的细胞器、代谢产物,进行亚细胞水平上的重构,保护受损的细胞,同时也可作为一种细胞死亡程序诱导细胞主动性死亡[11-12]。 根据细胞物质到达溶酶体腔途径的不同,自噬可以分为大自噬、小自噬以及分子伴侣介导的自噬3种形式,通常所说的“自噬”主要指大自噬,其过程大致包括自噬的诱导(形成自噬前体)、自噬体的形成、自噬溶酶体的形成以及内容物的降解[13]。
本实验中,通过未成熟昆明小鼠腹腔注射PMSG,免疫染色分析LC3蛋白来检测自噬在卵巢卵泡细胞中的表达。在卵巢卵泡发育的各个阶段中,卵母细胞LC3表达均为阴性。这些结果与有丝分裂II卵母细胞几乎没有自噬诱导的结果是一致的[14]。但是,在卵巢卵泡发育的各个阶段,颗粒细胞中LC3表达均呈强阳性,表明自噬主要发生在颗粒细胞中,颗粒细胞为卵泡闭锁过程中凋亡性细胞死亡的主要靶细胞,自噬性细胞死亡也可能参与卵泡闭锁的过程。
为了证实上面的假设,我们运用体外腹腔注射PMSG诱导昆明小鼠卵泡发育和闭锁的模型,检测自噬是否与颗粒细胞凋亡具有相关性[15]。Cleaved caspase-3作为评价颗粒细胞凋亡的指标,本研究发现在PMSG注射后第1、2天其蛋白水平下降,第3、4、5天其蛋白水平增加。LC3-II的表达与cleaved caspase-3的蛋白表达趋势一样,具有明显相关性。这些结果显示诱导自噬与颗粒细胞凋亡和卵巢卵泡闭锁密切相关的。
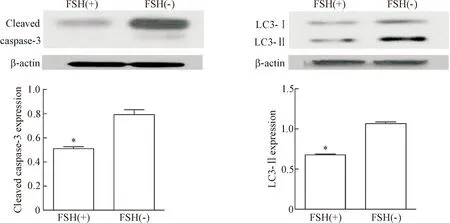
Figure 4. The protein levels of cleaved caspase-3 and LC3-II in cultured mouse granulosa cells after incubation under serum-free conditions in the absence or presence of FSH. Mean±SD.n=3.*P<0.05vsFSH (-).
图4体外培养的颗粒细胞去血清和FSH处理后cleavedcaspase-3和LC3-II的蛋白水平变化
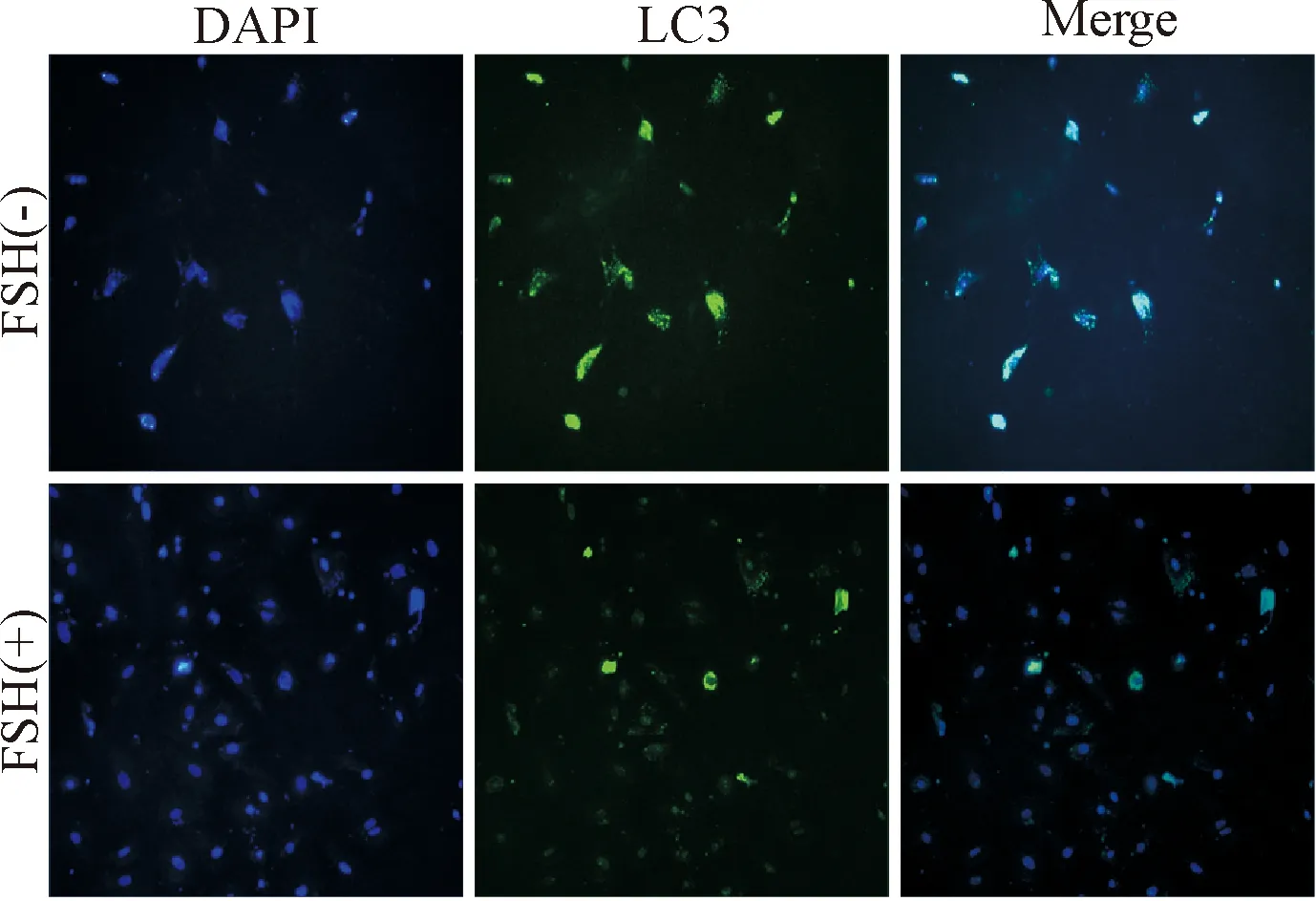
Figure 5. The immunofluorescence images of the granulosa cells cultured in serum-free with or without FSH conditions (×200).
图5体外培养的颗粒细胞去血清和FSH处理后LC3蛋白的免疫荧光图像观察
本研究通过分析卵巢组织LC3和cleaved caspase-3的共定位情况,检测颗粒细胞自噬和卵泡闭锁之间的关系。由于小卵泡不同发育阶段包括原始卵泡,初级卵泡和有腔卵泡。在原始卵泡,初级卵泡和有腔卵泡颗粒细胞中cleaved caspase-3表达均为阴性,因此不能确定cleaved caspase-3和LC3共定位。然而,在闭锁卵泡中,本研究结果表明在闭锁的早期和中期有腔卵泡中可见cleaved caspase-3 阳性颗粒的细胞同时出现了LC3表达阳性和聚集的LC3免疫反应。但是在健康窦状卵泡中,cleaved caspase-3蛋白呈阴性,LC3表达呈弱阳性并且部分呈分散分布。上述这些结果初步显示颗粒细胞自噬可能直接参与了卵巢卵泡发育的各个阶段中的卵泡闭锁过程。
有研究显示颗粒细胞凋亡受促性腺激素影响。本研究在体实验腹腔注射PMSG后早期(第1、2天)LC3-II和cleaved caspase-3的蛋白水平降低,随着体内对PMSG的代谢, PMSG注射后晚期(第3、4、5天)由于凋亡的诱导,LC3-II和cleaved caspase-3的蛋白水平依次升高,说明颗粒细胞自噬与凋亡一样是呈促性腺激素依赖的。为了证明上面的结果,本研究设计了体外颗粒细胞培养系统,添加FSH培养24 h后,显示颗粒细胞自噬呈促性腺激素依赖性,LC3-II蛋白质定位在胞浆中,围绕胞核呈同心圆样点状表达。
Rodrigues等[16]对新出生小鼠研究, 发现其卵母细胞中溶酶体数量增多, 只有少数生殖细胞凋亡。提示自噬可能是引起出生后生殖细胞死亡的重要机制, 而不是凋亡。青春期前大鼠闭锁卵泡卵母细胞死亡的过程,从自噬到凋亡, 直至两者共同作用导致细胞死亡。来源于新生大鼠的卵母细胞主要经历凋亡(活化的caspase-3和TUNEL反应阳性), 而在5、10、25、28 d雌性大鼠的闭锁卵泡中, 发现大部分卵母细胞具有局部性凋亡和自噬标记物的表达, 并且自噬标记物Lamp1和酸性磷酸酶强烈表达。Escobar等[17]假设, 卵母细胞死亡可能最初起始于线粒体等细胞器的自噬降解, 之后促进了caspases的活化,由此导致了DNA片段化,且不伴随核浓缩。Gonzales-Polo等[18]也证实自噬体的形成在凋亡之前,且这两条通路之间存在交叉性。
本研究中LC3在小鼠颗粒细胞中的表达定位和特点,提示他们可能直接或间接地影响卵泡颗粒细胞的分化和凋亡,并进一步影响卵泡的发育和闭锁过程,但要完全阐明LC3在雌性卵巢卵泡发育和闭锁中的相关机制仍需作进一步的研究。
综上所述,在小鼠卵泡发育过程中,LC3蛋白主要在小鼠颗粒细胞中表达,并且颗粒细胞自噬的表达模式与颗粒细胞凋亡的表达模式密切相关。在体和体外卵巢颗粒细胞自噬和凋亡均呈促性腺激素依赖性。
[1] Boone DL, Tsang BK. Caspase-3 in the rat ovary: localization and possible role in follicular atresia and luteal regression[J]. Biol Reprod, 1998, 58(6): 1533-1539.
[2] Kovacs J, Forgo V, Peczely P. The fine structure of the follicular cells in growing and atretic ovarian follicles of the domestic goose[J]. Cell Tissue Res, 1992, 267(3):561-569.
[3] D’Herde K, De Prest B, Roels F. Subtypes of active cell death in the granulosa of ovarian atretic follicles in the quail (Coturnix coturnix japonica)[J]. Reprod Nutr Dev, 1996, 36(2):175-189.
[4] Levine B, Klionsky DJ. Development by self-digestion: molecular mechanisms and biological functions of auto-phagy[J]. Dev Cell, 2004, 6(4):463-477.
[5] Voigt O, Pöggeler S. Self-eating to grow and kill: auto-phagy in filamentous ascomycetes[J]. Appl Microbiol Biotechnol, 2013, 97(21):9277-9290.
[6] Mattiolo P, Yuste VJ, Boix J, et al. Autophagy exacerbates caspase-dependent apoptotic cell death after short times of starvation[J]. Biochem Pharmacol, 2015, 98(4):573-586.
[7] Delou JM, Biasoli D, Borges HL. The complex link between apoptosis and autophagy promising new role for RB[J]. An Acad Bras Cienc, 2016, 8(4): 2257-2275.
[8] Duerrschmidt N, Zabirnyk O, Nowicki M, et al. Lectin-like oxidized low-density lipoprotein receptor-1-mediated autophagy in human granulosa cells as an alternative of programmed cell death[J]. Endocrinology, 2006, 147(8):3851-3860.
[9] Gao H, Lin L, Haq IU, et al. Inhibition of NF-κB promotes autophagy via JNK signaling pathway in porcine granulosa cells[J]. Biochem Biophys Res Commun, 2016, 473(1):311-316.
[10] 张 丹,李 静,李玉苹,等. 自噬减轻模拟缺血/再灌注微环境中肺微血管内皮细胞损伤[J]. 中国病理生理杂志, 2015, 31(7):1253-1258.
[11] Qin HD, Tan WG, Zhang Z, et al. 15d-prostaglandin JZ protects cortical neurons against oxygen-glucose deprivation/reoxygenation injury: involvement of inhibiting autophagy through up-regulation of Bcl-2[J]. Cell Mol Neurobiol, 2015, 35(3):303-312.
[12] 陈 艾, 童 煜, 毛 萌. 小自噬的研究进展[J]. 中国病理生理杂志, 2012, 28(5):955-960.
[13] La Rovere RM, Roest G, Bultynck G, et al. Intracellular Ca2+signaling and Ca2+microdomains in the control of cell survival, apoptosis and autophagy[J]. Cell Calcium, 2016, 60(2):74-87.
[14] Tsukamoto S, Kuma A, Murakami M ,et al. Autophagy is essential for preimplantation development of mouse em-bryos[J]. Science, 2008, 321(5885): 117-120.
[15] Yang YL, Ren LR, Sun LF, et al. The role of GPR1 signaling in mice corpus luteum[J]. J Endocrinol, 2016, 230(1):55-65.
[16] Rodrigues P, Limback D, McGinnis LK, et al. Multiple mechanisms of germ cell loss in the perinatal mouse ovary[J]. Reproduction, 2009, 137(4):709-720.
[17] Escobar ML, Echeverria OM, Ortiz R, et al. Combined apoptosis and autophagy, the process that eliminates the oocytes of atretic follicles in immature rats[J]. Apoptosis, 2008, 13(10):1253-1266.
[18] Gonzales-Polo R, Boya P, Pauleau A, et al. The apoptosis/autophagy paradox: Autophagic vacuolization before apoptotic death[J]. J Cell Sci, 2005, 118(Pt 14):3091- 3102.
(责任编辑: 林白霜, 余小慧)
LC3 protein expression and localization in mouse follicular granulosa cells
GUO Yan-jun, XU Ying, LIU Sheng-bing, HOU Jie, YE Xian-cai, WANG Zhi-jian, SHEN Zhong-fei
(College of Medicine, Jiaxing University, Jiaxing 314001,China. E-mail: shzhmy169@vip.sina.com)
AIM: To investigate the expression and localization of autophagy related protein microtublule associated protein 1 light chain 3 (LC3) at various stages of follicular development and atresia in the mice.METHODS: On 0,1,2,3,4 and 5 day after intraperitoneal injection of pregnant mare serum gonadotropin (PMSG), expression and positioning situation of autophagy related protein LC3 and apoptosis related protein cleaved caspase-3 were examined by the me-thod of immunohistochemical staining. The protein levels of cleaved caspase-3 and LC3 were determined by Western blot in cultured mouse granulosa cells after incubation under serum-free conditions in the absence or presence of FSH. LC3 subcellular localization in granulosa cells were studied by the method of immunofluorescence.RESULTS: The LC3 protein expressed in granulosa cells during all developmental stages mainly. Granulosa cells of atretic follicles that showed intense staining of cleaved caspase-3 and LC3. The protein levels of cleaved caspase-3 and LC3-II in the granulosa cells significantly decreased at 1 d and 2 d after intraperitoneal injection of PMSG (P<0.05). The protein levels of cleaved caspase-3 and LC3-II in the granulosa cells increased in turn on 3, 4 and 5 day after intraperitoneal injection of PMSG. The positive correlation between LC3-II and cleaved caspase-3 protein levels was observed (r2=0.8299,P<0.05). The LC3-II protein expressed with punctuate structures in granulosa cell cytoplasm cultured under serum-free conditions in the presence of FSH.CONCLUSION: LC3 is expressed in the follicular granulosa cells with cell specificity and regional specificity. Autophagy is induced mainly in granulosa cells during folliculogenesis and shows positive correlation with apoptosis. Ovarian granulosa cell autophagy and apoptosis are gonadotropic hormone dependent.
Granulosa cells; Microtubule associated protein 1 light chain 3; Cleaved caspase-3; Follicular development
1000- 4718(2017)09- 1690- 06
2017- 01- 12 [
] 2017- 04- 13
浙江省教育厅科研项目资助(No. Y201534052);浙江省实验动物科技计划项目(No. 2017C37173)
R339.2
A
10.3969/j.issn.1000- 4718.2017.09.025
△通讯作者 Tel: 0573-83643850; E-mail: shzhmy169@vip.sina.com

