海参体壁蛋白ACE抑制肽酶解工艺及产物分子量分布研究
,,,
(宁德师范学院生物系,福建宁德 352100)
海参体壁蛋白ACE抑制肽酶解工艺及产物分子量分布研究
周逢芳,蔡彬新,巫鑫睿,罗芬
(宁德师范学院生物系,福建宁德 352100)
以血管紧张素转化酶(ACE)抑制率和水解度为指标,筛选出适合海参体壁蛋白水解的酶。采用单因素和响应面法优化最优酶的水解条件,确定其最佳水解工艺,进而采用HPLC法探讨酶解产物的分子量分布。结果表明:中性蛋白酶在50 ℃、pH7.5、酶量3000 U/g、酶解5 h条件下,所得酶解产物的ACE抑制率最高,达到56.5%。此条件下酶解产物经HPLC分析,200~1000 Da(2~10肽)的海参多肽占44.1%。
海参,水解度,ACE抑制肽,分子量分布
高血压是一种常见的心血管疾病,预计到2025年全世界高血压患者将超过15.6亿[1]。导致高血压的原因很复杂,一些研究证明,ACE是肾素-激肽系统(ARS)和激肽释放酶-激肽系统(KKS)的关键酶,通过ARS和KKS两个途径,ACE参与体内血压调节,造成血压的升高,引发高血压[2-3],因此通过抑制ACE的活性来抑制血压升高是可行的。
目前有许多治疗高血压的合成药物,由于高血压患者往往需要终身治疗,因此长期服用产生了一定的副作用,如咳嗽、皮疹等[4]。相反,食物蛋白源ACE抑制活性肽没有表现出这些副作用,因此寻找新的食物来源的ACE抑制活性肽已成为重要的研究领域。随着海洋生物被人们越来越多的关注,藻类[5-6]、虾[7]、鱼[8-10]、海参[11]、鲍鱼加工副产品[12]等,已陆续分离出ACE抑制肽。
海参(Ludwigothureagrisea),属海参纲,无脊椎棘皮动物[13],具有很高的营养价值和药理活性[14]。目前海参主要的加工和保鲜技术是盐渍,严重制约了海参资源的利用。因此,开发精加工技术和高价值的产品,充分利用丰富的海参资源具有重要意义。海参富含蛋白质,其序列没有生物活性[15],但酶水解释放出的海参多肽,具备一定的生理功能[16]。蛋白酶具有高度专一性,不同酶酶切得到的肽段不同,且ACE抑制肽没有一个固定的结构,因此酶法生产ACE抑制肽存在一定的盲目性,无法控制目标肽段。只能根据酶切产物的活性进行筛选目标酶。赵元晖等[17]利用菠萝蛋白酶从营养价值较低的海地瓜酶解制备ACE抑制肽;Raheleh Ghanbari[18]利用海参制备ACE抑制和抗氧化活性的双功能蛋白水解物。本研究不同之处在于以北参南养的“霞浦海参”为原料,不同产地的海参其蛋白含量及成分应不尽相同,酶切的肽段存在较大区别;探讨不同的酶切产物ACE抑制活性与其分子量分布的关系。本研究的目的以ACE抑制率为指标,筛选蛋白酶,制备ACE抑制活性肽,优化最适酶的酶解工艺,并考察所得酶解产物分子量分布。
1 材料与方法
1.1材料与仪器
新鲜海参 福建霞浦;木瓜蛋白酶(60万U/g)、中性蛋白酶(6万U/g)、风味蛋白酶(20万U/g)、胰蛋白酶(6000 U/g)、胃蛋白酶(1万U/g)、碱性蛋白酶(20万U/g)、Sephadex G-25 北京索莱宝科技有限公司(Solarbio);血管紧张素转化酶(ACE)、马尿酰-组氨酰-亮氨酸(HHL) Sigma公司;溶菌酶、牛胰岛素、杆菌肽、色氨酸、乙腈 阿拉丁公司;福林-酚等其他试剂 国药集团化学试剂公司。
MC电子天平 奥豪斯仪器公司;UV2550紫外光分光光度计 日本岛津;PB-10PH计 上海般特仪器公司;3-16pk高速冷冻离心机 sigma公司;1200高效液相色谱仪 安捷伦公司。
1.2实验方法
1.2.1 海参体壁ACE抑制肽制备工艺 将海参体壁洗净,绞碎,取一定量匀浆液,按料水比1∶2,每克底物添加3000 U的酶,在酶的适宜条件(表1)下水解海参匀浆液。分别于1、2、3、4、5、6、7、8 h取样,沸水浴灭酶10 min后,于4 ℃,12000 r/min离心15 min得上清液。分别测定它们的水解度和ACE活性抑制率,探讨水解度与ACE抑制率的关系,确定最优酶。
1.2.2 酶解工艺条件的优化
1.2.2.1 单因素实验 固定料水比1∶2、时间5 h、pH7.0、加酶量3000 U·g-1,考察不同酶解温度(40、45、50、55、60 ℃)对ACE抑制率的影响。固定料水比1∶2、温度50 ℃、pH7.0、加酶量3000 U·g-1,考察不同时间(4、5、6、7、8 h)对ACE抑制率的影响。固定料水比1∶2、时间5 h、温度50 ℃、加酶量3000 U·g-1,考察不同pH(6、6.5、7、7.5、8)对ACE抑制率的影响。固定料水比1∶2、时间5 h、温度50 ℃、pH7.5,考察不同加酶量(1000、2000、3000、4000、5000 U/g)对ACE抑制率的影响。
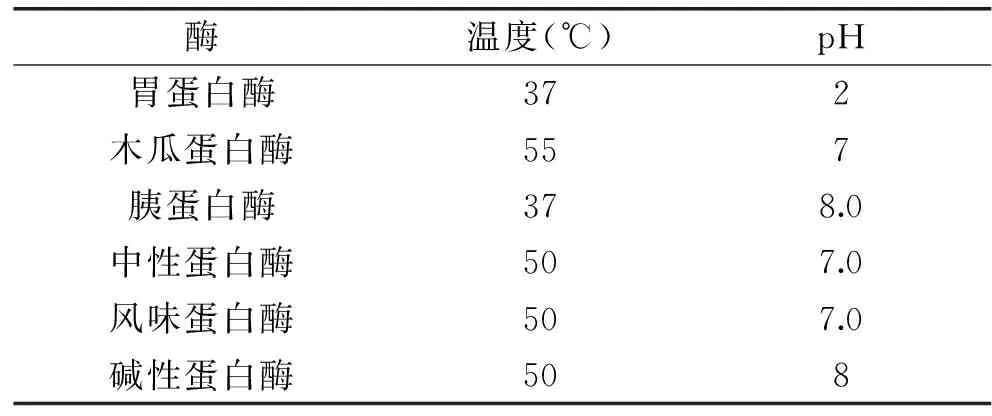
表1 酶解条件Table 1 Enzymatic hydrolysis conditions
1.2.2.2 响应面优化酶解工艺 根据Box-Behnkcn的中心组合设计原理,结合单因素实验结果,选择时间、温度和酶量三个因素为自变量,以ACE抑制率为响应值,设计三因素三水平的响应面优化实验,如表2。

表2 实验因素与水平Table 2 Factors and levels of the experiment
1.2.3 测定指标
1.2.3.1 水解度的测定 采用甲醛滴定法测水解度[19]:DH(%)=水解液中的α-氨基氮量/原料中总氮量×100
其中采用凯氏定氮法(GB/T5009.5.2010)测定总氮含量,甲醛滴定法测定氮量。
1.2.3.2 ACE抑制肽活性的测定 根据Cushman方法[20]改进,取2.0 mg/mL海参酶解液40 μL,加入20 μL ACE溶液(25 mU/mL),在37 ℃下保温5 min后加入50 μL HHL溶液开始反应,反应60 min后加入200 μL 1.0 mol/L HCl中止反应,得到反应液,利用HPLC进行分析测定。同时用40 μL pH8.3的硼酸缓冲液替代海参酶解液来制备反应液,作为空白对照组。色谱检测条件:色谱柱Zorbax SB-C18分析柱(4.6 mm×250 mm,填料粒径5 μm);柱温:25 ℃;流动相:乙腈-水(25∶75,V/V,各含0.1%三氟乙酸);流速:1 mL/min;检测波长:228 nm;进样量:10 μL。
ACE活性抑制率(I,%)=(M-N)/M×100
式中:M-空白对照组中马尿酸的峰面积;N-样品组中马尿酸的峰面积。
1.2.3.3 相对分分子量测定 分别选用分子质量:细胞色素C(Mw 12500 Da)、抑肽酶(Mw 6500 Da)、杆菌酶(Mw 1450 Da)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mw 451 Da)、乙氨酸-乙氨酸-乙氨酸(Mw 189 Da)标品,配成0.5 mg/mL的标准液,经0.45 μm膜过滤后,分析其分子量分布范围。
色谱条件如下:SRT SEC-100 300 mm×7.8 cm;流动相:0.1 mol/L磷酸盐缓冲液(pH7.0);检测:UV214 nm;流速:1 mL/min;柱温:30 ℃;进样体积:20 μL。由分子量对数与出峰时间关系,绘制标准曲线。按上述方法分析海参酶解液的分子量分布。
1.2.4 数据分析 响应面实验结果采用Design-Expert8.0.6程序进行分析,以p<0.05作为差异显著性判断标准。采用Excel2007软件作图。
2 结果与分析
2.1蛋白酶初步筛选
2.1.1 六种蛋白酶对海参体壁水解度的影响 由于酶具有特异性,不同酶的酶切位点不同,产生的肽段不一样,这决定了酶解产物的组成、结构和功能。实验选取了六种蛋白酶,分别在各种蛋白酶的理论适宜条件下进行水解,水解进程曲线如图1所示。虽然不同酶水解海参蛋白的能力存在差异,但总体来说,酶解过程中水解度的变化趋势基本相同,DH随着时间的延长而增大,前期水解度快速上升,后期水解度升高缓慢,这可能是因为随着水解反应的进行,可供蛋白酶水解的肽键数不断减少,或者体系中的酶活力下降或丧失。
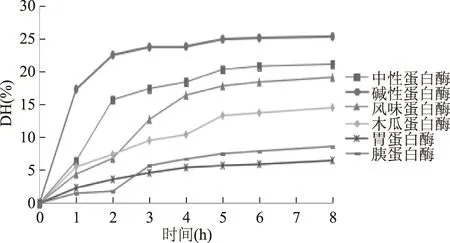
图1 蛋白酶水解产物酶解进程曲线Fig.1 Hydrolysis curves of hydrolysates
在六种酶中,碱性蛋白酶水解海参体壁蛋白的能力最强,2 h内DH就达到24.5%。这是由于碱性蛋白酶是一种非特异性肽键内切酶,有较多的切割位点,从肽链内部水解底物,产生大量小片段多肽,从而表现出了高水解度的特点。中性蛋白酶对海参蛋白的水解作用稍低于碱性蛋白酶。风味蛋白酶所含酶的种类复杂,作用范围较广,能够进行比较彻底的酶解。胰蛋白酶和木瓜蛋白底物位点的专一性较高。胃蛋白只能促进各种水溶性蛋白质水解成为多肽,所以其水解能力相对较弱。
2.1.2 六种酶对海参体壁ACE抑制活性的影响 测定六种蛋白酶不同酶解时间的ACE抑制活性,探讨DH对ACE抑制活性的影响,结果见图2。在水解反应的初期,ACE抑制率随水解度的升高而不断上升,在反应后期,水解液的ACE抑制率均有不同程度的下降,可能是因为水解前期具有ACE抑制活性的肽段就被迅速释放出来了,后期ACE抑制肽被降解为无活性的肽或氨基酸,导致酶解产物的抑制活性降低。这说明高水解度不一定具有高ACE抑制活性,即水解度与ACE抑制率之间不存在渐减或渐增的对应关系。由于实验的主要目的是制备ACE 抑制活性强的多肽,ACE抑制活性被作为考察选酶的关键因素,因此选用中性蛋白酶作为制备海参体壁ACE抑制肽的酶。
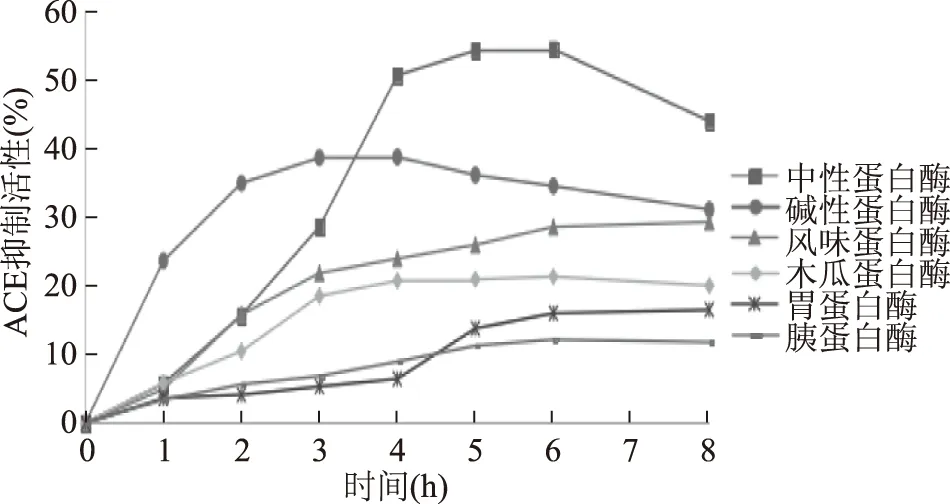
图2 蛋白酶水解产物ACE活性进程曲线Fig.2 ACE inhibitory activity curves of hydrolysates
2.2单因素实验
2.2.1 酶解时间对ACE抑制活性的影响 由图3可知,酶解5 h时,其ACE抑制率最强。当酶解时间在4~5 h,随时间的延长,ACE抑制率增加明显,可能是活性肽量增多。在5~8 h时,ACE抑制率逐渐变小,可能是过度水解生成了ACE抑制活性较低的小分子多肽或游离氨基酸。
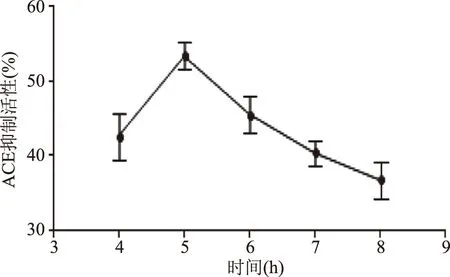
图3 时间对海参ACE抑制活性的影响Fig.3 Effect of time on ACE inhibitory activity
2.2.2 酶解温度对ACE抑制活性的影响 由图4可知,海参多肽ACE抑制率呈先上升后下降的趋势,温度为50 ℃时,ACE抑制率最高,达到54.3%,温度为60 ℃时,ACE抑制率最低,达到27.6%,可以看出温度对酶的作用影响较大。可能原因是温度较低时,没达到中性蛋白酶的最适温度,酶未充分发挥功效。当温度过高时,酶结构破坏,酶活力降低。

图4 温度对海参ACE抑制率的影响Fig.4 Effect of temperature on ACE inhibitory activity
2.2.3 酶解pH对ACE抑制活性的影响 由图5可知,pH7.5时ACE抑制率最强,为51.2%,但随pH变化ACE抑制率变化不显著(p>0.05),可能是由于中性蛋白酶适应的pH较广。由于pH对抑制率影响不明显,因此不作为响应面研究因素,选择抑制率最强点pH7.5作为响应面实验的pH。
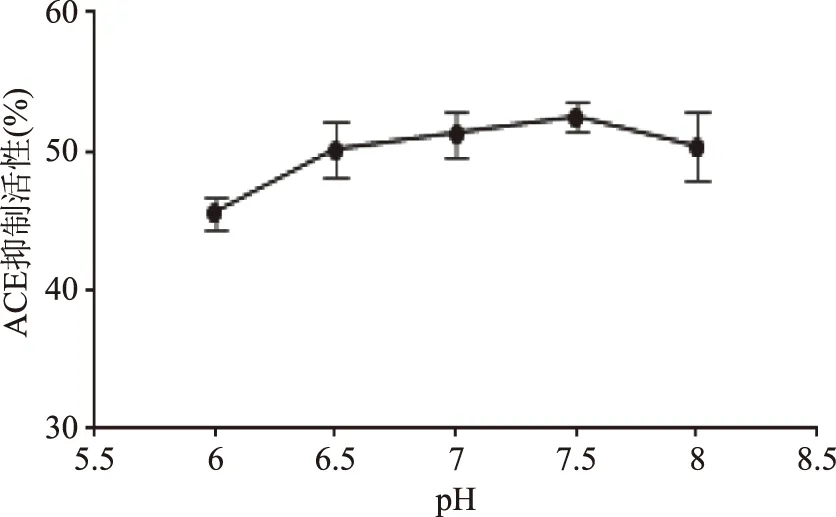
图5 pH对海参ACE抑制率的影响Fig.5 Effect of pH value on ACE inhibitory activity
2.2.4 酶量对ACE抑制活性的影响 由图6可知,ACE抑制率随着酶量的增加而升高,酶量3000 U/g时到达最大值,而后减小,4000 U/g后活性基本保持不变。可能是酶量的增加,促进蛋白水解出活性多肽。当酶到一定量时,部分活性多肽被水解成无活性的小分子肽或游离氨基酸,而后趋于稳定。
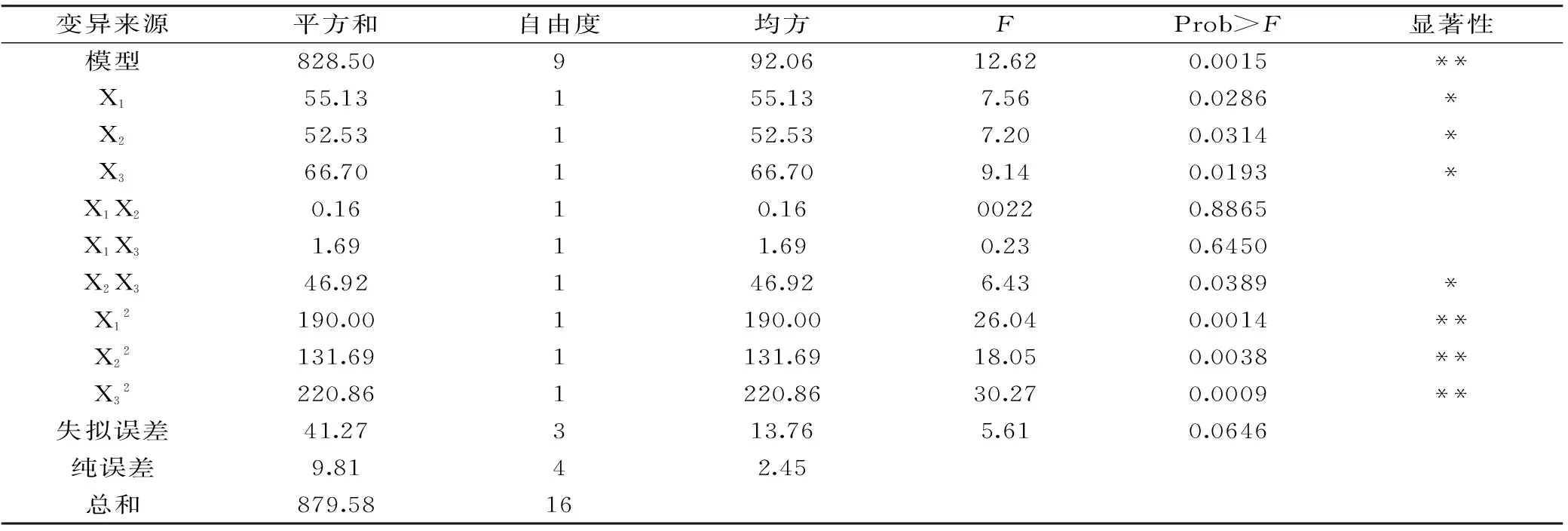
表4 回归系数模型及方差分析表Table 4 Coefficient of regression model and variance analysis
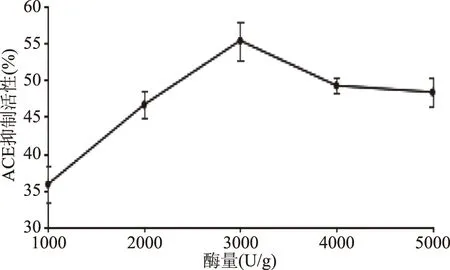
图6 酶量对海参ACE抑制率的影响Fig.6 Effect of enzyme amount on ACE inhibitory
2.3响应面优化实验
2.3.1 回归方程的建立与方差分析 以时间(X1)、温度(X2)、酶量(X3)为响应变量,以ACE抑制率(Y)为响应值进行实验,结果见表3。经过Design Expert 8.0.6统计分析软件处理,得到3个因素与响应值的回归方程为:
Y=54.86+2.63X1-2.56X2+2.89X3+0.2X1X2+0.65X1X3-3.42X2X3-6.72X12-5.59X22-7.24X32
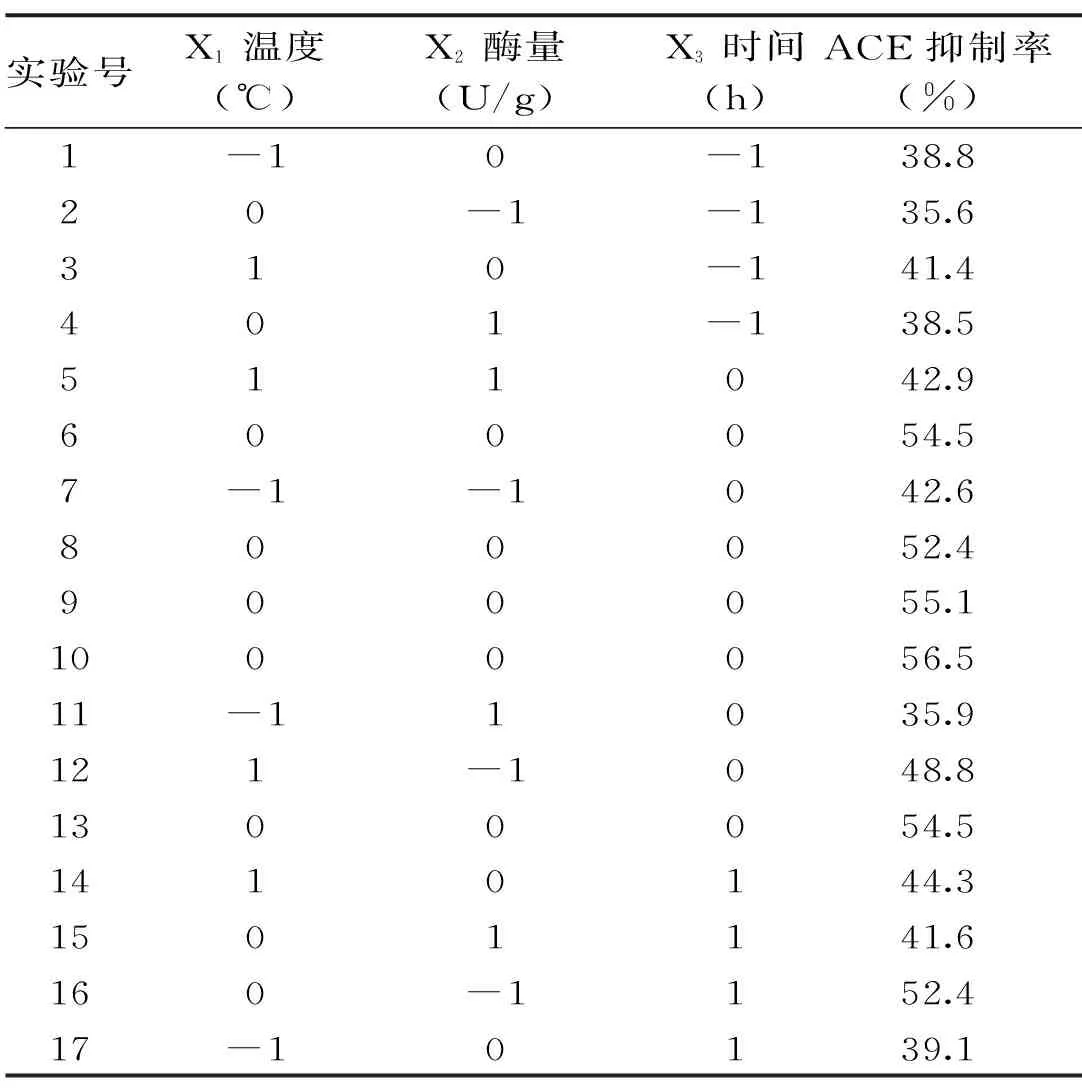
表3 响应面实验设计及结果Table 3 Design and results of response surface experiment

2.3.3 验证实验 按照最佳提取条件进行实验验证,重复三次,同时考虑到实际操作的便利,将ACE抑制肽的最佳酶解条件修正为:酶解温度50 ℃、pH7.5、加酶量3000 U/g、酶解5 h。实际测得的ACE抑制率为56.5%。
2.4酶解液的相对分子量分布
混合标准品的HPLC图谱,如图8,以Rt-lgMw 作对数曲线如图9,得到方程:lgMw=-0.4423Rt+7.9916(R2=0.9978)。图10为中性蛋白酶最佳条件下酶解产物HPLC图。根据方程式,海参酶解液的相对分子量2000 Da以上占13.25%,1000~2000 Da占28.21%,1000~200 Da占了44.1%,200~1000Da组分占的比例较大,这现象与具有ACE抑制活性的多肽主要集中在的2~10肽相符合[21]。

表5 中性蛋白酶酶解液相对分子量分布Table 5 Molecular weight distribution (percent of the total area)of protein hydrolysate
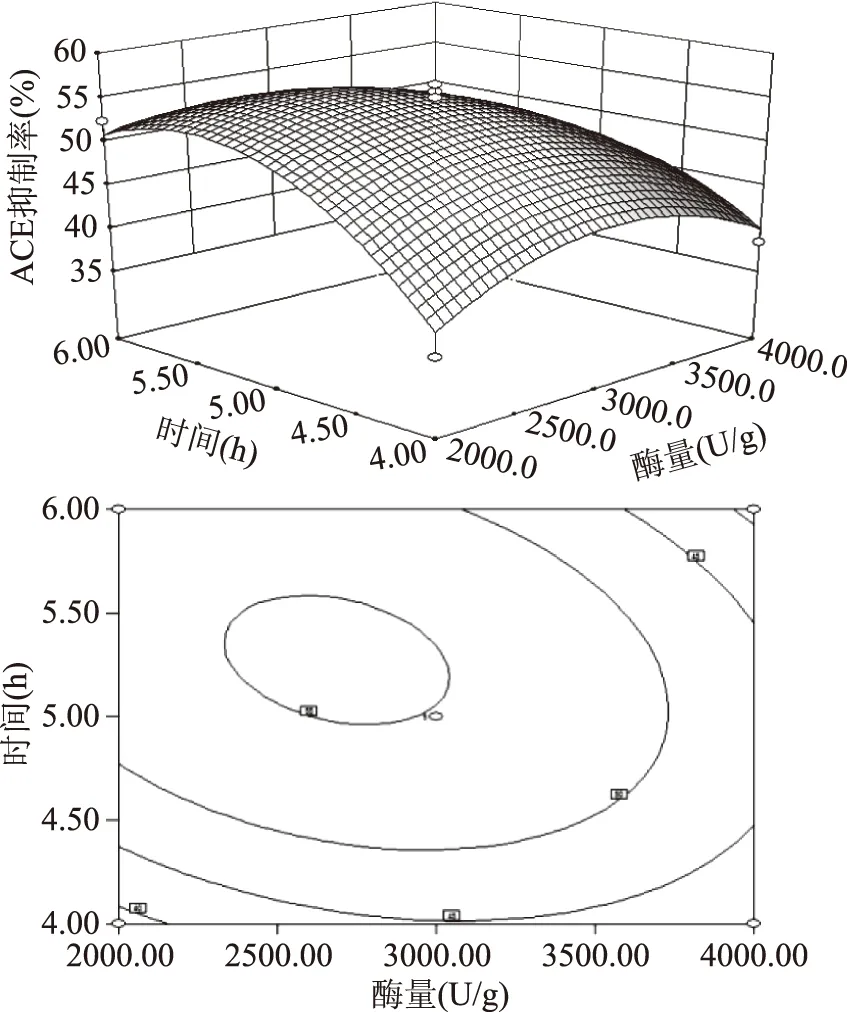
图7 酶量和时间对酶解液ACE抑制率影响的响应曲面和等高线Fig.7 Response surface plot and contour plot revealing effects of amount of enzyme and time on ACE inhibitory rate of hydrolysates

图8 混合标样色谱图像Fig.8 Chromatogram image of mixed standard sample

图9 相对分子质量标准曲线Fig.9 Standard curve of relative molecular weight
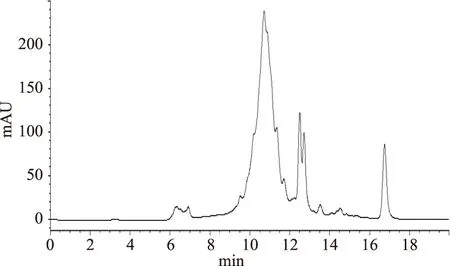
图10 中性酶酶解液的分子量分布色谱图Fig.10 The molecular weight distribution of the protein hydrolysates
3 结论
实验通过初步分析水解度与ACE抑制活性的关系,发现水解度与ACE抑制率之间不存在着对应关系。六种海参体壁蛋白酶解物中,中性蛋白酶解物的ACE抑制率最好。通过采用单因素和响应面法,中性蛋白酶其最佳水解工艺条件为50 ℃、pH7.5、酶量3000 U、酶解5 h条件下,所得酶解产物的ACE抑制率最高,达到56.5%,抑制肽浓度为21.5 mg/mL,此条件下酶解产物经HPLC分析,海参多肽在200~1000 Da(2~10肽)间占了44.1%。
[1]Kuo P. The contribution of depression to mortality among elderly with self-reported hypertension:Analysis using a national representative longitudinal survey[J]. Hypertens,2011,29:2084-2090.
[2]DW Cushman.Development and design of specific inhibitors of angiotensin converting enzyme[J]. American Journal of Cardiology,1982,49(6):1390-1394.
[3]MurrayBA,FitzgeraldRJ. Angiotensin converting enzyme Inhibitory peptides derived from food proteins:bioche emistry,bioactivity production[J].Curr Pharm Des,2011,13:773-791.
[4]Vercruysse L,Van Camp J. ACE inhibitory peptides derived from enzymatic hydrolysates of animal muscle protein[J].Agric Food Chem,2005,53:8106-8115.
[5]Fitzgerald C,Mora-Soler L.Isolation and characterization of bioactive pro-peptides withinvitrorenin inhibitory activities from the macroalga Palmaria palmata[J]. Agric Food Chem,2010,60:7421-7427.
[6]Hao Wu.Hydrolysis and purification of ACE inhibitory peptides from the marine microalga Isochrysis galbana [J].J Appl Phycol,2015,27:351-361.
[7]Lun HH,Lan CX,Yun SC.Analysis of novel angiotensin-I-converting enzyme inhibitory peptides from Protease hydrolyzed marine shrimp Acetes chinensis[J].Pept Sci,2006,12:726-733.
[8]Neyssene Aissaoui. ACE inhibitory and antioxidant activities of red scorpionfish(Scorpaena notata)protein hyohydrolysates[J]. Food Sci Technol,2015,52(11):7092-7102.
[9]Neyssene Aissaoui. ACE Inhibitory and Antioxidant Activities of Novel Peptides from Scorpaena notata Byprodu protein Hydrolysate[J]. Int J Pept Res Ther,2017,23:13-23.
[10]Bougatef A,Nedjar-Arroume N. Angiotensin I-converting enzyme(ACE)inhibitory activities of sardinelle(Sardinella aurita)by-products protein hydrolysates obtained by treatment withmicrobial and visceral fish serine-proteases[J]. Food Chem,2008,11:350-356.
[11]Zhao Y,Bafang L,Dong S. Anovel ACE inhibitory peptide isolated from Acaudina molpa-dioidea hydrolysate [J]. Peptides,2009,30:1028-1033.
[12]伍强.利用鲍鱼性腺制备ACE抑制肽[J]. 中国食品学报,2015,15(10):91-98.
[13]胡晓倩. 海参主要活性成分对大鼠脂质代谢影响的比较研究[J].食品科学,2009,30(23):393-396.
[14]李冰袁. 刺参对运动小鼠抗疲劳作用的研究[J].食品科学,2010,31(15):244-247.
[15]童静静,章元炳.海参多肽的研究进展[J].食品工业科技,2013,34(11):356-360.
[16]丽霞海.海参多肽生物学功能研究进展[J].食品科学,2015,36(9):215-219.
[17]Zhao Yuanhui,LI Bafang. Antihypertensive effectand purification of an ACE inhibitory peptide from sea cucumber gelatinhydrolysate[J]. Process Biochemistry,2007,42(12):1586-1591.
[18]G Raheleh,Z Mohammad. Angiotensin-I Converting Enzyme(ACE)Inhibitory and Anti-Oxidant Activities of Sea Cucumber(Actinopyga lecanora)Hydrolysates[J].International Journal of Molecular Sciences,2015,16(12):28870-28885.
[19]杨文博,张英华. 蛋白质水解度的测定方法研究[J]. 中国调味品,2014,39(3):88-91.
[20]Fitz Gerald R J,Meisel H. Milk protein-derived peptide inhibitors of Angiotmsin-converting enzyme[J]. BrJNutr,2000,84:33-37.
[21]吕乐,刘冬,万红霞,等.碱性蛋白酶 Alcalase 酶解大米蛋白制备小分子肽的动力学研究[J].现代食品科技,2014,30(7):150-153.
StudyonhydrolysisconditionandmolecularweightdistributionofACEinhibitorypeptidederivedfromseacucumberprotein
ZHOUFeng-fang,CAIBin-xin,WUXin-rui,LUOFen
(Department of Biology,Ningde Normal University,Ningde 352100,China)
With the hydrolysis degree and ACE inhibitory rate the index,the optimum enzyme was selected for hydrolyzing sea cucumber protein. The optimal condition for enzymatic hydrolysis was investigated through single factor experiment and orthogonal. HPLC was used to determine the molecular distribution of the hydrolysate. The results showed that the optimum enzyme was neutral protease. The optimized parameters were temperature 50 ℃,time 5h,pH7.5 and amount of enzyme 3000U/g . Under this condition,ACE inhibition rate was up to 56.5% and the relative molecular weight of 200~1000 Da(2~10 peptides)reached 44.1% .
sea cucumber;the degree of hydrolysis(DH);ACE inhibitory peptide;molecular weight distribution
2017-02-20
周逢芳(1978-),男,硕士,讲师,研究方向:活性物质提取和功能研究,E-mail:zhoufengfang123@163.com。
福建省科技重点项目(2014N0016);宁德科技局项目(20130139);校级项目(2015T10)。
TS201.2
:B
:1002-0306(2017)17-0163-06
10.13386/j.issn1002-0306.2017.17.031

