一株高产金属硫蛋白枯草芽孢杆菌的诱导发酵条件优化
, ,,
(1.浙江海洋大学,浙江舟山 316022; 2.国家海洋局第三海洋研究所,福建厦门 361000; 3.福建省海洋生物资源开发利用协同创新中心,福建厦门 361000)
一株高产金属硫蛋白枯草芽孢杆菌的诱导发酵条件优化
邹俊杰1,2,3,张宾1,孙继鹏2,3,*,阎光宇2,3
(1.浙江海洋大学,浙江舟山 316022; 2.国家海洋局第三海洋研究所,福建厦门 361000; 3.福建省海洋生物资源开发利用协同创新中心,福建厦门 361000)
金属硫蛋白为一类广泛存在于生物体内的多功能诱导性蛋白,具有转运储存金属离子、清除自由基、激活(失活)锌调节蛋白等功能,近年来已成为研究与开发的热点。本文以一株基因重组枯草芽孢杆菌为实验对象,对其诱导表达金属硫蛋白发酵条件进行研究。结果表明,枯草芽孢杆菌最优生长条件为:培养温度37 ℃,培养基初始pH7,摇床转速220 r/min,接种量4%;最佳诱导发酵条件为:菌液OD600=3.9,IPTG终浓度1 mmol/L,摇床转速220 r/min,诱导时间48 h,诱导金属Cd2+终浓度为50 μmol/L,发酵培养基无机盐为1% MgSO4、碳源为2%蔗糖、氮源为1.5%酵母浸出物+胰蛋白胨+氯化铵(2∶2∶1),枯草芽孢杆菌MT表达量达到最高为0.135 mg/mL。本研究为开发天然、高效海洋源金属硫蛋白提供了一定理论依据。
金属硫蛋白,枯草芽孢杆菌,发酵
金属硫蛋白(metallothionein,MT)是一类低分子质量、高巯基含量、能结合金属离子,尤其对Cd2+、Zn2+、Cu2+、Au+、Ag+等重金属具有较强亲和力的蛋白质,其广泛存在于从细菌到哺乳动物的多种生物体内,具有金属解毒、清除自由基、抗电离辐射、抗细胞凋亡、增强机体对抗不良状态的适应能力等多种功能,因此在医药、环境检测、保健品、化妆品等领域有广阔的市场应用前景[1]。
目前,由于MT在生物体内具有十分重要的生物学功能,其应用范围也越来越广泛,开发与利用MT已成为热点研究领域。自1957年Margoshes和Vallee[2]等报道从蓄积镉的马肾脏中分离出Cd-MT以来,研究发现几乎能从所有哺乳动物、鱼类、两栖类和某些植物及真核、原核微生物中分离得到Cd-MT[3-4]。陆续有日本学者Naiki[5]等从酿酒酵母IFO 0044 RCU菌株中分离得到不含芳香族氨基酸的MT;Olafson[6]等在蓝细菌中发现MT;Kneer[7]等发现粗糙脉孢菌能诱导类Cu-MT产生;吴传松[8]筛选得到具有产金属硫蛋白能力的酵母菌,并对培养条件进行优化,MT的产量由0.885 mg/g提高到了1.366 mg/g;成玉梁[9]通过对实验室诱变处理得到的金属硫蛋白高产且遗传性状稳定的酿酒酵母进行发酵诱导条件的优化,测得MT产量为0.074(以巯基活性计),较优化前大幅提高。尽管可以从各种动物器官、植物组织中分离提纯MT,但从动植物体中提纯MT仍存在着成本高、周期长等缺点。而利用微生物发酵培养,特别是依靠生物工程菌的培育来生产MT,因其具有无毒、来源可控、成本低廉、周期短等优点,必将受到市场开发的青睐。其中,路延笃[10]构建了猴金属硫蛋白α域表达载体,并用其转化大肠杆菌BL21(DE3),得到了产野生型猴金属硫蛋白的工程菌,MT产率0.76 mg/g。吕品[11]以绿色荧光蛋白为报告基因,构建了金属硫蛋白重组表达载体,并成功转化出产金属硫蛋白的毕赤酵母。苏艳芳[12]采用乳酸乳球菌N-乙酰葡萄糖胺糖苷酶AcmA的C端结构域作为融合标签和锚定功能域,成功实现了人源Ⅰ型金属硫蛋白在大肠杆菌体系的重组表达。
为解决制约MT产业发展原料来源瓶颈,本实验室以海洋源贝类为原料,选择安全的食品级微生物(益生菌)为表达宿主,通过构建MT表达载体,获得益生菌重组菌株,MT初始产率为0.073 mg/mL。其中,枯草芽孢杆菌作为很有吸引力的外源基因表达的宿主,具有以下优点:遗传学先进,生长迅速,培养条件简单,大部分枯草芽孢杆菌可以形成自然感受态,摄取外源DNA;枯草芽孢杆菌具有强大的蛋白质分泌能力,外源蛋白在枯草芽孢杆菌中表达后,蛋白跨越细胞膜,被加工或直接释放到培养基中而不发生聚集,回收和纯化蛋白较为简单;枯草芽孢杆菌分泌的蛋白质产品中不会混杂有胞被内毒素,被广泛应用于传统的食物,饮料发酵,食用防腐剂的生产;枯草芽孢杆菌是许多工业酶制剂的生产菌,因此具有良好的发酵基础和生产技术。另外,食品安全级工程菌(益生菌)作为表达宿主,其生物毒性低、遗传性状稳定,且该菌株八种蛋白酶缺陷,能大幅降低蛋白酶对MT的分解作用。
本研究以WB-800枯草芽孢杆菌工程菌(本实验室重组获得)为研究对象,综合考察其诱导表达金属硫蛋白发酵条件,获得MT高效表达最佳途径,得到MT样品,为开发天然、高效海洋源重金属生物解毒剂提供理论依据。
1 材料与方法
1.1材料与仪器
菌种:WB-800枯草芽孢杆菌工程菌(由国家海洋局第三海洋研究所保藏)。
麦芽糖、蔗糖、葡萄糖、无水硫酸镁、氯化钠、氯化锌、氯化钙、氯化铵、氯化镉、亚硒酸钠、乙二胺四乙酸二钠(EDTA)、乙腈、甲醇、氢氧化钾、硼酸、磷酸氢二钾、磷酸二氢钾等,以上试剂均为分析纯 西陇化工股份有限公司。
Tris-(2-carboxylethyl)-phosphine(三(2-酰乙基)磷盐酸盐)、Ammnium 7-Fluoro-2,1,3-bzoxadiazole-4-sulfonate(SBD-F衍生剂)、兔肝金属硫蛋白标准品(≥90%),Sigma-Aldrich上海贸易有限公司。
LB培养基、技术琼脂粉、Glycerol(甘油)、Neomycin Sulfate(硫酸新霉素)、Chloramphenicol(氯霉素)、IPTG Dioxane Free(异丙基硫代半乳糖苷)等,以上试剂均为分析纯 北京索莱宝科技有限公司。
平板培养基:酵母浸出物5 g/L,胰蛋白胨10 g/L,氯化钠10 g/L,琼脂粉15 g/L,自然pH。
LB培养基:酵母浸出物5 g/L,胰蛋白胨10 g/L,氯化钠10 g/L,自然pH。
UV-1780紫外可见分光光度计 岛津仪器有限公司;Waters e2695高效液相色谱仪 2475荧光检测器,沃特世科技有限公司;QTY-70S恒温摇床 上海知楚仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂等。
1.2菌种培育和优化
将-20 ℃保存菌种转接到平板培养基,37 ℃活化24 h。取一环活化菌种,接入装有50 mL LB培养基的200 mL三角烧瓶中,37 ℃,200 r/min育种20 h。取一定体积OD600=3.5的种子液,接入装有50 mL LB培养基的200 mL三角烧瓶中,保持装液量和37 ℃条件不变,分别优化培养基初始pH、摇床转速和接种量对菌种培育影响。各影响因素设计如下:培养基初始pH:5.0、6.0、7.0、8.0、9.0;摇床转速180、200、220、240 r/min;接种量1%、2%、4%、8%,每组设置三个平行实验,每2 h取样测定菌液OD600,确定最佳菌种培育条件。
1.3诱导发酵和优化
菌株在最佳条件下(培养基初始pH为7,培育转速为220 r/min,接种量为4%)培养,分别加入一定体积的葡萄糖、IPTG诱导剂、ZnSO4、Na2SeO3、CdCl2,37 ℃下摇瓶诱导发酵。分别考察了菌液OD600、IPTG终浓度、摇床转速、金属添加量及诱导发酵时间对菌株表达MT影响。各影响因素设计如下:菌液OD6001.0、2.0、3.0、3.9;IPTG诱导剂量0、50、100、500、1000 μmol/L;摇床转速180、200、220、240 r/min;诱导时间24、48、72 h;ZnSO4、Na2SeO3、CdCl2分别设立0、50、100、200、500、700 μmol/L,每组设置三个平行实验,测定发酵液中MT含量,确定最佳诱导发酵条件。
同时对发酵培养基中2%碳源(甘油、麦芽糖、蔗糖、葡萄糖);1.5%氮源(牛肉浸出粉(一号)、酵母浸出物+胰蛋白胨+氯化铵(2∶2∶1)(二号)、酵母浸出物+胰蛋白胨+尿素(2∶2∶1)(三号)、酵母浸出物+胰蛋白胨(1∶1)(四号));1%无机盐(硫酸镁、磷酸氢二钠+磷酸二氢钠(1∶1)、空白、氯化钠)分别进行考察,择出最优发酵培养基条件。
1.4 MT测定方法
取20 μL MT上清液,依次加入3 μL 20%TCEP,10 μL 1 mg/mL SBD-F,75 μL反应缓冲液(1 mol/L硼酸、30 mmol/L EDTA、0.8 mol/L KOH,pH10.5)振荡混匀,50 ℃水浴条件下反应30 min后,加入10 μL 4 mol/L HCl终止反应,用定容缓冲液(20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH7.5)定容至1 mL,振荡混匀,采用高效液相色谱法测定(流动相:乙腈∶甲醇∶定容缓冲盐=18∶2∶80;色谱柱:伊利特ODS-BP C18(4.6 mm×250 mm,5 μm);柱温:35 ℃;洗脱时间:20 min;流速:0.5 mL/min;激发波长:380 nm,发射波长:510 nm)[13]。
1.5数据处理方法
精确量取兔肝MT标准品,逐级稀释至0.05、0.1、0.15、0.2、0.25 mg/mL,HPLC法测定后绘制标准曲线(方法同1.4),将所测样品峰面积代入标准曲线,得到MT含量。
2 结果与讨论
2.1菌种培育条件优化
2.1.1 初始pH对菌种培育的影响 在菌体培育过程中,因营养物质的消耗和菌体生长代谢所产生的分泌物,导致菌液pH上升或下降,此过程通常不可控,所以大多数发酵培养仅对培养基的初始pH进行优化调控。培养基的初始pH主要影响菌体细胞膜电荷、膜渗透性及营养物质离子化程度,合适的初始pH能显著促进菌体对养分的分解与吸收。如图1所示,在初始pH6~8范围内,枯草芽孢杆菌的生长状况良好,稳定期内菌体密度较大。初始pH为7时,菌体24 h内生长最为活跃,在24~36 h内的生长稳定期菌体密度大,宋文龙[18]等发现,培养基初始pH低于6.8或高于7.6均不利于枯草芽孢杆菌的生长,当pH为7.2时活菌数最高,与本实验得出结论接近,故选初始pH7为培养基最佳初始pH。
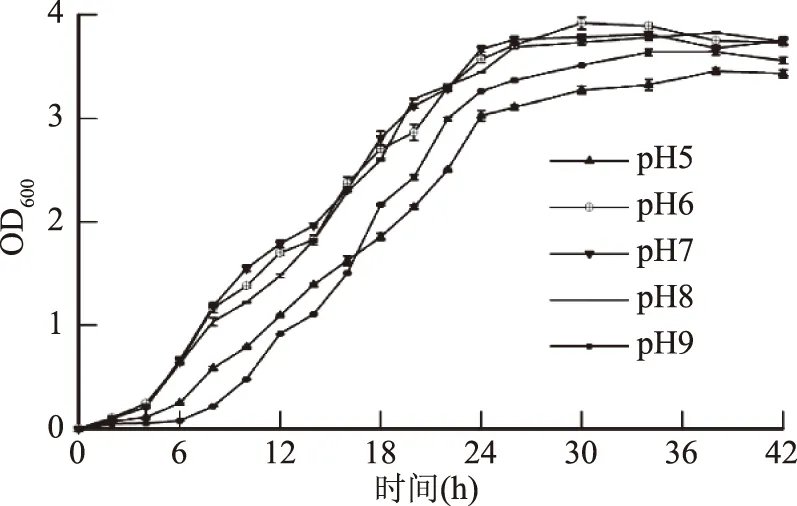
图1 初始pH对菌种培育的影响Fig.1 Effect of pH on cultivation of Bacillus subtilis
2.1.2 摇床转速对菌种培育的影响 枯草芽孢杆菌为好氧性细菌,摇瓶中的氧气量将直接影响细菌的生长和活性物质的产生。当装液量一定时,摇床转速为影响瓶内氧气量的重要因素。如图2所示,在180~240 r/min之间,随着转速的增加,菌体生长加快,但培养42 h后,220 r/min与240 r/min两组的OD600较高,这可能是因为后期菌体密度增大,过低的摇床转速已经不能满足所有菌体的供氧需求。周映华[19]等对枯草芽孢杆菌生长设立摇床转速:150、200、220、250、300 r/min,发现随着转速提高,OD600值升高,并在220 r/min时菌体密度达到峰值,与本文实验结果相符。故选取220 r/min为最佳培养转速。

图2 摇床转速对菌种培育的影响Fig.2 Effect of rotate speed on cultivation of Bacillus subtilis
2.1.3 接种量对菌种培育的影响 在发酵过程中,一般选取生长稳定期内的菌体用于后期诱导实验,这样既可保持高的细胞活力,又可获得尽可能多的细胞数。如图3所示,培养26 h时,接种量4%与8%组就已达到生长最高峰,而1%组别的生长最高峰出现在34 h。考虑到实际生产中的时间成本,故剔除1%与2%组别。对于8%组别,由于接种量过大,会造成菌体早衰,导致发酵后劲不足,张晓玲[20]等在利用枯草芽孢杆菌产胞外多糖的实验中也认为,由于枯草芽孢杆菌属好氧菌,当接种量过高时,导致氧气量和底物量不足,影响其生长继而影响次级代谢产物的表达,故本实验选取4%为菌体培育最佳接种量。
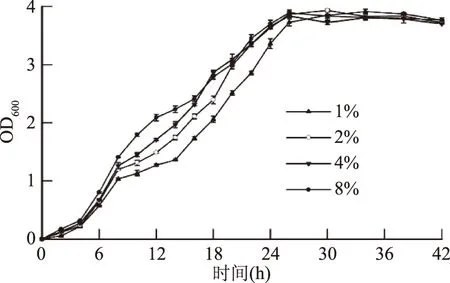
图3 接种量对菌种培育的影响Fig.3 Effect of inoculum rate on cultivation of Bacillus subtilis
2.2诱导发酵条件优化

图4 转速、诱导OD600、诱导时间和IPTG剂量对MT产量的影响Fig.4 Effect of rotate speed,OD600,Induction time,and IPTG on production of MT
2.2.1 诱导OD600、IPTG剂量、转速和诱导时间 同2.1.2所述,发酵过程中的氧气量决定了外源蛋白的表达量,如图4所示,在200~240 r/min范围内,MT的表达水平差距较小,为避免因过高的摇床转速引起菌体机械损伤,故选220 r/min为最佳诱导摇床转速。
诱导剂的加入触发诱导菌体启动子,菌体的生长受到抑制,合理选择诱导剂加入的时间点,可使培养基中的营养得到合理消耗,从而提高目的产物的表达量。如图4所示,随着诱导OD600的增加,发酵液中MT的含量也随之增加,这说明MT的表达量是与菌体密度成正相关,OD600=3.9时,正是菌体生长的最高峰,细胞活性高,菌体密度大,为此选取OD600=3.9为最佳诱导OD600。
如图4所示,当发酵时间为48 h时,MT的表达量达到最高,继续延长发酵时间MT的产量基本稳定,原因可能是当培养时间足够长时,由于累积产物的自我抑制作用以及生长过程中产生的其他不利物质的影响和作用,导致菌体诱导培养过程中整体效果变差,目的产物积累趋于稳定[17],故选48 h为最佳诱导时间。
IPTG会抑制菌体生长,诱导目的蛋白的表达,一般IPTG诱导浓度在0.1~1 mmol/L之间。如浓度过低,菌体生长过快消耗营养物质,使目的蛋白表达较少;浓度过高,细菌受到太强的抑制而生长不良,目的蛋白表达减少[8]。如图4所示,IPTG终浓度在1 mmol/L达到最大MT表达量。
2.2.2 诱导培养基 氮是构成重要生命物质蛋白质和核酸的主要元素,占菌体干重的12%~15%,是微生物发酵的主要营养[22]。枯草芽孢杆菌利用有机氮源的能力优于无机氮源,其中,因酵母浸出物富含氨基酸、维生素以及未知生长因子为枯草芽孢杆菌优良生长氮源。如图5所示,酵母浸出物+胰蛋白胨+氯化铵(2∶2∶1)组别相较其他组别为最佳诱导发酵培养基的氮源,其峰值MT表达量达到0.083 mg/mL。

图5 培养基对MT产量的影响Fig.5 Effect of culture medium on production of MT
除水分外,碳源是微生物生长和发酵需要最多的营养物质,占细胞含量的50%[23]。秦艳[21]等认为枯草芽孢杆菌利用单糖和二糖的能力优于多糖,故本实验选用无机碳源:麦芽糖、蔗糖、葡萄糖三组,有机碳源:甘油一组。如图5所示,甘油和麦芽糖相比对照组葡萄糖其MT表达量较小,而蔗糖组的MT表达量达到0.075 mg/mL,故选用2%的蔗糖作为诱导发酵培养基的碳源。
蛋白表达过程中,除碳源和氮源外,微量元素对生物活性有很大的调节作用。如图5所示,无机盐对MT表达量有利的顺序依次为:硫酸镁>磷酸盐>空白>氯化钠。硫酸镁组别MT的表达量达到0.090 mg/mL,相较空白组别提高了17%,故选用1%的硫酸镁作为诱导发酵培养基的无机盐。
2.2.3 诱导金属量 MT的合成可被许多因素如重金属、激素等所诱导,并可与多种金属结合。MT对常见金属的相对亲和力依次为Ag>Hg>Cu>Cd>Zn>Co=Ni[14]。如若金属流入量超过了现有的MT存留量时,金属离子则被其他蛋白质利用,同时启动MT的基因转录,加速诱导MT的合成,降低游离金属离子的水平,同时也有效减少刺激MT合成的因素,从而使细胞内金属离子数量维持相对平衡[15]。
如图6所示,Se4+终浓度在50~700 μmol/L范围内,MT的整体表达水平相较Cd2+和Zn2+并不理想,可能是由于Se4+自身双性特质,并且需将四价Se4+还原至二价,导致半胱氨酸残基对Se4+的结合能力有限。其中,当Se4+终浓度为100 μmol/L时,MT表达量达到峰值0.105 mg/mL。

图6 诱导金属量对MT产量的影响Fig.6 Effect of metal dose on production of MT
苗兰兰[17]等发现MT的两个结构域包含20个半胱氨酸(Cys)残基,通常能和7个Zn2+结合。Zn2+终浓度在50~700 μmol/L范围内,MT的表达量差异性较小,当Zn2+终浓度为700 μmol/L时,MT表达量达到峰值0.115 mg/mL。
当Cd2+终浓度为50 μmol/L时,MT表达量达到峰值0.135 mg/mL,随着Cd2+浓度的增大,由于Cd自身毒性作用较强,在诱导的同时也会抑制菌体活性,使MT表达量下降[16]。再者,考虑后期金属脱除实验中Cd2+的脱除,故选用50 μmol/L为Cd2+诱导终浓度。
综合考虑MT表达量和金属诱导剂量,选择Cd2+为最佳诱导金属,其终浓度为50 μmol/L。
3 结论
本研究以实验室保藏的一株高产MT的枯草芽孢杆菌WB-800为对象,进行培育诱导条件优化。枯草芽孢杆菌最优生长条件为:培养温度37 ℃,培养基初始pH7,摇床转速220 r/min,接种量4%;最佳诱导发酵条件为:菌液OD600=3.9,IPTG终浓度1 mmol/L,摇床转速220 r/min,诱导时间48 h,诱导金属Cd2+终浓度为50 μmol/L,发酵培养基无机盐为1% MgSO4、碳源为2%蔗糖、氮源为1.5%酵母浸出物+胰蛋白胨+氯化铵(2∶2∶1),MT表达量达到0.135 mg/mL,相较于初始MT产率0.073 mg/mL,优化效果显著。
现如今极大部分工程菌对MT实行胞内分泌,后期纯化过程中需经过细胞反复冻融破壁,采用有机溶剂粗提、浓缩后才能进一步提纯,导致发酵时间成本和经济成本较高。而本实验所采用菌株对MT实行胞外分泌,MT产率基数大并且发酵液可直接通过升温、离心、膜分离等物理手段进行提取分离,其操作简便、经济,且有效规避了因添加有机溶剂等对发酵产物造成污染,本研究可为MT的大规模工业化生产提供可行性技术途径。
[1]雍政. 探索一种硒诱导的新型金属硫蛋白[D]. 北京:中国人民解放军军事医学科学院,2003.
[2]Margoshes M,Vallee B L. A cadmiun protein from equine kidney cortex[J]. Journal of the American Chemical Society,1986,79(17):4813-4814.
[3]Winge D R,Premakumar R,Wiley R D,et al. Copper-chelatin:Purification and properties of a copper-binding protein from rat liver[J]. Archives of Biochemistry & Biophysics,1975,170(1):253-266.
[4]Comeau R D,Mcdonald K W,Tolman G L,et al. Gram scale purification and preparation of rabbit liver zinc metallothionein[J]. Preparative Biochemistry,1992,22(2):151-64.
[5]Naiki N,Yamagata S. Isolation and some properties of copper-binding proteins found in a copper-resistant strain of yeast[J]. Plant and Cell Physiology,1976,17(6):1281-1295.
[6]Olafson R W. Purification of prokaryotic metallothioneins[J]. Methods in Enzymology,1991,205:283-286.
[7]Kneer R,Kutchan T M,Hochberger A,et al.Saccharomycescerevisiaeand Neurospora crassa contain heavy metal sequestering phytochelatin[J]. Archives of Microbiology,1992,157(4):305-310.
[8]吴传松. 类金属硫蛋白产生菌的分离培养及特性研究[D].武汉:华中科技大学,2009.
[9]成玉梁,姚卫蓉,钱和. 一种产金属硫蛋白的酿酒酵母(Saccharomycescerevisiae)发酵工艺的研究[J]. 食品工业科技,2009,30(1):170-173.
[10]路延笃. 金属硫蛋白突变体的构建、表达及工程菌对重金属的吸附[D]. 武汉:华中农业大学,2007.
[11]吕品. 金属硫蛋白基因工程菌的构建及其对重金属响应的研究[D].太原:山西大学,2011.
[12]苏艳芳. 人源金属硫蛋白hMT-I的重组表达及其在乳酸乳球菌的表面展示[D]. 广州:华南理工大学,2015.
[13]王俊坤. 海洋源金属硫蛋白的提取、纯化和检测[D]. 青岛:中国海洋大学,2013.
[14]徐卓立,雍政,何冰. 蛋白质芯片及其在临床医学上的应用[J].国际肿瘤学杂志,2002,29(2):86-89.
[15]王诵涛,谢鹏,张敏红,等. 金属离子对细胞内金属硫蛋白基因调控的影响[J]. 中国畜牧兽医,2010,37(9):67-69.
[16]Kondo Y,Rusnak J M,Hoyt D G,et al. Enhanced apoptosis in metallothionein null cells[J]. Molecular Pharmacology,1997,52(2):195-201.
[17]苗兰兰. 产金属硫蛋白菌株的诱变育种及蛋白的分离提纯[D].大庆:黑龙江八一农垦大学,2013.
[18]宋文龙,丛丽娜,王红英. 枯草芽孢杆菌发酵条件的优化及微生态制剂的研制[J]. 食品工业科技,2013,34(17):206-209.
[19]周映华,吴胜莲,贺月林,等. 饲用枯草芽孢杆菌发酵条件的优化[J].湖南农业科学,2010(11):21-23.
[20]张晓玲,陈历俊,牟光庆. 一株产胞外多糖枯草芽孢杆菌发酵条件的优化[J]. 中国食品添加剂,2012(1):181-185.
[21]秦艳,李卫芬,黄琴. 枯草芽孢杆菌发酵条件的优化[J].饲料研究,2007(12):70-74.
[22]曹文娟,吴蔓莉,张明辉,等. 石油降解菌的筛选优化及其对油污土壤的修复特性[J].环境工程学报,2014,8(12):5493-5498.
[23]袁志辉,王健,杨文蛟,等. 土壤微生物分离新技术的研究进展[J].土壤学报,2014(6):1183-1191.
Optimizationofinducedfermentationconditionsforahigh-yieldingBacillussubtilisofmetallothionein
ZOUJun-jie1,2,3,ZHANGBin1,SUNJi-peng2,3,*,YANGuang-yu2,3
Metallothionein(MT)is a kind of multifunctional inducible protein widely distributed in the organism,with the functions of transportation and storage of metal ions,scavenging free radicals function,activation(inactivation)function of zinc regulatory proteins,and has been one of the hot fields of biology and medicine in basic research and applied research in recent years. In this paper,the fermentation conditions of a strain of high yield recombinantBacillussubtilisstrain were optimized. Through the single factor experiment,the optimal conditions for the growth of recombinantBacillussubtilisas follows,temperature 37 ℃,initial pH7,rotation speed 220 r/min,inoculation amount 4%,and the optimal fermentation conditions of induction as follows,OD600=3.9,IPTG concentration 1 mmol/L,the rotate speed 220 r/min,the induction time 48 h,50 μmol/L Cd2+,MgSO4(1%),sucrose(2%),nitrogen source(1.5%yeast extract+peptone+ammonium chloride)(2∶2∶1),the expression of MT reached 0.135 mg/mL. This study provides some theoretical basis for the development of the natural,efficient marine source metallothionein.
metallothionein;Bacillussubtilis;fermentation
2017-03-03
邹俊杰(1993-),男,硕士研究生,研究方向:天然产物开发与利用,E-mail:610720754@qq.com。
*通讯作者:孙继鹏(1980-),男,博士,研究方向:海洋药物与食品化学,E-mail:jpsun@tio.org.cn。
国家海洋局第三海洋研究所基本科研业务费专项资金资助项目(海三科2016031);福建省科技计划引导性项目“海洋源金属硫蛋白基因重组高效表达及发酵技术研究”。
(1.Zhejiang Ocean University,Zhoushan 316022,China;2.Third Institute of Oceanography,State Oceanic Administration,Xiamen 361000,China;3.Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources,Xiamen 361000,China)
TS201.3
:A
:1002-0306(2017)17-0130-06
10.13386/j.issn1002-0306.2017.17.025

