响应面法优化复合乳酸菌抑制荧光假单胞菌作用
,,, ,,*,,
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.北京林业大学生物科学与技术学院,北京 100083;3.大连东霖食品股份有限公司,辽宁大连 116101)
响应面法优化复合乳酸菌抑制荧光假单胞菌作用
孙梦桐1,马欢欢1,吕欣然2,林洋1,白凤翎1,*,励建荣1,宋强3
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.北京林业大学生物科学与技术学院,北京 100083;3.大连东霖食品股份有限公司,辽宁大连 116101)
目的:优化抑制荧光假单胞菌的复合乳酸菌组合。方法:应用牛津杯琼脂扩散法筛选对荧光假单胞菌具有协同抑制作用的复合乳酸菌,通过响应面法进行优化。结果:从11组复合乳酸菌中筛选获得LactobacillusplantarumDY4-2、Lb.sakeiYP4-5和Lb.sakeiLY1-6组合的抑菌作用最强,对荧光假单胞菌的抑菌直径为25.29 mm,比DY4-2、YP4-5和LY1-6单菌株分别高出2.93、4.80和5.35 mm。利用Box-Behnken进行三因素三水平的实验设计,以抑菌直径为响应值进行分析,优化最佳条件为:菌株DY4-2、YP4-5和LY1-6复合比 2∶3∶1、培养温度25 ℃、培养时间为48 h,优化的抑菌直径为25.84 mm。结论:乳酸菌复合可有效增加菌株间的协同作用,增加对荧光假单胞菌的抑菌活性,为研发高效控制水产品腐败菌乳酸菌生物制剂提供理论依据。
复合乳酸菌,荧光假单胞菌,抑菌作用,响应面,优化
荧光假单胞菌(Pseudomonasfluorescens)可引起低温条件下鱼类、虾和蟹等水产品的腐败变质[1-2]。崔方超等[2]从冷藏大菱鲆体表分离获得导致鱼体腐败的特定腐败菌菌株P001,经鉴定为Pseudomonasfluorescens。同时,天然鱼类肠道也是拮抗性乳酸菌的主要来源,Zhang等[3]从黑鲷鱼肠道中分离获得1株乳酸菌Leuconostoclactis对Proteusvulgaris、EscherichiacoliO157和Salmonellatyphimurium抑菌直径分别为13.30、13.70、12.70 mm。缪璐欢等[4]研究从鲤鱼肠道中分离出对EscherichiacoliO157∶H7具有较强拮抗活性的菌株LactobacillussakeiLY-19和LactobacillusplantarumLY-21,其抑菌直径分别为15.98 mm和16.32 mm。Kaynar等[5]从红鲷鱼肠道中分离获得菌株LactobacillusxylosusHC9对目标菌BacillusmegateriumP4具有较强的抑制作用。本研究前期应用从鲈鱼肠道获得LactobacillussakeiLY1-6对P.fluorescens进行抑制作用研究,并已取得良好效果[6]。但尚未应用复合乳酸菌对大菱鲆中优势腐败菌P.fluorescens进行抑菌作用研究。

表1 海鱼源性乳酸菌的11种不同组合Table 1 The 11 different composition of LAB derived marine fish
复合乳酸菌是将两种或两种以上的乳酸菌菌株混合后共培养,其发酵能力和抑菌效果均强于单株乳酸菌[7]。复合乳酸菌在食品生产和保鲜中的应用已有相关报道[8]。徐安书等[9]研制茎瘤芥叶胡萝卜混合汁复合乳酸菌发酵饮料,发现用嗜热链球菌、植物乳杆菌和嗜酸乳杆菌按1∶1∶1比例接种量2%研制的活菌型蔬菜汁复合乳酸菌发酵饮料,在4 ℃低温条件下可保存1个月。唐文静等[10]研究发现复合乳酸菌(LactobacilluscaseiLC1、LactobacillusplantarumLP1和乳酸菌L3)对Pseudomonasfragi和Shewanellaputrefacens抑菌效果强于单株乳酸菌,且4 ℃冷藏条件下与单株乳酸菌相比,复合乳酸菌有效延长了冷藏海鲈鱼块贮藏期。
响应面法(response surface methodology,RSM)基于数学与统计学结合,以体系的响应作为一个或多个因素的函数,拟合获得二次多项回归方程,并运用图形将函数关系表示出,后选择实验设计中的最优化条件[11]。可有效、快速地确定多因子系统的最优条件,已广泛应用于各类发酵条件和工艺参数等条件的优化[12-14]。
本文利用来源于海鱼肠道中无交叉拮抗作用的乳酸菌为出发菌株,筛选对荧光假单胞菌具有协同抑制作用的乳酸菌组合。采用响应面法优化复合乳酸菌的菌量比、培养温度和培养时间等因素,以增强复合乳酸菌的抑菌效果,旨在为应用乳酸菌生物防腐剂控制水产品中荧光假单胞菌提供理论依据。
1 材料与方法
1.1材料与仪器
乳酸菌菌株及来源 本实验室前期从海水鱼类肠道中分离获得的乳酸菌,S1(LactobacillusplantarumLP1-4)分离于大菱鲆肠道,S2(LactobacillusplantarumDY4-2)分离于刀鱼肠道,S3(LactobacillussakeiYP4-5)分离于牙鲆肠道,S4(LactobacillussakeiLY1-6)分离于鲈鱼肠道;指示菌PseudomonasfluorescensP001,分离于大菱鲆体表;MRS培养基、MRS营养琼脂、LB肉汤、LB营养琼脂培养基 北京奥博星生物技术有限公司;脱脂乳 上海钰博生物科技有限公司。
PHSJ-3F实验室pH计 上海仪电科学仪器股份有限公司;DL-CJ-2N型超级洁净工作台 东联哈尔(北京)仪器制造有限公司;LRH系列生化培养箱 上海一恒科学仪器有限公司;赛福智能生化培养箱 宁波海曙赛福实验仪器厂;GI54DS立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;IKA旋涡振荡器 北京卓信伟业科技有限公司;IKA磁力搅拌器 北京悠扬机电设备有限公司。
1.2实验方法
1.2.1 拮抗性乳酸菌测定 将保藏于-80 ℃ 4株乳酸菌分别接种于10%脱脂乳37 ℃活化12 h,后接种于MRS平板上连续培养2代至正常代谢水平。挑取活化后乳酸菌单菌落接种于MRS液体培养基中,37 ℃培养24 h,以荧光假单胞菌为指示菌,参照alomskiené等[15]利用牛津杯琼脂扩散法用制备好的发酵液进行抑菌实验。4株乳酸菌经无菌生理盐水10倍梯度稀释,制成约106CFU/mL菌悬液,4 ℃保存备用。
1.2.2 抑制荧光假单胞菌乳酸菌的交叉拮抗实验 参照李曼等[16]方法并稍作修改,采用交叉拮抗法筛选4株乳酸菌分别选用其中一株乳酸菌为供试菌株,其余3株乳酸菌菌株为目标菌。按照1.2.1进行抑菌实验。
1.2.3 抑制荧光假单胞菌复合乳酸菌抑菌实验 4株乳酸菌按排列组合C(n,m)得到11种混合乳酸菌组合(见表1),组内按1∶1、1∶1∶1和1∶1∶1∶1的比例将制备好的乳酸菌菌悬液混合,后分别以2%接种量置于10 mL MRS液体培养基,37 ℃培养48 h。按照1.2.1进行抑菌实验。
1.2.4 单因素及响应面实验设计
1.2.4.1 菌量比对荧光假单胞菌抑制作用的影响 将上述1.2.3实验得到对荧光假单胞菌具有最佳抑菌效果的组合进行正交实验,设计三因素三水平见表2。获得不同配比的乳酸菌组合,按照表中不同乳酸菌菌量的配比将制备好的乳酸菌菌悬液进行混合,后分别以2%的接种量置于10 mL MRS液体培养基,37 ℃培养48 h,按照1.2.1进行抑菌实验。
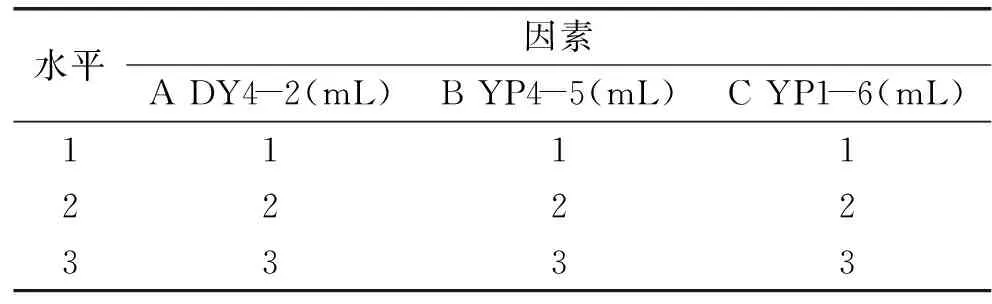
表2 三因素三水平正交表Table 2 The orthogonal table of three factors and three levels

表4 乳酸菌对荧光假单胞菌抑制作用Table 4 The inhibitory activity of LAB against P. fluorescens
1.2.4.2 培养温度对荧光假单胞菌抑制作用的影响 选择培养温度20、25、28、30、35、37 ℃,取200 μL复合乳酸菌悬液(菌量比为2∶3∶1)于10 mL MRS液体培养基中,分别在不同的培养温度条件下培养48 h,取发酵液按照1.2.1进行抑菌实验。
1.2.4.3 培养时间对荧光假单胞菌抑制作用的影响 选择培养时间为12、24、32、48、60、72 h,取200 μL复合乳酸菌菌液(复配比例2∶3∶1)接种于10 mL MRS液体培养基中,25 ℃静置培养,取不同培养时间的发酵液按照1.2.1进行抑菌实验。
1.2.5 响应面法优化抑菌条件 在单因素实验的基础上,选取菌株DY4-2、YP4-5 和LY1-6菌量比、温度和时间这3个因素作为多因素交叉组合实验的考察因素,以抑菌直径作为响应值,利用响应面方法中的Box-Behnken Design方法设计实验,通过实验数据拟合得到二阶响应模型,最终确定最优实验条件。每一个自变量的低、中、高水平分别以-1、0、1进行编码。实验因素水平编码见表3。

表3 Box-Behnken中心组合实验设计因素和水平Table 3 Factors and levels of Box-Behnken design
1.2.6 数据处理 实验均重复测定3次,数据采用平均值±标准差表示。采用SPSS 18.0和Design Expert 8.06软件对数据进行统计学分析,采用Origin 8.0软件进行绘图。
2 结果与分析
2.1拮抗性乳酸菌测定
4株乳酸菌发酵液对荧光假单胞菌的抑菌结果如表4所示,从中可看出,4株乳酸菌对荧光假单胞菌均具有较好的抑制作用,其中菌株DY4-2 抑菌效果最强,抑菌圈直径为20.36 mm;LP1-4次之,抑菌圈直径为19.61 mm;菌株LY1-6和YP4-5相对较弱。
2.2乳酸菌菌株间的交叉抑制作用
图1是乳酸菌菌株间交叉抑制测定结果(指示菌:LP1-4;供试菌:DY4-2、YP4-5和LY1-6),从中可看出,菌株DY4-2、YP4-5和LY1-6均无抑菌圈出现,表明菌株LP1-4与其余3株菌间无抑制作用。后分别以菌株DY4-2、LY1-6和DY4-2作为指示菌,也均无抑制作用(图均未列出)。结果表明,4株乳酸菌均无交叉抑制作用。因此,可作为复合乳酸菌实验的标准菌株。

图1 乳酸菌菌株间交叉拮抗结果Fig.1 Cross antagonistic results of strain of lactic acid bacteria
2.3抑制荧光假单胞菌复合乳酸菌抑菌实验
4株乳酸菌按排列组合C(n,m)得到11种混合乳酸菌组合抑菌结果图2所示,A图是第1组、第8组和第11组抑菌效果图,从中可看出,第8组复合乳酸菌抑菌直径明显大于其余2组,对荧光假单胞菌抑制作用最强,抑菌直径为25.29 mm。B图为11组的复合乳酸菌抑菌结果,复合乳酸菌的第1~5组和10~11组对荧光假单胞菌抑菌效果较差,抑菌圈直径均处于20.00 mm左右,而第6~9组的复合乳酸菌抑菌效果较强,抑菌圈直径均高于22.00 mm。第8组抑菌作用最强,其次是第6、7和9组,抑菌直径分别为22.45、22.11、23.05 mm。因此,选用第8组(S2:菌株DY4-2、S3:菌株YP4-5 和S4:菌株LY1-6)作为最佳复合乳酸菌组合进行下一步研究。
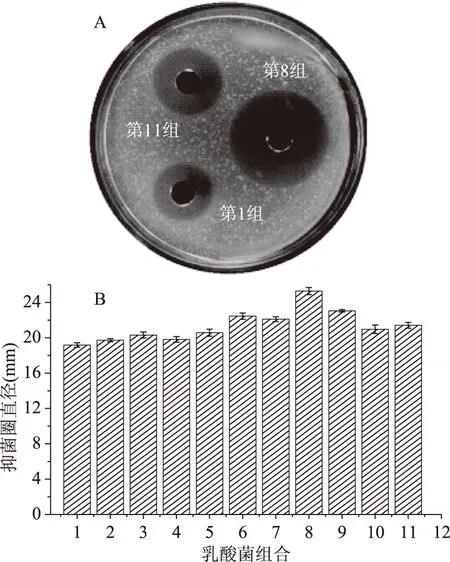
图2 乳酸菌不同组合对荧光抑菌抑菌结果Fig.2 The results of the different composes of LAB on P. fluorescent 注:第1组:S1、S2;第8组:S2、S3、S4;第11组:S1、S2、S3、S4。
2.4单因素实验结果分析
2.4.1 复合乳酸菌不同菌量比的抑菌实验 采用三因素三水平设计最佳抑菌效果的乳酸菌组合(A:菌株DY4-2,B:菌株YP4-5,C:菌株LY1-6),如表5所示,为不同菌量比对荧光假单胞菌抑制结果。从中可以看出,第6组A2B3C1(2∶3∶1)抑菌作用最强,抑菌直径为24.25 mm。因此,确定复合乳酸菌第6组为最适菌量比。
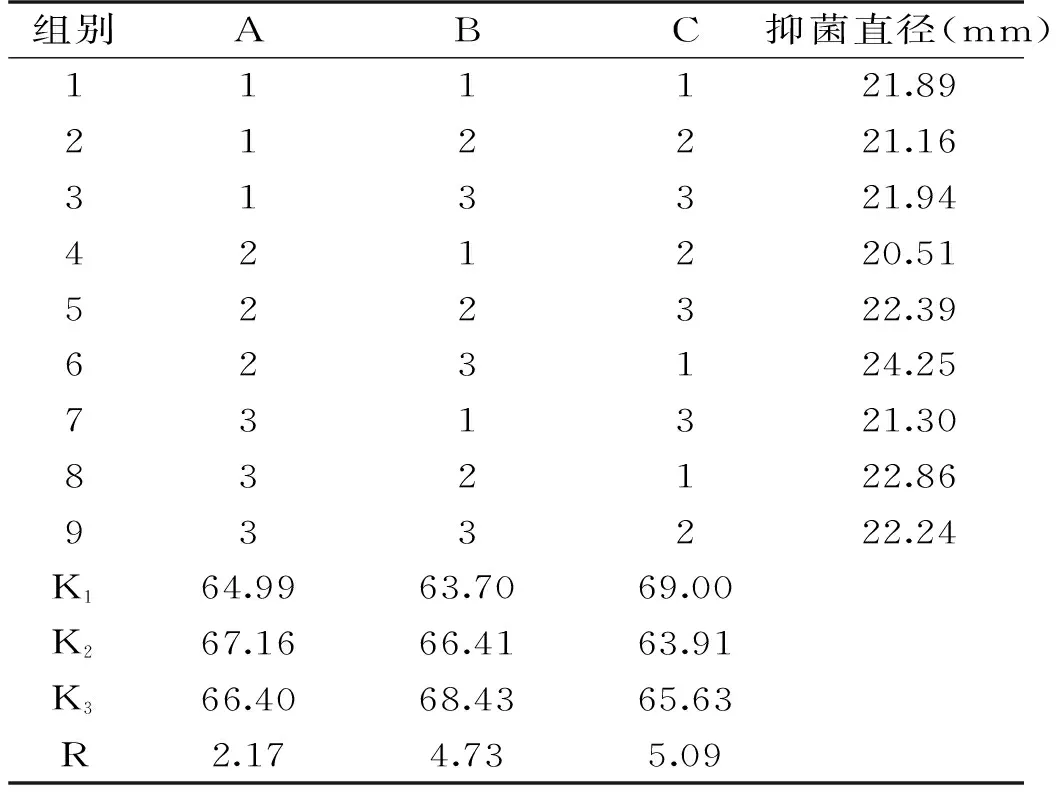
表5 不同配比的乳酸菌组合对荧光假单胞菌抑制影响Table 5 Antibacterial effect of the different proportions of LAB on P. fluorescent
2.4.2 培养温度对抑制荧光假单胞菌的影响 将菌株DY4-2、YP4-5和LY1-6按菌量比2∶3∶1混合后接种于MRS培养基中,不同温度下培养48 h后乳酸菌发酵液的抑菌结果如图3所示。从中可看出,随着培养温度的升高,复合乳酸菌抑菌效果呈先上升再下降、再上升又下降的趋势,当温度小于35 ℃时,对荧光假单胞菌的抑菌效果较强,抑菌圈直径均高于23.00 mm,温度37 ℃时,抑菌圈直径维持在20.00 mm左右。表明复合乳酸菌在较低的温度下培养产生的抑菌活性物质对荧光假单胞菌具有较强抑制作用。培养温度25 ℃抑菌效果最好,抑菌直径为24.26 mm。因此,确定复合乳酸菌培养温度为25 ℃为抑菌活性物质产生的最适培养温度。

图3 不同温度的复合乳酸菌对荧光假单胞菌抑菌结果Fig.3 The bacteriostatic results of different temperatures of LAB on P. fluorescent
2.4.3 培养时间对抑制荧光假单胞菌的影响 复合乳酸菌(菌量比2∶3∶1)接种于MRS培养基后置于25 ℃培养不同时间,乳酸菌发酵液的抑菌结果如图4所示。从中可看出,随着培养时间的延长,乳酸菌发酵液对荧光假单胞菌抑菌效果逐渐上升后下降的趋势,当培养48 h时,抑菌圈直径为24.39 mm,培养时间60~72 h时,抑菌圈直径维持在23.70 mm左右。表明复合乳酸菌培养48 h时,抑菌活性物质已完全形成。因此,确定复合乳酸菌抑菌活性物质产生的最适培养时间为48 h。

图4 不同时间的复合乳酸菌对荧光假单胞菌抑菌结果Fig.4 The bacteriostatic results of different time of LAB on P. fluorescent
2.5响应面对复合乳酸菌抑制荧光假单胞菌抑菌条件的优化
2.5.1 响应面法优化培养条件 通过Design Expert 8.0.6中的Box-Behnken 对菌量比(A)、温度(B)和时间(C)进行三因素三水平实验,所得的中心组合方案和实验结果如表6所示。

表6 Box-Behnken中心组合设计方案及实验结果Table 6 Design and results of Box-Behnken
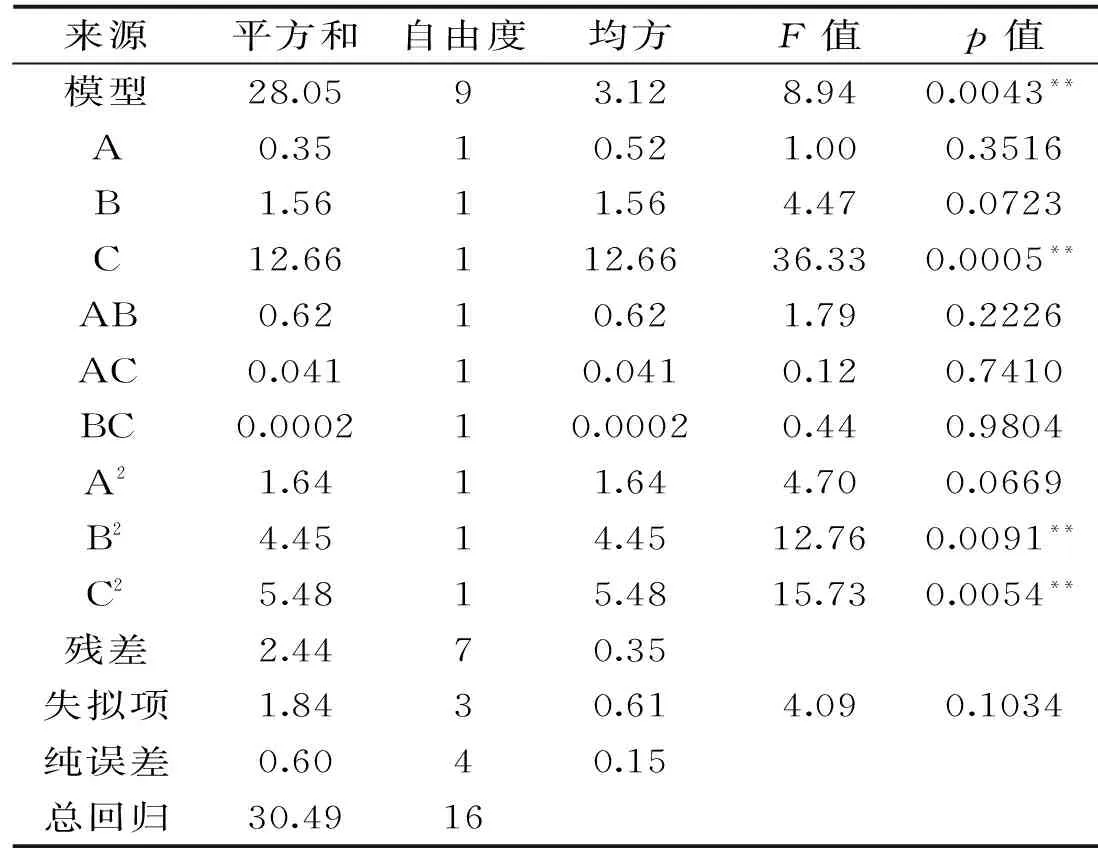
表7 回归模型方差分析Table 7 Variance analysis of regression mode
注:**极显著(p<0.01),*显著(p<0.05)。
以抑菌直径(Y)为响应值,根据Box-Behnken Design(BBD)设计的实验结果,利用Design Expert 8.0.6软件对表6数据进行分析,得到抑菌圈直径与菌量比(A)、温度(B)和时间(C)二次多项回归方程:Y=20.94-0.21A-0.44B-1.26C+0.39AB+0.10AC-0.007BC+0.62A2+1.03B2+1.14C2。对回归模型进行方差分析,结果如表7所示。
从表7可看出,模型F=8.94,p<0.01,说明该回归方程极显著。失拟项不显著(p>0.05),说明模型所拟合的二次回归方程与实际相符合。能正确反映抑菌圈直径Y与A、B和C之间的关系。回归模型可以较好地对优化实验中的各种实验结果进行预测。显著性检验结果表明,一次项的培养时间和二次项的温度和时间对抑菌圈直径有极显著影响(p<0.01)。决定系数R2=0.9200,说明模型的拟合度好,抑菌圈直径的实际值与预测值之间具有较好的拟合相关性。方差分析结果表明,各因素对抑菌圈直径的影响顺序依次为时间、温度和菌量比。
图5为菌量比A、培养温度B和培养时间C三因素的两两交互作用分析所得到的交互因子响应曲面图。a图中在等高线区域中心,抑菌直径最小,由中心向边缘逐渐增大。若底部投影为椭圆形,则两因素交互作用显著,由此可知温度与菌量比之间的交互作用显著,菌量比与培养时间、培养温度与培养时间之间的交互作用不显著。b和c图显示了C由高水平到低水平变化过程中等高线的数目明显多于A和B,说明培养时间对抑菌直径的影响显著。对多元二次回归方程进行求偏导,可以得到:Y=-0.21+0.39B+0.10C+1.24A;Y=-0.44+0.39A-0.007C+2.06B;Y=-1.26C+0.10A-0.007B+2.28C;联立方程组,解得复合乳酸菌对荧光假单胞菌抑菌活性最优条件的编码值为:A=-1,B=-1,C=-1。即在菌株DY4-2、YP4-5和LY1-6菌量比为2∶3∶1,培养温度为25 ℃,培养时间48 h时,模型预测复合乳酸菌对荧光假单胞菌抑菌直径最大值为26.13 mm。

图5 交互因子的响应面曲面图Fig.5 Response surface graph of interaction factors
2.5.2 验证性实验 响应值(Y)最大值时各因子水平为A=-1,B=-1,C=-1。对应的最佳培养条件为菌株DY4-2、YP4-5和LY1-6菌量比为2∶3∶1,培养温度为25 ℃,培养时间48 h时,在此条件下预测的最大值为26.13 mm。为了验证模型预测的准确性,依据响应面实验优化得到的培养条件进行验证性实验,得到复合乳酸菌对荧光假单胞菌抑菌圈直径为25.84 mm,与模型预测值相差1%,与理论值基本相符。
3 结论
通过Box-Behnken设计和响应面分析法,利用Design-Expert统计软件能够可靠地进行优化实验以及数据处理。本实验应用这一方法对复合乳酸菌对荧光假单胞菌的抑菌活性进行优化,在单因素实验的基础上应用Box-Behnken设计三因素三水平的实验,确定复合乳酸菌抑制荧光假单胞菌的培养条件为:乳酸菌组合(S2:菌株DY4-2、S3:菌株YP4-5 和S4:菌株LY1-6)以2∶3∶1菌量比,在25 ℃条件下培养48 h 时,抑菌直径为25.84 mm,与模型预测值相差1%,该模型可以较好地预测实际情况。因此,菌株DY4-2、YP4-5 和LY1-6复合后可有效增加抑制荧光假单胞菌能力,旨在为应用乳酸菌生物防腐剂控制水产品中荧光假单胞菌提供理论依据。
[1]Zhou Z J,Zhang L,Sun L.Pseudomonasfluorescens:Fur is required for multiple biological properties associated with pathogenesis[J]. Veterinary Microbiology,2015,175(1):145-149.
[2]崔方超,李婷婷,刘明爽,等. 大菱鲆荧光假单胞菌的群体感应现象及不同碳源培养下的腐败特性研究[J]. 现代食品科技,2015,31(12):49-55.
[3]Zhang W,Liu M,Dai X. Biological characteristics and probiotic effect ofLeuconostoclactisstrain isolated from the intestine of black porgy fish[J]. Brazilian Journal of Microbiology,2013,44(3):685-691.
[4]缪璐欢,杜静芳,马欢欢,等. 淡水鱼肠道中抗大肠杆菌O157∶H7乳酸菌的筛选及抑菌作用研究[J]. 食品与发酵工业,2015,41(10):7-13.
[5]Kaynar P,Beyatli Y. Antagonistic activities of Bacillus spp. strains isolated from the fishes[J]. Journal of Applied Biological Sciences,2012,6(3):77-81.
[6]马欢欢,吕欣然,林洋,等. 鲈鱼肠道LactobacillussakeiLY1-6对荧光假单胞菌抑制作用研究[J].食品工业科技,2016,37(23):150-155.
[7]王菲,张继伦,宁喜斌. 复合乳酸菌对肠出血性大肠杆菌O157∶H7抑制作用的研究[J]. 食品工业科技,2013,34(21):83-86.
[8]Cao R,Liu Q,Chen S,et al. Application of lactic acid bacteria(LAB)in freshness keeping of tilapia fillets as sashimi[J]. Journal of Ocean University of China,2015,14(4):675-680.
[9]徐安书,胡敏,何军. 茎瘤芥叶胡萝卜混合汁复合乳酸菌发酵饮料的研制[J]. 食品科学,2012,33(14):321-325.
[10]唐文静,宁喜斌,王楚文,等. 复合乳酸菌对冷藏海鲈鱼块的保鲜效果[J]. 微生物学通报,2016,43(3):559-566.
[12]Chabi I B,Kayodéa P P,Agbobatinkpo B P,et al. Use of response surface methodology to optimize the drying conditions of a bioactive ingredient derived from the African opaque sorghum beer[J]. African Journal of Biotechnology,2016,15(40):2234-2242.
[13]王建,罗红霞,于佳弘,等. 响应面法优化复合乳酸菌培养条件[J]. 中国酿造,2016,35(2):66-69.
[14]Soni P,Singh M,Kamble A L,et al. Response surface optimization of the critical medium components for carbonyl reductase production by Candida viswanathii MTCC 5158[J]. Bioresource Technology,2007,98(4):829-833.
[16]李曼,罗晨,张柏林. 应用交叉拮抗法筛选产细菌素菌株的实验研究[J]. 乳业科学与技术,2008,31(4):157-159.
OptimizationofantibacterialeffectofcomplexlacticacidbacteriaonPseudomonasfluorescensbyresponsesurfacemethodology
SUNMeng-tong1,MAHuan-huan1,LVXin-ran2,LINYang1,BAIFeng-ling1,*,LIJian-rong1,SONGQiang3
(1.College of Food Science and Technology,Bohai University;Food Safety Key Lab of Liaoning Province,National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China;2.College of Biology Science and Technology,Beijing Forest University,Beijing 100083,China;3.Dalian Donglin Food Co.,Ltd.,Dalian 116101,China)
Objective:To optimize an efficient complex lactic acid bacteria(LAB)with strong antagonistic activity againstPseudomonasfluorescens. Methods:The complex LAB strains with synergic and antagonistic effects againstP.fluorescenswere screened using the method of Oxford cup agar diffusion. The complex LAB were optimized by response surface methodology. Results:The best inhibitory complex ofLactobacillusplantarumDY4-2,Lb.sakeiYP4-5 andLb.sakeiLY1-6 were screened from 11 groups of complex LAB againstP.fluorescens,and the inhibitory zone diameter reached 25.29 mm,which was higher 2.93,4.80 and 5.35 mm than strain DY4-2,YP4-5 and YP1-6 respectively.Three-factor-three-level experiments designs were developed by Box-Behnken,and the inhibitory zone diameter was used as the responsive values. The bacterial suspension of strain DY4-2,YP4-5 and YP1-6 combined with the ratio of 2∶3∶1,culture temperature 25 ℃ and culture time 48 h,which the inhibitory zone diameter againstP.fluorescenswas 25.84 mm in the optimum conditions. Conclusion:The complex LAB can largely increase the synergy between the strain and the inhibitory activity againstP.fluorescens,which can provide theoretical basis for the research and development efficient LAB biopreservation control ofP.fluorescensin aquatic products spoilage.
complex lactic acid bacteria;Pseudomonasfluorescens;antibacterial activity;response surface method;optimization
2017-02-14
孙梦桐(1992-),女,硕士研究生,研究方向:食品安全与质量控制,E-mail:daysunmengtong@163.com。
*通讯作者:白凤翎(1964-),男,博士,教授,研究方向:食品安全与质量控制和食品微生物学,E-mail:baifling@163.com。
辽宁省科技厅攻关项目(2015103020);泰山学者蓝色产业领军人才团队支撑计划项目 ( 鲁政办字(2015)19号)。
TS201.3
:A
:1002-0306(2017)17-0119-06
10.13386/j.issn1002-0306.2017.17.023

