妊娠合并糖尿病与母胎缺氧诱导因子HIF-1α的关系
连亚婉吴青颜建英
1.福建省惠安县医院妇产科 362100;2.福建省立医院妇产科 350001;3.福建省妇幼保健院妇产科 350001
妊娠合并糖尿病与母胎缺氧诱导因子HIF-1α的关系
连亚婉1吴青2颜建英3*
1.福建省惠安县医院妇产科 362100;2.福建省立医院妇产科 350001;3.福建省妇幼保健院妇产科 350001
目的:探讨母血清HIF-1α、胎盘HIF-1α mRNA与妊娠合并糖尿病血糖控制情况的关系。方法:收集37¯40周孕产妇共75人,其中糖尿病合并妊娠组(n=15人),妊娠期糖尿病组(n=30人)和正常妊娠孕妇(n=30人),ELISA方法测定母血清HIF-1 α,RT-PCR法检测胎盘HIF-1α mRNA水平。结果:3组患者年龄、孕周的比较无统计学差异。糖尿病合并妊娠组血清HIF-1α、胎盘HIF-1α mRNA为78.42±11.85pg/L、0.43±0.12,明显大于妊娠期糖尿病组(58.68±18.10 pg/L,P=0.000、0.23±0.06,P=0.000)和正常糖耐量组(47.96±12.79 pg/L,P=0.000、0.19±0.08,P=0.000)。妊娠期糖尿病组血清HIF-1α、胎盘HIF-1α mRNA大于正常妊娠组,P值分别为0.01、0.021,差异有统计学意义。结论:糖尿病合并妊娠组血糖控制差,血清HIF-1α、胎盘HIF-1α mRNA最高,母血清HIF-1α能反映妊娠合并糖尿病的严重程度。
糖尿病合并妊娠;妊娠期糖尿病;缺氧诱导因子
妊娠合并糖尿病,包括糖尿病合并妊娠(Pregestational diabetes mellitus,PGDM)和妊娠期糖尿病(Gestational diabetes mellitus,GDM),前者为已有糖尿病的患者妊娠,而妊娠期糖尿病是指在妊娠期首次发生或发现的对葡萄糖的不耐受,其特征为高血糖,对母儿的危害程度与血糖水平密切相关[1]。
高血糖导致葡萄糖氧化及氧耗增加,进而导致胎儿体内血氧消耗过度而缺氧[2]。缺氧诱导因子(hypoxia inducible factor,HIF)是统属bHLH.PAS家族,分为HIF-1、HIF-2、HIF-3,HIF-1是当前唯一发现在特异性缺氧状态下发挥活性的敏感的转录因子,它与靶基因结合,如促红细胞生成素、血管内皮生长因子、血红素加氧酶-1等基因,通过促进靶基因转录,参与机体对缺氧的反应,引起多种病理生理反应[3,4]。
本文旨在研究母血清HIF-1α、胎盘HIF-1α mRNA与妊娠合并糖尿病血糖控制情况的关系,初探母血清HIF-1α能否反映妊娠合并糖尿病的严重程度,并为妊娠合并糖尿病的机制研究做铺垫。
1.资料与方法
1.1 收集2014年6月至2015年3月到惠安县医院妇产科、福建
省立医院妇产科就诊的 37~40周孕产妇。所有研究对象孕周计算无误。分组如下:
A组:糖尿病合并妊娠组(n=15人),孕前或早孕期诊断糖尿病,孕期未监控血糖者或者血糖控制不良者。
B组:妊娠期糖尿病组(n=30人),孕24-28周,糖耐量试验诊断妊娠期糖尿病的患者;孕期严格监控血糖,血糖控制良好者。C组:正常妊娠孕妇(n=30人),正常糖耐量组。
1.2 纳入标准和排除标准
①全部对象都是单胎自然妊娠。
②妊娠期糖尿病、糖尿病合并妊娠的诊断必须符合标准。糖尿病合并妊娠的诊断:早孕期或孕前行FPG检查,禁食8-12小时,最后查空腹血糖如FPG≥7.0 mmol/L,或HbA1C≥6.5,或任意血糖≥11.1mmol/L,且有糖尿病症状。妊娠期糖尿病的诊断:孕24-28周,禁食8-12小时,次日晨在5分钟内口服75 g葡萄糖,OGTT诊断界值为空腹、服糖后1h和2h的血糖值分别为5.1mmol/L,10.0mmol/L和8.5mmol/L。
③入院患者签署知情同意书,遵循知情和自愿的原则。
④排除孕妇同时存在妊娠期或分娩期的并发症,例如前置胎盘、胎盘早剥、胎儿窘迫等疾病。
⑤排除孕妇同时合并有外科的或内科其他疾病,如原发性高血压、心脏病、肾炎、肝炎、贫血等。
1.3 血糖控制的评价
①血糖控制良好标准:孕28周以后监测血糖轮廓(三餐后2小时、睡前),血糖正常次数达 80%以上血糖控制标准:餐前血糖<5.6mmol/L,餐后2小时血糖<6.7mmol/L。
②血糖控制不良标准:在孕28周以后每周血糖轮廓(三餐后2小时、睡前)正常次数少于 80%;或孕期未监测血糖,入院时查监测血糖正常次数少于80%。
1.4 实验方法
①血清 HIF-1α检测 所有患者均于清晨空腹抽取外周静脉血5ml,3000r/min,离心5min,取上层血清于试管中,-70℃保存。采用ELISA方法测定母血清 HIF-1α,试剂盒购自北京中杉金桥生物工程有限公司,严格按操作说明书测定。
②胎盘 HIF-1α mRNA检测 从胎盘母体面脐带对侧取约100mg胎盘组织,采用RNA抽提及逆转录试剂盒(Invitrogen,USA),并且检测RNA的完整性及纯度。构建荧光PCR反应体系25μL,含2×Power SYBR® Green PCR Master Mix 12.5μL、上游引物 F(10pmol/ μL)0.5μL、下游引物 R(10pmol/μL)0.5μL(和HIF-1α引物:5 ’ CCATTAGAAAGCAGTTCCGC3 ’ , 5 ’TGGGTAGGAGATGGAGATGC3’;产物194bp;β-actin引物:5’TTCCAGCCTTCCTTCCTGG3’,5’TTGCGCTCAGGAGGAGCAAT3’产物224 bp)(引物由生工生物工程(上海)股份有限公司合成)、cDNA模板2μL、ddH2O 9.5μL。反应条件为:95℃3分钟,然后 94℃50秒,55℃45 秒,72℃1分钟共 45 循环。采用BIO-RAD全定量PCR仪检测。以β-actin基因作为内参照,分析各反应的荧光强度得出CT值,并绘制β-actin 基因的标准曲线,参照标准曲线,得出目的基因的相对反应起始拷贝数。阴性对照以蒸馏水加入扩增体系,以β-actin基因作为内参照进行 PCR,用分析各反应的荧光强度得出CT值,并绘制 β-actin基因的标准曲线,得出目的基因的相对反应起始拷贝数。
1.5 统计学方法
应用 SPSS统计软件,正态分布数据以 x ± s表示,糖尿病合并妊娠组、妊娠期糖尿病组和正常糖耐量组两两比较用两独立样本的t检验,P < 0.05为差异有统计学意义
2.结果
3组患者年龄、孕周的比较无统计学差异,P>0.05。糖尿病合并妊娠组血清HIF-1α、胎盘HIF-1α mRNA为78.42±11.85pg/L、0.43±0.12,明显大于妊娠期糖尿病组(58.68±18.10 pg/L,P=0.000、0.23±0.06,P=0.000)和正常糖耐量组(47.96±12.79 pg/L,P=0.000、0.19±0.08,P=0.000)。妊娠期糖尿病组血清 HIF-1α、胎盘 HIF-1 α mRNA大于正常糖耐量组,P值分别为0.01、0.021,差异有统计学意义。见表1。
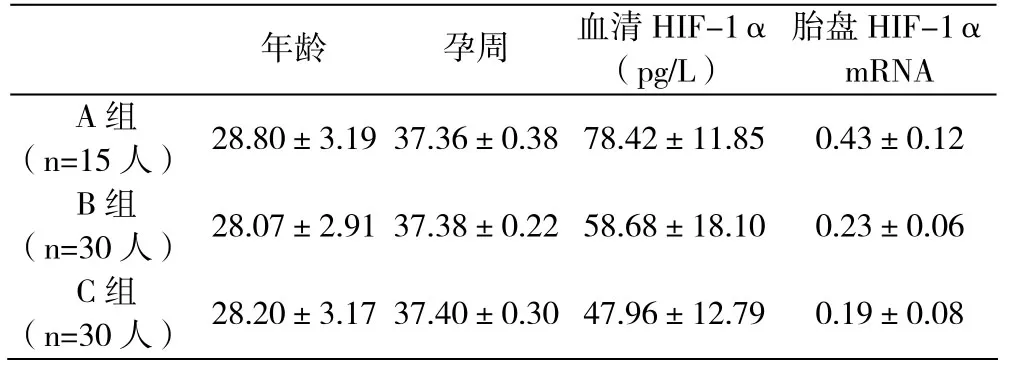
表1 3组一般资料及血清HIF-1α、胎盘HIF-1α mRNA的比较
3.讨论
妊娠期糖尿病孕妇发生死胎风险是正常孕妇的 4-6倍,新生儿死亡的风险是正常孕妇的 2-4倍。大多数围生儿死亡的原因不明,临床及实验研究均认为高胰岛素、高血糖导致胎儿宫内缺氧,可能是妊娠期糖尿病不良围生结局的原因[5,6]。
对于宫内缺氧状况的评估有多种方法,胎盘组织缺氧病理改变、EPO、HIF-1α,VEGF等均被认为是胎盘胎儿宫内缺氧的标志物或方法,但是没有统一的金标准。缺氧诱导因子(hypoxia inducible factor,HIF)是统属 bHLH.PAS家族,根据不同的亚单位结构分为HIF-1、HIF-2、HIF-3,目前 HIF-1是国内外研究的热点。HIF-1是当前唯一发现在特异性缺氧状态下发挥活性的敏感的转录因子,因此其较EPO具有更高的研究价值;其广泛表达于哺乳动物及人体各种组织细胞,妊娠期滋养细胞和胎盘也存在 HIF-1表达和分泌。HIF-1由α亚基和β亚基组成,HIF-1α是主要活性调节因子,它与靶基因结合,如促红细胞生成素(EPO)、血管内皮生长因子(VEGF)、血红素加氧酶(HO)-1等基因,通过促进靶基因转录,参与机体对缺氧的反应,引起多种病理生理反应[3,4]。
HIF-1作为转录因子,调控多种基因的表达,进而参与多项生理过程包括EPO的生成、铁转运、血管生成(VEGF的表达)和糖代谢等等,HIF是胚胎发育的重要调控因子。妊娠期母体高血糖状态导致氧耗增加,胎儿高血糖、高胰岛素状态,使葡萄糖氧化代谢增多,ROS相应增多,进而触发HIF的产生[7,8]。所以,高血糖、高胰岛素血症导致缺氧状态,进而对胎儿产生一系列围生期的多脏器影响,而HIF可能是这些病理生理改变的重要路径。
本实验糖尿病合并妊娠组血清 HIF-1α、胎盘 HIF-1α mRNA为明显大于妊娠期糖尿病组和正常糖耐量组。妊娠期糖尿病组血清HIF-1α、胎盘 HIF-1α mRNA大于正常糖耐量组,且差异有统计学意义。可见糖尿病合并妊娠组血糖控制最差,其血清HIF-1α、胎盘HIF-1α mRNA最高,母血清HIF-1α能反映妊娠合并糖尿病的严重程度,且与胎盘HIF-1α mRNA具有较好的一致性。
[1] Yang X,Hsu-Hage B,Zhang H,et al.Women with impaired glucose tolerance during pregnancy have significantly poor pregnancy outcomes[J].Diabetes Care. 2002;25(9):1619-24.
[2] Carson GF,Philipps AF,Simmons MA et al.Effects of sustained insulin infusion upon glucose uptake and oxygenation of the ovine fetus[J].Pediatr Res,1980;14:147-52.
[3] Wang GL,Jiang BH,Rue EA,Semenza GL.Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension[J].Proc Natl Acad Sci USA 1995;92:5510-4.
[4] Wang GL,Semenza GL.Purification and characterization of hypoxia-inducible factor 1[J].J Biol Chem 1995;270:1230-7.
[5] Kari A.Obstetric problems in diabetic pregnancy - The role of fetal hypoxia.Teramo Best practice & research[J].Clinical endocrinology & metabolism.2010;24(4):663-71.
[6] Lauenborg J,Mathiesen E,Ovesen P et al.Audit on stillbirths in women with pregestational type 1 diabetes[J].Diabetes Care 2003;26:1385 -89.
[7] Li HP,Chen X,Li MQ.Gestational diabetes induces chronic hypoxia stress and excessive inflammatory response in murine placenta[J].Int J Clin Exp Pathol.2013;6(4):650-9.
[8] Patel J,Landers K,Mortimer RH,et al.Regulation of hypoxia inducible factors(HIF)in hypoxia and normoxia during placental devel-opment[J].Placenta 2010;31:951-7.
R587.4
A
1672-5018(2017)02-017-2

