TiO2/微孔陶瓷的制备及光催化降解亚甲基蓝
赵妍,梁秀红,2
(1.河北工业大学生态环境与信息特种功能材料教育部重点实验室,天津300130;2.河北工业大学能源与环保材料研究所,天津300130)
TiO2/微孔陶瓷的制备及光催化降解亚甲基蓝
赵妍1,梁秀红1,2
(1.河北工业大学生态环境与信息特种功能材料教育部重点实验室,天津300130;2.河北工业大学能源与环保材料研究所,天津300130)
为解决粉体TiO2在水体系应用时存在易团聚、固液分离困难、循环使用受到限制等问题,以微孔陶瓷为载体,通过溶胶-凝胶和浸渍工艺制备TiO2/微孔陶瓷负载型光催化材料.研究负载后TiO2烧成过程中的物质变化、载体对TiO2晶型转变温度的影响、TiO2与载体的结合情况、载体对TiO2半导体性质的影响及负载型光催化材料对亚甲基蓝的催化降解能力及光催化稳定性.结果表明:经负载后TiO2从锐钛矿型向金红石型的转变温度由700℃提高到900℃;TiO2以物理方式黏附到微孔陶瓷表面及孔道;经微孔陶瓷负载TiO2之后,TiO2的带隙能由3.04 eV增加到3.06 eV;当TiO2/微孔陶瓷使用量为1 g,紫外光照射5 h,重复使用6次过程中,对亚甲基蓝溶液的去除率均高于90%,TiO2/微孔陶瓷具有较高的催化活性和使用稳定性.
微孔陶瓷;溶胶-凝胶;二氧化钛;光催化;去除率
0 前言
随着经济的发展和人们生活水平的提高,环境污染成为人们日益关注的焦点之一.光催化降解技术可以光催化氧化污染物,其中二氧化钛以廉价无毒、降解率高、氧化能力强等优点,被广泛地研究[1].但由于粉体TiO2在工作时,存在易团聚、活性成分损失大、比表面积有限、不易沉降、难回收和循环使用受到限制等问题,严重制约了其在工业方面的应用.近年来,以活性炭[2]、多孔陶瓷[3-4]、光学纤维[5-6]、玻璃[7]等作为载体,通过化学成键或物理黏附的方法,制备负载型纳米TiO2光催化剂,可以有效的解决以上问题,并增加其催化效率和使用稳定性.
由于微孔陶瓷大的比表面积、较高的机械强度、良好的吸附性能、对环境无污染、与催化剂相容性好[8],可以将其作为负载纳米TiO2的载体.将TiO2固定化于微孔陶瓷,既避免了催化剂的团聚、实现了循环使用,又可利用微孔陶瓷良好的吸附性能将目标降解物吸附到载体表面,增大TiO2和目标降解物接触的机率,提高TiO2的降解效率.因此多孔陶瓷作为TiO2催化剂的载体应用于污水处理有良好的应用前景.何秀兰等[9]采用溶胶-凝胶法在多孔陶瓷上负载纳米TiO2,结果表明催化剂对甲基橙溶液具有较好的光催化降解效果,并通过Sm3+掺杂提高其催化活性.高如琴等[10]采用水解沉淀法在多孔陶瓷上合成纳米TiO2薄膜,对甲醛的去除率达94.6%.
本工作以自制高气孔率、高强度、良好吸附性能的硅藻土基微孔陶瓷为载体,采用溶胶-凝胶和浸渍工艺,在微孔陶瓷表面及孔道负载纳米TiO2,并研究了载体对TiO2晶型转变温度的影响,TiO2与载体的成键情况,负载TiO2后微孔陶瓷表面的微观形貌,载体对TiO2半导体性质的影响,并考察了负载型TiO2对亚甲基蓝溶液的光催化降解能力和光催化稳定性.
1 实验
1.1 原料和样品的制备
选用天津弘喜泰化工贸易有限公司生产的硅藻土为主要多孔矿物原料,添加骨料(高岭土)和烧结助剂(长石和白云石),其质量比为7∶2∶1,采用压制成型工艺,在1 000℃烧结2 h,制备微孔陶瓷(φ= 20 mm),气孔率为56.03%,抗压强度为29.73 MPa,当微孔陶瓷使用量为2 g时,对浓度为10 mg/L的50 mL的亚甲基蓝溶液的去除率为90.633%.将微孔陶瓷于去离子水中超声波清洗3次,105℃烘干,待用.
钛酸丁酯、盐酸、硝酸、醋酸、无水乙醇和亚甲基蓝试剂均为天津大茂有限公司生产,去离子水为实验室自制.将钛酸丁酯、无水乙醇和醋酸,按体积比为3∶6∶2,置于A烧杯中搅拌30 min,将去离子水和无水乙醇,按体积比为1∶2,置于B烧杯并用硝酸调节其pH=1.5.将B烧杯的液体用恒压管以1 mL/min的速度滴入A烧杯,并剧烈搅拌40 min;将混合液体放入锥形瓶中并加入清洗好的微孔陶瓷,置于恒温(30℃)气浴震荡器中震荡60 min,将浸渍后的陶瓷取出,105℃烘干60 min,此步骤重复3次(剩余凝胶干燥20 h,研磨);将浸渍后的陶瓷和研磨好的粉末置于马弗炉中分别在500~900℃(间隔100℃)煅烧2 h,得到纳米TiO2/微孔陶瓷块体和纳米TiO2粉末.
1.2 样品表征
用德国布鲁克AXS有限公司生产的D8 FOCUS型多晶衍射仪,对样品进行测试,分析其物相组成,电压40 kV,电流40 mA,Cu靶,波长λ=0.154 06 nm,步速为10°/min,扫描范围5~80°.采用中国北京恒久科学仪器厂生产的HCT-2型热分析仪对样品进行热重和差热分析,从室温升至1 200℃、升温速率为10℃/min.用美国FEI公司生产的Nova Nano SEM450扫描电子显微镜对样品表面进行显微结构和表面化学元素组成分析.用日本HITACHI公司生产的U-390H型紫外-可见分光光度计测量样品的光谱吸收曲线.用北京产的T6型紫外分光光度计测量溶液的吸光度.
1.3 TiO2/微孔陶瓷对亚甲基蓝溶液的去除率测试
将1 g的TiO2/微孔陶瓷放入盛有50 mL初始浓度为10 mg/L亚甲基蓝溶液的培养皿(φ=90 mm)中,置于磁力搅拌器,暗室搅拌30 min,用紫外灯进行光照(光照强度10 mW·cm-2),然后每隔特定时间取样2.5 mL,采用可见分光光度计测量溶液的吸光度(亚甲基蓝λmax=664 nm).根据Langmuir定律,在最大波长处的吸光度和浓度具有线性关系,换算出浓度,即可计算亚甲基蓝的降解率

其中:Q为亚甲基蓝的降解率;C0为亚甲基蓝溶液的初始浓度;C为降解后亚甲基蓝溶液的浓度.
2 结果与讨论
2.1 样品的表征
2.1.1 热分析结果
图1是经105℃干燥后干胶/微孔陶瓷的热分析曲线.由图中热重曲线可知,由于微孔陶瓷载体是在1 000℃下高温烧结的,因此总的失重是Ti的化合物在加热过程中造成的,总失重率约为3%.质量损失过程主要包括3个阶段:室温至200℃,失重率为1.06%,这是因为吸附水和干燥时未脱去的乙醇脱附引起的;200~400℃,失重率为2.03%,这主要是由于羟基缩合反应,由无定形向锐钛矿相的转变而造成的;400~1 000℃,质量损失不明显为0.05%,主要是纳米晶粒表面的羟基基团的脱附造成的,TiO2表面一般存在Ti-OH和Ti-(OH)-Ti 2种类型的羟基基团,2种基团的脱附温度不同,所以羟基基团引起的失重温度较为宽泛[11].由图中差热曲线可知,在低温114℃出现小的吸热峰,对应Ti化合物的脱水脱醇.在328℃左右出现放热峰,对应有机基团的氧化和分解.在814℃出现小的放热峰,这是锐钛矿型TiO2向金红石型转变过程中放热产生的.同时也看到,在400~1 000℃基本没有质量损失,曲线趋于平滑,这是锐钛矿的晶相生长和由锐钛矿向金红石相转变的过程.
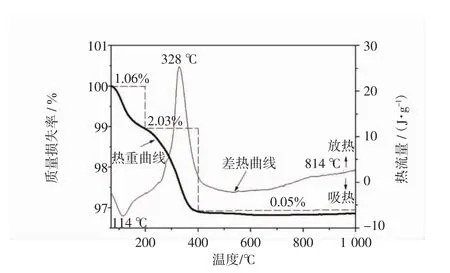
图1 干胶/微孔陶瓷的热分析Fig.1 Thermal analyses of dry gel/micro-porous ceramics
2.1.2 煅烧温度对TiO2晶型及烧成温度的影响
由图2a)可知,当煅烧温度低于700℃时,在2θ为25.2°(101),37.7°(004),48.0°(200)等处为锐钛矿型二氧化钛的特征峰,说明样品中只有锐钛矿型TiO2.当煅烧温度为700℃时,在2θ为27.3°(110),35.4°(101)等处出现金红石型二氧化钛特征峰,说明样品中开始有金红石型TiO2的出现.当煅烧温度为900℃时,样品中的TiO2全部为金红石型.由图2b)可知,微孔陶瓷载体主要成分为方石英型的SiO2,并伴随有少量的石英型SiO2和钙铝氧化物.样品经500℃煅烧,可以看到出现了锐钛矿型的TiO2,并且随着烧结温度的升高衍射峰强度逐渐增大,说明锐钛矿的晶型逐渐完整.当煅烧温度为900℃时,样品中开始有金红石型TiO2的出现这与2.1.1中在814℃出现小的放热峰是一致的.
由图2中的a)和b)对比可知,经过负载后TiO2锐钛矿相向金红石相转变的温度有明显的提高,由700℃提高到900℃.说明微孔陶瓷载体阻碍了金红石型TiO2的形成,最终提高了锐钛矿型向金红石型的转变起始温度.在二氧化钛的晶型中,锐钛矿型比金红石型表现出更高的光催化活性,并且TiO2经负载后有更宽的锐钛矿型烧成温度,为了降低烧成成本,选定煅烧温度为700℃.

图2 不同煅烧温度的TiO2的X射线衍射图Fig.2 XRD of TiO2sintering at different temperatures
从表1中可以看出,负载前后TiO2的晶粒尺寸都随着煅烧温度的升高而逐渐增大.在同一煅烧温度下,经过负载的TiO2的晶粒尺寸明显小于未负载TiO2的晶粒尺寸,这主要是因为载体阻碍了金红石型TiO2的形成.随着煅烧温度的升高,锐钛矿型TiO2向金红石型TiO2转变.由TiO2热力学焓随颗粒尺寸的变化[12]可知,当颗粒尺寸小于11 nm时,锐钛矿是最稳定的晶相.由表1可知制备锐钛矿TiO2的晶粒尺寸小于10 nm,因此样品中的锐钛矿型TiO2具有很好的稳定性.

表1 不同煅烧温度下TiO2粒子的粒径和晶相组成Tab.1 Particle size and crystalline phase constitute of TiO2sintering at different temperature
2.1.3 微孔陶瓷和TiO2/微孔陶瓷的显微和能谱分析
由图3a)可以看出,微孔陶瓷中含有硅藻土的原始孔洞和由颗粒堆积产生的三维孔洞,气孔率较高,且孔隙分布均匀,此类陶瓷表面粗糙,具有较大的比表面积,是负载TiO2的理想载体.由图3a)和图3b)图对比可知,基体表面附有大量细小颗粒.图3c)为图3b)的放大图,由图3c)的结构和形貌,可以明显的看出陶瓷表面有分布均匀的颗粒,其大小在纳米级.

图3 样品表面的SEM图片Fig.3 SEM of samples
将样品表面进行能谱分析,根据图4a)可知,微孔陶瓷主要由Si,O,Al,Mg,Ca等元素组成,其中Si,O,Al的含量较高,与2.1.2中微孔陶瓷主要为方石英相一致.在微孔陶瓷负载TiO2后,表面出现了大量Ti元素,并且O元素相对含量增加,Si,Al的含量明显下降.这主要是因为微孔陶瓷表面被大量Ti元素所覆盖,由于Ti与O结合为TiO2,因此O元素含量有所增加.结合显微和表面能谱分析可以说明,TiO2已经负载在微孔陶瓷表面,细小的TiO2晶粒均匀的分布在陶瓷表面与孔洞内.经过负载后既可以增加TiO2光催化材料的光照面积,又利于催化剂的回和收循环利用.
2.1.4 傅立叶红外分析
图5中a曲线为微孔陶瓷的红外吸收曲线,其中472.54 cm-1、774.65 cm-1和1 134.11 cm-1为SiO2中[Si-O]四面体形成的Si-O-Si的伸缩振动吸收峰.b曲线为干胶/微孔陶瓷的红外吸收曲线,对比a和b曲线可知Si-O-Si的伸缩振动吸收峰的峰位变化不大,有轻微偏移,但是峰强明显减弱,是因为微孔陶瓷表面负载了一层纳米二氧化钛.此外,在1 200~1 800 cm-1波段出现了新峰1 437.28 cm-1和1 554.57 cm-1,这是由醋酸中的羧酸根对称反对称振动所致.c曲线为TiO2/微孔陶瓷-700℃的红外吸收曲线,样品经干燥后偏移的峰位又回到原来位置,这可能是二氧化钛经过煅烧融入到微孔陶瓷载体中所致;出现的羧酸根对称反对称振动峰位消失,这是因为有机体挥发[13-14].由此说明,TiO2以物理方式粘附于微孔陶瓷载体.
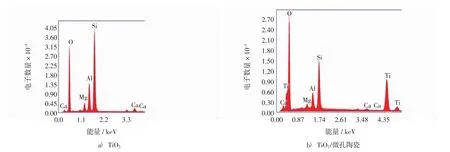
图4 样品表面的EDS谱图Fig.4 EDS of samples
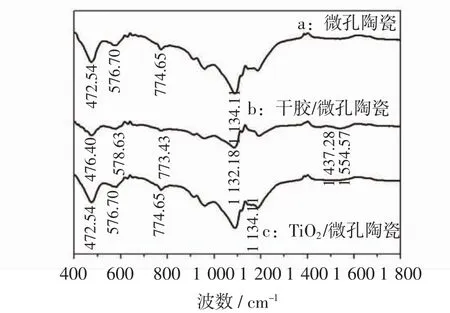
图5 微孔陶瓷和TiO2/微孔陶瓷的红外吸收光谱Fig.5 FTIR of micro-porous ceramics and TiO2/micro-porous ceramics
2.1.5 紫外-可见吸收光谱分析
由图6可知,当煅烧温度为700℃时,TiO2粉体的吸收波长阀值λg=407.4 nm,负载后TiO2的吸收波长阀值λg=405.3 nm.通过公式Eg=1 240/λg计算得到,TiO2粉体的带隙能Eg为3.04 eV,负载后TiO2的带隙能Eg为3.06 eV.对比可知,负载后TiO2的吸收边有蓝移效应,这是TiO2与微孔陶瓷载体间的界面效应造成的.由2.1.2中XRD结果可知,在相同温度煅烧时,负载后二氧化钛的晶粒尺寸减小,这会增强TiO2的量子尺寸效应.量子力学理论认为[15],带隙能量的改变量与半导体化合物粒子尺寸成反比,因此负载后锐钛矿型TiO2晶粒尺寸的减小导致带隙能的增大.TiO2的禁带宽度变宽,使电子-空穴对具有更强的氧化还原能力,从而有利于提高TiO2的光催化能力.
此外,从紫外可见吸收光谱中还可以判断氧化钛中Ti4+的配位情况.在图a)和图b)中,233 nm和304 nm处有明显并且宽的吸收峰,这说明TiO2处于六配位状态,(Td)中心Ti4+离子到O配体的电子跃迁所致的[16],因此图a)和图b)中的TiO2为锐钛矿相,与2.1.2中XRD结果700℃煅烧时,TiO2为锐钛矿相一致.

图6 样品的紫外-可见吸收光谱图Fig.6 UV-vis of samples
2.2 TiO2/微孔陶瓷的光催化性能
2.2.1 亚甲基蓝的自光解和微孔陶瓷载体的吸附
以亚甲基蓝溶液为目标降解物,在紫外灯照射而没有TiO2和微孔陶瓷的条件下测试亚甲基蓝的自身降解率.为了证明TiO2/微孔陶瓷对亚甲基蓝的去除率是以TiO2的光催化降解还是微孔陶瓷的吸附为主,选用没有负载TiO2的微孔陶瓷在相同条件下,测试微孔陶瓷对亚甲基蓝的去除率.
图7中的A曲线是亚甲基蓝溶液仅在紫外灯照下的降解率,B曲线是微孔陶瓷在紫外灯照下对亚甲基蓝的去除率.由A曲线可知,亚甲基蓝溶液在紫外灯照下有一定的自降解作用,去除率约为2%.由B曲线可知,微孔陶瓷对亚甲基蓝溶液的去除率为86.153%,微孔陶瓷的表面及孔道存在许多强氧化性的羟基官能团,这使微孔陶瓷有良好的吸附性能.由于染料的自光解率很低,以下实验中忽略不计.
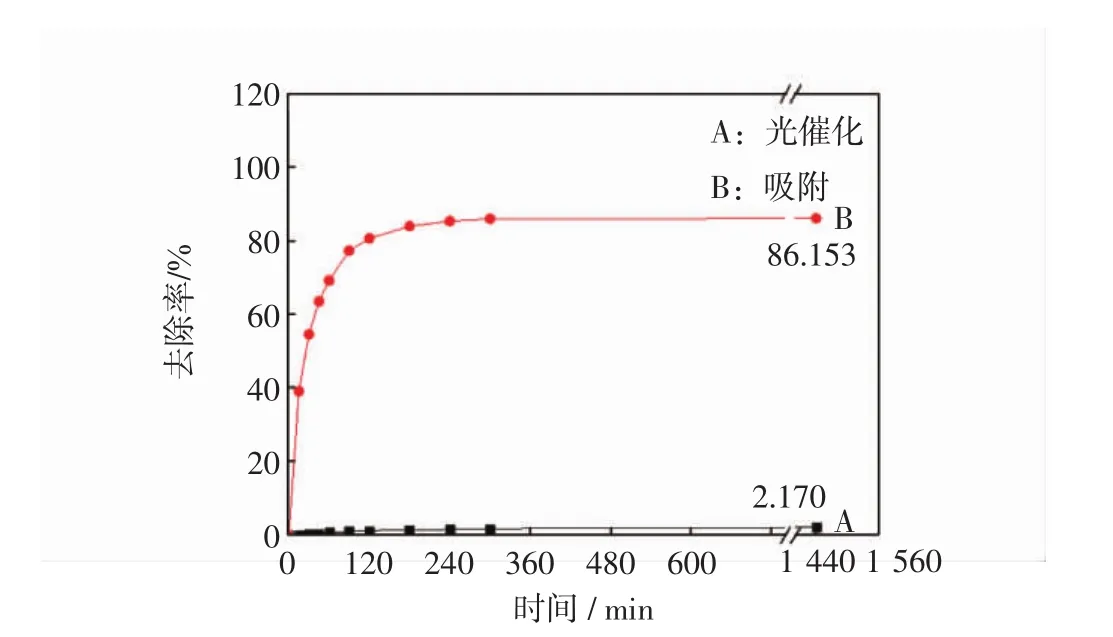
图7 空白对照Fig.7 Blank control
2.2.2 TiO2/微孔陶瓷使用量对亚甲基蓝去除率的影响
图8为固定光照强度为10 mW·cm-2,TiO2/微孔陶瓷的使用量为0.1~1.25 g,随着时间的延长亚甲基蓝去除率的曲线图.首先亚甲基蓝溶液与负载型TiO2暗室搅拌30 min,然后打开紫外灯进行光催化反应.
由图8可以看出,随着TiO2/微孔陶瓷使用量的增多,亚甲基蓝溶液达到完全去除的时间缩短.当负载型TiO2的投入量较少时,用来吸附目标降解物的陶瓷和降解目标降解物的TiO2位点很少,所以亚甲基蓝的去除速率很慢.当TiO2/微孔陶瓷使用量超过1 g时,去除率增加的趋势变化不大,这主要是因为当催化剂用量过多时,大量的二氧化钛不能参与降解过程,并且光照面积受容器的限制,所以亚甲基蓝的去除率不会随着TiO2/微孔陶瓷使用量的增加而一直增加[17-18],因此TiO2/微孔陶瓷使用量1 g为宜.
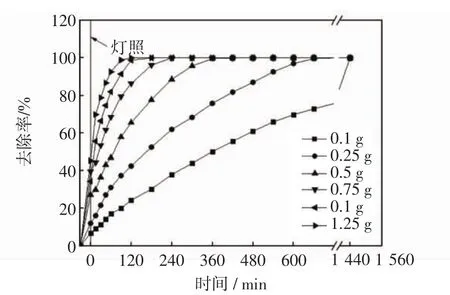
图8 TiO2/微孔陶瓷使用量对亚甲基蓝溶液去除率的影响Fig.8 Effect of usage of TiO2/micro-porous ceramics on removal rate of methylene blue
2.2.3 TiO2/微孔陶瓷的重复使用稳定性
在实际应用中,TiO2光催化材料重复使用和稳定性尤为重要.由图9可知,随着使用次数的增加,亚甲基蓝的去除率降低.在初次使用TiO2/微孔陶瓷时,亚甲基蓝的去除率可达100%;在重复使用6次过程中,亚甲基蓝的去除率均高于90%;当重复第7次使用时,亚甲基蓝的去除率为89.97%.由以上结果可以说明,在去除亚甲基蓝的过程中,是以TiO2的光催化降解为主.因为微孔陶瓷是通过吸附作用而去除溶液中的染料分子,当再次使用时,由于前一次的吸附饱和而几乎丧失吸附能力.在多次使用过程中,TiO2/微孔陶瓷表现出较高的催化活性.这是因为TiO2不断将微孔陶瓷吸附的染料分子降解,而实现载体再生和再利用,实现高效的工作.相比郭宇[19]制备的TiO2/氧化铝重复使用5次过程中对亚甲基蓝的降解率为82%±3%,本实验制备的TiO2/微孔陶瓷具有更高的催化活性和更长的使用寿命.因此TiO2/微孔陶瓷的稳定性和使用寿命都较理想,使其在今后水处理领域的应用成为可能性.
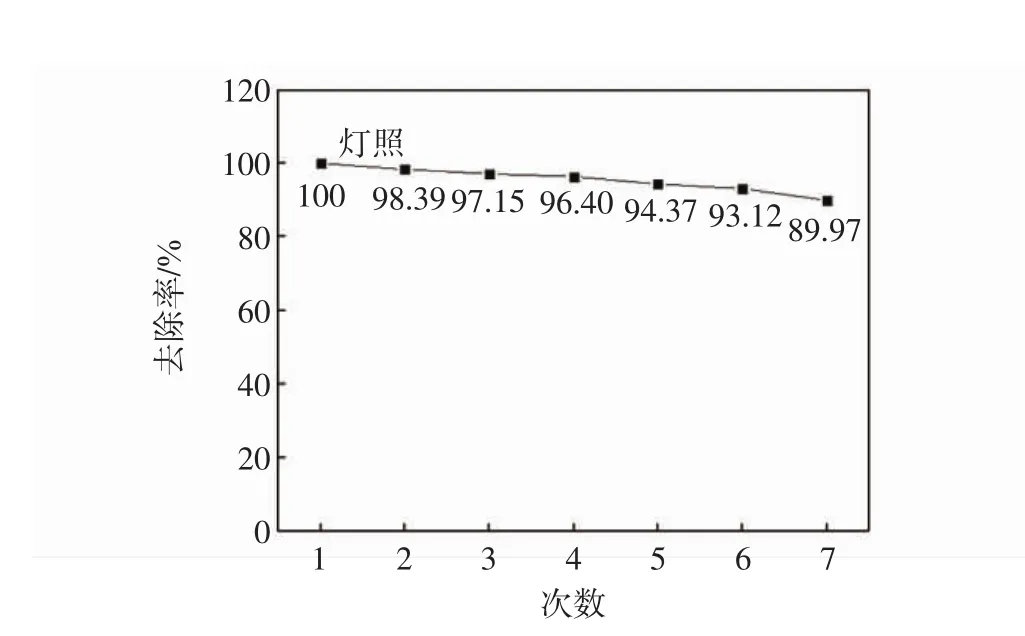
图9 TiO2/微孔陶瓷的重复利用次数Fig.9 Reutilization of TiO2/micro-porous ceramics
3 结论
1)利用溶胶-凝胶和浸渍工艺,将TiO2负载到微孔陶瓷表面及孔道,并且细小的纳米级TiO2晶粒分布均匀,没有出现团聚现象,成功制备了高稳定性和高催化活性的纳米TiO2/微孔陶瓷光催化材料.
2)通过在微孔陶瓷上负载TiO2,载体提高了TiO2由锐钛矿型向金红石型的转变温度,使高催化活性的锐钛矿型TiO2的烧成温度宽化为500~800℃.
3)经过微孔陶瓷负载TiO2后,TiO2的吸收边从407.4 nm减小到405.3 nm,出现蓝移现象,带隙能增加,由3.04 eV增加到3.06 eV,增加了0.02 eV,使电子-空穴对具有更强的氧化还原能力,提高了TiO2的光催化能力.
4)TiO2/微孔陶瓷在700℃煅烧,使用量为1 g,紫外光照5 h时,对亚甲基蓝溶液6次降解过程的去除率均高于90%,TiO2/微孔陶瓷表现出较高的催化活性和使用稳定性.
[1]陈桂华,葛昌华,潘富友,等.化学沉淀法制备纳米Fe/TiO2及其光催化活性的研究[J].人工晶体学报,2010,39(2):433-439.
[2]CARPIO E,ZUIGA P,PONCE S,et al.Photocatalytic degradation of phenol using TiO2nanocrystals supported on activated carbon[J].J Mol Catal A:Chem,2005,228(1/2):293-298.
[3]孟宪谦,薛友祥,吕华,等,TiO2光触媒担载多孔陶瓷室内空气净化元件的研究[J].现代技术陶瓷,2004,25(2):16-18.
[4]董秋花,赵中一,高宏宇,等.负载TiO2陶瓷管治理室内空气中的甲醛[J].南昌大学学报,2005,27(3):64-70.
[5]PEILL N J,HOFFMANN M R.Development and optimization of a TiO2-coated fiber-optic cable reactor;photo-catalytic degradation of 4-chlorophenol[J].Environ Sci Technol,1995,29(12):2974-2981.
[6]MOHSENI M.Gas phase trichloroethylene(TCE)photo oxidation and byproduct formation:Photolysis vs.titania/silica based photocatalysis[J]. Chemosphere,2005,59(3):335-342.
[7]高如琴,郑水林,刘月,等.硅藻土基多孔陶瓷的制备及其对孔雀石绿的吸附和降解[J].硅酸盐学报,2008,36(1):22-24.
[8]李恒,杜庆洋,李国昌,等.淀粉固化法制备堇青石多孔陶瓷[J].人工晶体学报,2013,42(9):1936-1939.
[9]何秀兰,郭英奎,王春艳,等.多孔陶瓷负载TiO2光催化降解甲基橙溶液的研究[J].人工晶体学报,2015,44(2):504-508.
[10]高如琴,郝丹迪,耿悦.多孔陶瓷固载TiO2薄膜的制备及甲醛光催化动力学[J].复合材料学报,2016,33(1):143-147.
[11]BACSA R R,KIWI J.Effect of rutile phase on the photocatalytic properties of anocrystalline titania during the degradation of p-coumaric acid[J]. Applied Catalysis B:Environmental,1998,16(1):19-29.
[12]Zhang H,Banfield J F.Understanding polymorphic phase transformation behavior during growth of nanocrystalline aggregates:insights from TiO2[J]. The Journal of Physical Chemistry B,2000,104(15):3481-3487.
[13]Nikaido M,Furuya S,Kakui T,et al.Photocatalytic behavior of TiO2nanoparticles supported on porous aluminosilicate surface modified by cationic surfactant[J].Advanced Powder Technology,2009,20(6):598-604.
[14]Ahn Y U,Kim E J,Kim H T,et al.Variation of structural and optical properties of sol-gel TiO2thin films with catalyst concentration and calcination temperature[J].Materials Letters,2003,57(30):4660-4666.
[15]Henglein A.Small-particle research:physicochemical properties of extremely small colloidal metal and semiconductor particles[J].Chemical reviews,. 1989,89(8):1861-1873.
[16]Luan Z,Maes E M,Van der Heide P A W,et al.Incorporation of titanium into mesoporous silica molecular sieve SBA-15[J].Chemistry of Materials,1999,11(12):3680-3686.
[17]OH S M,PAPK D W.Production of ultrafine titanium dioxide by DC plasma jet[J].Thin Solid Films,2001,386(2):233-238.
[18]Yu J G,Ma T T,Liu S W.Enhanced photocatalytic activated of mesoporous TiO2ggregates by embedding carbon nanotubes as eledtron-transfer channel[J].Physical Chemical Physics,2011,13(8):3491-3501.
[19]郭宇,金玉家,吴红梅,等.负载型二氧化钛光催化材料的制备及其光催化性能研究[J].光谱学与光谱分析,2015,35(6):1677-1681.
[责任编辑 田丰]
Preparation of TiO2/Micro-porous Ceramics and Photocatalytic Degradation on Methylene Blue
ZHAO Yan1,LIANG Xiuhong1,2
(1.Key Laboratory of Special Functional Materials for Ecological Environment and Information Ministry of Education,Hebei University of Technology,Tianjin 300130,China;2.Institute of Power Source and Ecomaterials Science,Hebei University of Technology,Tianjin 300130,China)
The aim of this work is to solve the problem that powder of TiO2is easy to reunite,difficult to be separated from liquid and recycled.With micro-porous ceramics as carrier,TiO2/micro-porous ceramics photocatalyst was obtained by sol-gel and impregnation process.Changes of TiO2in the process of sintering,transition temperature from anatase to rutile after coated,interface combination status between carrier and TiO2,changes of semiconductor nature of TiO2after coated, photocatalyst properties and stability of TiO2/micro-porous ceramics on methylene blue were studied.The results showed the transition temperature from anatase to rutile increased from 700℃to 900℃after coated on carrier,TiO2was bonded to the surface and pore of micro-porous ceramics by physical method,the band gap of TiO2increased from 3.04 eV to 3.06 eV after coated on carrier,and the removal rate of methylene blue was all higher than than that of 90%under ultraviolet irradiation for 5 h with 1g TiO2/micro-porous ceramics within 6 times,thus showingthatTiO2/micro-porous ceramicshas high catalytic activity and stability.
micro-porous ceramics;sol-gel;titanium dioxide;photocatalytic;removal rate
TB332
A
1007-2373(2017)04-0046-07
10.14081/j.cnki.hgdxb.2017.04.008
2017-03-13
天津市科技支撑计划(15ZCZDSF00030)
赵妍(1990-),女,硕士研究生.通讯作者:梁秀红(1969-),女,副研究员,liangxiuhong071@163.com.

