基于光学相干断层成像含支架的冠脉血管三维重建
,
(上海师范大学 信息与机电工程学院,上海 200234)
基于光学相干断层成像含支架的冠脉血管三维重建
仓定举, 王笑梅*,郑亚州
(上海师范大学 信息与机电工程学院,上海200234)
光学相干断层成像(OCT)以其具有高分辨率,实时成像等特征,已经成为冠状动脉疾病检测的一个新方法.对含支架的OCT冠脉血管图像进行三维重建研究,以期直观地显示三维空间结构图.通过比较选择合适的降噪算法对图像预处理,根据OCT图像的特性,利用改进的最大类间方差算法(Otsu)对冠脉血管进行分割,并利用一个新的自动算法对冠脉支架进行检测.由于图像存在大量可视支架,在对极坐标图像序列预处理之后,用全局的强度轮廓检测候选的像素,去除伪影,确定支架上下边界和位置,并合并相邻的候选像素为一个支架点,成功标记出检测到的支架点,可有效地排除伪影造成的干扰,提升聚类算法的精确度.在此基础上,利用Amira软件实现了对冠脉血管和支架进行三维重建和融合.
光学相干断层成像; 冠脉支架; 预处理; 支架检测; 血管分割; 三维重建
0 引 言
多年来,血管内超声、双源CT和多层螺旋CT等是治疗心冠状动脉等心血管疾病常见的临床诊断方法.但近年来,由于冠状动脉造影和CT检查存在着一些并发症,一些病患不愿接受这种治疗方法.而血管内的超声(IVUS)已经被用于自动的血管三维重建[1]和支架的检测[2],但是它受限于空间分解率和低信噪比,使检测工作非常困难.而光学相干断层成像(OCT)作为一个相对较新的光学信号获取技术,提供了体内血管(包括冠状动脉)的高分解率图像[3](大约是IVUS的10倍).这种血管内的感知技术可以准确地区分血管壁最表面层、支架,还有围绕着它们的血管组织[4].凭借获取血管高分解横截面图像的能力,OCT可以成为诊断带有支架的冠状动脉病人的一个基准工具,并且可引导最优的抗血小板疗法来提前阻止晚期支架血管堵塞的产生.OCT与IVUS相似,当转换器在旋转并且导管处于一个高的、即时的反馈速度时,导管通过向血管壁发射红外线而不是超声来获取冠状动脉的横截面图像,该过程以辐射的方式进行.这种技术提供了很多有价值的内容,包括关于合适的支架部署,活体[5]内不同支架类型的行为,不同支架类型(例如药物洗脱支架)对血管壁治愈的影响等信息.大量研究数据已经阐述了一个在活体内贴壁不良的支架的评估,支撑内膜覆盖的评估和血小板组成与维度的评估的高敏感性.这种信息用来评估不同的支架类型在活体内的表现,以此来测试新药物对于不同支架覆盖的影响.
OCT的高分辨率可以提供清晰的冠脉血管断层图像序列,支架的很多细节可以通过图像观察到,然而手动标记支架是一个耗时耗力而且效率较低的过程,如果能够提出一个自动的识别支架算法来辅助检测冠脉血管的支架,会给医生带来极大的便利,并能有效地减小主观的误判.
Ughi等[6]提出了一种血管内OCT全自动三维可视化方案.该方法准确、快速,适合冠状动脉介入治疗的在线应用,但是会造成3D图像分辨率的下降,形成运动伪影[7].
最近的研究已经借助分析血管内的OCT图像序列提出了几个方法来检测血管壁和支架.一个通用的方法是基于阈值检测,如果伪影存在,血管壁的一个区域会被隐藏,这会导致血管壁被不准确地分割[8].
作者对含支架的OCT冠脉血管图像进行三维重建研究,以期直观地显示三维空间结构图.通过比较,选择合适的降噪算法对图像进行预处理,根据OCT图像的特性,利用改进的Otsu算法对冠脉血管进行分割,并提出一个新的自动算法进行支架提取.实验表明,该算法利用Amira软件实现了对冠脉血管和支架进行三维重建和融合.
1 实验图片
1.1OCT图像
OCT图像是在一个20.0 mm/s的反馈速度期间获得的.通过OCT对植入支架的冠状动脉血管进行扫描,得到一个包含271帧的图像序列的OCT图像.每一幅图像尺寸为504 pixels×968 pixels.每一幅图像显示一片包含支架的血管壁信息.
由于受图像导管位置,心脏移动,多余回声和注入后残留血液的影响,各帧图像情况均不同,质量也显著不同.图像包含的所有的原始信息和一些细节可能会在从极坐标转换为直角坐标的过程中丢失.本实验中,支架检测采用的是在极坐标系统中的原始图像数据.
1.2OCT图像对比分析
图1即为同一图像的横截面图像和极坐标图像的对比.图1中可以识别血管壁、导管、伪影、导引钢丝和支架.其中支架和血管壁是实验感兴趣的区域,而伪影可能会干扰到支架检测的部分.
2 实验的研究方法
2.1研究流程
冠脉支架的检测及其三维重建的流程如图2所示.首先,对271帧图像进行预处理,然后进行冠脉支架的检测和血管壁的分割,最后利用Amira对检测和分割结果图像序列进行三维可视化.
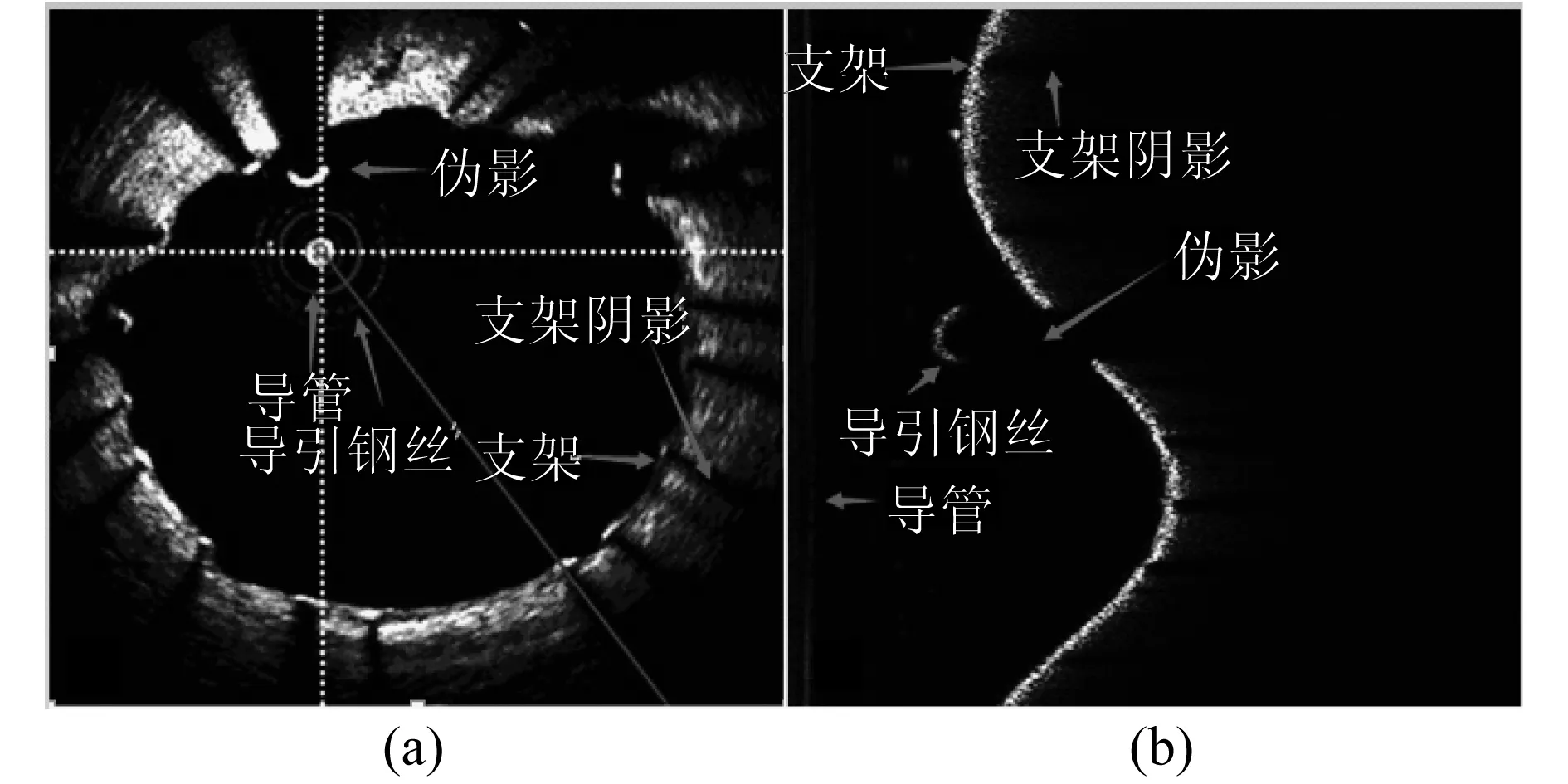
图1 横截面图像(a)和极坐标图像对应图(b)
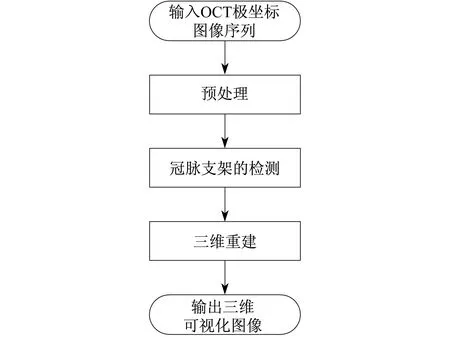
图2 冠脉支架的检测及其三维重建的流程
2.2预处理
由于生物组织的高散射性,扫描和检测中的非线性等因素,通过OCT系统获得的生物医学图像存在各种噪声,使图像模糊、失真,从而影响图像质量.对各种噪声的成因和常用的降噪算法进行分析比较,通过实验对比,选取合适的降噪算法对OCT图像进行处理.
实验主要是以去噪前后图像噪声的相对强度和相关程度为指标来衡量去噪算法优劣.实验采用图像信噪比[9](SNR),图像均方误差[10](MSE)、峰值信噪比[11](PSNR)几个参数作为评价指标[12].
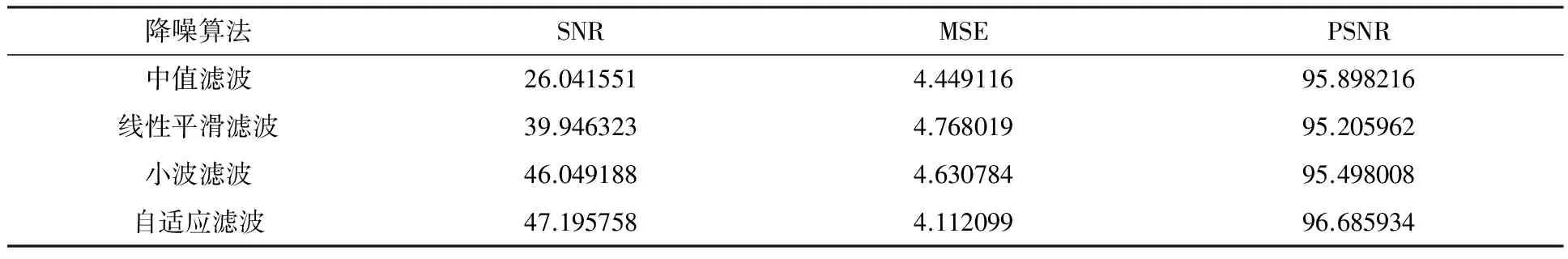
表1 图像降噪后的客观数据
由表1数据可以看出,中值滤波的SNR最低,而自适应滤波的SNR最高,信噪比越高,对图像降噪效果越好;线性平滑滤波的PSNR最低,而自适应滤波的PSNR最高,PSNR越大表示图像的失真越少,图像质量越好;线性平滑滤波的MSE最高,而自适应滤波的MSE最低,MSE作为PSNR的分母,大于1时,越小越好.
根据客观量化分析,最终选择自适应滤波方法对图像进行降噪处理.对图像进行去噪处理前后的图片(第242帧)如图3所示.

图3 灰度化和去噪前后对比图
2.3冠状动脉支架的检测
正如前面所说,为了避免在极坐标转换为直角坐标的过程中,丢失图像的细节和深度信息.实验运用的方法直接基于极坐标进行.支架检测每步的结果图如图4所示.

图4 支架检测每步的结果图.a.一行图片的强度轮廓图;b.手动标记明显的含支架的行;c.候选像素标记图(红色为候选像素点);d.导引钢丝移除后的结果;e.Canny边缘检测的结果;f.候选像素点聚集合并后的结果
2.3.1 候选像素检测
因为在OCT图像中,支架反射了大部分光,同时血管壁分散和减弱了光,如图4a所示,红色部分为每行强度值最大点.同时一个金属的支架通常可以通过如下性质判定:一个亮点跟随一个追踪的阴影部分.图4b中A,B,C即为手动标记处的候选支架.Bruining等提出了一种基于K近邻的支架检测方法,把每行转换为一个特征向量[8].
根据从支架到阴影的距离是相似的这一特点,本实验用强度轮廓的斜率这一特征值来检测支架.斜率反应了局部的强度变化.支架像素与组织像素相比,斜率通常更大.候选的像素标记结果的例子如图4c所示.
从图4c中可以看到阈值分割的效果很明显,候选支架像素少了很多.但是,一个支架可能占有好几行,所以检测到的相邻候选支架点可能属于一个支架.下一步需要对其进行聚集合并.参考很多前人的实验,有个共同的问题是,实验结果受伪影影响很大,会导致误判.所以在聚集之前,先进行伪影的移除.
2.3.2 伪影移除
众所周知,导引钢丝的伪影也会像支架一样,反射大部分能量,表现出跟支架相似的特性.所以实验中,很可能会将其误判为一个候选的支架.然而伪影也有自己的特性:1)和支架相比,距离导引钢丝更近;2) 强度值更大,计算出的斜率更大,同时整个反馈过程中是连续的.根据这两个特征值,可以设计一个联合的伪影过滤器.联合的特征值由伪影的距离阈值和斜率阈值共同决定.
图4d展示了导引钢丝移除后的支架检测结果.如果没有导引线被使用,过滤器不会移除任何候选的支架.对比图4c,发现图片中伪影已经基本移除干净.
2.3.3 Canny算子支架边缘检测
下一步理论上是应该聚集合并候选像素,然而由于支架的宽度和两个邻近支架的间隙可能会显著不同.所以直接聚集候选像素特别困难.为了解决这个问题,必须要知道每个像素的宽度和位置.因为追踪的阴影和图像的导管对齐,在极坐标图像中,几乎是水平的,它们的宽度和位置接近于相应的支架的宽度和位置.一个阴影的最顶层和最底层的边界定义了支架的聚集区域.为了使边缘和宽度更加明显,采用Canny算子边缘检测.
图4e可以明显的看到通过支架的上下边缘宽度及位置.
2.3.4 聚集候选像素点
在聚集的开始处,把5个像素的距离作为聚集的阈值,不断地进行聚集合并处理.对于每个被检测的底端边界,选择其上方的第一个聚集,移除所有其他的聚集.同一个聚集的候选像素的平均位置决定了相应支架的位置.对比图4d,图4f中大部分的候选支架点都被很好地聚集合并了,红色的点就是实验最终检测到的支架的位置.
2.4冠状动脉血管壁的分割

图5 基于边缘检测方法的几种算子对OCT血管壁分割的效果
因为要准确得到血管壁信息,所以必须对所获得的OCT图像集实施图像分割操作.对血管壁进行的分割方法有很多,利用几种算子检测的结果如图5所示.
采用的图像是背景为黑色的图像序列,血管壁信息与背景色区分度十分明显,因此,采用日本学者OTSU于1979年提出的一种对图像进行二值化处理的高效算法——最大类间方差算法(Otsu)对图像进行分割.Otsu算法是一个基于阈值的算法,又称大律法,可以不用先将图像预处理为直方图而直接计算阈值.它对前景与背景区分度明显的图像有很好的分割效果.具体算法如下:设利用某一阀值将图像分为前景和背景两幅图像,当这两幅图像类内方差最小和类间方差最大的时候,取得的阀值定义为最佳阀值,然后利用这个最佳阀值对图像进行二值化处理.
为了加强图像的边界,采用改进的Otsu算法对血管壁进行分割,即首先获得图像对比度拉伸范围,然后调节灰度图像的亮度或彩色图像的颜色矩阵,以此提高图像的对比度,使血管壁更加清晰地呈现出来,然后再用传统的Otsu算法进行分割.
利用改进的Otsu算法分割图像的部分结果如图6所示.其中4a,c分别为37帧与242帧的原始图像,4b,d为分割后的图像.可以发现分割后,血管壁的边界更加清晰可见.而且没有明显出现前面几种算子中的断点、离散等情况,也没有出现锐化图像的对比度下降,图像变灰暗的情况.整体效果基本满足实验要求.
将分割结果转化为直角坐标图像如图7所示.
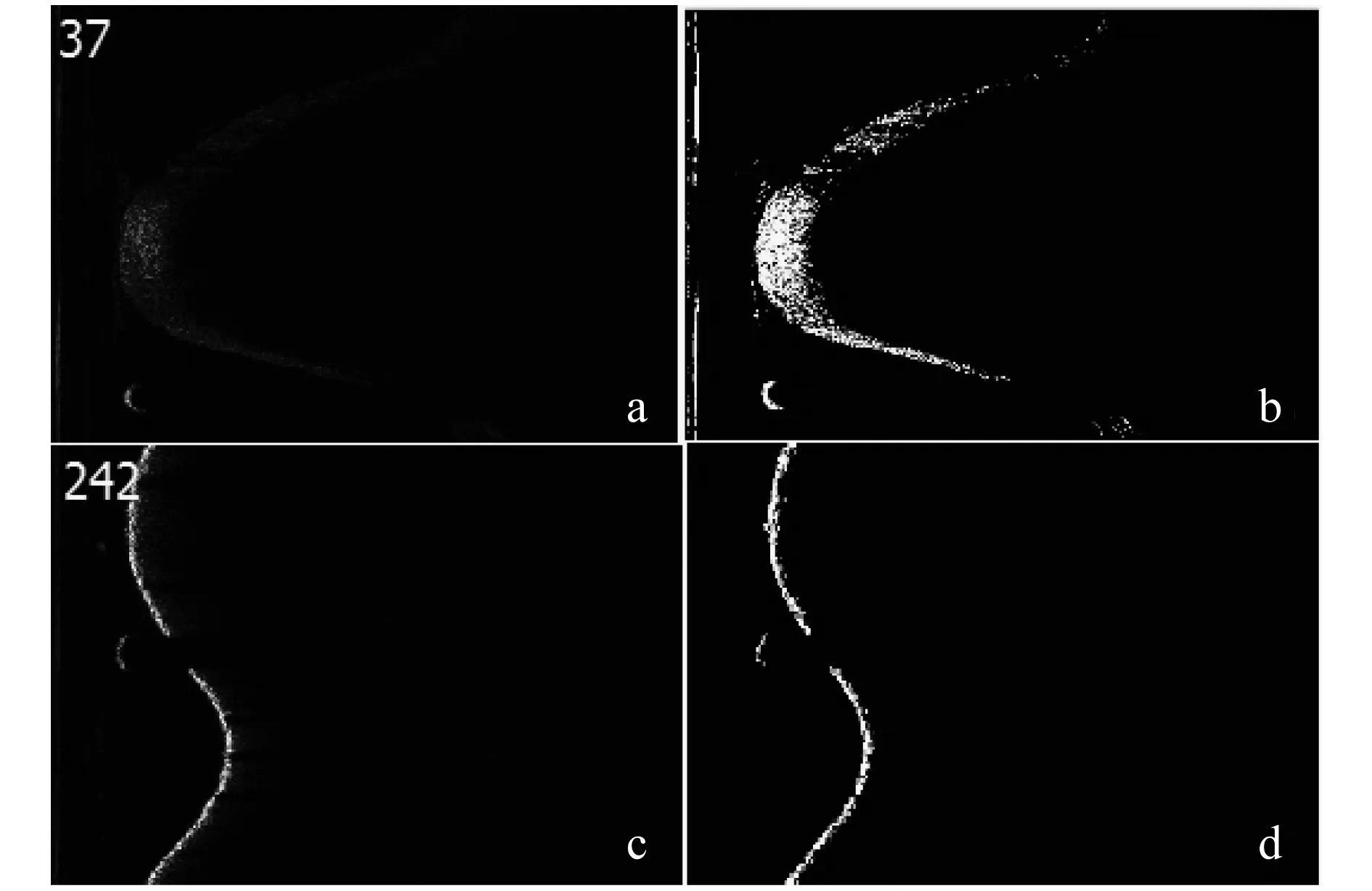
图6 Otsu分割结果对比
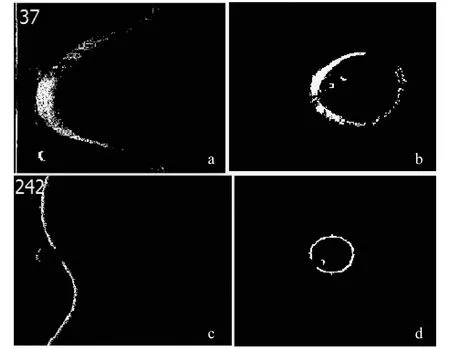
图7 分割结果转化为直角坐标图像
由图7结果可已看出,利用Otsu算法选取最佳阀值可以理想地分割出OCT图像的血管壁信息.由于OCT系统成像的非均匀性扫描以及支架等结构的约束,分割图像中局部呈现不连续性分布,但是这并不影响人眼的最终识别.
271帧处理结果如图8所示.

图8 批处理271帧图像结果
2.5三维重建及结果分析
借助于Amira软件完成植入支架的冠状动脉OCT图像的三维重建过程.
批处理血管壁分割后的OCT图像结果序列如图9所示.

图9 OCT血管壁的空间结构图
经过Amira模块处理过的OCT血管壁总体三维重建结果如图10所示.

图10 OCT血管壁的总体三维重建结果图
全屏显示,冠脉血管壁重建的各个角度视图如图11所示,图11a,b,c分别为从正面、侧面和俯视图,而d是对应于a的空间结构图和三维重建图的结合.

图11 OCT血管的多个角度的三维重建结果图
对支架作同样的处理,支架信息的重建结果如图12所示.

图12 支架的三维重建实验界面
利用Amira模块处理过后的结果如图13所示,13a和b分别为支架的正视图和俯视图,而13c和d是相应的融合图.
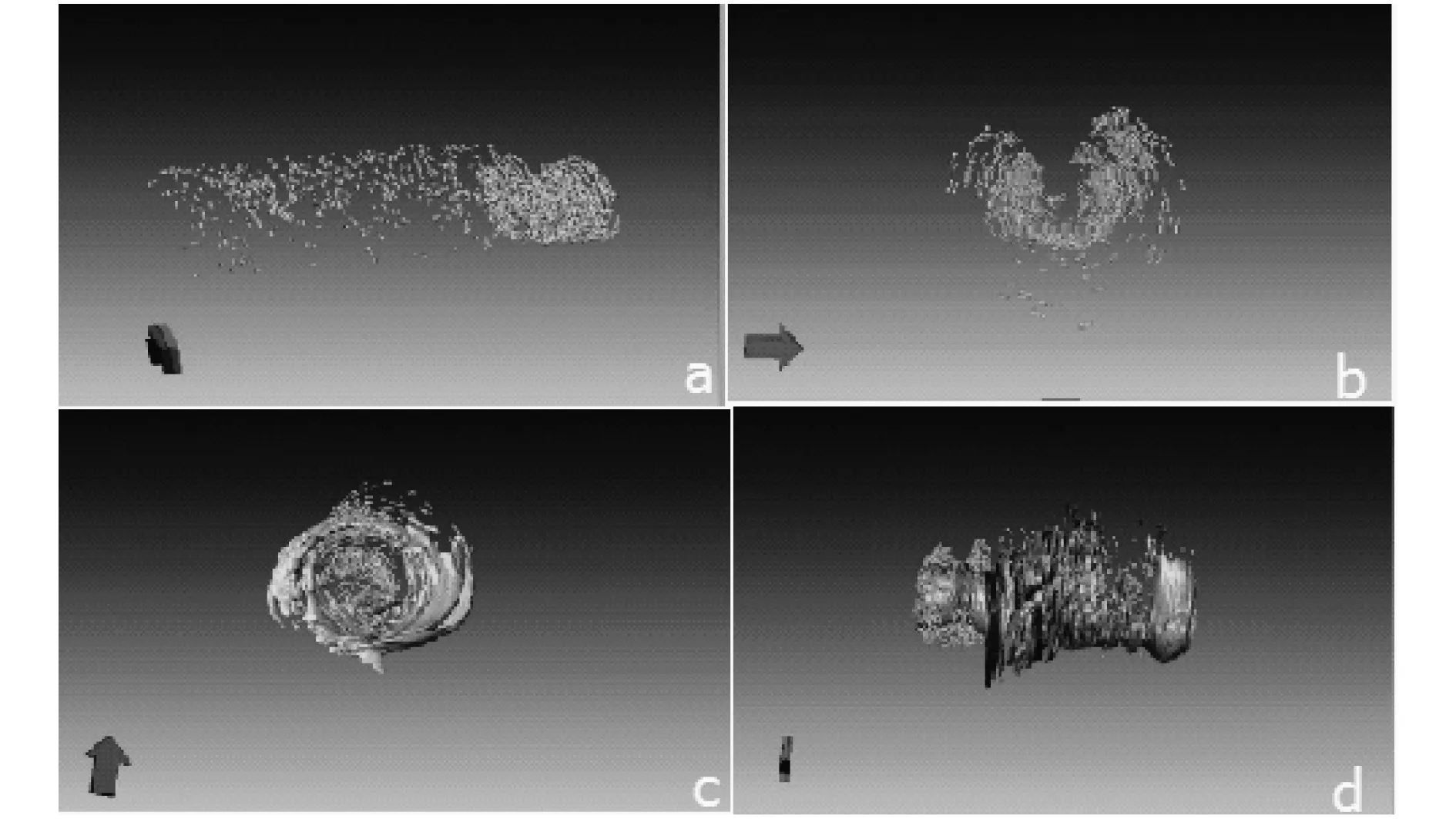
图13 利用Amira模块处理过后的结果图
3 算法分析及对比
对含支架的冠脉血管进行三维重建之前,对血管壁的分割和支架的检测是三维重建效果优劣的重要基础.
纵观近几年的研究现状,国外对冠状动脉支架检测及三维重建的研究取得了一定的成果,然而算法各有优缺,并没有取得十分理想的支架检测及三维重建结果,国内对此研究较少.下面就国内外的研究现状进行一些对比和总结.
1) 胡增阳[13]提出一套血管支架的检测算法对支架进行了定位,很好地实现了冠脉血管支架的提取,但是一方面不能去除OCT图像的噪声和伪影,另一方面可能错误的把某些支架点滤除.
作者提出的算法在冠脉支架检测的第二步就专门的设计了一个过滤器,有效地去除了伪影.第三步通过对支架的上下边缘检测,更有效地确定支架的位置.
同时,在图像从极坐标转化为直角坐标的过程中,作者提出的一套新的自动的算法,直接基于极坐标标记出检测到的支架点的位置,然后在三维重建时再转化为直角坐标,这样就很好地防止了原始信息和细节的丢失.
2) 国外研究中,关于血管壁属性的知识在心血管疾病的管理中可能会是有价值的[13].
Bruining等[13]实现了对支架进行检测.在某些情况下,由于图像失真和噪声,支架检测算法是不能够检测支架的,必须通过手动审查纠正这一横截面的图像,增加了大量的人为工作.同时由于其聚类算法的局限性,会出现不少误判,作者提出的算法根据支架的特性采用一个基于斜率的阈值方法来作为支架检测的标准(特征值),有效地避免了聚类算法的局限性.
3) 最近的研究已经借助分析血管内的OCT图像序列提出了几个方法来检测血管壁和支架[14-16].然而,这些算法仅仅在没有导引钢丝伪影的OCT图像中能有效地工作.如果存在伪影,血管壁的一个区域会被隐藏,这会导致血管壁的分割不准确.
由检测和重建的结果分析可知,作者提出的自动支架检测的算法有效地实现了对植入支架的冠状动脉OCT图像序列的位置自动检测和三维重建.
4 结论与展望
实验主要以含支架的冠状动脉OCT图像为研究对象,以探究冠脉血管中支架的位置及其三维重建为目的,基于支架检测和血管壁分割的结果,利用Amira软件对其进行三维重建,对植入支架的冠状动脉OCT图像序列的三维重建研究做了初步的探索,并取得一定的效果.与二维图像相比,三维图像更立体地展示了深度和空间的信息,更加符合观察者对事物本来面貌的感知.
因此,对二维图像进行三维重建,更好地显示了图像数据和诊断信息,为医生提供了逼真的诊疗工具,是现代医学发展的必然需求.同时未来的发展可以尝试从其他方面入手,进行血管壁分割和支架的提取,例如流体力学方向仍然是一个比较新的领域.可以在三维建模的基础上,加之以血流动力学的知识,以真实OCT血管图为载体,做流体力学的模拟仿真,评估在不同应力下血管的动态变化.
[1] 杨宇.基于快速推进法的血管内超声图像序列的三维分割 [J].北京生物医学工程,2011,30(6):582-587.
Yang Y.Three dimensional segmentation of intravascular ultrasound image sequences based on fast marching method [J].Beijing Biomedical Engineering,2011,30(6):582-587.
[2] 孙正.应用血管内超声与X射线造影图像融合的血管三维重建 [J].工程图学学报,2010,31(1):116-223.
Sun Z.Using intravascular ultrasound and X-ray angiogram image fusion of 3D reconstruction of vessels [J].Engineering Drawing Science Journal,2010,31(1):116-223.
[3] Bruining N,Sihan K,Ligthart J,et al.Automated Three-Dimensional Detection of Intracoronary Stent Struts in Optical Coherence Tomography Images [J].Journal of the American College of Cardiology,2011,58(20):221-224.
[4] Pinto T L,Waksman R.Clinical applications of optical coherence tomography [J].Interv Cardiol,2006,19(6):566-73.
[5] Feyter P J D,Nieman K.New coronary imaging techniques:what to expect? [J].Heart,2002,87(3):195-197.
[6] Ramasamy R,Mata D A,Jain L,et al.Microscopic visualization of intravasal spermatozoa is positively associated with patency after bilateral microsurgical vasovasostomy [J].Andrology,2015,3(3):532-535.
[7] Hassan A K M,Bergheanu S C,Theo S,et al.Late stent malapposition risk is higher after drug-eluting stent compared with bare-metal stent implantation and associates with late stent thrombosis[J].European Heart Journal,2010,31(10):1172-1180.
[8] Tung K P,Shi W Z,De Silva R,et al.Automatical vessel wall detection in intravascular coronary OCT [C].Biomedical Imaging:From Nano to Macro,2011 IEEE International Symposium on,2011.
[9] Robson P M,Grant A K,Madhuranthakam A J,et al.Comprehensive quantification of signal-to-noise ratio and g-factor for image-based and k-space-based parallel imaging reconstructions [J].Magnetic Resonance in Medicine,2008,60(4):895-907.
[10] Hore A,Ziou D.Image Quality Metrics:PSNR vs.SSIM [C].International Conference on Pattern Recognition,Istanbul:IEEE,2010.
[11] 佟雨兵,张其善,祁云平.基于PSNR与SSIM联合的图像质量评价模型 [J].中国图象图形学报,2006,11(12):1758-1763.
Tong Y B,Zhang Q S,Qi Y P.An image quality evaluation model based on the combination of PSNR and [J].Chinese Journal of image and graphics,2006,11(12):1758-1763.
[12] 唐海波,高应俊,何永健,等.光学相干层析图像的散斑去躁和边缘特征提取 [J].量子电子学报,2010,27(2):129-133.
Tang H B,Gao Y J,He Y J,et al.Speckle denoising and edge feature extraction in optical coherence tomography [J].Journal of Quantum Electronics,2010,27(2):129-133.
[13] 胡增阳,王笑梅.基于OCT图像的冠状动脉血管支架自动检测 [J].计算机与数字工程,2015(8):1493-1496.
Hu Z Y,Wang X M.Automatic detection of coronary artery stent based on OCT image [J].Computer and Digital Engineering,2015 (8):1493-1496.
[14] Bruining N,Sihan K,Ligthart J,et al.Automated three-dimensional detection of intracoronary stent struts in optical coherence tomography images [J].Journal of the American College of Cardiology,2011,58(20):221-224.
[15] Gurmeric S,Isguder G G,Carlier S,et al.A new 3-d automated computational method to evalu-ate in-stent neointimal hyperplasia ininvivointravascu-lar optical coherence tomography pullbacks [J].Medical Image Computing and Computer Assisted Intervention,2009,5762:776-785.
[16] Kauffmann C,Motreff P,Sarry L.Invivosuper-vised analysis of stent reendothelialization from optical coherence tomography [J].IEEE Transactions on Medical Imaging,2010,29(3):807-818.
(责任编辑:包震宇)
DreconstructionofcoronaryarterycontainingstentstrutbasedonOCTimages
Cang Dingju,WangXiaomei*,ZhengYazhou
(The College of Information,Mechanical and Electrical Engineering,Shanghai Normal University,Shanghai200234,China)
Optical coherence tomography (OCT) has become a new method for detecting coronary artery disease,which is widely used for its high resolution.In this article,we study algorisms for3D images reconstructing from2D cross-sectional coronary images.The images are firstly denoised by self-adapted median filter algorithm.According to the characteristics of OCT images,an improved Otsu algorithm is used to segment the coronary vessels.A new full automatic algorithm is then applied for stent detection.All2D OCT images are converted into polar coordination.Based on the visible stent features shown in the OCT images,with global intensity histogram and intensity contours,we can identify candidate pixels and remove the artifacts to locate the stent on the lower boundary.By merging adjacent candidate pixels to a point on the stent,we can then accurately delineate the stent position.This process does not require a priori knowledge of stent status and the contours of blood vessels.It is immune from interferences induced by artifacts and avoids the accuracy problem of clustering algorithm.The final results show that the proposed method is able to conduct3D reconstruction and fusion effectively.
OCT; coronary artery strut; pre-processing; strut detection; vessel segmentation;3D reconstruction
2016-02-05
仓定举(1990-),男,硕士研究生,主要从事医学图像处理方面的研究.E-mail:1213193181@qq.com
导师简介: 王笑梅(1970-),女,博士,副教授,主要从事图像处理,生物信息学等方面的研究.E-mail:xiaomei@shnu.edu.cn
TP391.41
:A
:1000-5137(2017)04-0547-09
*

