Ni基双金属催化剂的制备和应用进展
苑 晓,宋红兵
(1.中国化工博物馆,北京 1 0 0 0 1 1;2. 青岛科技大学 化工学院,山东 青岛 2 6 6 0 4 2)
Ni基双金属催化剂的制备和应用进展
苑 晓1,宋红兵2
(1.中国化工博物馆,北京 1 0 0 0 1 1;2. 青岛科技大学 化工学院,山东 青岛 2 6 6 0 4 2)
Ni可以与许多过渡金属以不同比例形成合金,制备不同组分的Ni基双金属催化剂。Ni基双金属催化剂一方面提供更多的调控参数来优化催化剂的电子性质和化学性质,以期获得高活性、高选择性和高稳定性的催化性能;另一方面,还可以减少贵金属的负载量,甚至研发出非Pt族的双金属催化剂,以降低催化剂成本。介绍了Ni基双金属催化剂的制备方法及设计原理,并着重探讨了近年来Ni基双金属催化剂在加氢、脱氢、重整、氧化反应等多相催化及电催化领域的应用。
镍基双金属催化剂;多相催化;电催化
催化过程在现代石油加工、能源、制药及环境保护等领域被广泛使用,它的核心是催化剂。Ni基催化剂是金属催化剂中应用最广泛的催化剂之一,在工业生产中发挥着重要的作用。在19世纪末,法国化学家Paul Sabatier在研究乙炔在热氧化镍作用下的氢化作用时,发现了金属镍粉的催化作用,并成功将其应用于其他加氢反应中,他也因为Ni催化剂获得了1912年的诺贝尔化学奖[1]。在Ni催化剂在工业中获得广泛应用的同时,研究者们也很快意识到单组分的Ni催化剂很难满足技术进步对催化剂活性、选择性和稳定性的要求。
双金属催化剂具有不同于相应单金属催化剂的电子性质和化学性质,往往表现出优于单金属催化剂的性能。20世纪60年代埃克森研究与工程公司系统研究了双金属催化剂,并延续至今。在所有双金属催化剂中,研究最多的是Pt族金属催化剂,但高成本限制了它在工业中的大规模应用[1-2]。Ni廉低易得,同时具有类似Pt族金属的电子性质,因此在一些反应中可替代Pd或Pt催化剂[3-5]。Ni可以与所有贵金属和许多过渡金属以不同比例形成合金,进而制备出一系列不同组分的Ni基双金属催化剂,并用于不同的反应。Ni基双金属催化剂可提供更多的调控参数来优化它的电子性质和化学性质,以期获得高活性、高选择性和高稳定性的催化性能;Ni基双金属催化剂还可以减少贵金属的负载量,甚至研发出非Pt族的双金属催化剂,以降低催化剂的成本。
本文介绍了Ni基双金属催化剂的制备方法,并着重探讨了近年来Ni基双金属催化剂在加氢、脱氢、重整、氧化反应等多相催化及电催化领域的应用。
1 Ni基双金属催化剂的制备
双金属催化剂的结构受制备方法、金属在周期表中的相对位置、金属的还原电位等多种因素的影响。目前制备双金属催化剂的方法相对成熟,选择哪种方法主要取决于所需催化剂的表面和体相结构[1-2]。工业上常用共浸渍法或顺序浸渍法制备负载型双金属催化剂或合金材料,其中,采用顺序浸渍法易获得核壳型材料,即先还原催化活性低的金属核(通常为3d过渡金属),然后再将活性高的金属(通常为贵金属)沉积到核表面。另一方面,基础研究常采用湿浸渍法合成形貌、尺寸和组成可控的双金属催化剂,也用来合成各种双金属纳米粒子[6-7]。根据双金属纳米粒子的形成机制,湿浸渍法分为两类:种子生长法和一锅共还原法。在种子生长法中,先将活性较低的金属制备成种子,再将其分散在活性较高的金属前体溶液中;活性较高的金属在种子表面被还原形成均匀的层,从而获得核壳结构。在一锅共还原法中,同时加入两种金属前体,最终的结构取决于金属的还原电位;理论上,具有相似还原电位的金属可能同时被还原形成合金结构,而具有不同还原电位的金属被顺次还原形成核壳结构。实际上,金属的还原过程还受表面活性剂、还原剂和温度等合成条件的影响,这些因素与金属还原电位一起决定了双金属纳米粒子的结构[8-11]。
除了制备方法,周期表中两种金属的相对位置也会影响双金属体系的结构。当两种金属在周期表的位置非常接近时,容易形成固溶体或可混溶体系。例如,Ni可与Co,Cu,Rh,Pd,Ir以任何比例混溶,很容易形成合金。周期表中远离Ni的金属(如Pt)通常与Ni形成不同的金属间化合物,其中电催化应用较多的Pt3Ni是最稳定的化合物。采用还原金属前体盐的方法制备双金属催化剂,金属的还原电位也是决定结构的关键因素。因此,可控合成双金属材料需要考虑多个影响因素。随着材料制备科学的发展,通过可控合成不同结构的Ni基双金属催化剂来调节及优化催化剂性能成为可能,同时需要建立催化剂的表面/体相结构与催化性能之间的关系。在过去的十多年中,大量的先进表征技术,如俄歇电子能谱、X射线光电子能谱(XPS)、扩展的X射线吸收精细结构光谱、低能电子衍射等,以及理论计算如密度泛函理论(DFT)的发展和应用[1-2,12-13],为深入认识和理解双金属催化剂表面结构与催化性能的关系提供了良好的条件。
1.1 核壳结构
核壳结构双金属材料通常可通过种子生长法或一锅共还原法获得。在“Ni@贵金属”这类核壳结构双金属材料中,Ni作为核、贵金属作为壳。当采用种子生长法时,先还原Ni前体盐来制备Ni核,然后在其表面沉积贵金属。当采用一锅共还原法时很难形成这种结构,这是因为贵金属的还原电位比Ni高,贵金属先被还原,后还原的Ni将沉积在贵金属核上作为壳层,得到“贵金属@Ni”这种核壳结构[14]。此外,核-多壳结构更加复杂,制备过程需要精确的动力学控制,但这类结构往往表现出良好的光学和电子性质。近期,研究者在低温溶液中,采用肼作为还原剂,在立方和八面体的Pd核上合成出了Pd-Ni-Pt多壳结构(见图1)[15]。在该研究中,Pd立方体作为成形的晶体基底,可以催化和引导Ni定向生长;在Ni定向生长后添加Pt离子来置换金属Ni,从而形成逐层包裹的三元金属纳米粒子。

图1 立方Pd-Ni-Pt的核-夹层-壳纳米粒子的合成[15]Fig.1 Synthesis of cubic Pd-Ni-Pt core-sandwich-shell nanoparticles[15].
1.2 合金结构
当两种金属原子在材料中均匀分布时形成合金体系。一些金属混合形成合金后在热力学上更稳定,而有些金属必须严格控制反应条件才能形成合金结构。一种方法是使用强还原剂,可以同时还原所有金属前体来形成合金。例如,在含有十六烷基三甲基溴化铵表面活性剂的水溶液中,使用NaBH4作为还原剂还原Ni2+和Fe2+形成双金属NiFe合金纳米粒子(这两种金属不能以任意比例进行热力学混合)[9,16]。另外,通过表面活性剂也可以引导反应和晶体生长路径来制备特定形状的纳米粒子。例如,在油胺和油酸中用CO还原金属前体盐制备的Pt3Ni合金纳米晶体,可作为常用的氧还原反应催化剂[17-18]。温度对金属前体的还原也有影响,如在反应温度150 ℃时,Ni(acac)2和Pt(acac)2混合物中Ni几乎没有被还原;当温度进一步升至200 ℃时,有90%的Ni被还原[4]。在同样的温度下,仅存在Ni前体时仅有42%的Ni被还原,这表明Pt或Pt(acac)2的存在使得Ni更易被还原。同时,混合前体溶液的表观反应起始温度(115 ℃)比Pt(acac)2单组分溶液的表观反应起始温度(137± 1 ℃)低。
1.3 多孔结构
双金属合金粒子通常比表面积较低,不利于在催化反应中应用。而多孔合金材料具有比表面积大、气体渗透性好、质量扩散能力强和密度低的优点,使其在催化反应中更具应用前景。1927年,Murray Raney用浓氢氧化钠选择性浸渍一块NiAl合金(NiAl3和Ni2Al3)来合成多孔镍(或雷尼镍),这种多孔的雷尼镍材料由于成本低、催化活性高被用作非均相催化剂已有80多年历史。Wang等[19]采用过量的浓硝酸选择性地溶解合金纳米粒子中的非贵金属组分,来获得具有纳米孔隙的材料。化学腐蚀法可用于任何贵金属和非贵金属的合金纳米粒子(如NiPt,NiRh)中,以增大比表面积和提高窄孔径的分布。
近些年采用的电化学腐蚀法是一种改进的选择性更好的制备多孔合金的方法。原理是在二元或多组分合金中选择性溶解非贵金属活性组分,其中剩余的贵金属组分可沿着三维孔隙表面自由扩散。该方法形成的是核壳纳米多孔结构,表面被贵金属组分覆盖,而内部残留一部分非贵金属组分。Chen等[20]采用电化学方法在低电位下的酸性溶液中腐蚀Pd20Ni80合金,制备了一种纳米多孔的PdNi双金属催化剂。该方法的优点是通过调节电位可以控制纳米多孔合金中Ni的残留量。他们还用类似的电化学方法制备了具有层状结构和高比表面积的多孔NiPt合金纳米粒子。
2 Ni基双金属催化剂在催化反应中的应用
由于Ni具有类似Pd和Pt的电子性质,因此可应用于这两种金属作为催化剂的类似反应中。本综述主要关注Ni基双金属催化剂的最新进展,其中贵金属(Ru,Rh,Pd,Ir,Pt,Au,Ag)和过渡金属(Fe,Co,Cu)主要作为客体金属(图2)。在一些情况下,Ni也作为客体金属或助剂来改变贵金属的催化活性。由于Ni还原电位较低,当Ni暴露在Ni基双金属催化剂表面时极易被氧化。然而,有时候氧化态的Ni依然可以通过改变第二组分的几何和/或电子环境来提高催化剂的性能,这一部分着重应用于多相催化及电催化领域。本文将比较Ni基双金属催化剂与相应的单金属催化剂的催化性能,并在理解催化剂的电子能态和几何构型的基础上分析催化剂的构效关系。
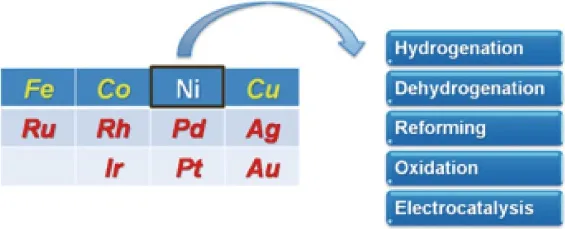
图2 Ni基双金属催化剂及其催化应用Fig.2 Ni-based bimetallic catalysts and their catalytic applications.
2.1 加氢反应
2.1.1 加氢脱卤反应
直接排放到环境中的含卤化合物对大气和地下水体都会造成严重危害,需要采用催化加氢脱氯的方法将有毒有害的含卤化合物转化为可回收或可利用的产物。Ni基催化剂已应用于氯代芳香化合物加氢脱氯反应中[21-22]。在催化邻氯烷烃(如1,2-二氯丙烷)脱氯时,Ni催化剂使用的反应条件比Pt和Pd催化剂更苛刻,如高温和高氢气压力[23]。因此,研究者通过采用贵金属(Pd,Ru,Ag,Au等)改性Ni催化剂的方法,使得改性的Ni基双金属催化剂既有贵金属的高活性同时具有Ni的高选择性[24-26]。Simagina等[24]报道了碳负载的NiPd双金属催化剂在六氯苯加氢脱氯反应中的催化性能,相比于可以催化六氯苯转化为苯的纯Pd催化剂,NiPd催化剂可以高选择性地获得单氯苯和二氯苯产物,且反应物的脱氯程度与NiPd催化剂表面的Pd浓度成正比。研究者还发现,位于富Ni双金属表面孤立的Pd原子比位于较大Pd聚集区域的Pd原子活性高。纯Ni催化1,2-二氯乙烷脱氯反应时主要生成乙烷,而添加了Cu的NiCu双金属催化剂可提高氯乙烯的选择性[27]。
2.1.2 CO2加氢反应
发展低碳清洁能源和温室气体减排是当前的催化研究热点,CO2催化加氢反应是其中的重要途径之一[28-29]。早期研究发现,在甲醇合成反应中,Ni可以提高Cu催化剂的活性,Ni的沉积使得从CO2和H2形成甲醇的速率显著提高[30]。Cu-Ni/SiO2催化剂具有与工业上使用的Cu/ZnO/Al2O3催化剂类似的活性[31]以及更高的甲醇选择性。最近研究发现,CuxNiy/γ-Al2O3双金属合金催化剂催化CO2加氢的活性与合金组成密切相关[32]。在相同反应条件下,Cu3Ni7/γ-Al2O3催化剂比商用Cu/ZnO/Al2O3催化剂的甲醇形成速率还高。催化剂的高活性可归因于较大的比表面积、较小的合金粒子尺度和较低的还原温度。研究者采用碳纳米管-石墨烯负载的Ni-Pd合金催化剂催化CO2加氢制备甲酸[33]。即使在高温和高压下,CO2加氢形成甲酸的热力学也是不利的,因此通常将有机/无机碱加入到反应混合物中以增加转化率。近期,有研究者在没有添加任何碱的水中采用非均相催化剂,在极为温和的反应条件下获得了收率非常低的甲酸[34]。Peng等[35]提出了NiPd合金上形成甲酸的反应机理,H2在贵金属(如Pt,Ru,Rh,Pd)上分解生成H原子,而CO2在过渡金属(如Ni)上被还原。DFT计算也证明了CO2吸附在Ni表面上作为中间体连续与H反应,最终生成产物甲酸。
2.1.3 氢解反应
木质素具有转化为燃料和化学品的巨大潜力,而木质素中C—O键的氢解是将其转化为芳香族化合物的有效途径。近期Zhang等[36-37]开发了一系列Ni基核壳双金属催化剂Ni-M(M=Ru,Rh,Pd,Au),可以高效催化木质素模型化合物的氢解(见图3)。由于两种金属还原性能的差异,这类双金属催化剂是具有Ni壳的核壳结构。XPS和X射线近边结构吸收光谱研究结果表明,电荷从贵金属向Ni转移,使得Ni表面富集电子。此外,核壳双金属催化剂的金属颗粒尺寸通常远小于纯Ni催化剂(Ni85Ru15和Ni85Rh15的金属颗粒尺寸约2 nm,而Ni7Au3的金属颗粒尺寸约4 nm),使催化剂的表面原子数大大增加。在催化木质素模型化合物2-苯氧基-1-苯基乙醇的氢解反应中,Ni基双金属催化剂显示出极好的协同效应。纯Ni催化剂通常活性低但氢解产物选择性高,而纯Ru和Rh催化剂活性高但选择性差,而Ni基双金属核壳催化剂综合了两方面的优点,可同时获得高转化率和单体的高选择性。
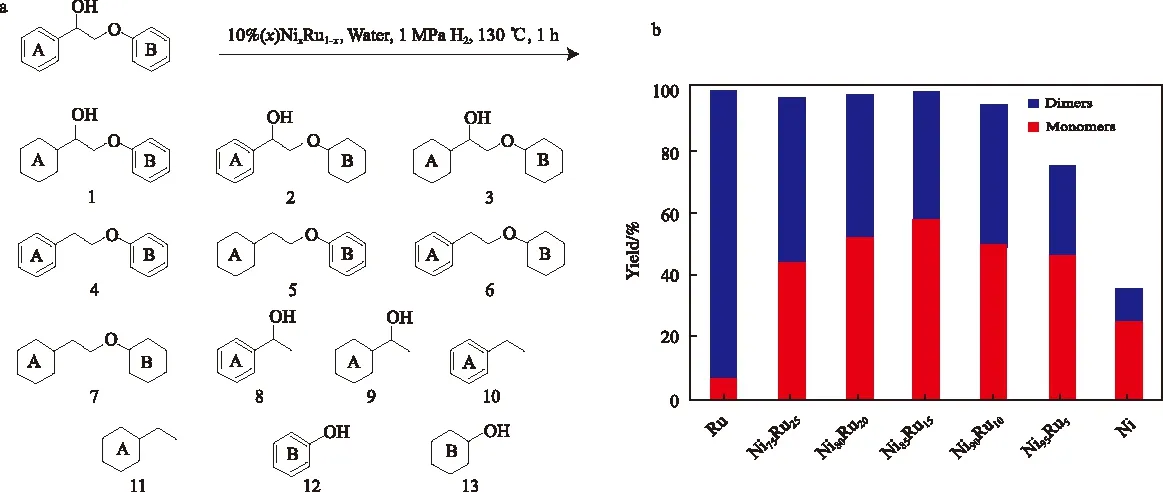
图3 木质素模型化合物氢解后的13种产物(a)以及不同Ni/Ru比的Ni-Ru催化剂上单体和二聚物的产率(b)[36-37]Fig.3 Thirteen products identified after hydrogenolysis of lignin model compound(a) and yields of monomers and dimers over Ni-Ru catalysts with varying Ni/Ru ratio(b)[36-37].
2.2 脱氢反应
2.2.1 氨脱氢反应
由于氨具有用作氢存储介质的潜力,氨的分解近来受到越来越多的关注。氨在0.9 MPa、20 ℃条件下即可被液化,具有较高的能量密度,因此氨脱氢反应可作为一种优良的化学储氢媒介。Ru是单金属中最好的氨脱氢催化剂,但Ru资源有限且价格昂贵,因此寻找替代催化剂是研究者关注的焦点之一。Guo等[38-40]采用微观反应动力学模拟研究了Co,Pt,Pd,Ni,Ru,Rh,Ir,Re,Mo表面的催化氨分解反应,结合DFT计算得到的氮结合能预测了氨脱氢活性,并利用程序升温脱附和高分辨率电子能量损失谱等实验方法确认了表层双金属Ni-Pt-Pt(111)可以在20 ℃分解氨,优于Ru(001)表面的催化反应。
2.2.2 肼脱氢反应
肼也是一种重要的储能材料,完全分解后仅产生氢和氮:

同时,肼也可以不完全分解成氨和氮:
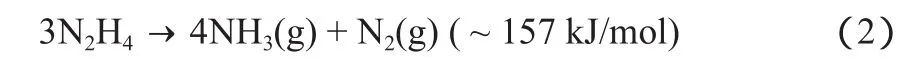
从储氢的观点看,必须选择性地促进反应(1)、抑制反应(2)。Singh等[41-42]研究发现Rh,Pt,Ir与Ni的组合可在室温下100%选择性催化水合肼完全分解。在表面活性剂存在下,采用共还原法可以合成不同Rh/Ni比的双金属RhNi催化剂。尽管单一的Ni对该反应无催化活性,但Ni的存在使双金属催化剂在Rh/Ni质量比为4∶1时H2的选择性实现了100%。同比例的物理混合Ni纳米颗粒和Rh纳米颗粒却没有显示出增强的选择性,这证实了双金属在反应中的协同作用。RhNi合金化修饰了催化剂表面,并调节Rh与N—N、N—H键的相互作用以及中间体的稳定性。尽管RhNi催化剂的活性非常好,但仍使用了大量的Rh(在Rh4Ni中Rh含量为80%(w)),成本较高,还需进一步探究更廉价的高性能催化剂。
2.3 重整反应
2.3.1 烃类重整
Besenbacher等[43]曾报道,负载在MgAl2O4上的AuNi合金催化剂在干气重整反应中活性较高,且比纯Ni催化剂更不易形成积碳。Au原子的高电子密度使相邻Ni原子的电子密度增强并具有更高的有效配位数。Au对Ni表面改性主要有两方面的影响因素:表面活化烃分子的能力、表面结合C并形成积碳的倾向。CH4中第一个H原子解离被认为是在纯Ni催化剂上干气重整过程的控速步骤。通过DFT计算和实验方法证实,在Ni表面添加Au可稍增加CH4离解的能垒,因此Au会阻碍CH4解离。同时Au的添加还会产生第二种影响,即Au修饰的Ni表面具有低得多的C吸附能力。在纯Ni表面最稳定的吸附位是最密堆积的三重位,但与Au原子相邻的三重位是不稳定的。Au对C原子吸附的影响明显强于对CH4活化的影响,因此掺杂了Au的Ni催化剂既耐积碳,又可以保持高活性。
2.3.2 醇类重整
水相中负载的NiPt/C和NiPt/γ-Al2O3催化剂上乙二醇的重整反应,揭示了双金属催化剂增强的活性与催化剂结构变化的关系[44]。在反应条件下,Ni析出后分散在双金属催化剂表面,基于模型表面的理论和实验研究确定Ni比Pt活性更高。最近,Moraes等[45-46]研究了Pt添加对Ni/CeO2催化剂催化乙醇低温重整反应性能的影响。通过对催化剂进行表征,他们推测了Ni/CeO2比NiPt/CeO2失活更快的原因。在第一步中,两种催化剂都能将乙氧基物种、脱氢物种(乙醛、乙酰基物种)和乙酸盐物种分解成H2,CO,CHx。之后存在两种可能性:1)CHx物种被氢化并解吸生成CH4,或与水反应产生H2和CO;2)这些CHx物种进一步脱氢生成碳。因此当反应途径2)的速率高于CHx物种的解吸速率时,碳在表面上富集并导致催化剂失活。向Ni/ CeO2催化剂中添加Pt可促进脱氢和乙酸盐物种分解生成H2、CH4、CO和碳酸盐物种。Pt可通过离解吸附氢和Ni表面吸附氢的溢流来有效形成活性氢物种。这些高度活泼的氢原子与吸附的碳前体反应,最终生成CH4并解吸。因此,Pt在Ni表面上的掺杂减少了碳化镍的形成并增加了催化剂的稳定性。
2.4 氧化反应
2.4.1 CO氧化
在空气净化处理中,将CO催化氧化成CO2是去除它们的主要方法。NiPd双金属催化剂比单金属Pd催化剂的活性更高[47-49]。Pd和Ni之间的相互作用提高了Ni和Pd的还原性,从而提高了催化剂的活性。Mu等[50]报道了负载型双金属NiPt催化剂在室温下可以100%催化CO氧化。NiPt(111)表面由表面二维NiO1-x纳米岛和亚层Ni原子组成。表面氧化Ni单层纳米岛在岛边缘与配位不饱和阳离子键合,为O2离解吸附提供了活性位点。另一方面在表面氧化物岛的边缘处产生的O原子,在亚层的Ni原子作用下更易发生氧化反应。Holgado等[51]比较了负载在CeO2载体上的双金属核壳AuNi纳米粒子和相应的单金属催化剂的催化CO氧化的性能,发现Au/CeO2比Ni/CeO2具有更好的催化性能,而AuNi/CeO2的活性优于Au/CeO2。通过对催化剂进行结构表征,发现反应期间仅Ni原子暴露在催化剂表面上。研究者认为,位于Au@Ni纳米颗粒核的Au原子通过诱导效应对Ni的d态局部密度产生了电子效应。
2.4.2 烃类氧化
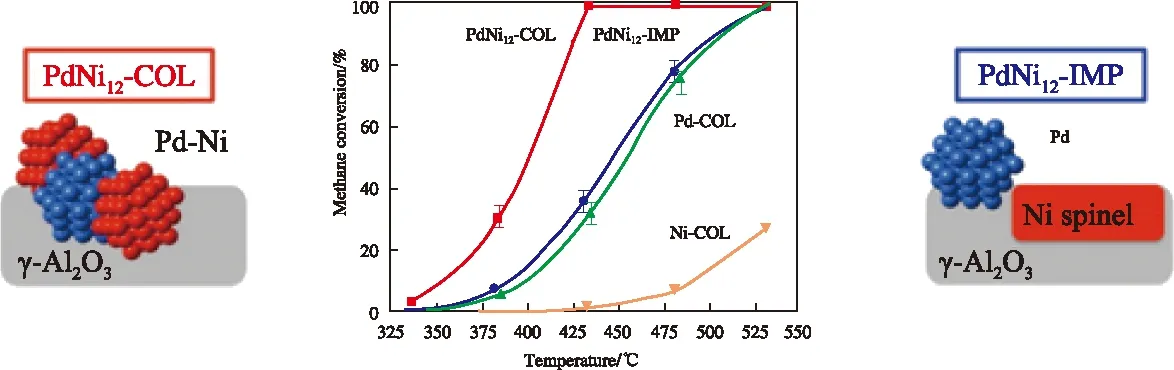
图4 NiPd双金属催化剂的制备流程及其催化CH4燃烧性能[49]Fig.4 Schematic diagram for the synthesis of bimetallic NiPd catalysts and their catalytic performances in the methane combustion[49].
2.5 电催化反应
氧还原反应是质子膜燃料电池中的基本电极反应,其中,氧在酸性或碱性介质中在阴极被还原成水。另一方面,燃料组分(如H2和甲醇)在阳极处被引入以产生质子。Chen等[20]通过在酸性溶液中电化学腐蚀Pd20Ni80合金的方法,制备了多孔纳米NiPd双金属催化剂。含Ni约9%的多孔NiPd双金属催化剂电催化氧还原的活性明显优于商业Pd/C催化剂和纳米多孔Pd催化剂。多孔纳米NiPd催化剂的优良电催化性能可能与其独特的连续纳米孔隙和双金属协同作用有关。

图5 PdNi、Pd纳米颗粒和商业Pd/C催化剂在含甲醇的KOH溶液中的归一化循环伏安曲线Fig.5 Normalized CV curves of methanol in KOH solution on PdNi,Pd NPs and commercial Pd/C catalysts.
3 结语
理论计算方法的发展和实验表征技术的进步,使得研究者从原子水平设计Ni基双金属催化剂的结构和了解反应机理成为可能。有一些反应倾向于在双金属催化剂的特定表面上进行,因此,要获得优异的催化性能,对表面特异性双金属催化剂的合理设计以及对构效关系的理解是至关重要的。除了催化剂的理性设计,另一个主要问题涉及Ni基双金属催化剂在反应条件下的稳定性。通常可以看出,在高反应温度下(如在重整条件下),相对于贵金属的高扩散速率,Ni将导致双金属催化剂的初始结构被破坏并损失初始活性。通过向其中引入扩散阻挡层可以防止Ni的扩散,例如,用与Pt催化性能相近的碳化钨(WC)代替体相Pt制备Pt-Ni-WC加氢催化剂,WC是一种非常有效的扩散阻挡层,可以抑制Ni原子向体相扩散。这说明参照Pt-Ni-WC结构,可以制备出更稳定和更高活性的Ni基加氢催化剂,而且使Pt负载量减少,降低催化剂的成本。
[1] Liao Fenglin,Lo T W B,Tsang S C E. Recent developments in palladium-based bimetallic catalysts[J].ChemCatChem,2015,7(14):1998-2014.
[2] Yu Weiting,Porosoff M D,Chen Jingguang. Review of Ptbased bimetallic catalysis:From model surfaces to supported catalysts[J].Chem Rev,2012,112(11):5780-5817.
[3] Li Dalin,Atake I,Shishido T,et al. Self-regenerative activity of Ni/Mg(Al)O catalysts with trace Ru during daily start-up and shut-down operation of CH4steam reforming[J].J Catal,2007,250(2):299-312.
[4] Li Dalin,Nakagawa Y,Tomishige K. Methane reforming to synthesis gas over Ni catalysts modi fi ed with noble metals[J]. Appl Catal,A,2011,408(1/2):1-24.
[5] Nagaoka K,Jentys A,Lercher J A. Methane autothermal reforming with and without ethane over mono- and bimetal catalysts prepared from hydrotalcite precursors[J].J Catal,2005,229(1):185-196.
[6] Liu Huiling,Nosheen F,Wang Xun. Noble metal alloy complex nanostructures:Controllable synthesis and their electrochemical property[J].Chem Soc Rev,2015,44(10):3056-3078.
[7] Zhang Hui,Jin Mingshang,Xia Younan. Enhancing the catalytic and electrocatalytic properties of Pt-based catalysts by forming bimetallic nanocrystals with Pd[J].Chem Soc Rev,2012,41(24):8035-8049.
[8] Carpenter M K,Moylan T E,Kukreja R S,et al. Solvothermal synthesis of platinum alloy nanoparticles for oxygen reduction electrocatalysis[J].J Am Chem Soc,2012,134(20):8535-8542.
[9] Singh S K,Xu Qiang. Complete conversion of hydrous hydrazine to hydrogen at room temperature for chemical hydrogen storage[J].J Am Chem Soc,2009,131(50):18032-18033.
[10] Wang Hongli,Yan Junmin,Wang Zhili,et al. Highly effi cient hydrogen generation from hydrous hydrazine over amorphousnanocatalyst at room temperature[J].J Mater Chem A,2013,1(47):14957-14962.
[11] Wu Yuen,Cai Shuangfei,Wang Dingsheng,et al. Syntheses of water-soluble octahedral,truncated octahedral,and cubic Pt-Ni nanocrystals and their structure-activity study in model hydrogenation reactions[J].J Am Chem Soc,2012,134(21):8975-8981.
[12] Frenkel A I,Applications of extended X-ray absorption fi nestructure spectroscopy to studies of bimetallic nanoparticle catalysts[J].Chem Soc Rev,2012,41(24):8163-8178.
[13] Yang J C,Small M W,Grieshaber R V,et al. Recent developments and applications of electron microscopy to heterogeneous catalysis[J].Chem Soc Rev,2012,41(24):8179-8194.
[14] Xiang Ji,Li Peng,Chong Hanbao,et al. Bimetallic Pd-Ni core-shell nanoparticles as effective catalysts for the Suzuki reaction[J].Nano Res,2014,7(9):1337-1343.
[15] Sneed B T,Young A P,Jalalpoor D,et al. Shaped Pd-Ni-Pt core-sandwich-shell nanoparticles:In fl uence of Ni sandwich layers on catalytic electrooxidations[J].ACS Nano,2014,8(7):7239-7250.
[16] Singh S K,Singh A K,Aranishi K,et al. Noble-metal-free bimetallic nanoparticle-catalyzed selective hydrogen generation from hydrous hydrazine for chemical hydrogen storage[J].J Am Chem Soc,2011,133(49):19638-19641.
[17] Wu Jianbo,Qi Liang,You Hongjun,et al. Icosahedral platinum alloy nanocrystals with enhanced electrocatalytic activities[J]. J Am Chem Soc,2012,134(29):11880-11883.
[18] Zhang Jun,Yang Hongzhou,Fang Jiye,et al. Synthesis and oxygen reduction activity of shape-controlled Pt3Ni nanopolyhedra[J].Nano Lett,2010,10(2):638-644.
[19] Wang Dingsheng,Zhao Peng,Li Yadong. General preparation for Pt-based alloy nanoporous nanoparticles as potential nanocatalysts[J].Sci Rep,2011,1:37.
[20] Chen Luyang,Guo Hai,Fujita T,et al. Nanoporous PdNi bimetallic catalyst with enhanced electrocatalytic performances for electro-oxidation and oxygen reduction reactions[J].Adv Funct Mater,2011,21(22):4364-4370.
[21] Lingaiah N,Uddin M A,Muto A,et al. Vapour phase catalytic hydrodechlorination of chlorobenzene over Ni-carbon composite catalysts[J].J Mol Catal A:Chem,2000,161(1/2):157-162.
[22] Murthy K V,Patterson P M,Jacobs G,et al. An exploration of activity loss during hydrodechlorination and hydrodebromination over Ni/SiO2[J].J Catal,2004,223(1):74-85.
[23] Kovalchuk V I,d’Itri J L. Catalytic chemistry of chloro- and chlorof l uorocarbon dehalogenation:From macroscopic observations to molecular level understanding[J].Appl Catal,A,2004,271(1/2):13-25.
[24] Simagina V,Likholobov V,Bergeret G,et al. Catalytic hydrodechlorination of hexachlorobenzene on carbon supported Pd-Ni bimetallic catalysts[J].Appl Catal,B,2003,40(4):293-304.
[25] Srbowata A,Juszczyk W,Kaszkur Z,et al. Hydrodechlorination of 1,2-dichloroethane on active carbon supported palladium-nickel catalysts[J].Catal Today,2007,124(1/2):28-35.
[26] Srbowata A,Sadowska M,Juszczyk W,et al. Hydrogenassisted dechlorination of 1,2-dichloroethane over silicasupported nickel-ruthenium catalysts[J].Catal Commun,2007,8(1):11-15.
[27] Choi Y H,Lee W Y. Effect of second metals and Cu content on catalyst performance of Ni-Cu/SiO2in the hydrodechlorination of 1,1,2-trichloroethane into vinyl chloride monomer[J]. J Mol Catal A:Chem,2001,174(1/2):193-204.
[28] Chang Xiaoxia,Wang Tuo,Gong Jinlong. CO2photoreduction:Insights into CO2activation and reaction on surfaces of photocatalysts[J].Energy Environ Sci,2016,9(7):2177-2196.
[29] Wang Wei,Wang Shengping,Ma Xinbin,et al. Recent advances in catalytic hydrogenation of carbon dioxide[J].Chem Soc Rev,2011,40(7):3703-3727.
[30] Nerlov J,Chorkendorff I. Methanol synthesis from CO2,CO,and H2over Cu(100) and Ni/Cu(100)[J].J Catal,1999,181(2):271-279.
[31] Studt F,Abild-Pedersen F,Wu Qiongxiao,et al. CO hydrogenation to methanol on Cu-Ni catalysts:Theory and experiment[J].J Catal,2012,293:51-60.
[32] Zhao Fuzhen,Gong Miao,Zhang Yuhua,et al. The performance and structural study of CuNi alloy catalysts for methanol synthesis[J].J Porous Mater,2016,23(3):733-740.
[33] Nguyen L T M,Park H,Banu M,et al. Catalytic CO2hydrogenation to formic acid over carbon nanotube-graphene supported PdNi alloy catalysts[J].RSC Adv,2015,5(128):105560-105566.
[34] Preti D,Resta C,Squarcialupi S,et al. Carbon dioxide hydrogenation to formic acid by using a heterogeneous gold catalyst[J].Angew Chem,Int Ed,2011,50(52):12551-12554.
[35] Peng G,Sibener S J,Schatz G C,et al. CO2hydrogenation to formic acid on N(i111)[J].J Phys Chem C,2012,116(4):3001-3006.
[36] Zhang Jiaguang,Asakura H,van Rijn J,et al. Highly effi cient,NiAu-catalyzed hydrogenolysis of lignin into phenolic chemicals[J].Green Chem,2014,16(5):2432-2437.
[37] Zhang Jiaguang,Teo J,Chen Xi,et al. A series of NiM(M = Ru,Rh,and Pd) bimetallic catalysts for effective lignin hydrogenolysis in water[J].ACS Catal,2014,4(5):1574-1583.
[38] Guo Wei,Stamatakis M,Vlachos D G. Design principles of heteroepitaxial bimetallic catalysts[J].ACS Catal,2013,3(10):2248-2255.
[39] Guo Wei,Vlachos D G. Patched bimetallic surfaces are active catalysts for ammonia decomposition[J].Nat Commun,2015,6:8619.
[40] Hansgen D A,Vlachos D G,Chen Jingguang. Using first principles to predict bimetallic catalysts for the ammonia decomposition reaction[J].Nat Chem,2010,2(6):484-489.
[41] Singh S K,Xu Qiang. Bimetallic nickel-iridium nanocatalysts for hydrogen generation by decomposition of hydrous hydrazine[J].Chem Commun,2010,46(35):6545-6547.
[42] Singh S K,Xu Qiang. Bimetallic Ni-Pt nanocatalysts for selective decomposition of hydrazine in aqueous solution to hydrogen at room temperature for chemical hydrogen storage[J]. Inorg Chem,2010,49(13):6148-6152.
[43] Besenbacher F,Chorkendorff I,Clausen B S,et al. Design of a surface alloy catalyst for steam reforming[J].Science,1998,279(5358):1913-1915.
[44] Tupy S A,Karim A M,Bagia C,et al. Correlating ethylene glycol reforming activity with in situ EXAFS detection of Ni segregation in supported NiPt bimetallic catalysts[J].ACS Catal,2012,2(11):2290-2296.
[45] Moraes T S,Neto R C R,Ribeiro M C,et al. The study of the performance of PtNi/CeO2-nanocube catalysts for low temperature steam reforming of ethanol[J].Catal Today,2015,242:35-49.
[46] Moraes T S,Rabelo Neto R C,Ribeiro M C,et al. Ethanol conversion at low temperature over CeO2-supported Ni-based catalysts. Effect of Pt addition to Ni catalyst[J].Appl Catal,B,2016,181:754-768.
[47] Hilli Y,Kinnunen N M,Suvanto M,et al. Preparation and characterization of Pd-Ni bimetallic catalysts for CO and C3H6oxidation under stoichiometric conditions[J].Appl Catal,A,2015,497:85-95.
[48] Shan S,Petkov V,Yang Lefu,et al. Atomic-structural synergy for catalytic CO oxidation over palladium-nickel nanoalloys[J].J Am Chem Soc,2014,136(19):7140-7151.
[49] Shen J,Hayes R E,Wu Xiaoming,et al. 100 temperature reduction of wet methane combustion:Highly active Pd-Ni/ Al2O3catalyst versus Pd/NiAl2O4[J].ACS Catal,2015,5(5):2916-2920.
[50] Mu Rentao,Fu Qiang,Xu Hong,et al. Synergetic effect of surface and subsurface Ni species at Pt-Ni bimetallic catalysts for CO oxidation[J].J Am Chem Soc,2011,133(6):1978-1986.
[51] Holgado J P,Ternero F,Gonzalez-delaCruz V M,et al. Promotional effect of the base metal on bimetallic Au-Ni/CeO2catalysts prepared from core-shell nanoparticles[J].ACS Catal,2013,3(9):2169-2180.
[52] Hungria A B,Calvino J J,Anderson J A,et al. Model bimetallic Pd-Ni automotive exhaust catalysts:Inf l uence of thermal aging and hydrocarbon self-poisoning[J].Appl Catal,B,2006,62(3/4):359-368.
(编辑 王 萍)
Progresses in synthesis and application of Ni-based bimetallic catalysts
Yuan Xiao1,Song Hongbing2
(1. Chemical Industry Museum of China,Beijing 100011,China;2. College of Chemical Engineering,Qingdao University of Science and Technology,Qingdao Shandong 266042,China)
Nickel can alloy with various transition metals in different mass ratios,which makes it easier to develop a series of Ni-based bimetallic catalysts with different compositions. This bimetallic catalyst,provides more control parameters to optimize its electronic and chemical properties in order to achieve enhanced catalytic properties with high activity,selectivity and stability;on the other hand,Ni-based bimetallic catalysts can also reduce noble metal loading,and even be benif i cial to the development of non-platinum group of bimetallic catalysts. We will provide a brief introduction of the synthesis methods and design principles of Ni-based bimetallic catalysts,and discuss their application in the fi elds of hydrogenation,dehydrogenation,reforming,oxidation and electrocatalysis.
nickel based bimetallic catalyst;heterogeneous catalysis;electrocatalysis
10.3969/j.issn.1000-8144.2017.08.021
1000-8144(2017)08-1089-08
TQ 426.82
A
2017-01-13;[修改稿日期]2017-05-31。
苑晓(1984—),女,山东省淄博市人,博士,工程师,电话 010-82035908,电邮 yingxiu0654@126.com。
国家自然科学基金项目(51303008)。
——庆祝中国共产党成立一百周年贵金属纪念币展

