颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛乳蛋白合成的影响
田 雯 丁洛阳 吴天佑 王翠芳 王洪荣* 敖长金
(1.扬州大学动物科学与技术学院,扬州225009;2.上海光明荷斯坦牧业有限公司,上海200436;3.内蒙古农业大学动物科学学院,呼和浩特010018)
颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛乳蛋白合成的影响
田 雯1丁洛阳1吴天佑2王翠芳3王洪荣1*敖长金3
(1.扬州大学动物科学与技术学院,扬州225009;2.上海光明荷斯坦牧业有限公司,上海200436;3.内蒙古农业大学动物科学学院,呼和浩特010018)
本试验旨在比较颈静脉灌注酪蛋白模式和理想模式的氨基酸混合物对泌乳中期荷斯坦奶牛乳产量、乳成分以及乳腺对氨基酸摄取利用的影响。选择8头泌乳中期[泌乳天数:(82±11) d]荷斯坦奶牛作为试验动物,试验采用随机区组设计,将试验牛随机分为2组,分别颈静脉灌注160 g/d酪蛋白模式(Casein组)和理想模式的氨基酸混合物(R组)。2个试验组分别以各自灌注前作为空白对照组(C1组为Casein组的空白对照组,C2组为R组的空白对照组)。预试期14 d,灌注期5 d。试验采用全混合日粮(TMR)饲喂,以玉米、豆粕、棉籽粕、玉米青贮、苜蓿干草和羊草为主要原料,参照NRC(2001)奶牛饲养标准配制。结果表明:灌注酪蛋白模式的氨基酸混合物后,乳蛋白产量和含量较灌注前呈上升趋势(乳蛋白产量上升7.14%,P=0.078;乳蛋白含量上升3.27%,P=0.072);并且,奶牛动脉血浆中异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)和组氨酸(His)的浓度较灌注前有不同程度的上升(Ile的浓度提高31.5%,P=0.097;Leu的浓度提高65.9%,P=0.041;Lys的浓度提高36.9%,P=0.088;His的浓度提高40.1%,P=0.010),而苏氨酸(Thr)、缬氨酸(Val)、蛋氨酸(Met)、苯丙氨酸(Phe)和精氨酸(Arg)的浓度在数值上虽较灌注前高但无显著差异(P>0.05)。灌注酪蛋白模式的氨基酸混合物后,奶牛乳腺对天冬氨酸(Asp)和半胱氨酸(Cys)的摄取率显著升高(Asp的摄取率提高95.2%,P=0.031;Cys的摄取率提高49.6%,P=0.031),而奶牛乳腺对甘氨酸(Gly)的摄取率显著降低(降低158.3%,P=0.041)。灌注理想模式的氨基酸混合物后,乳蛋白含量比灌注前有上升趋势(提高5.78%,P=0.064),而乳脂产量显著低于灌注前(降低8.57%,P=0.015);并且,奶牛动脉血浆中Arg的浓度有上升趋势(提高18.0%,P=0.093),而酪氨酸(Tyr)的浓度呈下降趋势(降低47.8%,P=0.074)。灌注理想模式的氨基酸混合物后,奶牛乳腺对谷氨酸(Glu)、Cys和Ile的摄取率显著上升(Glu的摄取率提高118.7%,P=0.015;Cys的摄取率提高77.4%,P=0.032;Ile的摄取率提高46.0%,P=0.012),而奶牛乳腺对Ser的摄取率呈下降趋势(降低56.2%,P=0.052)。灌注氨基酸混合物后,Casein组乳脂产量增量显著高于R组(P=0.012),且Casein组的乳产量增量(P=0.095)和乳糖产量增量(P=0.091)较R组有升高的趋势,而2组间其他指标增量无显著差异(P>0.05)。由此得出,在本试验条件下,颈静脉灌注酪蛋白模式和理想模式的氨基酸混合物均可提高泌乳奶牛的乳蛋白含量,而灌注酪蛋白模式氨基酸混合物同时可以促进乳蛋白产量的升高,因此,颈静脉灌注酪蛋白模式氨基酸混合物的效果优于灌注理想模式氨基酸混合物。
酪蛋白模式;理想模式;氨基酸混合物;灌注;奶牛;乳蛋白
牛乳中含有丰富的营养物质及多种活性物质,对人类的健康起到关键作用。为了进一步提高牛乳中有助于人类健康的营养成分,目前,乳品质量和乳品安全成为研究的首要课题。乳蛋白是构成牛奶营养品质的重要物质基础,也是奶业核心竞争力的标志。
乳蛋白对机体获取的可代谢蛋白质或氨基酸的应答是由一系列因素决定的,如泌乳阶段、蛋白质和能量水平、蛋白质或氨基酸供给量及组成[1]。奶牛饲粮中含有平衡的氨基酸模式可提高可代谢蛋白质转化为乳蛋白的效率[2-4]。Bach等[5]提出,奶牛乳腺存在理想的氨基酸供应模式,该模式可使蛋白质合成和氨基酸利用效率达到最优。研究报道,泌乳奶牛产后灌注酪蛋白可显著提高乳产量和乳糖产量[6-7]。而Rius等[8]研究发现,奶牛皱胃灌注酪蛋白模式氨基酸并未对乳蛋白合成造成显著影响。Rulquin等[9]在2007年提出了小肠可吸收必需氨基酸的理想模式[包括9种必需氨基酸:赖氨酸(Lys)、蛋氨酸(Met)、亮氨酸(Leu)、组氨酸(His)、苯丙氨酸(Phe)、苏氨酸(Thr)、精氨酸(Arg)、异亮氨酸(Ile)和缬氨酸(Val)],其中Lys和Met是由Mata分析得出,而其他氨基酸的推荐比例均源于试验研究。并且,有研究证实,利用Rulquin等[9]推荐的必需氨基酸模式校正的小肠可吸收氨基酸模式可促进奶牛乳蛋白合成并提高氮利用效率[10]。这2种氨基酸模式中支链氨基酸(BCAA)之间的组成配比和His的供给略有不同,而其他氨基酸供给相似。
一般而言,增加非结构性碳水化合物,尤其是玉米淀粉的摄入,能够提高乳产量、乳蛋白产量以及氮利用效率[11-12],并且,有研究报道,给奶牛饲喂高淀粉饲粮比饲喂低淀粉饲粮对乳及乳蛋白的生产具有更大的效果[12]。因此,本研究选择以玉米型饲粮作为基础饲粮,探讨在能量不受限制的条件下灌注Rulquin等[9]推荐的理想模式和酪蛋白模式氨基酸混合物是否会对泌乳中期奶牛乳产量和乳蛋白产量产生促进效应,旨在为奶牛乳腺营养代谢调控研究提供理论依据。
1 材料与方法
1.1试验动物及饲粮
选择8头健康、体重相近[(509±56) kg]、平均泌乳天数(DIM)为(82±11) d的荷斯坦奶牛(其中头胎4头、经产4头)作为试验动物。以玉米、豆粕、棉籽粕、玉米青贮、苜蓿干草和羊草为主要原料,参照NRC(2001)[4]奶牛饲养标准,根据体重为550 kg、乳产量为25 kg、乳脂和乳蛋白含量分别为4.0%和3.0%的荷斯坦奶牛营养需要配制基础饲粮。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(干物质基础)
1)预混料为每千克饲粮干物质提供Premix provided the following per kg of the DM of diet:Zn 10 000 mg,Mn 3 500 mg,Fe 1 750 mg,Cu 1 600 mg,I 84 mg,Co 42 mg,Se 42 mg,VA 70 IU,VD3120 000 IU,VE 2 100 IU。
2)泌乳净能和可代谢蛋白质根据NRC(2001)[4]计算,其余营养水平为实测值。NELand MP were calculated according to NRC (2001)[4], while the other nutrient levels were measured values.
1.2试验设计及饲养管理
本试验采用随机区组设计,根据胎次和乳产量,将试验牛随机分为2组,分别颈静脉灌注160 g酪蛋白模式(Casein组)和理想模式氨基酸混合物(R组)。2个试验组分别以各自灌注前作为空白对照组(C1组为Casein组的空白对照组,C2组为R组的空白对照组)。试验预试期14 d,灌注期5 d,灌注期前1天于颈静脉安装留置针(G14加长型,中国)。饲粮采用全混合日粮(TMR)形式饲喂,每头牛单独饲喂,并记录采食量。每天饲喂2次(06:00和18:00),自由饮水。每天根据前1 d的剩料量调整饲喂量,确保每天剩料量不超过10%。每天挤奶2次(05:30和17:30)。
1.3氨基酸灌注液的配制及灌注方法
各组每日氨基酸的灌注量和预测占可代谢蛋白质的百分比见表2。氨基酸灌注液委托江苏南京剑桥生物科技有限公司配制完成,配制方法参考Aikman等[1]。用超纯水配制的0.8%(质量体积分数)NaOH溶液溶解氨基酸混合物粉剂,调整氨基酸灌注液的pH至7.4,最后经过0.22 μm滤膜过滤灭菌,灌装,2~4 ℃保存待用。氨基酸灌注液按照每头牛每天2.5 L的量配制,保存不得超过3 d。利用真空蠕动泵(BT100-1L,中国)将氨基酸灌注液匀速从颈静脉留置针灌入奶牛体内,每天从晨饲开始,连续灌注6 h。
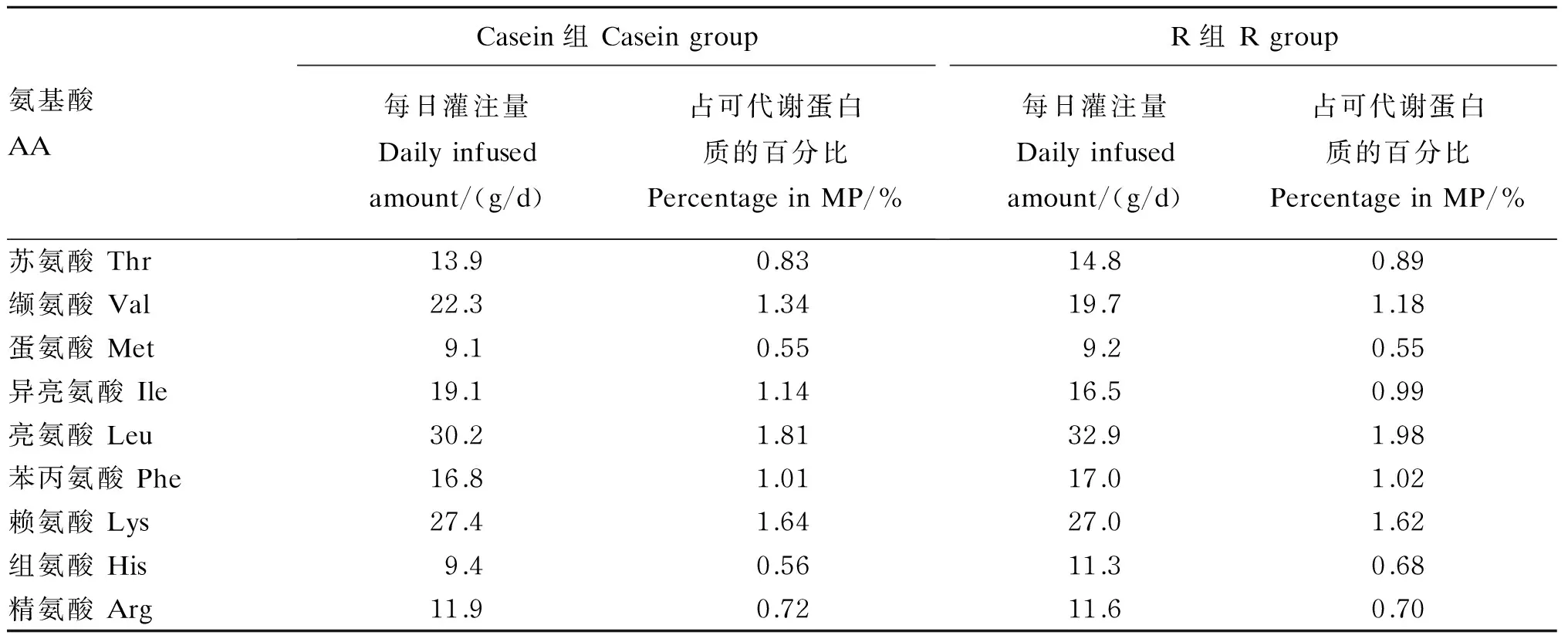
表2 每日各氨基酸的灌注量和预测的占可代谢蛋白质的百分比
氨基酸占可代谢蛋白质的百分比通过NRC(2001)[4]和观测值计算。
The percentage of AA in MP was calculated by the NRC (2001)[4]and observed values.
1.4样品采集与分析
1.4.1 饲粮样品的采集
试验期每天记录采食量,分别在预试期和灌注期的最后2 d采集饲粮样,采集量约为1 kg,采集后及时在65 ℃烘干测定初水分,2 d采样完成后粉碎、混匀,四分法缩样,取约500 g再次粉碎,过筛后保存,待测干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)、中性洗涤纤维(ADF)、粗脂肪(EE)、钙(Ca)和磷(P)等常规化学成分的含量。常规化学成分含量的测定方法如下:干物质含量采用105 ℃烘干至恒重法测定;粗蛋白质含量利用消化炉(HYP-308,中国)和自动定氮仪(KDN-103F,中国)测定;中性洗涤纤维和酸性洗涤纤维含量利用纤维分析仪(Ankom-200I,美国)测定,具体测定方法参照Van Soest等[13];粗脂肪含量使用索氏提取器测定;钙和磷含量的测定参照张丽英[14]的方法。
1.4.2 乳样的采集与检测
试验期每天记录乳产量,分别在预试期和灌注期的最后2 d早晚2次采集乳样,每天按照每头牛早晚的乳产量制备混样,每40 mL牛奶添加3~4滴防腐剂重铬酸钾溶液(15%,质量体积分数)后立即送往内蒙古天和荷斯坦牧业有限公司DHI检测中心,利用乳成分分析仪(Bentley FTS/FCM 400 Combi,美国)测定乳蛋白、乳脂和乳糖含量。
1.4.3 血样的采集与检测
分别在预试期和灌注期的最后1天06:00开始采集尾动脉(代替阴外动脉,参照Emery等[15]和Cant等[16])和乳静脉血样于促凝管和抗凝管中,每3 h 1次,共采集4次。抗凝血样采集后立即离心(10 min,2 810×g)、分装,按照每头牛的采样位点(尾动脉)制备4个时间点的混合血浆,-20 ℃保存待测。利用氨基酸分析仪(L-8900,日本)测定血浆中游离氨基酸的浓度。促凝血样采集后放置2~3 h后离心(10 min,2 810×g)、分装,按照每头牛的采样位点(乳静脉)制备4个时间点的混合血清,-20 ℃保存待测。利用全自动生化分析仪(Hitachi-7160,日本)通过比色法测定血清中尿素(urea)、游离脂肪酸(NEFA)、β-羟丁酸(BHBA)、甘油三酯(triacylglycerol,TG)和葡萄糖(GLU)浓度,尿素试剂盒、游离脂肪酸试剂盒、β-羟丁酸试剂盒、甘油三酯和葡萄糖试剂盒均购自北京华英生物技术研究所。
1.5数据计算
乳蛋白效率(milk protein efficiency,MPE)参照Appuhamy等[17]的方法计算,公式如下:
乳蛋白效率=乳蛋白产量(kg/d)/总粗蛋白质摄入量(kg/d)。
式中粗蛋白质摄入量包括饲粮中采食的粗蛋白质+灌注的氨基酸。
乳腺氨基酸摄取率(AA extraction rate of mammary gland,ExtractionM)计算公式如下:
ExtractionM=(CEA-CMV)/CEA。
式中:CMV、CEA分别为游离氨基酸在乳腺静脉和动脉血浆中的浓度(μmol/L)。
1.6统计分析
试验数据进行统计分析前将每期最后2 d的干物质采食量、乳产量和乳成分数据按照每头牛做平均数。采用SPSS 16.0软件对数据进行统计分析。配对资料采用配对样本t检验,成组资料采用独立样本t检验对灌注前后的数据差值作比较,P<0.05为显著差异。结果以平均值±标准误表示。
2 结果与分析
2.1颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛采食量、泌乳性能和乳蛋白效率的影响
如表3所示,灌注酪蛋白模式的氨基酸混合物后,奶牛乳蛋白产量和含量均较灌注前有上升趋势(乳蛋白产量提高7.14%,P=0.078;乳蛋白含量提高3.27%,P=0.072),且总粗蛋白质摄入量显著提高(提高9.43%,P=0.020)。灌注理想模式的氨基酸混合物后乳蛋白含量比灌注前有上升趋势(提高5.78%,P=0.064),而乳脂产量显著低于灌注前(降低8.57%,P=0.015)。灌注氨基酸混合物后,Casein组乳脂产量增量显著高于R组(P=0.012),且Casein组的乳产量增量和乳糖产量增量较R组有升高的趋势(P=0.095;P=0.091),而2组间其他指标增量无显著差异(P>0.05)。
2.2颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛动脉血浆中氨基酸浓度的影响
如表4所示,灌注酪蛋白模式的氨基酸混合物后,奶牛尾动脉血浆必需氨基酸中异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)和组氨酸(His)的浓度较灌注前有不同程度的上升(Ile的浓度提高31.5%,P=0.097;Leu的浓度提高65.9%,P=0.041;Lys的浓度提高36.9%,P=0.088;His的浓度提高40.1%,P=0.01),而其他几种必需氨基酸——苏氨酸(Thr)、缬氨酸(Val)、蛋氨酸(Met)、苯丙氨酸(Phe)和精氨酸(Arg)的浓度灌注前后并无显著差异(P>0.05)。然而,灌注酪蛋白模式的氨基酸混合物后,奶牛尾动脉血浆非必需氨基酸中谷氨酸(Glu)的浓度比灌注前有上升的趋势(提高13.4%,P=0.092)。灌注理想模式的氨基酸混合物后,奶牛尾动脉血浆中Arg的浓度有上升趋势(提高18.0%,P=0.093),而酪氨酸(Tyr)的浓度呈下降趋势(下降47.8%,P=0.074)。灌注2种不同模式的氨基酸混合物后,Casein组和R组间奶牛尾动脉各种氨基酸浓度增量均无显著差异(P>0.05)。
2.3颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛乳腺氨基酸摄取率的影响
如表5所示,灌注酪蛋白模式的氨基酸混合物后,奶牛乳腺对天冬氨酸(Asp)和半胱氨酸(Cys)的摄取率显著升高(Asp的摄取率提高95.2%,P=0.031;Cys的摄取率提高49.6%,P=0.031),而奶牛乳腺对甘氨酸(Gly)的摄取率显著降低(降低158.3%,P=0.041)。灌注理想模式氨基酸混合物后,奶牛乳腺对Glu、Cys和Ile的摄取率显著上升(Glu的摄取率提高118.7%,P=0.015;Cys的摄取率提高77.4%,P=0.032;Ile的摄取率提高46.0%,P=0.012),而奶牛乳腺对Ser的摄取率呈下降趋势(下降56.2%,P=0.052)。灌注2种不同模式的氨基酸混合物后,Casein组和R组间奶牛乳腺对各种氨基酸的摄取率增量均无显著差异(P>0.05)。

表3 颈静脉灌注不同模式混合氨基酸对泌乳奶牛采食量、泌乳性能和乳蛋白效率的影响
2.4颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛血清尿素和能量代谢产物浓度的影响
如表6所示,灌注酪蛋白模式的氨基酸混合物后,奶牛血清中甘油三酯的浓度有下降的趋势(下降13.3%,P=0.096),而尿素、葡萄糖、β-羟丁酸和游离脂肪酸的浓度并无显著变化(P>0.05)。而灌注理想模式的氨基酸混合物后,奶牛血清中上述指标的浓度均无显著变化(P>0.05)。同样地,灌注2种不同模式的氨基酸混合物后,Casein组和R组间奶牛血清中上述指标的浓度增量均无显著差异(P>0.05)。
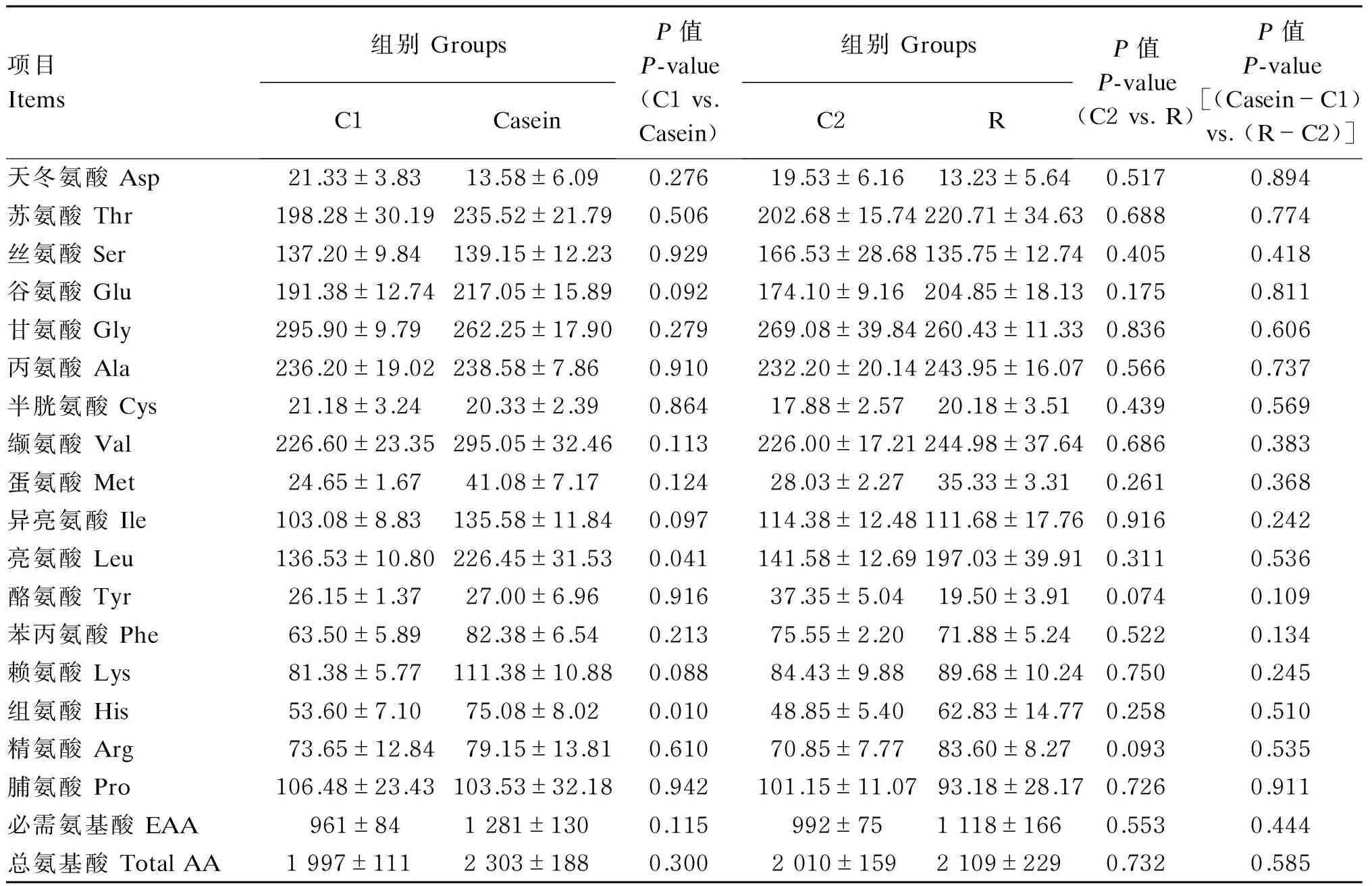
表4 颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛动脉血浆中氨基酸浓度的影响

表5 颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛乳腺氨基酸摄取率的影响

续表5项目Items组别GroupsC1CaseinP值P-value(C1vs.Casein)组别GroupsC2RP值P-value(C2vs.R)P值P-value[(Casein-C1)vs.(R-C2)]赖氨酸Lys5.60±2.448.23±0.640.32810.63±2.748.33±1.260.5560.279组氨酸His2.88±3.157.29±2.360.1384.71±2.969.59±2.570.1550.896精氨酸Arg-0.14±5.182.16±3.490.4733.08±5.413.75±3.990.7620.655脯氨酸Pro10.70±13.6211.73±8.450.9489.41±9.953.77±5.550.2910.677必需氨基酸EAA8.60±1.209.93±1.920.67112.71±2.9015.22±2.380.5350.805总氨基酸TotalAA8.29±1.747.28±0.740.66210.98±1.7310.55±1.370.8110.836

表6 颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛血清尿素和能量代谢产物浓度的影响
3 讨 论
3.1颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛乳产量和乳成分的影响
本研究发现,颈静脉灌注氨基酸混合物前后以及灌注组间采食量和乳产量均无显著变化,与前人研究结果一致[18-20],可能是持续灌注氨基酸混合物的时间较短,不会对奶牛的采食量和乳产量产生显著影响[13]。
颈静脉灌注酪蛋白模式氨基酸混合物后使乳蛋白产量和含量呈现上升的趋势,与前人研究结果基本一致。研究发现,灌注必需氨基酸混合物会对乳蛋白产生应答反应[21-22]。Doepel等[23]报道,当奶牛饲粮提供72%的可代谢蛋白质时,通过皱胃灌注350.2 g的酪蛋白模式氨基酸混合物可显著提高乳蛋白产量和乳糖产量,另外乳产量也呈现上升趋势。但对于本研究,乳蛋白产量的升高可能是由于供给了平衡的氨基酸模式引起的,也可能是因为灌注组额外供给了奶牛需要可代谢蛋白质的10.6%的氨基酸混合物,使得总粗蛋白质摄入量的升高所造成的,具体原因仍需进一步研究证实。由于乳产量和乳糖产量没有显著变化,所以灌注酪蛋白模式氨基酸混合物并未对乳糖产量造成影响,而先前研究报道必需氨基酸有助于乳糖的分泌[23],在本试验并未得到类似结果。同样地,乳脂产量和含量也无显著变化,可能还是与短期灌注未对乳腺造成持续刺激有关,不足以使乳糖和乳脂产生应答反应。
Haque等[10]报道,供给平衡的必需氨基酸模式(与理想模式相同)可以提高奶牛乳产量(提高3.0%)、乳真蛋白质产量(提高8.0%)、乳真蛋白质含量(提高4.5%)和乳粗蛋白质含量(提高4.3%)。灌注理想模式的氨基酸混合物后乳蛋白含量比灌注前有上升趋势(提高5.78%),与先前报道结果基本一致,而乳脂产量显著低于灌注前(降低8.57%),乳脂含量无显著变化,这可能是由于乳产量在数值上的降低引起的。与灌注酪蛋白模式的氨基酸混合物相似,灌注理想模式的氨基酸混合物后未对乳糖产量和含量造成显著影响,与前人研究结果[10]不一致,原因可能同样是由灌注时间短造成的。然而,与灌注理想模式的氨基酸混合物相比,灌注酪蛋白模式的氨基酸混合物后乳糖产量增量呈现升高的趋势,由于乳糖产量决定乳产量,因此,灌注酪蛋白模式的氨基酸混合物后乳产量增量与灌注理想模式的氨基酸混合物相比也同样呈现出上升趋势,这与前人研究结果[23]一致。另外,灌注酪蛋白模式的氨基酸混合物后乳脂产量增量较灌注理想模式的氨基酸混合物有显著升高。一般认为,以玉米青贮为基础的饲粮中Lys和Met是第一限制性氨基酸,而His和Leu的供给不受限制[2]。对比2种不同模式的氨基酸混合物后发现,Lys和Met的额外供给水平基本相同,而酪蛋白模式组中His和Leu的供给水平低于理想模式组,相反地,对于Val和Ile,酪蛋白模式组高于理想模式组。因此,在本研究基础饲粮条件下,从饲粮和灌注总体来看,酪蛋白模式组中的BCAA之间的平衡和总氨基酸之间的平衡以及能量与蛋白质之间的平衡关系可能均优于理想模式组。
本研究结果显示奶牛的平均乳蛋白效率为0.28,各组间无显著差异,此水平属于中等水平,与前人的报道相近。Nadeau等[24]报道,饲喂含有14%~18%粗蛋白质的饲粮且乳产量为13~57 kg/d标准乳(FCM)的奶牛,乳蛋白效率一般在0.18~0.40,另外,乳蛋白效率提高泌乳性能也相应提高。
3.2颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛动脉血浆氨基酸浓度和乳腺氨基酸摄取率的影响
与预期基本一致,在灌注酪蛋白模式氨基酸混合物后奶牛动脉血中各必需氨基酸的浓度在数值上都有不同程度的增加,而Thr、Val、Met、Phe和Arg的浓度并未达到显著水平。相同地,灌注理想模式的氨基酸混合物后奶牛动脉血中大部分必需氨基酸的浓度在数值上有所上升,而部分必需氨基酸如Ile和Phe在数值上与空白对照组相比是降低的,以上研究结果与前人研究报道[10,17,23]基本一致。就本研究而言,灌注氨基酸混合物后奶牛动脉血中部分必需氨基酸的浓度未出现显著上升甚至有所下降,造成以上结果的原因可能有:灌注氨基酸混合物扰乱了奶牛机体原本内环境的稳态,而灌注期较短没能使机体重新建立起另一种稳态;必需氨基酸的突然增多可能导致肝脏对其产生代谢作用,使其参与糖异生作用或产生非必需氨基酸等,因此,在本研究中,酪蛋白模式组和理想模式组中奶牛动脉血浆Glu浓度均有提高(分别提高13.4%和17.7%)。
乳腺氨基酸摄取率主要是由乳腺对氨基酸的绝对摄取量和动脉氨基酸浓度决定,乳腺氨基酸摄取率与绝对摄取量成正比,与动脉氨基酸浓度成反比,而乳腺氨基酸绝对摄取量又由动脉氨基酸浓度决定,因此乳腺氨基酸摄取率和动脉氨基酸浓度的变化幅度存在密切关系。所以,灌注2种模式的氨基酸混合物后,奶牛乳腺对于部分非必需氨基酸的摄取率有的上升有的下降,均是由乳腺氨基酸绝对摄取量和动脉氨基酸浓度的变化程度决定的。然而,在理想模式组,乳腺对Ile的摄取率显著升高,这可能是由于BCAA之间的平衡性造成的。与酪蛋白模式组相比,理想模式组的BCAA供给相当于高Leu低Ile和Val,因此,会造成Ile的摄取率增加。
灌注酪蛋白模式的氨基酸混合物后,奶牛乳腺对Asp和Cys的摄取率显著升高(分别提高95.2%和49.6%),而奶牛乳腺对Gly的摄取率显著降低(降低158.3%)。灌注理想模式的氨基酸混合物后,奶牛乳腺对Glu、Cys和Ile的摄取率显著上升(分别提高118.7%、77.4%和46.0%),而奶牛乳腺对Ser的摄取率呈下降趋势(降低56.2%)。
本研究结果显示,2个氨基酸混合物灌注组间动脉血中各氨基酸浓度增量无显著差异,主要原因是2个氨基酸混合物灌注组中个别氨基酸占可代谢蛋白质比例虽略有差异,但不足以使饲粮和灌注总体的氨基酸产生显著变化,由于乳腺吸收量一定而动脉氨基酸浓度增量无显著变化,所以未对乳腺氨基酸摄取率的增量造成显著影响。
3.3颈静脉灌注不同模式的氨基酸混合物对泌乳奶牛血清尿素和能量代谢产物浓度的影响
本研究中,灌注不同模式的氨基酸混合物后血清中尿素浓度均无显著变化,表明乳腺摄入的氨基酸并未超出乳蛋白合成的需要量,所以没有多余的氨基酸转化为氨态氮进入尿素循环。由于灌注氨基酸混合物后血清中甘油三酯、β-羟丁酸和游离脂肪酸的浓度与灌注前相比无显著变化,所以它们不能为乳的合成和乳脂的产生提供额外的能量和乳脂前体物,因此,2个氨基酸混合物灌注组中乳脂产量没有显著上升,反而在理想模式组中乳脂产量出现了显著降低的结果。据报道,奶牛在泌乳过程中必须摄取足够的能量以维持正常泌乳[23]。本研究中灌注酪蛋白模式和理想模式的氨基酸混合物后奶牛血清葡萄糖和β-羟丁酸的浓度在数值上均有所降低,但未出现显著差异,而在乳蛋白含量上均有上升趋势(分别提高3.27%和5.78%),这就表明了乳腺摄取的能量用以支持乳蛋白合成。而本试验2个氨基酸混合物灌注组中动脉血中部分必需氨基酸的浓度没有显著上升,其中原因可能是乳腺摄取的必需氨基酸转化为ATP为泌乳供能。
4 结 论
在本试验条件下,颈静脉灌注酪蛋白模式和理想模式氨基酸混合物均可使泌乳奶牛乳蛋白含量升高,而灌注酪蛋白模式氨基酸混合物同时可以促进乳蛋白产量的提高,因此,颈静脉灌注酪蛋白模式氨基酸混合物效果优于灌注理想模式氨基酸混合物。
致谢:
非常感谢卢德勋先生在试验牧场的联系和试验方案的设计上给予的帮助和指导;感谢内蒙古农业大学“奶业973”团队在试验的执行和样品的采集上给予的大力帮助。
[1] AIKMAN P C,REYNOLDS C K,HUMPHRIES D J,et al.Milk protein response to abomasal or mesenteric vein essential amino acid infusion in lactating dairy cows[J].Journal of Dairy Science,2002,85(5):1079-1084.
[2] RULQUIN H,PISULEWSKI P M,VÉRITÉ R,et al.Milk production and composition as a function of postruminal lysine and methionine supply:a nutrient-response approach[J].Livestock Production Science,1993,37(1/2):69-90.
[3] SCHWAB C G.Amino acid nutrition of the dairy cow:current status[C]//Proceedings of Cornell Nutrition Conference for Feed Manufacturer.Ithaca,NY:Cornell University,1996:184-198.
[4] NRC.Nutrient requirements of dairy cattle[S].7th rev ed.Washington,D.C.:National Academies Press,2001.
[5] BACH A,HUNTINGTON G B,CALSAMIGLIA S,et al.Nitrogen metabolism of early lactation cows fed diets with two different levels of protein and different amino acid profiles[J].Journal of Dairy Science,2000,83(11):2585-2595.
[6] ØRSKOV E R,GRUBB D A,KAY R N B.Effect of postruminal glucose or protein supplementation on milk yield and composition in Friesian cows in early lactation and negative energy balance[J].British Journal of Nutrition,1977,38(3):397-405.
[7] LARSEN M,LAPIERRE H,KRISTENSEN N B.Abomasal protein infusion in postpartum transition dairy cows:effect on performance and mammary metabolism[J].Journal of Dairy Science,2014,97(9):5608-5622.
[8] RIUS A G,APPUHAMY J A D R N,CYRIAC J,et al.Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids[J].Journal of Dairy Science,2010,93(7):3114-3127.
[9] RULQUIN H,RAGGIO G,LAPIERRE H,et al.Relationship between intestinal supply of essential amino acids and their mammary metabolism in the lactating dairy cow[M]//ORTIGUES-MARTY I.Energy and protein metabolism and nutrition.Wageningen:Wageningen Academic Publishers,2007,124:587.
[10] HAQUE M N,RULQUIN H,ANDRADE A,et al.Milk protein synthesis in response to the provision of an “ideal” amino acid profile at 2 levels of metabolizable protein supply in dairy cows[J].Journal of Dairy Science,2012,95(10):5876-5887.
[11] BRODERICK G A.Effects of varying dietary protein and energy levels on the production of lactating dairy cows[J].Journal of Dairy Science,2003,86(4):1370-1381.
[12] RIUS A G,MCGILLIARD M L,UMBERGER C A,et al.Interactions of energy and predicted metabolizable protein in determining nitrogen efficiency in the lactating dairy cow[J].Journal of Dairy Science,2010,93(5):2034-2043.
[13] VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber and non-starch polysaccharide in relation to animal nutrition[J].Journal of Dairy Science,1991,74(10):3583-3597.
[14] 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2003.
[15] EMERY R S,BROWN L D,BELL J W.Correlation of milk fat with dietary and metabolic factors in cows fed restricted-roughage rations supplemented with magnesium oxide or sodium bicarbonate[J].Journal of Dairy Science,1965,48(12):1647-1651.
[16] CANT J P,DEPETERS E J,BALDWIN R L.Mammary amino acid utilization in dairy cows fed fat and its relationship to milk protein depression[J].Journal of Dairy Science,1993,76(3):762-774.
[17] APPUHAMY J A D R N,KNAPP J R,BECVAR O,et al.Effects of jugular-infused lysine,methionine,and branched-chain amino acids on milk protein synthesis in high-producing dairy cows[J].Journal of Dairy Science,2011,94(4):1952-1960.
[18] DONKIN S S,VARGA G A,SWEENEY T F,et al.Rumen-protected methionine and lysine:effects on animal performance,milk protein yield,and physiological measures1[J].Journal of Dairy Science,1989,72(6):1484-1491.
[19] ARMENTANO L E,BERTICS S J,DUCHARME G A.Response of lactating cows to methionine or methionine plus lysine added to high protein diets based on alfalfa and heated soybeans[J].Journal of Dairy Science,1997,80(6):1194-1199.
[20] RULQUIN H,PISULEWSKI P M.Effects of graded levels of duodenal infusions of leucine on mammary uptake and output in lactating dairy cows[J].Journal of Dairy Research,2006,73(3):328-339.
[21] METCALF J A,CROMPTON L A,WRAY-CAHEN D,et al.Responses in milk constituents to intravascular administration of two mixtures of amino acids to dairy cows[J].Journal of Dairy Science,1996,79(8):1425-1429.
[22] DOEPEL L,LAPIERRE H.Changes in production and mammary metabolism of dairy cows in response to essential and nonessential amino acid infusions[J].Journal of Dairy Science,2010,93(7):3264-3274.
[23] DOEPEL L,LAPIERRE H.Deletion of arginine from an abomasal infusion of amino acids does not decrease milk protein yield in Holstein cows[J].Journal of Dairy Science,2011,94(2):864-873.
[24] NADEAU E,ENGLUND J E,GUSTAFSSON A H.Nitrogen efficiency of dairy cows as affected by diet and milk yield[J].Livestock Science,2007,111(1/2):45-56.
*Corresponding author, professor, E-mail: hrwang@yzu.edu.cn
(责任编辑 菅景颖)
Effects of Jugular-Infused Amino Acid Mixture of Different Profiles on Milk Protein Synthesis of Lactating Dairy Cows
TIAN Wen1DING Luoyang1WU Tianyou2WANG Cuifang3WANG Hongrong1*Aochangjin3
(1. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China; 2. Shanghai Bright Holstan Co., Ltd., Shanghai 200436, China; 3. College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China)
This experiment was undertaken to compare the effect of jugular-infused amino acid mixture of casein and ideal profiles on milk yield, milk composition, extraction and utilization of amino acids in mammary gland of mid-lactation Holstein cows. Eight mid-lactation [lactation days: (82±11) d] Holstein cows were used for this study. The dairy cows were randomly assigned to 2 groups by a random block design. The 2 groups were randomly distributed as jugular infusions of 160 g amino acid mixture of casein (Casein group) and ideal profiles (R group), and taken themselves before infusion as blank control group (C1 group was the blank control group for Casein group, and C2 group was the blank control group for R group), respectively. The adaptation period lasted for 14 days and the infusion period lasted for 5 days. Total mixed ration (TMR) was adopted and formulated by corn, soybean meal, cottonseed meal, corn silage, alfalfa hay and Chinese wildrye according toFeedingStandardofDairyCowfor NRC (2001). The results showed that compared with before infusion, the milk protein yield and content had upward trends after jugular-infused amino acid mixture of casein profile (milk protein yield was increased by 7.14%,P=0.078; milk protein content was increased by 3.27%,P=0.072), in addition, the arterious plasma concentrations of isoleucine (Ile), leucine (Leu), lysine (Lys) and histidine (His) were increased in different extent (Ile concentration was increased by 31.5%,P=0.097; Leu concentration was increased by 65.9%,P=0.041; Lys concentration was increased by 36.9%,P=0.088; His concentration was increased by 40.1%,P=0.010), and the arterious plasma concentrations of threonine (Thr), valine (Val), methionine (Met), phenylalanine (Phe) and arginine (Arg) in Casein group were numerically higher than those in C1 group, but the differences were not significant (P>0.05). The extraction rates of aspartic acid (Asp) and cysteine (Cys) by mammary gland for cows of Casein group were significantly higher than those of C1 group (Asp extraction rate was improved by 95.2%,P=0.031; Cys extraction rate was improved by 49.6%,P=0.031), whereas the extraction rate of glycine (Gly) by mammary gland for cows of Casein group was significantly lower than that in C1 group (decreased by 158.3%,P=0.041). Compared with before infusion, infused amino acid mixture of ideal profile tended to increase the milk protein content (increased by 5.78%,P=0.064) and significantly decrease the milk fat yield (decreased by 8.57%,P=0.015), moreover, there were an upward trend of arterious plasma Arg concentration (increased by 18.0%,P=0.093) and a downward trend of arterious plasma Tyr concentration (decreased by 47.8%,P=0.074) after cows were infused amino acid mixture of ideal profile. After cows were infused of amino acid mixture of ideal profile, the extraction rates of glutamic acid (Glu), Cys and Ile by mammary gland were significantly improved (Glu extraction rate was improved by 118.7%,P=0.015; Cys extraction rate was improved by 77.4%,P=0.032; Ile extraction rate was improved by 46.0%,P=0.012), and the extraction rate of Ser was decreased (decreased by 56.2%,P=0.052). However, the milk fat yield increment (P=0.012) of Casein group was significantly higher than that of R group, and the milk yield increment (P=0.095) and lactose yield increment (P=0.091) tended to be higher for cows receiving amino acid mixture of casein profile than for those receiving amino acid mixture of ideal profile, but the other index increments had no significant differences between Casein and R group (P>0.05). Under this experiment condition, the milk protein content of lactating dairy cows can be increased by the jugular infusions of amino acid mixture of casein and ideal profiles, and the milk protein yield has an upward trend when lactating dairy cows are
jugular infusion of amino acid mixture of casein profile. So, the application effect of jugular-infused amino acid mixture of casein profile is superior to the jugular-infused amino acid mixture of ideal profile.[ChineseJournalofAnimalNutrition,2017,29(9):3109-3119]
casein profile; ideal profile; amino acid mixture; infusion; dairy cows; milk protein
10.3969/j.issn.1006-267x.2017.09.012
2017-04-11
国家重点基础研究发展计划(973计划)项目(2011CB100803);扬州大学高端人才支持计划
田 雯(1986—),女,内蒙古呼和浩特人,博士研究生,从事乳蛋白合成调控研究。E-mail: tween2012@163.com
*通信作者:王洪荣,教授,博士生导师,E-mail: hrwang@yzu.edu.cn
S816
:A
:1006-267X(2017)09-3109-11

