热应激条件下机体发生氧化应激的机制
张轶凤 齐智利
(华中农业大学动物科技学院,武汉430070)
热应激条件下机体发生氧化应激的机制
张轶凤 齐智利*
(华中农业大学动物科技学院,武汉430070)
热应激是指机体在高温条件下对热暴露所做出的非特异性生理反应的总和。有研究表明热应激会引起机体氧化还原平衡紊乱,发生氧化应激,损伤细胞和组织,从而影响机体的生长发育及健康状况。热应激一直都是国内外研究的热点,随着全球气温的上升,热应激问题将会更加突出,本文就热应激条件下氧化应激发生的机制作一综述,以期为后续的相关研究提供参考。
热应激;氧化应激;抗氧化系统;活性氧;活性氮
随着全球气温的升高,热应激给畜牧业带来了很大的经济损失,热应激的发生是由于机体释放到环境中的热量与机体产生的热量处于负平衡状态(产生大于释放),这种失衡有很多因素,如环境温度、湿度、光照和运动等[1],在现代畜牧业的发展过程中,热应激对于家畜的影响几乎是无法避免的。热应激使家畜的采食量下降、机体营养代谢消耗增加、免疫机能下降,造成家畜生长性能和繁殖性能的降低[2-3]。一般认为,热应激导致的生产和繁殖性能下降与采食量降低有直接的关系,但是越来越多的研究表明,热应激首先降低采食量和营养物质的吸收,进而影响机体代谢水平;特别是产生过多自由基,引起机体抗氧化机能紊乱[4-5],细胞和线粒体氧化损伤最终导致家畜生产和繁殖性能下降。动物在热应激条件下体温会升高,体温的升高会影响机体内代谢酶的活性,使机体代谢率升高,高代谢率会导致自由基的产生增加,自由基会和很多大分子物质反应,如脂质、蛋白质和核酸。很多研究表明,当动物受到热应激侵害时,机体内的过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)的活性受到影响,影响机体的抗氧化系统,从而改变自由基的含量,这表明热应激可以引起机体氧化应激[5-7]。氧化应激是指体内氧化和抗氧化系统失衡,产生过多的活性氧(ROS)和活性氮(RNS),造成机体组织细胞及蛋白质和核酸等生物大分子损伤[8]。所有生物,包括简单的生命形式,如酵母和细菌,都具有复杂的抗氧化系统,来平衡体内不断产生的氧化物质。在机体内存在着2条抗氧化系统,即抗氧化酶系统和抗氧化非酶系统。很多研究发现氧化应激可以引起脂质氧化和DNA损伤,产生的过多自由基可以在体内诱发肠炎和肠道黏膜通透性增加等肠道相关疾病,从而影响机体的生长发育[9]。热应激一直以来都是限制畜牧业发展的关键性因素,研究在热应激条件下机体氧化应激的变化不仅可以全面揭示热应激引起氧化应激的机制,同时可以为热应激条件下如何缓解氧化应激提供理论依据。本文就热应激引起氧化应激的机制作一综述。
1 热应激与氧化/抗氧化平衡
氧化/抗氧化平衡时,机体处于正常生理状态,一旦这种平衡被打破就会引起氧化应激反应,热应激打破了机体的氧化/抗氧化平衡状态(图1),引起了氧化应激反应,从而给机体带来危害,同时给畜牧业带来很大的经济损失。

HS:热应激 heat stress;complex Ⅰ:复合体Ⅰ;complex Ⅱ:复合体Ⅱ;complex Ⅲ:复合体Ⅲ;complex Ⅳ:复合体Ⅳ;monoamine oxidase:单胺氧化酶;mitochondrion:线粒体;oxidation:氧化;native protein:天然蛋白质;oxidited protein:氧化蛋白;induction:诱导;binding:结合;degradation:降解;apoptosis:凋亡;lysine:赖氨酸;ARE:抗氧化反应元件 antioxidant response element;ΔΨ:膜通透性 membrane permeability;citrulline:瓜氨酸;nucleus:细胞核。
图1热应激条件下氧化应激发生的机制
Fig.1 Mechanism of oxidative stress under heat stress
2 热应激与自由基
家畜处于热应激状态下其采食量下降,影响机体的代谢水平,特别是产生过多的自由基,自由基是指能独立存在的含有1个或2个以上不配对电子的任何原子或原子团。ROS中的一部分是在自由基反应过程中产生的,这部分严格意义上来说不属于自由基,但是却可以直接或间接地触发自由基反应,因此一般认为机体内的自由基主要有ROS和RNS,参与机体内的各种代谢反应。
2.1热应激与ROS
ROS是正常细胞的代谢产物,可与糖和脂质反应,也可与蛋白质直接反应,还能使一些氨基酸残基发生突变[16]。研究发现,热应激下ROS产生过多,破坏了线粒体膜,使细胞色素C(Cyto-C)释放到细胞液,一旦Cyto-C进入就会很快完成组装,激活半胱氨酸的级联反应,随后胱氨酸的天冬氨酸蛋白水解酶3(Caspases-3)基因表达量上升,导致细胞凋亡[17]。还有研究发现热休克蛋白70(Hsp70)抑制凋亡蛋白酶激活因子(Apaf-1)的基因表达[18]和Cyto-C的释放[19],使Caspases-3基因表达量下降,减少细胞凋亡。研究发现Hsp70还可通过激活抗氧化酶(如SOD)来减少ROS的产生[20]。很多研究已表明,热应激下Hsp70的基因表达量上升[21-22],而Reeg等[23]发现ROS使Hsp70降解失活,加重了热应激程度,形成一个恶性循环,给机体带来严重损伤。热休克蛋白虽然可以激活抗氧化酶,但会有部分被降解,起作用的热休克蛋白的量还是很少的。此外,研究发现在夏季热应激下奶牛体内的Nrf2基因表达量升高[24]。黄毅[25]还发现热应激使Keap1基因的表达量下降,从而Nrf2基因释放入核,表达量上升,产生SOD1和血红素加氧酶-1(HO-1)来抑制ROS的产生,缓解氧化应激。Sholomskas等[26]研究表明小鼠在热应激下使氧化还原因子1(Ref-1)过表达,激活了核转录激活蛋白1(AP-1),一方面抑制细胞凋亡,另一方面使锰超氧化物歧化酶(Mn-SOD)活性升高,从而负反馈调节抑制了ROS产生,缓解了氧化应激,减少了氧化应激带来的细胞和组织损伤。解偶联蛋白(UCPs)是线粒体内膜蛋白,在哺乳动物体内发现有5种(UCP1、UCP2、UCP3、UCP4和UCP5),其中对氧化应激反应起调节作用的主要是UCP2和UCP3[27-28]。UCPs的主要作用是通过调节质子泄漏来降低ROS的产生。Affourtit等[29]报道在胰岛细胞中UCP2基因表达量升高,线粒体ROS生成减少,结果表明UCP2对胰岛素有负调节作用,通过能量代谢调节ROS产生。有研究表明,热应激下UCPs基因表达量下调,这种下调与ROS的增加有关,热应激使ROS产生过多,UCPs无法及时抑制ROS产生而导致其基因表达量下调[30]。
2.2热应激与RNS
RNS主要有一氧化氮(NO)和过氧亚硝基(ONOO-)。NO在细胞中以L-精氨酸作为底物通过一氧化氮合酶(NOS)催化产生,可直接反映机体氧化应激水平(图1)。研究发现热应激的刺激下小鼠体内NOS的基因表达量上调,从而催化L-精氨酸生成大量的NO,对机体造成损伤[31]。NO是具有高活性的自由基,在细胞信号通路中也是一个重要的信号分子,参与各种机体反应。NO不仅可以与氧合血红蛋白反应来有效地防止NO与氧直接高速反应生成二氧化氮(NO2),还可以与ROS反应产生具有很强氧化性的ONOO-,使Mn-SOD和铁超氧化物歧化酶(Fe-SOD)失活[32]。而且可以攻击多不饱和脂肪酸,在此过程中产生的不稳定的中间体脂质过氧化物(LOO-和LOOH)可以引起脂质过氧化,造成蛋白质和DNA的损伤[33]。同时热应激状态下,ROS产生增多,与NO发生反应,使过氧化硝基增多,很可能造成机体中毒[31]。ONOO-可以通过使酪氨酸残基硝基化来修饰蛋白质,氧化色氨酸和半胱氨酸,使其失去活性,造成机体损伤[34]。此外,研究还发现线粒体结构的完整性受到破坏和线粒体膜通透性的增加造成线粒体钙离子(Ca2+)内流增加,Ca2+可以与钙调蛋白结合使NOS活性增强,NO生成增多[35]。RNS在自由基引起氧化应激过程中起着重要的作用,在人的研究上发现,RNS可引发很多疾病,如血栓、癌症等。但是在动物热应激状态下的研究很少,这还需要进一步的研究。
3 热应激对抗氧化酶系统的影响

热应激可分为急性热应激和慢性热应激,不同的热应激下机体内抗氧化酶的活性不同(表1)。急性热应激状态下,机体突然受到刺激,使体内自由基迅速增多,体内抗氧化酶系统做出应答,CAT、SOD、GSH-Px的活性明显升高,来清除过多的自由基。而慢性热应激使机体较长时间的受到热应激的侵害,CAT、SOD、GSH-Px的活性下降,抗氧化酶系统被破坏,无法及时地清除大量自由基,打破了机体的氧化平衡,从而引起机体氧化应激。不同的热应激会使抗氧化酶活性不同,而动物不同的耐热能力也会使抗氧化酶活性存在差异。一系列研究表明热应激使抗氧化酶的活性发生了改变,但都是在表观上说明酶活性的变化,而如何影响酶活性相关的研究并不能清楚的解释其机制(表1)。影响酶活性的因素有很多,如乙酰化、甲基化、酶活中心微量元素含量等。研究发现某些氨基酸发生乙酰化使一些蛋白质表达发生改变,影响了酶的活性[36]。但对于热应激下甲基化、磷酸化影响酶活性的研究还没有报道,因此热应激是否使某些蛋白质甲基化或某些氨基酸磷酸化而使酶的活性发生改变,这还有待于进一步研究。
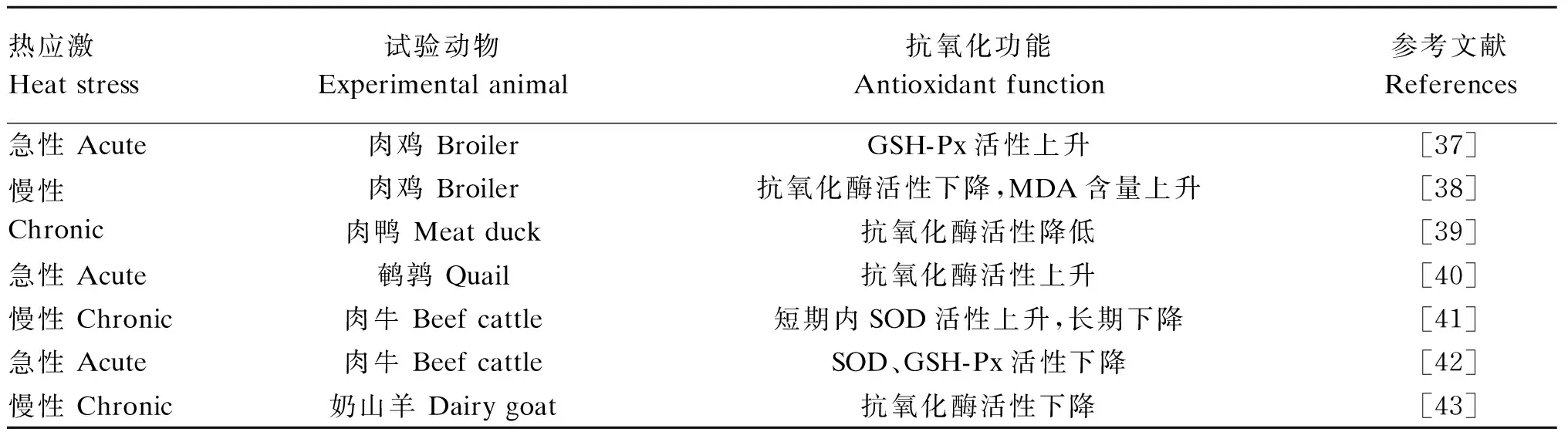
表1 热应激条件下抗氧化酶的变化
4 热应激对抗氧化非酶系统的影响
机体内发生氧化应激时,除抗氧化酶系统外,还存在着抗氧化非酶系统,抗氧化非酶系统有维生素C、维生素E、GSH、类胡萝卜素及微量元素铜、锌、硒、锰等,这些非酶物质参与机体内的生物转化。
非酶物质大都从采食获得,在热应激状态下,动物的采食量下降,使大部分非酶物质减少,抗氧化非酶系统的抗氧化能力下降,引起氧化应激。不同非酶物质的作用机制不同(表2),维生素E在生物系统中是一个重要的抗氧化剂,可以插入到脂质双分子层结构中与维生素C和其他抗氧化系统结合终止脂质氧化[33]。糖皮质激素在体内能够促进蛋白质的分解,增强机体对外界不良环境的适应能力,热应激条件下糖皮质激素分泌过多引起细胞一定程度的损伤,而维生素C可以调节体内糖皮质激素,从而缓解热应激下的细胞损伤。锌在生物体内的抗氧化防御系统起着重要作用,参与CuZn-SOD构成来缓解氧化应激[44];还可以调控金属硫蛋白表达来提高机体抗氧化能力[45]。研究发现铬可以促进RNA的合成,通过在细胞核中大量积累来调节细胞核合成的作用,同时,它还具有酶的功能,能催化DNA的聚合,防止DNA损伤[46]。而热应激增加了尿液中铬的含量,使铬大量流失,无法满足机体的需求,引起DNA损伤。此外,硒也是机体内重要的元素,GSH-Px是最主要的硒依赖性酶,当热应激发生时无法满足机体对硒的需求而导致GSH-Px的活性下降。SOD是依赖硒的另一种抗氧化酶,与GSH-Px共同发挥抗氧化作用,将大量的自由基转化为无毒的羟基化合物,并催化H2O2分解成水[47]。
5 缓解氧化应激的抗氧化剂
热应激状态下机体内的自由基产生过多,引起细胞和组织发生氧化应激,从而给机体带来危害。为了缓解热应激下引起的氧化应激,减少经济损失,国内外对于抗氧化剂添加的研究有很多(表3)。热应激引起的氧化应激主要是由于体内的自由基增多,超过了机体所能清除的能力,通过添加抗氧化剂增强了机体对于自由基的清除力,从而缓解氧化应激。但是研究发现在畜牧业生产中需要更多安全有效的抗氧化剂,这有待于进一步去研究开发。
6 小结与展望
热应激状态下自由基产生过多容易引起氧化应激给动物机体带来危害,本文就热应激引起氧化应激的机制做了详细阐述,该机制可作为预防热应激参考依据的一部分。一些自由基可作为信号分子在细胞通路中反馈抑制自由基的产生,如果清楚地知道在自由基作用下的细胞通路的基因在热应激下表达的情况,就能更好地完善该机制,更有效地缓解热应激引起的氧化应激。目前缓解氧化应激的添加剂实际效果报道不一,而且添加量没有统一的标准。是否可以采取多种添加剂混合或开发更多的中草药添加剂来更好地缓解氧化应激,但关于这方面的研究报道还很少,有待于进一步的研究。
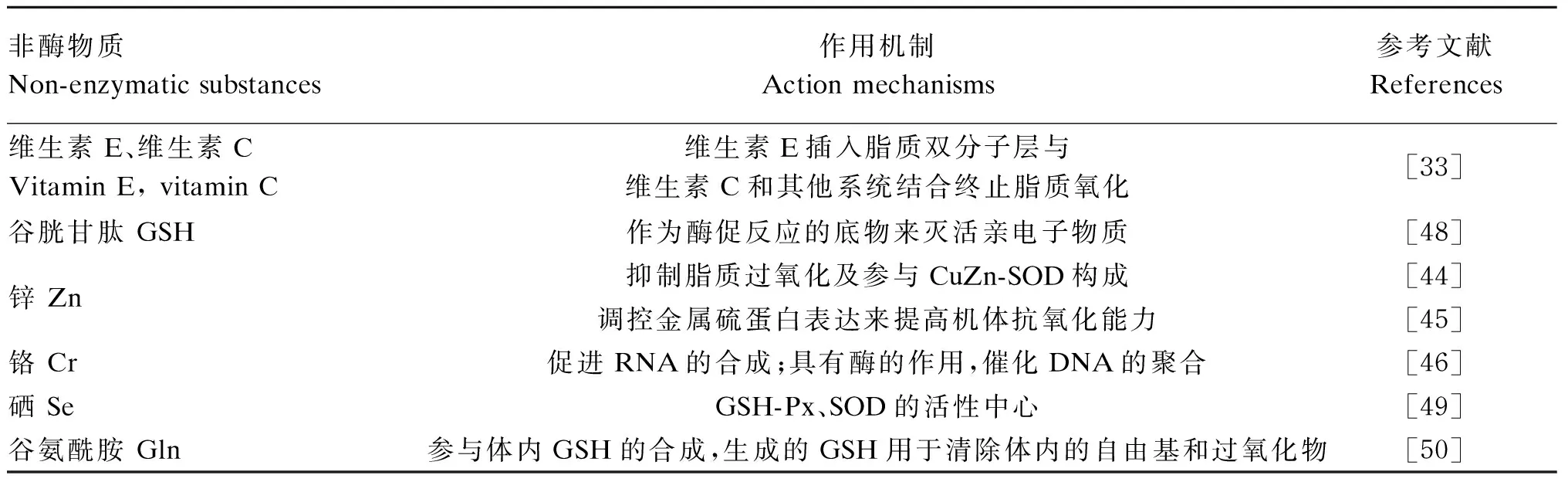
表2 热应激条件下抗氧化非酶系统
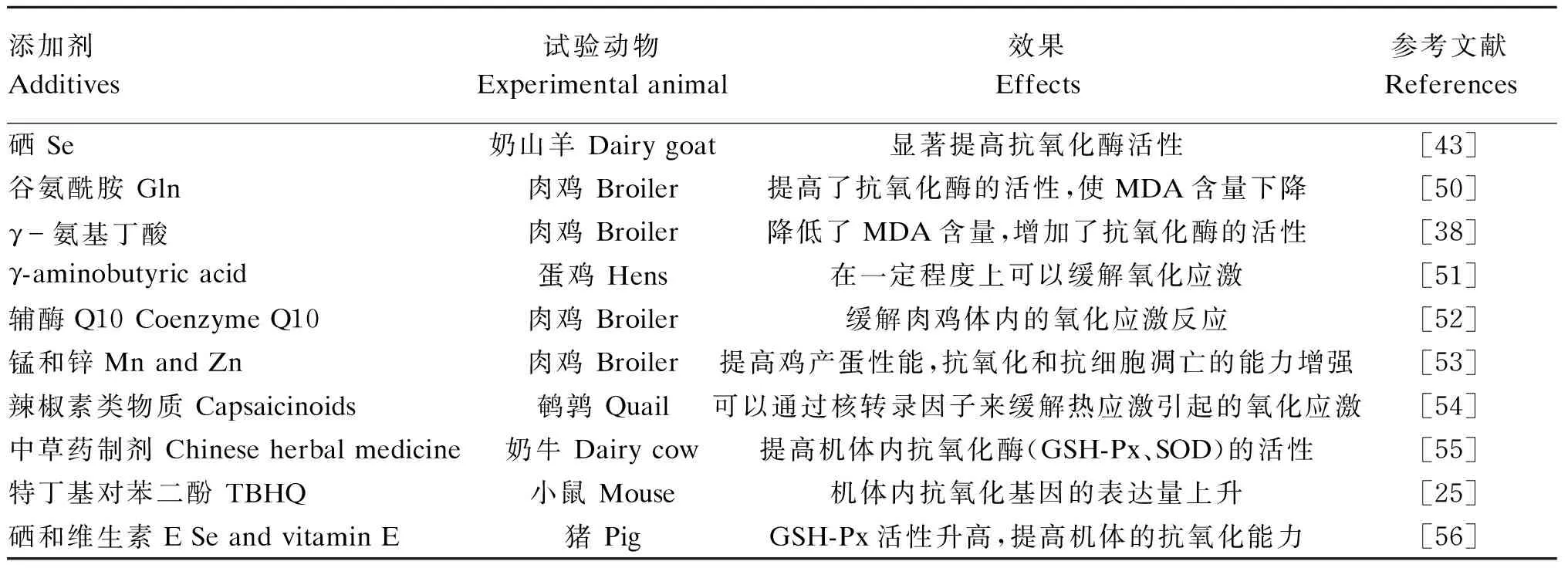
表3 2010—2016年热应激条件下抗氧化剂研究
[1] RENAUDEAU D,COLLIN A,YAHAV S,et al.Adaptation to hot climate and strategies to alleviate heat stress in livestock production[J].Animal,2012,6(5):707-728.
[2] 宁章勇,刘思当,赵德明,等.热应激对肉仔鸡呼吸、消化和内分泌器官的形态和超微结构的影响[J].畜牧兽医学报,2003,34(6):558-561.
[3] HU H,BAI X,SHAH A A,et al.Dietary supplementation with glutamine and γ-aminobutyric acid improves growth performance and serum parameters in 22-to 35-day-old broilers exposed to hot environment[J].Journal of Animal Physiology and Animal Nutrition,2016,100(2):361-370.
[4] QUINTEIRO-FILHO W M,RODRIGUES M V,RIBEIRO A,et al.Acute heat stress impairs performance parameters and induces mild intestinal enteritis in broiler chickens:role of acute hypothalamic-pituitary-adrenal axis activation[J].Journal of Animal Science,2012,90(6):1986-1994.
[5] YANG L,TAN G Y,FU Y Q,et al.Effects of acute heat stress and subsequent stress removal on function of hepatic mitochondrial respiration,ROS production and lipid peroxidation in broiler chickens[J].Comparative Biochemistry and Physiology Part C:Toxicology and Pharmacology,2010,151(2):204-208.
[6] ZENG T,LI J J,WANG D Q,et al.Effects of heat stress on antioxidant defense system,inflammatory injury,and heat shock proteins of Muscovy and Pekin ducks:evidence for differential thermal sensitivities[J].Cell Stress and Chaperones,2014,19(6):895-901.
[7] GU X H,HAO Y,WANG X L.Overexpression of heat shock protein 70 and its relationship to intestine under acute heat stress in broilers:2.intestinal oxidative stress[J].Poultry Science,2012,91(4):790-799.
[8] HALLIWELL B,WHITEMAN M.Measuring reactive species and oxidative damageinvivoand in cell culture:how should you do it and what do the results mean?[J].British Journal of Pharmacology,2004,142(2):231-255.
[9] THANAN R,OIKAWA S,HIRAKU Y,et al.Oxidative stress and its significant roles in neurodegenerative diseases and cancer[J].International Journal of Molecular Sciences,2014,16(1):193-217.
[10] BABIOR B M,LAMBETH J D,NAUSEEF W.The neutrophil NADPH oxidase[J].Archives of Biochemistry and Biophysics,2002,397(2):342-324.
[11] LIOCHEV S I,FRIDOVICH I.Superoxide and iron:partners in crime[J].IUBMB Life,1999,48(2):157-161.
[12] RAY G,HUSAIN S A.Oxidants,antioxidants and carcinogenesis[J].Indian Journal of Experimental Biology,2002,40(11):1213-1232.
[13] RUSSO A,MITCHELL J B,MCPHERSON S.The effects of glutathione depletion on thermotolerance and heat stress protein synthesis[J].British Journal of Cancer,1984,49(6):753-758.
[14] AGARWAL A,PRABAKARAN S A.Mechanism,measurement,and prevention of oxidative stress in male reproductive physiology[J].Indian Journal of Experimental Biology,2005,43(11):963-974.
[15] MANUCHA W,VALLÉS P.Hsp70/nitric oxide relationship in apoptotic modulation during obstructive nephropathy[J].Cell Stress and Chaperones,2008,13(4):413-420.
[16] GAO H B,TONG M H,HU Y Q,et al.Mechanisms of glucocorticoid-induced Leydig cell apoptosis[J].Molecular and Cellular Endocrinology,2003,199(1/2):153-163.
[17] STADTMAN E R,LEVINE R L.Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J].Amino Acids,2003,25(3/4):207-218.
[18] BEERE H M,WOLF B B,CAIN K,et al.Heat-shock protein 70 inhibits apoptosis by preventing recruitment of procaspase-9 to the Apaf-1 apoptosome[J].Nature Cell Biology,2000,2(8):469-475.
[19] KLEIN S D,BRÜNE B.Heat-shock protein 70 attenuates nitric oxide-induced apoptosis in RAW macrophages by preventing cytochrome c release[J].Biochemical Journal,2002,362(3):635-641.
[20] ARNAL M E,LALLS J P.Gut epithelial inducible heat-shock proteins and their modulation by diet and the microbiota[J].Nutrition Reviews,2016,74(3):181-197.
[21] XIE J J,TANG L,LU L,et al.Differential Expression of heat shock transcription factors and heat shock proteins after acute and chronic heat stress in laying chickens (Gallusgallus)[J].PLoS One,2014,9(7):e102204.
[22] YU J M,BAO E D.Effect of acute heat stress on heat shock protein 70 and its corresponding mRNA expression in the heart,liver,and kidney of broilers[J].Asian-Australasian Journal of Animal Sciences,2008,21(8):1116-1126.
[23] REEG S,JUNG T,CASTRO J P,et al.The molecular chaperone hsp70 promotes the proteolytic removal of oxidatively damaged proteins by the proteasome[J].Free Radical Biology and Medicine,2016,99:153-166.
[24] ZACHUT M,KRA G,LIVSHITZ L,et al.Seasonal heat stress affects adipose tissue proteome toward enrichment of theNrf2-mediated oxidative stress response in late-pregnant dairy cows[J].Journal of Proteomics,2017,158:52-61.
[25] 黄毅.热应激对小鼠肝脏抗氧化功能的影响及日粮添加TBHQ的缓解作用研究[D].硕士学位论文.南京:南京农业大学,2012.
[26] SHOLOMSKAS L M,ROCHE K L,BLOOMER S A.Aging impairs induction of redox factor-1 after heat stress:a potential mechanism for heat-induced liver injury[J].International Journal of Physiology Pathophysiology & Pharmacology,2015,7(1):14-26.
[27] SUSKI J M,SCHÖNFELD P,BONORA M,et al.Guanosine diphosphate exerts a lower effect on superoxide release from mitochondrial matrix in the brains of uncoupling protein-2 knockout mice:new evidence for a putative novel function of uncoupling proteins as superoxide anion transporters[J].Biochemical and Biophysical Research Communications,2012,428(2):234-238.
[28] NABBEN M,HOEKS J,BRIEDÉ J J,et al.The effect ofUCP3 overexpression on mitochondrial ROS production in skeletal muscle of young versus aged mice[J].FEBS Letters,2008,582(30):4147-4152.
[29] AFFOURTIT C,JASTROCH M,BRAND M D.Uncoupling protein-2 attenuates glucose-stimulated insulin secretion in INS-1E insulinoma cells by lowering mitochondrial reactive oxygen species[J].Free Radical Biology and Medicine,2011,50(5):609-616.
[30] MUJAHID A,SATO K,AKIBA Y,et al.Acute heat stress stimulates mitochondrial superoxide production in broiler skeletal muscle,possibly via downregulation of uncoupling protein content[J].Poultry Science,2006,85(7):1259-1265.
[31] BOUCHARD J N,YAMASAKI H.Heat stress stimulates nitric oxide production inSymbiodiniummicroadriaticum:a possible linkage between nitric oxide and the coral bleaching phenomenon[J].Plant and Cell Physiology,2008,49(4):641-652.
[32] ISCHIROPOULOS H,ZHU L,CHEN J,et al.Peroxynitrite-mediated tyrosine nitration catalyzed by superoxide dismutase[J].Archives of Biochemistry and Biophysics,1992,298(2):431-437.
[33] REED T T.Lipid peroxidation and neurodegenerative disease[J].Free Radical Biology and Medicine,2011,51(7):1302-1319.
[34] ISCHIROPOULOS H,AL-MEHDI A B.Peroxynitrite-mediated oxidative protein modifications[J].FEBS Letters,1995,364(3):279-282.
[35] DAWSON T M,DAWSON V L,SNYDER S H.Molecular mechanisms of nitric oxide actions in the brain[J].Annals of the New York Academy of Sciences,1994,738:76-85.
[36] GUAN K L,XIONG Y.Regulation of intermediary metabolism by protein acetylation[J].Trends in Biochemical Sciences,2011,36(2):108-116.
[37] PAMOK S,AENGWANICH W,KOMUTRIN T.Adaptation to oxidative stress and impact of chronic oxidative stress on immunity in heat-stressed broilers[J].Journal of Thermal Biology,2009,34(7):353-357.
[38] CHAND N,MUHAMMAD S,KHAN R U,et al.Ameliorative effect of synthetic γ-aminobutyric acid (GABA) on performance traits,antioxidant status and immune response in broiler exposed to cyclic heat stress[J].Environmental Science and Pollution Research International,2016,23(23):23930-23935.
[39] 李燕.有机铬对热应激肉鸭肠黏膜形态、HSP70 mRNA和抗氧化能力的影响[D].硕士学位论文.武汉:华中农业大学,2013.
[40] DEL VESCO A P,GASPARINO E,ZANCANELA V,et al.Effects of selenium supplementation on the oxidative state of acute heat stress-exposed quails[J].Animal Physiology and Animal Nutrition,2017,101(1):170-179.
[41] 宋小珍,付戴波,瞿明仁,等.热应激对肉牛血清内分泌激素含量、抗氧化酶活性及生理生化指标的影响[J].动物营养学报,2012,24(12):2485-2490.
[42] 胡煜,蔡明成,王玲,等.热应激状态下牛血清生化指标、miRNA表达变化及其相关性分析[J].畜牧兽医学报,2016,47(9):1840-1847.
[43] 许啸.奶山羊高温预警指标的筛选及有机铬调控作用研究[D].硕士学位论文.武汉:华中农业大学,2013.
[44] YIN L L,ZHANG Y,GUO D M,et al.Effects of zinc on interleukins and antioxidant enzyme values in psoriasis-induced mice[J].Biological Trace Element Research,2013,155(3):411-415.
[45] ZHENG J J,ZHANG Y,XU W T,et al.Zinc protects HepG2 cells against the oxidative damage and DNA damage induced by ochratoxin A[J].Toxicology and Applied Pharmacology,2013,268(2):123-131.

[47] 颜雪明,洪敏,张华,等.微量元素硒及有机硒药物研究进展[J].广东微量元素科学,2003,10(9):1-10.
[48] ZHANG H J,XU L,DRAKE V J,et al.Heat-induced liver injury in old rats is associated with exaggerated oxidative stress and altered transcription factor activation[J].FASEB Journal,2003,17(12):2293-2295.
[49] XU D N,LI W Y,HUANG Y M,et al.The effect of selenium and polysaccharide ofAtractylodesmacrocephalaKoidz. (PAMK) on immune response in chicken spleen under heat stress[J].Biological Trace Element Research,2014,160(2):232-237.
[50] 李文立,路静,孙振钧,等.谷氨酰胺对热应激肉鸡抗氧化性能的影响[J].动物营养学报,2011,23(4):695-702.
[51] ZHU Y Z,CHENG J L,REN M,et al.Effect of γ-Aminobutyric acid-producingLactobacillusstrain on laying performance,egg quality and serum enzyme activity in Hy-line brown hens under heat stress[J].Asian-Australasian Journal of Animal Sciences,2015,28(7):1006-1013.
[52] KIKUSATO M,NAKAMURA K,MIKAMI Y,et al.The suppressive effect of dietary coenzyme Q10on mitochondrial reactive oxygen species production and oxidative stress in chickens exposed to heat stress[J].Animal Science Journal,2015,87(10):1244-1251.
[53] 朱勇文.饲粮锰、锌对肉鸡的抗热应激效应及其分子机制的研究[D].博士学位论文.北京:中国农业大学,2016.
[54] SAHIN N,ORHAN C,TUZCU M,et al.Capsaicinoids improve egg production by regulating ovary nuclear transcription factors against heat stress in quail[J].British Poultry Science,2016,58(2):177-183.
[55] 胡永灵,叶世莉,罗佳捷.中草药制剂对热应激奶牛泌乳性能、抗氧化能力及免疫功能的影响[J].草业学报,2015,24(1):132-140.
[56] LIU F,COTTRELL J J,FURNESS J B,et al.Selenium and vitamin E together improve intestinal epithelial barrier function and alleviate oxidative stress in heat-stressed pigs[J].Experimental Physiology,2016,101(7):801-810.
*Corresponding author, associate professor, E-mail: zhiliqi@mail.hzau.edu.cn
(责任编辑 王智航)
Mechanism of Oxidative Stress in Body under Heat Stress
ZHANG Yifeng QI Zhili*
(College of Animal Sciences and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Heat stress is the nonspecific physiological responses of body to heat exposure at high ambient temperature. A large number of studies show that heat stress can cause the body redox unbalance, which results in oxidative stress, damaged cells and tissues, and affecting growth and development as well as health. This research on heat stress has always been a hot research field both at home and abroad. With the increase of global temperature, the problem of heat stress will become more prominent. In this paper, the mechanism of oxidative stress under heat stress is reviewed to provide a reference for the following study.[ChineseJournalofAnimalNutrition,2017,29(9):3051-3058]
heat stress; oxidative stress; antioxidant system; reactive oxygen species; reactive nitrogen species
10.3969/j.issn.1006-267x.2017.09.005
2017-03-01
国家重点研发项目(2016YFD0500507);湖北省科技支撑计划项目(2014BBA205);华中农业大学重点引智项目(110000200420170126);校自主科技创新培育专项(2662016PY010)
张轶凤(1994—),女,河南商丘人,硕士研究生,从事反刍动物营养研究。E-mail: 2494318936@qq.com
*通信作者:齐智利,副教授,硕士生导师,E-mail: zhiliqi@mail.hzau.edu.cn
S852.2
:A
:1006-267X(2017)09-3051-08

