新辅助化疗对胃癌细胞超微结构及核基质结合区结合蛋白质1表达的影响
朱旭升, 吴晓宇
论 著
新辅助化疗对胃癌细胞超微结构及核基质结合区结合蛋白质1表达的影响
朱旭升, 吴晓宇
目的探讨新辅助化疗对胃癌细胞超微结构的影响与对胃癌组织中核基质结合区结合蛋白质1(Special AT rich sequence binding protein 1,SATB1)表达的关系。方法对2013年12月至2015年12月江苏省中医院消化系肿瘤外科60例进展期胃癌患者术后癌组织进行超微结构观察,60例中40例行新辅助化疗,其中20例用介入途径(介入组),20例用静脉途径(静脉组),另20例直接行手术治疗为对照组。同时检测新辅助化疗前、后胃癌组织及癌旁组织SATB1的免疫组化表达。结果对化疗敏感的病例癌细胞的细胞器严重损伤,包括核固缩、线粒体和内质网肿胀;对化疗不敏感的病例癌细胞的细胞器未受破坏或仅轻度损伤,其中介入组细胞损伤程度高于静脉组(P=0.047)。在癌细胞损伤明显的病例中,SATB1的表达更加明显(P=0.035)。结论介入法新辅助化疗对胃癌细胞的损伤作用更大。SATB1的表达与胃癌细胞损伤程度相关,可作为评估新辅助化疗疗效新的标志物。
胃肿瘤; 显微镜检查,电子,透射; 核基质附着区结合蛋白质1; 新辅助化疗
胃癌患者在就诊时多数已为进展期,Ⅲ、Ⅳ期占50%~60%。研究发现,进展期胃癌获得根治性切除的比例少,术后局部复发及远处转移的发生率高,5年生存率低[1]。近年来,国内外临床研究表明,新辅助化疗可以降低肿瘤的分期,提高胃癌患者的根治性切除率,减少术后复发转移率,提高生存率[2-4]。本文从超微结构及核基质结合区结合蛋白质1(special AT-rich sequence binding protein 1,SATB1)的表达,来阐述新辅助化疗对胃癌细胞的影响。
1 资料与方法
1.1 研究对象
对江苏省中医院消化系肿瘤外科2013年12月至2015年12月收治的60例行胃癌根治术的患者进行分组观察。其中男33例,女27例;年龄25~75岁,平均年龄57岁;均经胃镜明确诊断为胃腺癌;通过全腹CT、MRI或超声内镜对肿瘤分期,cTNMⅡ期23例、Ⅲ期37例;KPS评分>60分,凝血、肝、肾功能等基本正常。40例术前行新辅助化疗,其中20例采用介入法给药(介入组),20例采用静脉法给药(静脉组),另20例直接手术为对照组。3组年龄、性别、cTNM分期、病理类型等比较,差异无统计学意义(均P>0.05)(表1)。

表1 介入组、静脉组和对照组患者一般资料比较
病理学类型:1为高分化腺癌,2为中分化腺癌,3为低分化腺癌,4为印戒细胞癌
1.2 化疗方法及方案
介入组采用Seldinger法。经一侧股动脉插管,导管插入腹腔动脉起始部,注入造影剂,根据肿瘤显影情况判断血供来源,选择插管部位。若肿瘤显影不明显,则根据肿瘤所在部位,超选择插管:肿瘤位于贲门和胃体部者选择胃左动脉或腹腔动脉插管;肿瘤位于胃窦部者,选择性插入肝总动脉或胃十二指肠动脉。静脉组选择周围静脉滴注化疗。
化疗方案均为顺铂60 mg/m2,紫杉醇135 mg/m2。持续滴注2 h。两组病例均化疗1次,术前常规预防性使用地塞米松,化疗当天给予水化和利尿措施以减少毒性反应。化疗后第7天复查血常规、肝功能,第7~14天进行手术。
1.3 观察项目
1.3.1 细胞超微结构的变化 用电镜观察术后病理切片中癌细胞与癌旁正常胃黏膜细胞的线粒体、内质网、细胞核、核膜、核仁等超微结构的损伤程度。根据细胞器上述受损项评价,0~1项为无损伤,2~3项为轻度损伤,4~5项为中度损伤,>5项变化为重度损伤。
1.3.2 SATB1的表达 取胃癌及癌旁组织蜡块,行链霉亲和素-过氧化物酶法(streptavidin-perosidase,SP)检测SATB1表达情况,按免疫反应评分(immunoreactivity score,IRS)评估,IRS=染色程度×阳性细胞百分率。染色程度评分:细胞核无染色、弱染色、中等染色、强染色分别计为0分、1分、2分、3分。染色细胞百分率评分:1个视野内着色细胞1%~10%计1分;11%~50%计2分;51%~75%计3分;>75%计4分;阴性计0分。IRS值满3分为弱阳性;4分为阳性;≥5分为强阳性。取阳性及强阳性作为比较值,阴性及弱阳性不作参考。
1.4 统计学方法
应用SPSS 21.0统计学软件进行数据分析,计量资料采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌细胞与正常胃黏膜细胞超微结构的差异
胃癌细胞超微结构(图1)相比正常胃黏膜细胞(图2),细胞形状不规则;细胞膜可见微绒毛,核体积增大,核膜内陷增多,核仁增大,核内可见核内小体及假性包含物;细胞质相对减少,线粒体数量较多且形态不规则,游离核糖体增多,粗面内质网等细胞器减少。
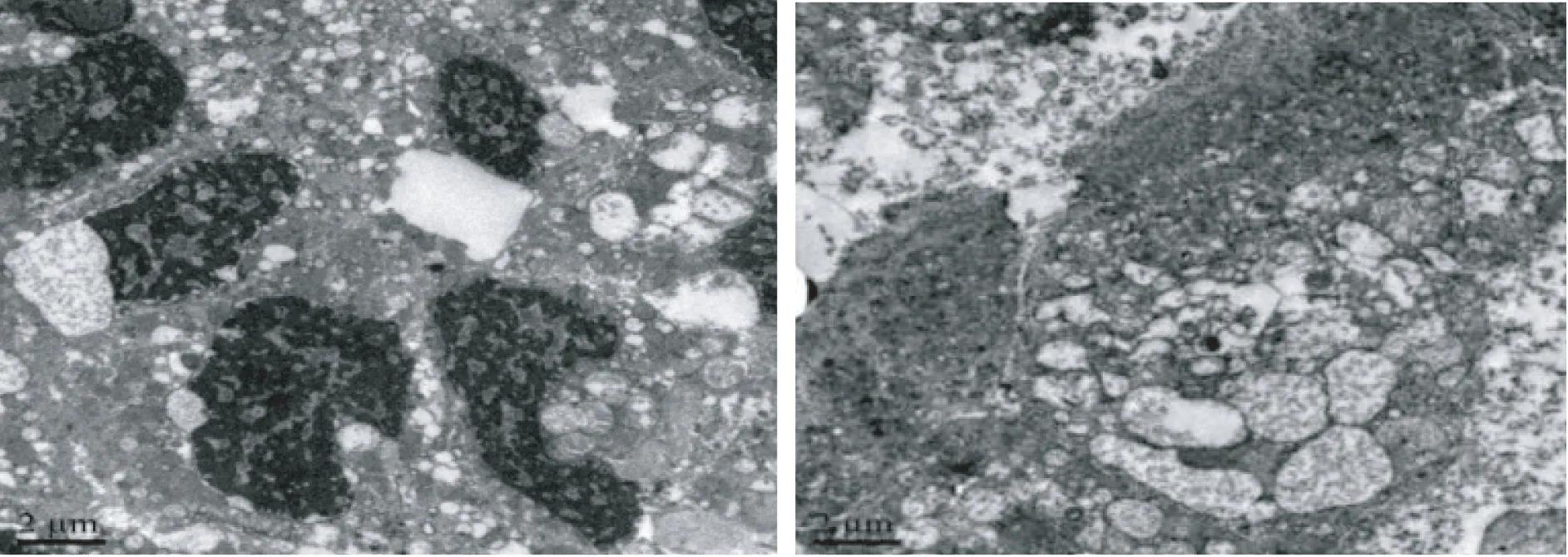
图1 胃癌细胞超微结构(2 μm)图2 正常胃黏膜细胞
2.2 新辅助化疗对胃癌细胞超微结构的影响
在化疗组患者术后病理标本中可见:对化疗反应好者可见癌细胞大量坏死、崩解,大量细胞碎片,溶酶体增多,单核细胞浸润,成纤维细胞增生,出现纤维化反应;对化疗反应较好者可见细胞碎片,有些细胞的核仁出现固缩、分裂,核内出现空泡,线粒体破坏明显,粗面内质网肿胀,但仍有未坏死癌细胞;对化疗反应差者可见癌细胞细胞器基本无损伤,或仅见细胞核固缩及核膜皱缩,粗面内质网轻度肿胀,线粒体肿胀,嵴减少(图3~图4)。

图3 介入组胃癌细胞线粒体肿胀,异染色质比例降低,个别线粒体呈空泡状,核膜破坏,核固缩且出现分裂,核仁固缩(A,2 μm);单核细胞浸润及纤维化反应(B,5 μm) ×1000
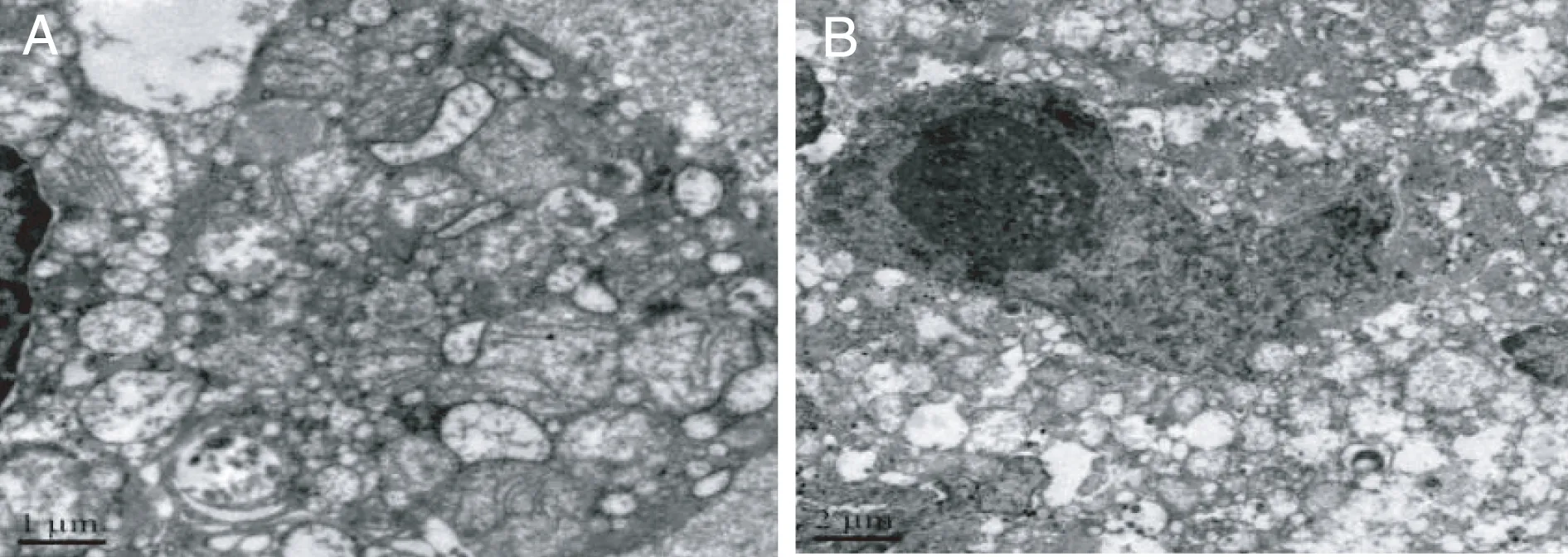
图4 静脉组胃癌细胞肿胀,但细胞核改变较少,核仁较大(A,1 μm;B,2 μm)
2.3 新辅助化疗不同方式对胃癌细胞超微结构影响
通过电镜下观察统计各组术后标本发生胃癌细胞超微结构变化的例数及占比(表2),结果可见,介入组对胃癌细胞超微结构的影响明显大于静脉组(P<0.05)。

表2 术后3组胃癌细胞超微结构改变病例数(%)比较
注:表中χ2值与P值是介入组与静脉组比较,未比较手术组
2.4 新辅助化疗不同方式对胃癌细胞损伤程度比较
通过电镜下观察介入组与静脉组术后标本胃癌细胞超微结构受损项评分例数的统计(表3),结果可见介入组导致癌细胞超微结构损伤程度(5项以上者)高于静脉组(χ2=7.943,P=0.047)。

表3 不同化疗方式对胃癌细胞损伤程度的比较
2.5 胃癌细胞细胞器损伤与SATB1表达的关联性
免疫组化结果显示(图5),60例胃癌患者术前的癌组织中SATB1表达结果显示阴性,而术后结果显示弱阳性9例,阳性18例,强阳性33例。在癌旁组织SATB1表达结果显示阴性。在胃癌细胞超微结构改变明显的病例中,SATB1的表达水平高,出现强阳性的概率更高,差异有统计学意义(P=0.035),见表4及图6~图7。
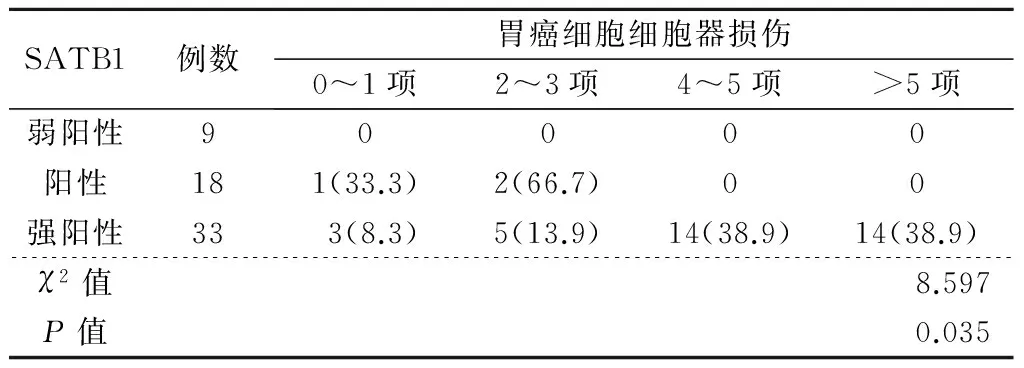
表4 SATB1与胃癌细胞细胞器损伤[例(%)]
3 讨论
目前,进展期胃癌术后5年生存率仅为30%~50%[5]。因此,寻求有效治疗方法、提高手术切除率及降低术后复发率至关重要。术前化疗即新辅助化疗的临床应用近年来发展迅速,其能够控制原发病灶,降低临床分期,利于手术治疗。

图5 免疫组化SATB1表达(SP法 ×200)A:弱阳性表达;B:阳性表达;C:强阳性表达;D:阴性表达

目前电镜的研究主要应用于观察肠黏膜形态及肾脏、血脑屏障及细胞株的超微结构变化,对胃癌细胞超微结构的研究和报道甚少,同时缺少相应的评价标准。本研究用超微结构对比观察不同化疗方式对胃癌细胞的损伤程度及疗效,结果显示,癌细胞大量坏死、崩解,大量细胞碎片,溶酶体增多,单核细胞浸润,成纤维细胞增生,出现纤维化反应;对化疗反应较好者可见细胞碎片,有些细胞的核仁出现固缩、分裂,核内出现空泡,线粒体破坏明显,粗面内质网肿胀。同时,不同化疗方式对胃癌细胞在超微结构下显示的的细胞结构损坏程度有不同,介入组在细胞器的损伤程度上明显重于静脉组(P<0.01)。
本研究中发现,存在化疗耐受的现象。实验结果中,化疗反应差者可见癌细胞器基本无损伤,或仅见细胞核固缩及核膜皱缩,粗面内质网轻度肿胀,线粒体肿胀,嵴减少。这类病例对化疗的敏感性较差,往往会增加不良反应发生率,影响整体治疗效果。以下问题值得研究:①是否存在化疗敏感性的预测方法?②是否能在减少化疗剂量的同时不降低临床疗效?我们认为,预测敏感性更为重要,可以判断胃癌对于化疗是否敏感,选择合理的治疗方法,避免过度治疗。
SATB1是一种核基质结合区组织特异性表达的结合蛋白[6],通过与位于BCL-2基因3'端非翻译区主要断裂区结合,调节BCL-2基因的转录活性发挥作用[7]。Han等[8]研究发现,SATB1可限定多个基因组的位点和补充染色质修饰酶来调节染色质的结构和基因表达,对乳腺癌的生长转移起到重要作用。SATB1基因在结直肠癌、乳腺癌、肝癌等多种恶性肿瘤中过表达,并能调节多个肿瘤相关基因的转移[9-11]。正常胃黏膜组织中STAB1的表达阳性率明显低于胃癌组织,SATB1的表达与肿瘤的侵犯深度和淋巴结转移程度相关[12-13],SATB1的上调表达可能促进胃癌的发生和转移。本研究结果显示,新辅助化疗后,超微结构改变明显的胃癌细胞中,SATB1的表达水平高于超微结构改变不明显的,出现强阳性的概率更高,表明SATB1的表达与胃癌细胞损伤程度有关,但具体原因尚待进一步研究。
[1] 何若冰, 陈俊强. 胃癌新辅助化疗的研究进展[J].世界华人消化杂志,2009,17(12):1207-1211.
[2] Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. N Engl J Med, 2006,355(1):11-20.
[3] 方育, 王亚军, 李非, 等. 奥沙利铂联合甲酰四氢叶酸钙和氟尿嘧啶新辅助化疗方案治疗进展期胃癌的研究[J].中华胃肠外科杂志,2006,9(6):510-512.
[4] 李刚,夏雷,魏尉,等.谷氨酰胺改善新辅助化疗引起的进展期胃癌患者肠黏膜通透性改变及毒性反应[J].中国肿瘤外科杂志,2014,6(6):341-344.
[5] Lamb P, Sivashanmugam T, White M, et al. Gastric cancer surgery--a balance of risk and radicality[J]. Ann R Coll Surg Engl, 2008,90(3):235-242.
[6] Alvarez JD, Yasui DH, Niida H, et al. The MAR-binding protein SATB1 orchestrates temporal and spatial expression of multiple genes during T-cell development[J]. Genes Dev, 2000,14(5):521-535.
[7] Ma C, Zhang J, Durrin LK, et al. The BCL2 major breakpoint region (mbr) regulates gene expression[J]. Oncogene, 2007,26(18):2649-2657.
[8] Han HJ, Russo J, Kohwi Y, et al. SATB1 reprogrammes gene expression to promote breast tumour growth and metastasis[J]. Nature, 2008,452(7184):187-193.
[9] 周来勇, 刘芳, 童健, 等. 实时荧光定量RT-PCR分析非小细胞肺癌SATB1 的表达和临床病理意义[J].南方医科大学学报,2009,29(3):534-537.
[10] Cheng C, Lu X, Wang G, et al. Expression of SATB1 and heparanase in gastric cancer and its relationship to clinicopathologic features[J]. APMIS, 2010,118(11):855-863.
[11] Zhao XD, Ji WY, Zhang W, et al. Overexpression of SATB1 in laryngeal squamous cell carcinoma[J]. ORL J Otorhinolaryngol Relat Spec, 2010,72(1):1-5.
[12] 杨欢,李倩,傅薇薇,等.SATBl和COX-2在胃癌中的表达及其临床意义[J].徐州医学院学报,2013,33(5):334-337.
[13] 宋桂芹, 刘康, 白亦光, 等. SATB1在胃癌细胞SGC-7901中表达的研究[J].中华全科医学,2014,12(1):21-23,封3.
AdvancedgastriccancercellultrastructurechangeafterneoadjuvantchemotherapyandcanceroustissueSATB1expression
ZHUXusheng1,WUXiaoyu2.
(1.DepartmentofGeneralSurgery,NanjingGaochunHospitalofTCM,Nanjing211300,China; 2.DepartmentofDigestiveTumorSurgery,JiangsuProvinceHospitalofTCM,Nanjing210029,China)
ZHUXusheng,Email:2758966243@qq.com
ObjectivePhase by observing the progress of the changes of the ultrastructure of gastric cancer cells after neoadjuvant chemotherapy and carcinoma tissue SATB1 expression, and to explore new adjuvant chemotherapy for gastric cancer cell damage mechanism, and the relationship between the ultrastructural changes and SATB1.MethodsFrom December 2013 and December 2015, 60 patients with advanced gastric cancer were enrolled in Department of Digestive Tumor Surgery; Jiangsu Province Hospital of TCM, including 20 cases who accepted interventional chemotherapy and intravenous chemotherapy to the 20 cases, direct surgical treatment as control group 20 cases. SATB1 immunohistochemical expression of gastric cancer tissues and tissues adjacent to carcinoma were detected before and after the new adjuvant chemotherapy.ResultsIn cases where chemotherapy was sensitive, the organelles of cancer cells were severely damaged, including pyknosis, mitochondria, and endoplasmic reticulum swelling. In cases where chemotherapy was not sensitive, the organelles of cancer cells were not destroyed or only mildly damaged. The injury degree of the interventional group was higher than that of the intravenous group (P=0.047). The expression of SATB1 was more significant in the cases with obvious cancer damage (P=0.035).ConclusionsInterventional neoadjuvant chemotherapy has more damage to gastric cancer cells. SATB1 expression is related to tumor infiltrating degree, and SATB1 can be used as a new marker to evaluate the efficacy of neoadjuvant chemotherapy.
Stomach neoplasms; Cells; Microscopy, electron, transmission; Matrix attachment region binding proteins 1; Neoadjuvant chemotherapy
211300 江苏 南京, 南京市高淳中医院 普外科(朱旭升); 210029 江苏 南京,江苏省中医院 消化系肿瘤外科(吴晓宇)
朱旭升,Email:2758966243@qq.com
10.3969/j.issn.1674-4136.2017.04.009
1674-4136(2017)04-0239-04
2017-01-18][本文编辑:钦嫣]

