苹果链格孢菌胞外多糖及分光光度法改用酶标仪法的稳定性
房芳,柳春燕,陈靠山,2,袁平川,王浩
(1.皖南医学院,芜湖 241000;2.山东大学)
苹果链格孢菌胞外多糖及分光光度法改用酶标仪法的稳定性
房芳1,柳春燕1,陈靠山1,2,袁平川1,王浩1
(1.皖南医学院,芜湖 241000;2.山东大学)
通过对传统多糖含量测定方法蒽酮法加以改进,以全波长酶标仪代替可见分光光度计进行糖含量测定,对苹果链格孢菌胞外多糖在不同温度、光照、pH值和金属离子条件下的此测定方法稳定性进行研究。结果表明,分光光度法改用酶标仪法后,其线性关系良好、稳定性及精密度较好,具有可重复性,且操作简便,适用于大样本测量分析。苹果链格孢菌胞外多糖在20~80℃下的热稳定性较好,在pH=6的弱酸及Na+溶液中多糖稳定性较好,强酸强碱及Cu2+、Fe3+溶液中稳定性较差,光照可对多糖稳定性产生影响。
胞外多糖;蒽酮法;稳定性;分光光度法;全波长酶标仪
多糖是除蛋白质、核酸、脂肪外的另一类重要的生物大分子物质,具有抗肿瘤[1]、抗氧化[2]、抗衰老、免疫调节等多种药理学活性[3,4]。多糖含量的测定方法有多种:利用多糖的还原性进行测定,如3,5-二硝基水杨酸盐(DNS)比色法[5]等;利用糠醛缩合显色法进行测定,如地衣酚-硫酸(盐酸)法[6]、苯酚-硫酸法[7,8]和蒽酮-硫酸法[9]等,其中苯酚法和蒽酮法又是最为常用的两种多糖含量测定方法,具有方便快捷、准确度高、稳定性好[10]等多个优点。传统的蒽酮法,采用分光光度法测定糖含量,操作过程中需不断清洗更换比色皿,操作繁琐,耗样量大,大样本分析时程长易导致误差,而酶标仪的使用使操作更加简便、用样量少、可同时测定多个样本、适用于大样本的分析测定,苏颖[11]、赵艳[12]等人利用酶标仪测定虫草多糖、食用菌多糖结果表明该法是一种快速准确的方法。本文将选用苹果链格孢菌胞外粗多糖(一种真菌胞外多糖,MTT法检测发现其具有一定抗肿瘤作用)为原料,以全波长酶标仪代替可见分光光度计快速测定样品中多糖的含量,并对多糖的稳定性作进一步研究,为苹果链格孢菌胞外多糖的研究利用奠定基础。
1 试验材料
1.1 材料
苹果链格孢菌Alternaria maliRoberts菌株由实验室分离保藏,苹果链格孢菌胞外粗多糖由实验室提供。
1.2 仪器和试剂
酶标仪(美国Bio-TeK公司);7200型可见分光光度计(美国Unico);电子天平FA2004N(上海民桥精密科学仪器有限公司);数显控温水浴锅GKC4(上海波洛实验设备有限公司);艾科浦超纯水系统AFZ-1001-U(颐洋企业发展有限公司);96孔单条可拆酶标板(Costar)。
蒽酮、葡萄糖、NaCl、KCl、AlCl3、FeCl3、CaCl2、CuSO4、MgSO4、浓H2SO4、无水乙醇均为分析纯(AR)试剂。
2 试验方法
2.1 苹果链格孢菌胞外粗多糖制备
PDA培养基配制:称取200 g马铃薯,去皮后切碎,加水1 000 mL煮沸30 min,四层纱布过滤后加入20 g葡萄糖,充分溶解后121℃高压蒸汽灭菌20 min,冷却后贮存备用。
将苹果链格孢菌(Alternaria maliRoberts)接种于PDA液体培养基中,28℃恒温摇床发酵6 d。发酵液除去菌丝体后60℃减压浓缩至原体积的1/4并加入三倍体积95%乙醇,4℃醇沉过夜。离心收集沉淀,超纯水复溶得到胞外粗多糖溶液,以Sevage法脱蛋白并旋蒸除去有机溶剂,D301-R阴离子交换树脂脱色,超纯水洗脱,收集洗脱液,选用截留分子量为3 500的透析袋,超纯水透析72 h后冷冻干燥即得到胞外粗多糖[13]。
2.2 分光光度法改用酶标仪法测定粗多糖含量[14]
2.2.1 葡萄糖标准溶液制备
精密称取105℃干燥至恒重的无水葡萄糖标准品200 mg,加入超纯水定容至1 000 mL,摇匀即得。
2.2.2 待测样品溶液制备
精密称取20 mg胞外粗多糖,加入超纯水定容至100 mL,摇匀即得。
2.2.3 蒽酮试剂的配制
称取蒽酮0.2 g,加入浓硫酸定容至100 mL,宜当日配制使用。
2.2.4 标准曲线绘制
显色反应:准确吸取葡萄糖标准溶液0、0.2、0.4、 0.6、0.8、1.0 mL(相当于葡萄糖0、0.04、0.08、0.12、0.16、0.2 mg)于10 mL加塞试管中,超纯水补足至1 mL。各试管分别准确加入0.2%蒽酮试剂4.0 mL,摇匀,于冰水浴中冷却后移至沸水浴中反应10 min,取出置冰水浴10 min。
分光光度法:以空白(0 mg葡萄糖)做参比,采用可见分光光度计在625 nm波长下比色,测定各管溶液的光密度值(OD),以葡萄糖浓度为横坐标,光密度值为纵坐标,绘制标准曲线。
酶标仪法:各反应试管分别准确吸取200 μL至96孔单条可拆酶标板,使用酶标仪于625 nm波长处测定吸光度值并以葡萄糖浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
2.2.5 样品的测定
准确吸取待测样品溶液1.0 mL于10 mL加塞试管中,按2.2.4方法进行显色反应,并于625 nm波长处采用酶标仪法及分光光度法分别测定吸光度,根据标准曲线计算多糖含量。
2.3 测定方法评价
2.3.1 稳定性试验
将0.2 mg·mL-1的葡萄糖标准溶液依次稀释为0.02、0.04、0.08、0.12、0.16、0.2 mg·mL-1,6个梯度,各重复3次。准确吸取样品溶液与此6个梯度葡萄糖储备液各1 mL按2.2.4方法进行显色反应,并于0~120 min内每隔20 min进行测定,625 nm下采用酶标仪法测定吸光度,记录并分析数据。
2.3.2 重复性试验
分别取样品溶液、0.08 mg·mL-1葡萄糖溶液各5份,每份1 mL按2.2.4方法进行显色反应,625 nm下采用酶标仪法测定吸光度,记录并分析数据。
2.3.3 加标回收率试验
设置7个实验组,每组加0.5 mL样品溶液,然后分别加入0、0.02、0.04、0.08、0.12、0.16、0.2 mg·mL-1葡萄糖溶液各0.5 mL按2.2.4方法进行显色反应,各重复3次,625 nm下采用酶标仪法测定吸光度,记录并分析数据。
2.4 酶标仪法测定苹果链格孢菌胞外多糖稳定性影响因素
采用蒽酮硫酸法,以全波长酶标仪代替可见分光光度计在625 nm波长下测定苹果链格孢菌胞外多糖在不同温度、光照、pH值和金属离子条件下的稳定性[15]。
2.4.1 温度条件
取苹果链格孢菌胞外多糖溶液(经0.45 μm滤膜过滤)各1.5 mL至离心管中,封口避光条件下分别于20、30、40、50、60、70、80℃恒温水浴1 h,各重复3次,酶标仪法测定吸光度。
2.4.2 光照条件
取苹果链格孢菌胞外多糖溶液(经0.45 μm滤膜过滤)各1.5 mL至离心管中,封口室温条件下分别光照0、1、2、3、4、5、6 d,对照组避光放置,各重复3次,酶标仪法测定吸光度。
2.4.3 pH条件
取苹果链格孢菌胞外多糖溶液(经0.45 μm滤膜过滤)各2 mL至离心管中,室温下用0.1 mol·L-1HCl和0.1 mol·L-1NaOH分别调节pH至2、4、6、8、10、12,各重复3次,酶标仪法测定吸光度。
2.4.4 金属离子条件
取苹果链格孢菌胞外多糖溶液(经0.45 μm滤膜过滤)各1 mL至离心管中,分别加入离子浓度为0.05 mol·L-1的NaCl、KCl、AlCl3、FeCl3、CaCl2、CuSO4、MgSO4溶液4 mL,各重复3次,酶标仪法测定吸光度。
2.5 统计学处理
采用SPSS13.0统计软件,以t检验分析组间显著性差异,P<0.05表示有统计学意义。
3 试验结果
3.1 两种测定方法的葡萄糖浓度-吸光度标准曲线的回归方程比较
采用酶标仪法于625 nm测定溶液吸光值,根据标准葡萄糖浓度-吸光度绘制标准曲线,回归方程为Y=3.816 4x+0.005 1,R2=0.999 7(n=6),葡萄糖溶液浓度在0~0.2 mg·mL-1范围内,酶标仪法线性关系良好。
采分光光度法于625 nm测定溶液吸光值,根据标准葡萄糖浓度-光密度绘制标准曲线,回归方程为Y=6.467 1x+0.005,R2=0.999 9(n=6),葡萄糖溶液浓度在0~0.2 mg·mL-1范围内,分光光度法线性关系良好。
根据酶标仪法计算得到多糖含量为0.0748mg·mL-1,根据分光光度法计算得到多糖含量为0.075 4 mg·mL-1,两种方法测定同一样品结果相近。
3.2 酶标仪法测定方法的评价结果
3.2.1 酶标仪法测定苹果链格孢菌胞外多糖的稳定性
根据测定的各溶液显色反应后的吸光值,计算各溶液中的葡萄糖含量,然后计算各组的SD值及RSD值,结果见表1。

表1 酶标仪法测定苹果链格孢菌胞外多糖的稳定性Table 1Stability of the determination of Alternaria mali Roberts exopolysaccharides content by multiskan spectrum
各组的RSD值均小于3%,说明0~120 min内酶标仪测定出各溶液的吸光度是稳定的,测定值不因显色反应后放置时间的增加而发生明显变化,该方法的稳定性较高。
3.2.2 酶标仪法测定苹果链格孢菌胞外多糖的重复性
根据测定的吸光值,计算样品溶液、葡萄糖储备液中的葡萄糖含量,结果见表2。

表2 酶标仪法测定苹果链格孢菌胞外多糖的重复性Table 2Reproducibility of the determination of Alternaria mali Roberts exopolysaccharides content by multiskan spectrum
从试验结果来看,5组重复下的试验结果很接近,且RSD值均小于3%,说明该方法具有良好的重复性。
3.2.3 加标回收率试验结果
根据测定的7组吸光值,计算各组的糖含量,进一步计算各组的回收率,结果见表3。
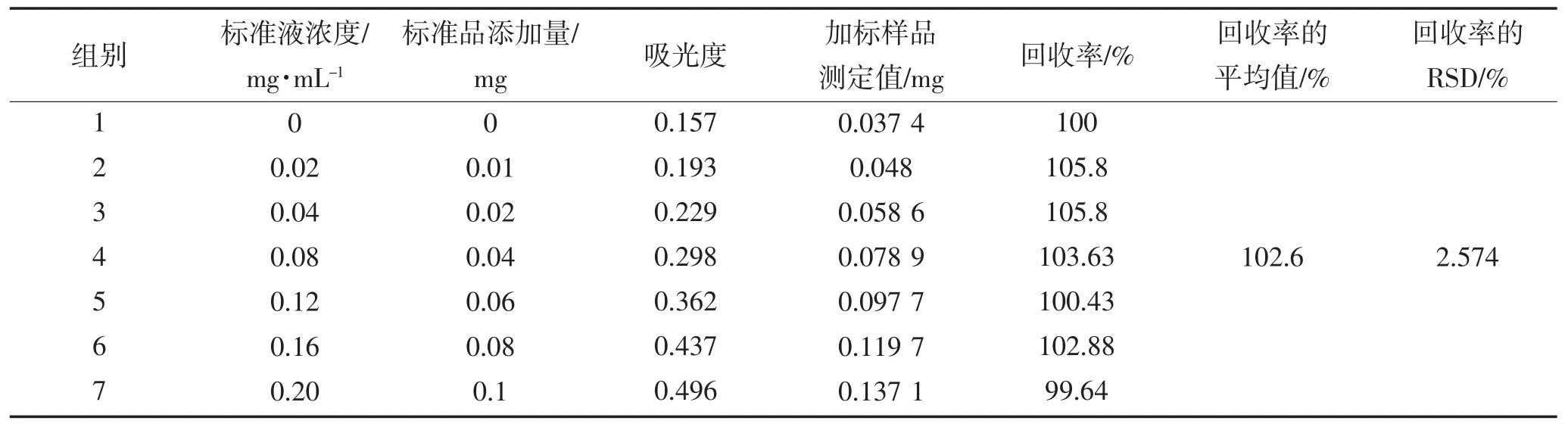
表3 加标回收率实验结果Table 3The recovery of standard addition
7组加标回收率实验的平均值为102.6%,RSD为2.574%,说明这种方法有较高的回收率,准确度较高。通过以上稳定性、重复性、加标回收率实验的结果可以看出,酶标仪法具有较高的稳定性、重复性和回收率,这种方法应用于测定多糖含量,有较高的准确性。
3.3 苹果链格孢菌胞外多糖稳定性影响因素
3.3.1 温度对多糖稳定性的影响
由图1可知,不同温度处理后多糖溶液吸光度值变化不明显(与20℃组相比,P>0.05),苹果链格孢菌胞外多糖的热稳定性较好。

图1 温度对多糖稳定性的影响(n=3,P>0.05 vs 20℃组,*P<0.05 vs 20℃组)Fig.1Effects of temperature on the polysaccharide stability(n=3,P>0.05 vs 20℃group,*P<0.05 vs 20℃group)
3.3.2 光照对多糖稳定性的影响
由图2可知,通过对比光照及避光条件下多糖水溶液吸光度的变化,光照条件可加速多糖的某些反应过程(氧化或腐败等),起到一定的催化作用。
3.3.3 pH对多糖稳定性的影响
由图3可知,苹果链格孢菌胞外多糖在pH>8的碱性条件下吸光度增加(pH=10,12时,P<0.01),或由于在碱性条件下糖分子通过烯醇化和异构化作用使得单糖组成发生变化,进而影响其吸光度,使吸光度上升,碱性进一步增加则可破坏糖分子结构使得吸光度下降。在pH<4的酸性条件下吸光度也有增加(pH=2时,P<0.05),但在常温条件下酸对糖分子的稳定性影响小于碱的影响。因此糖分子宜在弱酸条件下保存,而这与试验中测得的苹果链格孢菌胞外多糖pH约为6.7相一致。
3.3.4 金属离子对多糖稳定性的影响
由图4可知,加入金属离子溶液后,K+、Al3+、Ca2+、Mg2+使吸光度稍有降低(n=3,*P<0.05 vs Na+组),Cu2+、Fe3+使吸光度明显降低(n=3,**P<0.01 vs Na+组),可能与多糖与Cu2+、Fe3+间的络合作用有关,试验结果表明,大多数金属离子对苹果链格孢菌胞外多糖有一定影响。
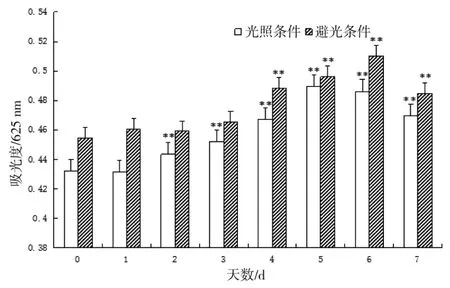
图2 光照对多糖稳定性的影响(n=3,**P<0.01 vs 0天组)Fig.2Effects of sunlight on the polysaccharide stability(n=3,**P<0.01 vs 0 d group)

图3 pH对多糖稳定性影响(n=6,*P<0.05 vs pH=6组,**P<0.01 vs pH=6组)Fig.3Effects of pH on the polysaccharide stability(n=6,*P<0.05 vs pH=6 group,**P<0.01 vs pH=6 group)
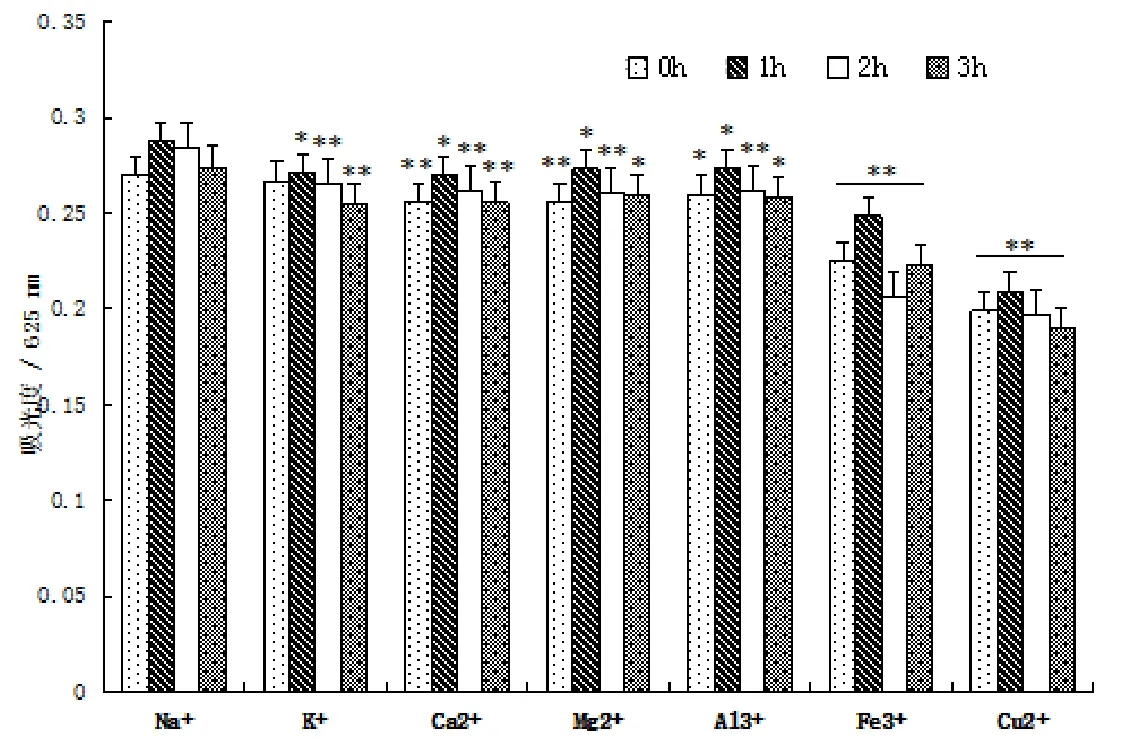
图4 金属离子对多糖稳定性影响(n=3,*P<0.05 vs Na+组,**P<0.01 vs Na+组)Fig.4Effects of metal ions on the polysaccharide stability(n=3,*P<0.05 vs Na+group,**P<0.01 vs Na+group)
4 结论
以上试验表明,分光光度法改用酶标仪法测定多糖含量,其线性关系良好,稳定性及精密度较好,且具有可重复性,可用于苹果链格孢菌胞外多糖的含量测定。改进后的蒽酮法其操作更加简便,无需更换及清洗比色皿,适用于大样本测量分析。每次测定所消耗的样品量较少,仅需200 μL即可,96孔板代替比色皿,可同时测定多个样品,避免因操作时间过长所引起的误差。但在实验过程中也需注意多个问题:蒽酮在光照条件下不稳定,蒽酮试剂需现用现配且注意避光保存;浓硫酸易吸水需注意周围环境影响,操作需快速准确;由于每次测定的加样量较少,需注意操作带来的误差,加入液体时应避免产生汽泡,液面高度一致,且注意保证板孔内的清洁。
苹果链格孢菌胞外多糖的热稳定性较好,酸碱稳定性较差,应避免与强酸碱溶液混合,多数金属离子均对多糖的稳定性有一定的影响,Cu2+、Fe3+影响最大,多糖溶液应尽量避免存储于金属容器中,光照对多糖自身稳定性影响不大,但可催化加快多糖的其他化学变化过程(氧化或者腐败等),其原因尚不明确,还需进一步探讨。
通过对传统多糖含量测定方法进行改进,可简化其操作,更适合大样本的分析,且通过对苹果链格孢菌胞外多糖稳定性进行测定,可为苹果链格孢菌胞外多糖的研究利用奠定基础。
[1]Zhu L,Cao J F,Chen K S,et al.Anti-tumor and immunomodulatory activities of an exopolysaccharide from Rhizopus nigricans on CT26 tumor-bearing mice[J].Int Immunopharmacol,2016,36:218-224.
[2]Wang Z Y,Zhao Y Y,Su T T.Extraction and antioxidant activity of polysaccharides from Rana chensinensis skin[J].Carbohydrate Polymers,2015,115:25-31.
[3]Jia D,Rao C G,Xue S X,et al.Purification,characterization and neuroprotective effects of a polysaccharide from Gynostemma pentaphyllum[J].Carbohydrate Polymers,2015,122:93-100.
[4]林俊,李萍,陈靠山.近5年多糖抗肿瘤活性研究进展[J].中国中药杂志,2013,38(8):1116-1125.
[5]毛淑敏,许家珍,周帅飞,等.苯酚-硫酸法联合DNS法测定金银花不同花期多糖的含量[J].中南药学,2015,13(1):65-67.
[6]伍时华,张健,方杰,等.地衣酚法定量测定发酵液中D-核糖的研究[J].广西工学院学报,2000,11(4):55-58+62.
[7]胡金明,李宏平,郑洪南,等.乌梅丸水提液中多糖理化性质分析及预防结肠炎的作用[J].现代生物医学进展,2015,15(34):6653-6658.
[8]王立东,冯丹丹,吴桐,等.香菇中水溶性多糖的提取工艺研究[J].黑龙江八一农垦大学学报,2015,27(2):65-68.
[9]吴静芬,张媛媛,吉中强,等.半夏多糖的含量测定[J].中国中医药信息杂志,2006,13(10):54-55.
[10]喻亚飞,刘应蛟,徐贝,等.两种玉竹多糖含量测定方法的比较研究[C]//.第四届中国中药商品学术大会暨中药鉴定学科教学改革与教材建设研讨会论文集.北京:中国商品学会,2015:139-142.
[11]苏颖,周选围.苯酚-硫酸法改用全波长酶标仪快速测定虫草多糖含量[C]//.中国菌物学会、中国科学院微生物所.第八届海峡两岸菌物学学术研讨会论文集.北京:中国菌物学会、中国科学院微生物所,2007:186-192.
[12]赵艳,毕荣宇,牟德华.利用酶标仪测定6种食用菌中多糖含量[J].食用菌,2013,35(1):59-61.
[13]魏广金.拟康氏木霉胞外多糖的分离、纯化及生物学活性研究[D].济南:山东大学,2007.
[14]张晓静.硫酸蒽酮法测定半夏多糖的含量研究[J].中国医药指南,2012,10(19):120-121.
[15]史娟,李红英.甘蔗叶多糖稳定性影响因素的测定[J].贵州农业科学,2014,42(9):72-74.
Stability of the Alternaria mali Roberts Exopolysaccharides and the Change from Spectrophotometer to Multiskan Spectrum
Fang Fang1,Liu Chunyan1,Chen Kaoshan1,2,Yuan Pingchuan1,Wang Hao1
(1.Wannan Medical College,Wuhu 241000;2.Shandong University)
In order to find an efficient,quick and stable method for determination ofAlternaria maliRoberts exopolysaccharides,the content and stability of exopolysaccharides in light condition,different temperature,pH,metal ions were studied by a multiskan spectrum microplate spectrophotometer.The results showed that the method for mensurating the exopolysaccharide content by multiskan spectrum had good linear relationship,stability and repeatability,the operation was simple and suitable for large sample measurement and analysis.TheAlternaria maliRoberts exopolysaccharides had better thermal stability at 20-80℃and remained stable in weak acid(pH=6)and Na+ion solution,strong acid and alkali solution or Cu2+、Fe3+ions had an impact on the stability of exopolysaccharides,the light could also influence the stability.
exopolysaccharides;anthrone-sulfuric acid method;stability;spectrophotometry;Multiskan Spectrum
Q539
A
1002-2090(2017)04-0072-06
10.3969/j.issn.1002-2090.2017.04.016
2016-08-23
安徽省自然科学基金(1408085MH197);安徽省教育厅重点项目(KJ2015A199);大学生科研资助金(WK2015S23)。
房芳(1996-),女,皖南医学院2014级硕士研究生。
陈靠山,男,教授,博士研究生导师,E-mail:ksc313@126.com。

