超声辅助变压滚揉对鸡肉蛋白质结构及含水量的影响
李 鹏,王红提,孙京新※,冯 婷(. 青岛农业大学食品科学与工程学院,青岛 6609;. 青岛农业大学机电工程学院,青岛 6609)
超声辅助变压滚揉对鸡肉蛋白质结构及含水量的影响
李 鹏1,王红提2,孙京新1※,冯 婷1
(1. 青岛农业大学食品科学与工程学院,青岛 266109;2. 青岛农业大学机电工程学院,青岛 266109)
为了探讨超声辅助变压滚揉对原料肉腌制过程蛋白质结构及水分含量的影响,该研究以鸡胸肉为原料分别进行静置腌制(对照)、真空滚揉(vacuum tumbling,VT)腌制和超声辅助变压滚揉(pressure-transform tumbling curing assisted by ultrasound,PTU)腌制处理100 min,采用拉曼光谱、低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)、扫描电镜(scanning electron microscopy,SEM)和透射电镜(transmission electron microscope,TEM)测定不同腌制处理后鸡肉肌原纤维蛋白的二级结构、肌肉中水分含量以及肌肉组织微观结构的变化。结果显示,经过VT和PTU腌制处理的鸡肉其各项指标较对照组均发生显著变化(P<0.05),其中拉曼光谱分析显示PTU处理的鸡肉肌原纤维蛋白质二级结构组成发生更显著变化,α-螺旋含量降低(P<0.05),β-折叠和β-转角的含量显著增加(P<0.05);LF-NMR结果显示PTU处理的鸡肉的结合水横向弛豫时间和不易流动水横向弛豫时间较VT处理显著减小(P<0.05),而对应的结合水峰面积百分比和不易流动水峰面积百分比都较其他处理组增加(P<0.05)。扫描电镜和透射电镜研究结果也显示经PTU处理的鸡肉组织结构破坏最严重,Z线以及肌原纤维膜降解最为明显。综上,PTU处理能够通过改变蛋白质结构、水分存在状态分布以及微观结构的变化来加速原料鸡肉腌制效率,改善嫩度和提高保水性;研究结果为PTU技术在肉制品加工中的应用及相关设备的开发提供理论依据。
蛋白质;水分;微观结构;鸡肉;超声辅助变压滚揉;真空滚揉
0 引 言
鸡肉以其低脂肪、低胆固醇,高蛋白质含量等特点越来越受到消费者的青睐。随着生活水平的提高,人们对鸡肉类食用品质的要求也越来越高,因此研究鸡肉产品的开发,生产工艺的改进,品质的提升等成为鸡肉加工业的热点[1]。在鸡肉制品加工过程中,滚揉是最常用的一种加工方法[2],它能够促进腌制、缩短生产周期,改善产品的嫩度、口感,提高产品保水性和出品率[3-4]。
目前生产中最常用的滚揉方式是真空滚揉,传统真空滚揉受真空度和温度等条件的影响,如果控制不当,容易造成耗时长、肉块温度升高、微生物快速繁殖、颜色劣变以及过度失水等风险[5-7]。变压滚揉是近几年提出来的一种新的滚揉方式,是指在滚揉过程中通过调整滚筒内的压力,主要是以加压和常压为主,使肉块交替处于压迫和疏张状态,造成肉组织呈现一种呼吸模式,从而有利于盐溶性蛋白的释放和腌制液的渗透,提高滚揉腌制效果[8-9]。但是加压滚揉对于滚揉设备的要求比较高,需要使用专门的耐高压材料和质量高的气体,这也增加了生产成本和不方便性,因此目前也处于研究阶段。超声波技术是一种新兴的高效、环保、绿色加工技术,目前超声波技术在肉品加工领域也有一定的应用,并且取得良好的效果,如能够加速肉制品的腌制速率、加快肌原纤维的断裂、改善产品的嫩度等[10-11],其主要作用机理是通过超声波的空穴作用导致组织的物理性破坏从而发挥作用[12]。超声波处理也容易导致物料的升温,因此在使用过程应该控制超声时间和强度,McDonnell等[13]在对超声波促进猪肉的腌制过程中,通过在容器中安置冷却管来降温,以防止温度上升导致的产品品质下降。
因此,本研究结合不同滚揉腌制技术的特点,从提高腌制效率和改善产品食用品质的角度出发,设计了一款具有可实施性、成本较低、使用方便的超声辅助变压滚揉设备,通过测定滚揉后鸡肉蛋白质的结构、水分存在状态以及微观结构的变化,来评价该技术在肉制品滚揉腌制过程中作用效果,并且揭示其作用机理,从而为这一技术在肉制品工业化生产中的应用及相关设备的开发提供理论依据和技术参考。
1 材料与方法
1.1 材料
新鲜鸡胸肉:青岛正大食品有限公司;食盐、复合磷酸盐、抗坏血酸钠、亚硝酸钠等辅料均为食品级;戊二醛、磷酸盐、乙醇、叔丁醇、四氧化锇等均为分析纯。
1.2 仪器设备
GR-20型滚揉机,诸城市新得利食品机械有限责任公司;JM1003超声波振动棒,深圳市日康达创超声波有限公司;超声辅助变压滚揉机,将同样的一台GR-20型滚揉机进行改造,在滚揉机底部增加超声波振动棒(40 kHz,140 W,如图1所示;本实验室自主设计制造);HH-S6型恒温水浴锅,金坛市恒丰仪器厂;Acculab型电子天平,赛多利斯科学仪器(北京)有限公司;JY Labram HR800显微激光拉曼光谱仪,法国Jobin-Yvon公司;PQ001台式低场核磁共振分析仪,苏州纽迈分析仪器股份有限公司;Eiko IB.5型离子溅射镀膜机,日本Hitachi公司;7500F扫描电子显微镜,日本电子株式会社;Leica EM UC7超薄切片机,德国莱卡仪器有限公司;HT7700日立透射电子显微镜,日本日立高新技术公司。
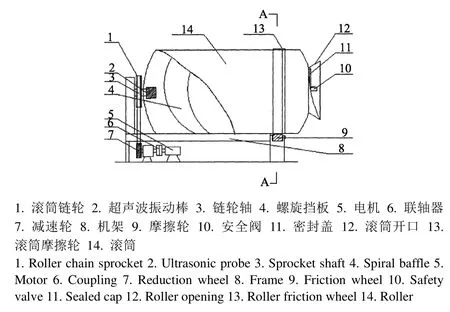
图1 超声辅助变压滚揉机示意图Fig.1 Schematic diagram of experimental set-up for pressure-transform tumbling assisted by ultrasound
1.3 方法
1.3.1 腌制液的配制
参考冯婷等[11]的方法,略有修改。腌制液的配方(以原料肉质量计算)为食盐2%、复合磷酸盐0.3%、抗坏血酸钠250 mg/kg、亚硝酸钠150 mg/kg。配制完后,腌制液先进行预冷,温度控制在0 ℃左右,待用。
1.3.2 肉样的处理
新鲜鸡胸肉去除筋、腱、脂肪后切成大小、形状规格基本一致的肉块样品((50±1)g,5 cm×5 cm×2 cm),随机等量分为3组,腌制处理参考苑瑞生[2]和Siró等[3]的方法,略作修改,每个处理重复3次。具体方法如下:
静置腌制(对照组):0~4 ℃低温库中,将其中一组鸡肉样品与腌制液混匀(料液比100∶30 g/mL),置于不锈钢容器静置腌制100 min。
真空滚揉(vacuum tumbling,VT)处理:0~4 ℃低温库中,将其中一组鸡肉样品与腌制液(料液比100∶30 g/mL)一起倒入滚揉机内,设定真空度为0.08 MPa,转速16 r/min,单向连续真空滚揉100 min。
超声辅助变压滚揉(pressure-transform tumbling assisted by ultrasound,PTU)处理:将鸡肉样品与腌制液(料液比100∶30 g/mL)倒入自主设计制作的超声波辅助变压滚揉机内,滚揉程序设计为:0~4 ℃低温库中,真空度为0.08 MPa,转速16 r/min,单向连续滚揉15 min后停止滚揉;立刻去掉真空恢复常压,同时启动超声程序处理5 min后停止;再重复上述操作周期4次,总共处理时间为100 min。
1.3.3 拉曼光谱分析
参照谢媚等[7]的方法分别提取经3组不同处理100 min后的鸡肉样品的肌原纤维蛋白。将提取到的肌原纤维蛋白稀释到40 μg/mL,置于4 ℃冰箱中短期保存,用于拉曼光谱分析。
肌原纤维蛋白的拉曼光谱采用配备514.5 nm氩离子激光的Labram HR 800激光拉曼分析仪进行测试,参数设定参考Xu等[14]的研究方法。每个样品测试3次。测试完成后用仪器自带的软件Labspec对光谱进行平滑,多点基线校正去除荧光背景。根据苯丙氨酸环在1 003 cm-1伸缩振动强度作为内标进行归一化(它的强度不随蛋白质结构变化而变化),肽键骨架振动和氨基酸侧链光谱条带指认通过与文献报道[7,14]的多肽和蛋白质拉曼光谱相比对而得到。蛋白质二级结构(α-螺旋、无规则卷曲、β-折叠、β-转角及其他结构)含量计算参考Alix等的方法[15]。
1.3.4 低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)分析
参考Han等[16]的方法,略加修改。本试验LF-NMR驰豫时间(T2)测量在NMR PQ001分析仪上进行。测试条件为:质子共振频率为22.6 MHz,测量温度为32 ℃。称取大小为0.5 cm×0.5 cm×0.5 cm的肉样0.5~0.6 g,放入直径15 mm的核磁管,而后放入分析仪中。NMR横向驰豫时间T2选用硬脉冲CPMG序列(carr-purcell-meiboom-gill sequence)进行测量。所使用的参数为:τ值(90°脉冲和180°脉冲之间的时间)为50 μs。重复扫描20次,重复间隔时间为1 s得到3 000个回波。
1.3.5 扫描电镜(scanning electron microscopy,SEM)
参考Palka等[17]的方法,并作适当修改。将3种经不同处理的肉样分别切成0.5 cm×0.5 cm×0.3 cm的小肉块,置于质量分数为2.5%戊二醛溶液中,4 ℃固定3 d后,用0.1 mol/L的磷酸盐缓冲液(pH值7.4)漂洗5~6次,每次20 min。再将肉样放入用0.2 mol/L的磷酸缓冲液(pH值7.4)配制的1%四氧化锇溶液中,4 ℃中固定2 h,然后再用0.1 mol/L的磷酸缓冲液(pH值7.4)漂洗5~6次,每次10 min;漂洗后的肉样依次用50%、70%、80%和90%的乙醇梯度脱水各15 min,100%乙醇脱水3次,每次30 min;样品脱水后,用叔丁醇置换3次,每次30 min。脱水后的样品在液氮中冷冻断裂后放入超临界CO2干燥仪中干燥,然后将样品观察面向上贴在扫描电镜样品台上,用Eiko IB.5离子溅射镀膜机对肉样进行喷金处理,最后在7500F扫描电子显微镜下(电压为15.0 kV)下放大1 000倍观察肌纤维结构的变化。
1.3.6 透射电镜(transmission electron microscope,TEM)
参考闵辉辉等[18]的方法,并稍作修改。将3种经不同处理的肉样分别切成0.2 cm×0.2 cm×0.2 cm的小肉块,立即置于质量分数为2.5%戊二醛溶液中,4 ℃条件下固定3 d;然后用0.1 mol/L的磷酸缓冲液(pH值7.4)漂洗5~6次,每次20 min;再将肉样放入用0.2 mol/L的磷酸缓冲液(pH值7.4)配制的1%四氧化锇溶液中,在4 ℃条件下固定2 h,然后再用0.1 mol/L的磷酸缓冲液(pH值7.4)漂洗5~6次,每次10 min;分别用体积分数为50%、70%、80%、90%、100%乙醇溶液进行逐级脱水,每次10~15 min,其中100%乙醇脱水3次,其他浓度各1次;用100%乙醇∶100%丙酮=1∶1溶液、100%纯丙酮各置换1次,每次10 min;置换后的样品于Epon-812环氧树脂和丙酮等体积混合液中渗透4 h,再在Epon-812环氧树脂中渗透过夜,然后用Epon-812环氧树脂将样品进行包埋;利用Leica EM UC7超薄切片机进行切片处理;切片利用醋酸双氧铀-柠檬酸铅双重染色,自然干燥后在HT7700日立透射电子显微镜下观察拍照,放大4 000倍观察肌原纤维的超微结构的变化。
1.3.7 统计分析
采用SPASS 19.0软件进行方差分析,并用多重比较分析法进行比较,每个试验最少为3次平行,结果均表示为平均值±标准偏差。
2 结果与分析
2.1 不同滚揉处理对鸡肉蛋白拉曼光谱的影响
2.1.1 鸡肉肌原纤维蛋白拉曼光谱条带的指认
拉曼光谱条带可以提供肽的骨架构象信息,其中酰胺I和酰胺Ⅲ的骨架振动模式与二级结构的含量变化有密切关系[7,14]。图2是鸡肉样品肌原纤维蛋白的拉曼光谱图,通过与文献报道[14,19]的多肽和蛋白质拉曼光谱比对,可以对肽键骨架振动和氨基酸侧链光谱条带进行指认,结果如表1所示。

图2 不同滚揉处理后鸡肉蛋白质结构的拉曼光谱图Fig.2 Raman spectra in 700-2 000 cm-1region of protein structure in chicken treated by different tumbling treatments

表1 鸡肉肌原纤维蛋白质拉曼光谱条带的指认Table 1 Assignment of some Raman bands of chicken myofibrillar protein
2.1.2 从酰胺Ⅰ分析鸡肉滚揉处理过程中肌原纤维蛋白二级结构的变化
由于拉曼光谱的酰胺Ⅰ带和酰胺Ⅲ带极少受到其他分子群的干扰,因此,其具有较强的拉曼效应,是分析鉴定蛋白质二级结构的可靠模型;蛋白质的二级结构主要包括α-螺旋、β-折叠、β-转角和无规则卷曲这几种形式[20]。在范围1 645~1 690 cm-1的谱带归属于酰胺Ⅰ带,一般而言,α-螺旋含量高的蛋白质的酰胺Ⅰ带主要集中在1 645~1 657 cm-1拉曼光谱的条带中心区域;以β-折叠结构为主的条带主要在1 665~1 680 cm-1;β-转角含量高的蛋白质在1 680 cm-1附近;无规则卷曲结构在1 660~1 665 cm-1附近[21]。由图2可以看出,鸡肉在滚揉加工处理后,酰胺Ⅰ带最大峰位置发生偏移,静置腌制处理时最大峰出现在1 656.01 cm-1处,而经VT和PTU处理后分别变为1 659.15 cm-1和1 662.78 cm-1,这可能与蛋白质二级结构中的α-螺旋含量减少和β-折叠含量增加有关,这与谢媚等[7]的研究关于不同滚揉程度对鹅肉肌原纤维蛋白结构影响的结果相一致。此外,拉曼光谱的酰胺Ⅲ带也是分析蛋白质二级结构变化的重要条带,其条带主要分布在1 230-1 350 cm-1之间,主要是由C-N的伸缩振动和N-H平面内的弯曲引起[22-23]。在酰胺Ⅲ带中,表征不同结构的条带有部分重合的区域,高α-螺旋含量的蛋白质主要在1 260~1 300 cm-1处,与β-转角存在重合区域;β-折叠在1 238~1 245 cm-1处;无规则卷曲结构出现在1 250 cm-1处[22]。由图2可见,鸡肉经滚揉处理后,酰胺Ⅲ带最大峰位置出现一定的左移,其中PTU处理组左移程度相对较强。由此可见,滚揉可能是引起鸡肉肌原纤维蛋白α-螺旋结构变化的一个重要原因,而且PTU处理的尤为明显。原因可能是PTU能够更大程度地破坏维持α-螺旋结构稳定的氢键,使α-螺旋结构解开,又通过分子间暴露的疏水残基相互作用形成折叠结构或其他的转角、无规则卷曲结构[21]。
2.2 肌原纤维蛋白中二级结构的定量分析
参照Alix等[15]的方法计算了不同滚揉对鸡肉肌原纤维蛋白二级结构的影响,结果见表2,可以看出VT和PTU处理组较对照组,其蛋白质二级结构有显著变化(P< 0.05)。对照组鸡肉蛋白的α-螺旋结构相对含量为77.97%,而经过VT和PTU处理的分别降至58.71%和30.22%,显著低于对照组(P<0.05);而β-折叠和β-转角含量,PTU处理组显著高于VT和对照组(P< 0.05)。这表明滚揉处理导致鸡肉蛋白的α-螺旋向β-折叠、β-转角和无规则卷曲结构发生转化,而且这些变化与酰胺I带最大峰偏移的结果相吻合(由图2可见)。有研究报道[7,24],滚揉的摔打作用和超声波的“空化效应”对肉的组织结构会产生一定的整体性破坏,导致部分蛋白质长链发生断裂,从而使其二级结构发生改变。肌肉蛋白质构象变化这一现象广泛存在于肉制品的生产加工过程中,对产品的蛋白质凝胶特性、质构、风味等加工特性会产生一定的影响,曹莹莹[25]在研究鸡肉蛋白质凝胶时发现,当蛋白质分子结构中β-折叠或者无规则卷曲比例提高时,其凝胶性和保水性较强;而当蛋白质分子中α-螺旋增加时,凝胶性和保水性有所降低。Liu等[26]在研究蛋白质结构对鱼肉和猪肉凝胶性的影响时,也证实β-折叠构象的形成有益于蛋白质凝胶的形成。此外,Li等[27]在对鸡肉蛋白悬浮液进行超声处理的研究中发现超声处理能够降低鸡肉蛋白质的α-螺旋结构含量,增加β-折叠、β-转角和无规则卷曲结构的含量,而且能够提高鸡肉保水性和凝胶性等加工特性。由此可以推断,在肉制品加工过程,通过超声辅助变压滚揉腌制技术对于改善产品的加工特性和食用品质具有积极的作用,同时也能够提高企业的经济效益。
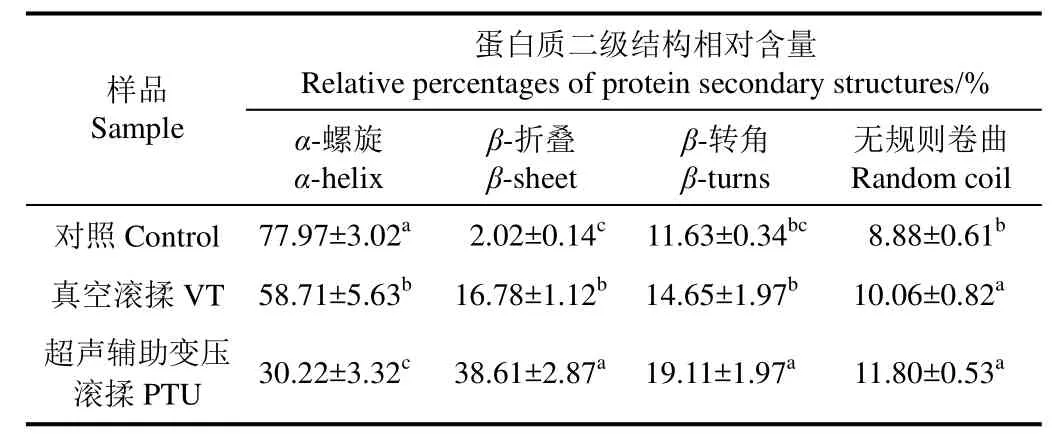
表2 不同滚揉处理对鸡肉蛋白质二级结构含量的影响Table 2 Relative percentages of protein secondary structures of chicken by different tumbling treatments
2.3 不同滚揉处理对鸡肉水分状态的影响
利用低场核磁共振技术(LF-NMR)测定不同滚揉腌制处理下鸡肉横向弛豫T2结果如图3所示。图中在1~1 000 ms的弛豫时间内每个曲线上都有4个波峰,分别代表鸡肉样品中水分存在的4种不同形态。其中横坐标是横向弛豫时间T2,表征水分的流动性,可用来检测肉中水分子的移动和分离状态。弛豫时间越短,表明水与底物结合程度越紧密;驰豫时间越长,水与底物结合的越疏松,水分越自由[28-29]。从图3可以看出,在0.1~1.5 ms的位置有1个小峰,为T20峰;在2~10 ms左右有1个小峰,为T21峰;在10~100 ms处出现1个较大的峰,为T22峰;100~1 000 ms处也有一个很小的峰出现,为T23峰,这与闵辉辉等[18]研究不同电压击晕鸡肉的LF-NMR结果基本一致。一般认为T20和T21代表的是与蛋白质等大分子相结合的结合水; T22代表了肌肉中存在于肌原纤维与膜之间的不易流动水。如图所示,T22的峰为主峰,其信号幅值占总信号的90%左右,表明不同腌制过程的鸡肉组织中水分的主要存在形态为不易流动水,这部分水与肉的保水性具有极强的相关性,对于肉和肉制品的加工特性、产量及经济效益有很重要的影响;T23代表了细胞外的间隙中能自由流动的自由水,这部分水所占比例比较低,也是在加工贮藏过程中最容易失去的[30]。从图3和表3中还可以看出,3组不同处理鸡肉的水分形态及分布存在差异,除代表结合水的T20时间差异不显著(P>0.05);经PTU处理后的鸡肉T21和T22都显著低于VT处理的(P<0.05)。有研究表明[31],弛豫时间T2可以间接表明水分的自由度,T2越短表明水与底物结合越紧密,保水性越好;T2时间越长表明水分越自由,保水性越差。

图3 不同滚揉处理对鸡肉横向弛豫时间T2的影响Fig.3 Effects of different tumbling treatment on T2relaxation time of chicken samples

表3 不同滚揉处理对鸡肉弛豫时间T2分布和峰面积的影响Table 3 Effects of different tumbling treatment on distribution and area proportion of T2relaxation time of chicken samples
不同滚揉处理对鸡肉弛豫时间T2及其对应峰面积P2的影响结果如表3所示。其中P20、P21、P22和P23分别表示弛豫时间T20、T21、T22和T23的弛豫峰面积百分比,其变化可以表征经不同滚揉处理后各种状态水分的含量变化情况。经过滚揉处理的鸡肉样品的横向弛豫时间T21和T23所对应峰面积所占比例P21和P23较对照组样品发生显著变化(P<0.05),PTU处理组的P21最大,P23基本消失;其P22值也最大,但与其他两组比较差异不显著(P>0.05)。这可能是由于PTU处理时,一方面由于超声波促进了食盐等腌制液的渗透,提高了肌肉组织的渗透压,使得肉中的自由水分逐渐渗出,因此P23峰面积降低;另一方面PTU处理时,其中机械摩擦能够破坏更多的肌肉蛋白质高级结构,使其更加松散,从而容纳更多的结合水和不易流动水[24]。本研究的拉曼光谱结果也证明了PTU处理能够加快肌原纤维蛋白结构的变化。Straadt等[32]和Li等[33]研究也发现通过提高肌肉的横向弛豫时间T2对应的面积,特别是不易流动水部分的面积,有助于提高肉和肉制品的保水性,改善产品品质,同时增加出品率、提高经济效益。
2.4 不同滚揉处理的鸡肉肌原纤维扫描电镜结果
分别对不同腌制处理100 min后的鸡肉样品组织进行扫描电镜观察,结果如图4所示。可以看出,不同处理组之间,肌肉微观结构差异比较大。对照组样品组织结构比较完整,肌纤维彼此平行排列且紧密、纤维间空隙较小,肌膜结构相对完整;VT处理的样品,其肌纤维大多数发生断裂,呈现交错、杂乱的排列,肌膜也受到严重的破坏,许多肌原纤维暴露出来;而经PTU处理的样品,其组织结构破坏最为严重,完整的肌纤维结构基本消失,肌纤维边界不清、排列混乱,而且暴露的肌原纤维间空隙明显。结果表明滚揉的机械作用能够比较强烈的破坏鸡肉肌纤维以及肌原纤维结构的完整性,促使肌膜结构破裂,而且PTU处理组效果尤为明显,说明在超声波辅助作用下,较短时间的滚揉就能达到比较好的效果。Jayasooriya等[10]和Awad等[12]研究发现,由于超声波具有空化作用,使分子受迫振动,因此在肉品的加工和嫩化过程采用合理的超声波处理能够使肌纤维快速的压缩、收张以及加速相关蛋白酶的释放,从而导致完整的组织结构比较快的发生断裂和分解,提高肉的滚揉腌制效率。

图4 不同滚揉处理后鸡肉纤维扫描电镜图(×1 000倍)Fig.4 Scanning electron microscopy of myofiber of chicken treated by different tumbling treatments(×1 000 times)
2.5 不同滚揉处理的鸡肉肌原纤维透射电镜结果
图5为经过不同滚揉腌制处理100 min后所得样品的透射电镜图,由此可见,不同处理组之间微观结构情况与扫描电镜结构相一致,样品间差别比较明显。对照组肌肉结构破坏较轻,肌原纤维排列整齐,肌节相对完整,Z线、M线、I带和A带清晰可见。VT处理100 min后,有少量Z线排列开始出现错位,少量肌节长度有所增加并在Z线处发生断裂,部分肌原纤维膜发生降解,肌原纤维间间距增大,总体上说其组织结构已经有所破坏,但不是很严重。而经PTU处理后的样品,Z线排列不再整齐有序,大量肌节呈现弯曲变形状态,大量Z线蛋白和肌原纤维膜发生降解,肌原纤维发生断裂,肌纤维结构破坏严重,肌原纤维小片化程度大,肌原纤维之间间隙增大。史培磊等[34]在对鹅肉进行滚揉处理后,发现经过滚揉肌肉的微观结构发生了显著变化,Z线开始扭曲,部分发生裂解,这与本研究的结果一致。还有许多国内外研究也揭示了不同的高压处理或超声波处理都能够加速肌肉结构的破坏以及蛋白的降解,在肉品加工领域起到嫩化、促进腌制、改善口感和出品率等作用[10-11]。,因此,本研究的试验结果也能够反映PTU处理对于改善鸡肉制品的加工特性具有积极作用,比如提高腌制速度、嫩度和保水性等。
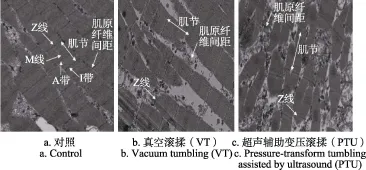
图5 不同滚揉处理后肌原纤维透射电镜图(×4 000倍)Fig.5 Transmission electron microscope of myofibril structure of chicken treated by different tumbling treatments (×4 000 times)
3 结 论
通过对鸡肉进行静置、真空滚揉和超声辅助变压滚揉3种腌制处理后,鸡肉的蛋白结构、水分存在状态以及微观结构存在显著的差异。经过相同的滚揉处理时间,超声辅助变压滚揉的鸡肉蛋白的α-螺旋结构比静置和真空滚揉处理显著降低(P<0.05),同时β-折叠和β-转角含量显著增加(P<0.05);超声辅助变压滚揉比真空滚揉处理显著降低了鸡肉中结合水横向弛豫时间T21和不易流动水弛豫时间T22(P<0.05),同时所对应的结合水峰面积P21也呈增加趋势(P<0.05),从而有助于提高鸡肉及其制品的保水性、改善产品品质。超声辅助变压滚揉也加速了肌纤维组织结构的破坏,导致肌原纤维蛋白以及肌原纤维膜的快速降解,有利于改善产品的食用品质。本研究为今后超声辅助变压滚揉腌制技术在畜禽肉制品深加工中的应用以及相关设备的开发提供了一定的理论依据。
[1] Yusop S M, O,Sullivan M G, Kerry J F, et al. Influence of processing method and holding time on the physical andsensory qualities of cooked marinated chicken breast fillets[J]. LWT-Food Science and Technology, 2012, 46(1): 363-370.
[2] 苑瑞生. 滚揉工艺对鸡肉调理制品食用品质影响的研究[D].泰安: 山东农业大学,2011. Yuan Ruisheng. Study of Tumbling Technology on the Edible Quality of Prepared Chicken[D]. Tai’an: Shandong Agricultural University, 2011. (in Chinese with English abstract)
[3] Siró I, Vén Cs, Balla Cs, et al. Application of an ultrasonic assisted curing technique for improving the diffusion of sodium chloride in porcine meat[J]. Journal of Food Engineering, 2009, 91(2): 353-362.
[4] 汤春辉,黄明,樊金山,等. 调理鸭胸肉制品滚揉腌制工艺优化[J]. 食品科学,2013,34(14):63-67. Tang Chunhui, Huang Ming, Fan Jinshan, et al. Optimization of vacuum tumbling conditions for prepared duck breast fillets[J]. Food Science, 2013, 34(14): 63-67. (in Chinese with English abstract)
[5] Szerman N, Gonzalez C B, Sancho A M, et al. Effect of whey protein concentrate and sodium chloride addition plus tumbling procedures on technological parameters, physicalproperties and visual appearance of sous vide cooked beef[J]. Meat Science, 2007, 76 (3): 463-473
[6] Patrascu L, Ianitchi D, Dobre I, et al. Effect of tumbling time and injection rate on the processing characteristics, tenderness and color of pork biceps femoris muscle[J]. Fascicle VI-Food Technology, 2011, 35(1): 9-18.
[7] 谢媚,曹锦轩,潘道东,等. 滚揉对成熟过程中鹅肉品质及其蛋白质结构的影响[J]. 现代食品科技,2014,30(10):205-211. Xie Mei, Cao Jinxuan, Pan Daodong, et al. Influence of different tumbling methods on meat quality and protein structure of goose muscle during postmortem aging[J]. Modern Food Science and Technology, 2014, 30(10): 205-211. (in Chinese with English abstract)
[8] 詹文圆,郇延军,孙敬,等. 变压滚揉腌制工艺对冷却猪肉中微生物的影响[J]. 食品工业科技,2009,30(1):211-213. Zhan Wenyuan, Huan Yanjun, Sun Jing, et al. Effect of pressure-transform tumbling craft on the microbe existed in the cooling pork[J]. Science and Technology of Food Industry, 2009, 30(1): 211-213. (in Chinese with English abstract)
[9] 詹文圆. 肉制品加工中变压滚揉腌制技术研究[D]. 无锡:江南大学,2008. Zhan Wenyuan. Study on Pressure-transform Tumble Curing Techonology in Meat Processing[D]. Wuxi: Jiangnan University, 2008. (in Chinese with English abstract)
[10] Jayasooriya P J, Torley B R, Arcy D, et al. Tenderization of semitendinosus muscle using high intensity ultrasound[J]. Meat Science, 2007, 75(4): 628-639.
[11] 冯婷,孙京新,徐幸莲,等. 超声波辅助变压滚揉对鸡肉腌制品质的影响[J]. 现代食品科技,2015,31(5):248-254. Feng Ting, Sun Jingxin, Xu Xinglian, et al. Effect of vacuum-pressure alternating tumbling aided by ultrasonic waves on the quality of marinated chicken[J]. Modern Food Science and Technology, 2015, 31(5): 248-254. (in Chinese with English abstract)
[12] Awad T S, Moharram H A, Shaltout O E, et al. Applications of ultrasound in analysis, processing and quality control of food: a review[J]. Food Research International, 2012, 48(2), 410-427.
[13] McDonnell C K, Lyng J G, Arimi J M, et al. The acceleration of pork curing by power ultrasound: A pilot-scale production[J]. Innovative Food Science and Emerging Technologies, 2014, 26(12): 191-198.
[14] Xu Xinglian, Han Minyi, Fei Ying, et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J]. Meat Science, 2011, 87(3): 159-164.
[15] Alix A J P, Pedanou G, Berjot M. Fast determination of the quantitative secondary structure of proteins by using some parameters of the raman amide Ⅰ band[J]. Journal of Molecular Structure, 1988, 174: 159-164.
[16] Han Minyi, Wang Peng, Xu Xinglian, et al. Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J]. Food Research International, 2014, 62: 1175-1182
[17] Palka K, Daun H. Changes in texture, cooking losses, and myofibrillar structure of bovine M. semitendinosus during heating[J]. Meat Science, 1999, 51(3): 237-243.
[18] 闵辉辉,孙京新,徐幸莲,等. 不同电压击昏鸡肉微观结构及理化特性研究[J]. 中国食品学报,2016,16(1):77-83. Min Huihui, Sun Jingxin, Xu Xinglian, et al. The microstructure and physico-chemical characteristics of chicken after different electrical stunning voltages[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(1): 77-83. (in Chinese with English abstract )
[19] 张玉林,曹锦轩,潘道东,等. 成熟过程中活性氧簇(ROS)对肌原纤维蛋白结构的影响[J]. 现代食品科技,2014,30(9):26-33. Zhang Yulin, Cao Jinxuan, Pan Daodong, et al. Effect of reactive oxygen species (ROS) on structural changes in meat myofibrillar protein during ageing[J]. Modern Food Science and Technology, 2014, 30(9): 26-33. (in Chinese with English abstract)
[20] Pelton J T, Mclean L R. Spectroscopic methods for analysis of protein secondary structure[J]. Analytical Biochemistry, 2000, 277(2): 167-176.
[21] 曹锦轩,张玉林,韩敏义,等. 腊肉加工过程中肌原纤维蛋白结构的变化[J]. 中国农业科学,2013,46(18):3871-3877. Cao Jinxuan, Zhang Yulin, Han Minyi, et al. Changes of the construction of myofibrillar proteins in chinese traditional bacon during processing[J]. Scientia Agricultura Sinica, 2013, 46(18): 3871-3877. (in Chinese with English abstract )
[22] Herrero A M. Raman spectroscopy a promising technique for quality assessment of meat and fish: A review[J]. Food Chemistry, 2008, 107: 1642-1651.
[23] Herrero A M. Raman spectroscopic study of structural changes in hake muscle proteins during frozen storage[J]. Journal of Agricultural and Food Chemistry, 2004, 52: 2147-2153.
[24] Jayasooriya S D, Torley P J, D’Arcy B R, et al. Effect of high power ultrasound and ageing on the physical properties of bovine Semitendinosus and Longissimus muscles[J]. Meat Science, 2007, 75(4): 628-639.
[25] 曹莹莹. 超高压结合热处理对肌球蛋白凝胶特性的影响研究[D]. 南京:南京农业大学,2012. Cao Yingying. Study on Effects of Ultra-High Pressure Combining with Heating on Myosin Gel Properties[D]. Nanjing: Nanjing Agricultural University, 2012. (in Chinese with English abstract )
[26] Liu R, Zhao S M, Xie B J, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25(5): 898-906.
[27] Li Ke, Kang Zhangli, Zhao Yingying, et al. Use of highintensity ultrasound to improve functional properties of batter suspensions prepared from PSE-like chicken breast meat[J]. Food and Bioprocess Technology, 2014, 7(12): 3466-3477.
[28] Bertram H C, Donstrup S, Karlsson A H, et al. Continuous distribution analysis of T2relaxation in meat: An approach in the determination of water-holding capacity[J]. Meat Science, 2002, 60(3): 279-285.
[29] Pearce K L, Rosenvold K, Andersen H J, et al. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes-A review[J]. Meat Science, 2011, 89(2): 111-124.
[30] 李侠,孙圳,杨方威,等. 适宜冻结温度保持牛肉蛋白稳定性抑制水分态变[J]. 农业工程学报,2015,31(23):238-245. Li Xia, Sun Zhen, Yang Fangwei, et al. Appropriate freezing temperature to maintain beef protein stability and inhibit myowater state changes[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(23): 238-245. (in Chinese with English abstract)
[31] 李春,张录达,任发政,等. 利用低场核磁共振研究冷却条件对猪肉保水性的影响[J]. 农业工程学报,2012,28(23):243-249. Li Chun, Zhang Luda, Ren Fazheng, et al. Study on different chilling factors influencing water-holding capacity of pork based on low-field nuclear magnetic resonance (LF-NMR)[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(23): 243-249. (in Chinese with English abstract)
[32] Straadt I K, Rasmussen M, Andersen H J, et al. Aging-induced changes in microstructure and water distribution in fresh and cooked pork in relation to water-holding capacity and cooking loss-a combined confocal laser scanning microscopy (CLSM) and low-field nuclear magnetic resonance relaxation study[J]. Meat Science, 2007, 75(4): 687-695.
[33] Li Chunbao, Liu Dengyong, Zhou Guanghong, et al. Meat quality and cooking attributes of thawed pork with different low field NMR T21[J]. Meat Science, 2012, 92(2): 79-83.
[34] 史培磊,闵辉辉,李春保,等. 滚揉腌制前后鹅肉品质的变化[J]. 食品科学,2011,32(11):88-92. Shi Peilei, Min Huihui, Li Chunbao, et al. Changes in meat quality characteristics of goose breast muscle after tumbling[J]. Food Science, 2011, 32(11): 88-92. (in Chinese with English abstract)
Effects of pressure-transform tumbling assisted by ultrasound on protein structure and water content of chicken
Li Peng1, Wang Hongti2, Sun Jingxin1※, Feng Ting1
(1. College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China; 2. College of Mechanical and Electrical Engineering, Qingdao Agricultural University, Qingdao 266109, China)
Curing has important functions in meat products, which contributes positively to the structural and sensory characteristics of the meat. By various curing methods, a wide variety of cured meat products are produced. Considering the processing time or the weight ratio of brine to meat needed to obtain a product with better characteristics from a sensorial or a structural point of view, neither scientists nor manufacturers came to a similar standpoint. Nowadays, to some extent, reducing curing time and improving the curing operations may be achieved through tumbling or other methods. From a production perspective, fast tumbling can shorten processing time and is favorable, but it can lead to more heat production and products of poor quality. Ultrasound is a novel processing technology which may accelerate mass transfer through the mechanism of cavitation in meat tissue. Ultrasound is also favorable from an eating point of view since it results in more tender and juicy meat. In order to explore novel curing processing for shortening curing time and improving product quality, we assessed the effects of pressure-transform tumbling curing assisted with ultrasound (PTU) technique on the protein secondary structures, moisture distribution and microstructure of chicken. For this purpose, fresh chicken breasts were selected (50±1 g, 5 cm × 5 cm × 2 cm) and treated at 4 ℃ for 100 min with one of the 3 following curing treatments: (1) static brining, (2) vacuum tumbling (VT) (rotation speed of 16 revolutions per minute, 0.08 MPa, 100 min, 15 minutes of continual work and then 5 minutes of resting period), or (3) pressure-transform tumbling assisted with ultrasound (40 kHz, 140 W; parameter setting was consistent with the VT curing, and the only difference was the ultrasound treatment of the meat samples carried out by activating ultrasonic probe during the resting period). The ratio of meat weight to brine weight was 100: 30 (g/mL) for all treatments. The brine solution was composed of 2% NaCl, 0.3% compound phosphates, 250 mg/kg sodium ascorbate and 150 mg/kg sodium nitrite (relative to meat weigh). The results showed that the proportion of α-helix was reduced greatly (P<0.05), and the amount of β-sheet and β-turn were increased (P<0.05) after PTU treatment. The LF-NMR (low-field nuclear magnetic resonance) data indicated that the transverse relaxation time of the bound water (T21) and immobilized water (T22) was clearly reduced by PTU compared with VT and static brining. Moreover, the proportion of peak area of T21was significantly increased (P<0.05) for PTU treatment, which indicated that the water molecules were combined with protein more tightly and part of free water was turned into immobilized water. SEM (scanning electron microscopy) and TEM (transmission electron microscope) showed that PTU could result in severe degradation of myofibril and larger distance between muscle fibers compared to static brined or VT samples. Based on this study one can conclude that PTU treatment can serve as a useful alternative to tumbling for improving curing in meat tissue as well as enhancing water-holding capacity and textural properties. The research provides a theoretic basis and practical application reference for the PTU technology in the meat industry and related equipment design.
protein; moisture; microstructure; chicken; pressure-transform tumbling assisted ultrasound (PTU); vacuum tumbling (VT)

表2 2017年《农业工程学报》在Google Scholar中的高被引论文及引用次数
10.11975/j.issn.1002-6819.2017.16.040
TS251.1
A
1002-6819(2017)-16-0308-07
李 鹏,王红提,孙京新,冯 婷. 超声辅助变压滚揉对鸡肉蛋白质结构及含水量的影响[J]. 农业工程学报,2017,33(16):308-314.
10.11975/j.issn.1002-6819.2017.16.040 http://www.tcsae.org
Li Peng, Wang Hongti, Sun Jingxin, Feng Ting. Effects of pressure-transform tumbling assisted by ultrasound on protein structure and water content of chicken[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(16): 308-314. (in Chinese with English abstract)
doi:10.11975/j.issn.1002-6819.2017.16.040 http://www.tcsae.org
2017-05-15
2017-07-31
山东省现代农业产业技术体系家禽创新团队项目资助(SDAIT--11-11);“十二五”国家科技支撑计划课题资助(2012BAD28B03);青岛农业大学高层次人才基金项目(6631115050);江苏省“双创计划”资助对象(双创博士类)项目。
李 鹏,男,山东青岛人,讲师,博士,主要从事肉品加工与质量安全控制研究。Email:lipengqd@126.com
※通信作者:孙京新,男,山东临朐人,教授,博士,主要从事肉品加工与质量安全控制研究。Email:jxsun20000@163.com

