犬源伪狂犬病病毒的分离鉴定及其主要毒力基因分子特征分析
吴发兴,邹 敏,董雅琴,刘 爽,李晓成
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛易邦生物工程有限公司,山东青岛 266114)
犬源伪狂犬病病毒的分离鉴定及其主要毒力基因分子特征分析
吴发兴1,邹 敏2,董雅琴1,刘 爽1,李晓成1
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛易邦生物工程有限公司,山东青岛 266114)
对发生临床疑似伪狂犬病毒(PRV)感染的牧羊犬组织样品,进行研磨、细胞接种、传代培养、细胞病变效应(CPE)观察、PCR检测、效价测定、电镜观察、IFA检测、家兔接种以及基因测序分析等,结果成功分离到1株犬源PRV毒株,命名为XJ-14株。该毒株可致PK-15细胞产生变圆、破碎、逐渐呈拉网式漂浮等特征性细胞病变;PRV gE-PCR检测阳性,病毒效价达10-7.45/0.1 mL;病毒粒子在电镜下呈圆形,有囊膜,直径约150 nm;PRV荧光抗体检测阳性,接种家兔后可致家兔奇痒、麻痹死亡。对该毒株gC、gE、TK基因进行全基因测序,发现gE糖蛋白的48、497位各插入了1个D,另有12个氨基酸位点发生点突变,其gC蛋白氨基酸序列64~70位出现了7个氨基酸(AASTPAA)插入。结果表明,此牧羊犬病例是由PRV感染所致。
犬;伪狂犬病病毒;XJ-14株;分离鉴定;毒力基因
伪狂犬病(Pseudorabies,PR)也称奥耶斯基氏病(Aujeszky's disease),是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种烈性传染病[1]。PRV为双链DNA病毒,属疱疹病毒科、α疱疹病毒亚科[2]。PR为多种动物共患病。几乎所有的哺乳动物以及部分鸟类对PRV有易感性。病猪、鼠类是PRV的主要传染源,犬、猫、羊等动物为其终末宿主[3]。
2014年3月份,新疆伊犁州某羊场饲养的牧羊犬陆续出现精神沉郁、蜷缩、呕吐、厌食、发烧等异常表现,随后出现站立不稳、抽搐、流涎、呻吟、啃咬身体及物品等现象,3~5 d后死亡。经当地兽医初步诊断,怀疑是狂犬病,后经当地兽医实验室检测为PRV阳性。本实验室对送来的死亡犬组织样品进行了系统的实验室诊断及相关研究。
1 材料与方法
1.1 材料
1.1.1 组织样品。1份经PCR检测为PRV核酸阳性的发病牧羊犬脑组织和淋巴结组织混合样品,来自新疆某养羊场。将样品预先研磨,反复冻融,离心及过滤除菌,置-80 ℃冰箱保存备用。
1.1.2 参考病毒株和细胞。PRV Min-A株,购自中国兽医药品监察所,由本室保存。PK15细胞,由中国动物卫生与流行病学中心畜病监测室保存并提供,无外源污染,按常规方法培养。
1.1.3 主要试剂。MEM液体培养基、青霉素-链霉素溶液、0.25% Trypsin-EDTA,购自Gibco;新生牛血清(NBS),购自内蒙古金源康;DNAzol,购自Invitrogen公司;EX-Taq HS DNA聚合酶、GC buffer I、DL2 000 DNA Marker等,均购自宝生物(大连)工程有限公司;DNA胶回收试剂盒,购自上海生工生物工程有限公司;PRV荧光抗体,由中国兽医药品监察所薛青红博士惠赠。
1.1.4 引物及序列比对用参考毒株。参照 MinA株(GenBank登陆号AY170318)等毒株的相应序列,采用Primer 5.0软件,分别设计了PRV gE基因检测以及gE、gC和TK基因扩增引物(表1)。将引物序列交上海生工生物工程技术服务有限公司合成,稀释成工作浓度后,-20 ℃保存备用。用于序列分析的参考毒株包括:Bartha(JF797217)、Kaplan(JF797218)、Becker(JF797219)、DUL34Pass(JQ809330)、SuHV-1(NC006151)、Kolchis(KT983811)、Hercules(KT983810)、Ea(AF158090、AF171937、 AF080571)、MinA(AY170318、AY171242)、Fa(KM189913)、BJ-YT(KC981239)、TJ(KJ789182)、ZJ01(KM061380)、JS-2012(KP257591)、HN1201(KP722022)、SC 1987(KT809429)、HLJ08(KT824771)、LA(AY173124、AY173125)。

表1 PRV检测及主要毒力基因扩增引物
1.1.5 实验动物。5只健康成年家兔,购自青岛康大兔业有限公司,由专人隔离饲养观察。
1.2 方法
1.2.1 病料处理。取解冻的待检病料5 g左右,用灭菌手术剪剪碎,加入适量PBS溶液(pH7.2)混匀;用灭菌研磨器充分研磨,再用1.5 mL无菌离心管分装,反复冻融2~3次,-70 ℃保存备用。
1.2.2 病毒分离培养。取已处理好的病料上清液,接种已长满单层的PK-15细胞,吸附1 h后,加入适量DMEM维持液(含1% NBS、1%双抗溶液,下同)后继续培养观察。设未接种细胞作为阴性对照,每8 h观察1次细胞病变效应(CPE)产生情况。待80%细胞产生CPE后收获并进行再次传代增殖,直至CPE稳定、特异,回收全部培养物,-80 ℃冻存备用。
1.2.3 DNA模板的制备。取PRV MinA株、分离株F1~F5代病毒液各250 µL,加入750 µL DNAzol,缓慢颠倒混匀后室温放置3 min;12 000 r/min、4 ℃离心10 min;取500 µL上清置于新管中,加入500 µL预冷的无水乙醇,颠倒混匀后室温放置5 min;7 500 r/min、4 ℃离心5 min;弃上清,加入1 mL预冷的75%乙醇洗涤1~2次;12 000 r/min、4 ℃离心5 min;弃上清,将沉淀自然室温干燥,最后用30 µL DEPC水溶解,-20 ℃保存备用。
1.2.4 PRV PCR检测鉴定。PCR扩增体系为:2×GC Buffer I 12.5 µL、dNTPs(10 mmol/L) 2 µL、上下游引物(20 µmol/L)各0.5 µL、EX-Taq HS DNA聚合酶0.5 µL、DNA 2.5 µL,最后用灭菌水补足至25 µL。PCR反应条件为:98 ℃预变性5 min,94 ℃50 s,62 ℃ 50 s,72 ℃ 1 min,共32个循环,最后72 ℃延伸10 min,随后取5 µL PCR产物进行电泳观察并成像。
1.2.5 电镜观察。取XJ-14株F5培养物(下同),4 ℃、5 000 r/min离心30 min;取上清,弃细胞碎片,送青岛大学附属医院电镜室进行电镜观察。
1.2.6 效价测定。取长满单层的PK-15细胞,经消化后制备96孔细胞板。取XJ-14株F5细胞毒进行10-1~10-9连续10倍稀释并接种96孔板;细胞板四周各边缘孔仅加入维持液作为空白对照,第10排各孔接种MinA株作为阳性对照,用Reed-Muench法计算病毒效价(TCID50/0.1 mL)。
1.2.7 免疫荧光试验。取长满单层的PK-15细胞,经消化后制备12孔细胞板,取XJ-14株F5代细胞毒,从10-1稀释至10-4接种,设立PRV阳性对照、正常细胞对照,继续培养12 h;经洗涤、冷丙酮固定后,用PRV荧光抗体进行染色,洗涤、晾干,50%甘油PBS封板,进行荧光检测。
1.2.8 分离株主要毒力基因测序及分析。对XJ-14株F5代细胞毒总DNA进行gE、gC、TK基因50 µL扩增,经电泳检测后,回收目的条带,送样测序。获得测序结果后,应用Editseq软件进行校对拼接,再分别使用DNAstar、Clustal 1.83、MEGA 6.0等软件,进行分离株与参考毒株相应基因的多序列比对、推导氨基酸序列变异分析及进化树构建。
1.2.9 兔体接种试验。将5只兔子分成2组:攻毒组3只,每只颈部皮下注射XJ-14株F5代细胞毒2 mL;另2只兔子颈部皮下注射细胞维持液2 mL。然后进行隔离饲养观察。
2 结果
2.1 病毒分离结果
将病料处理上清液接种PK-15细胞,12 h后开始出现细胞病变,36 h后收获全部培养物;第2代接种后8 h开始出现细胞病变,24 h收获;继续传至第5代,收获全部培养物-80 ℃冻存。CPE主要表现为:接毒后8 h左右,细胞开始变圆、变亮、破碎,逐渐呈渔网样漂浮。约在接种后24 h收获(图1)。
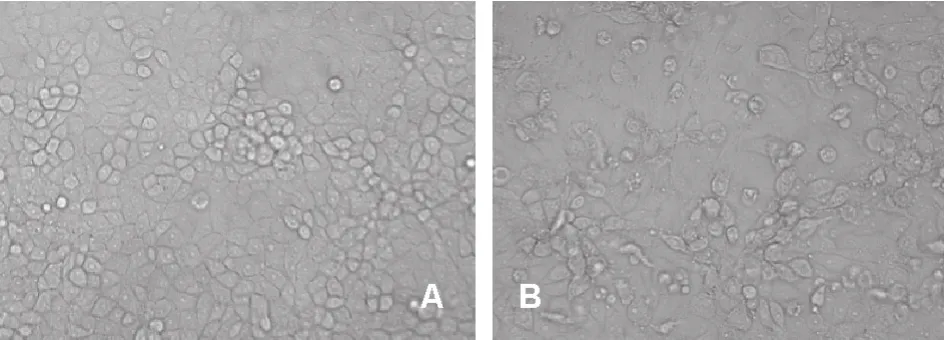
图1 XJ-14接种PK-15后的细胞病变(200×)
2.2 PRV PCR检测结果
对MinA株、XJ-14株F1~F5代细胞培养物总DNA进行PCR检测,证实分离到的病毒株为PRV(图2)。
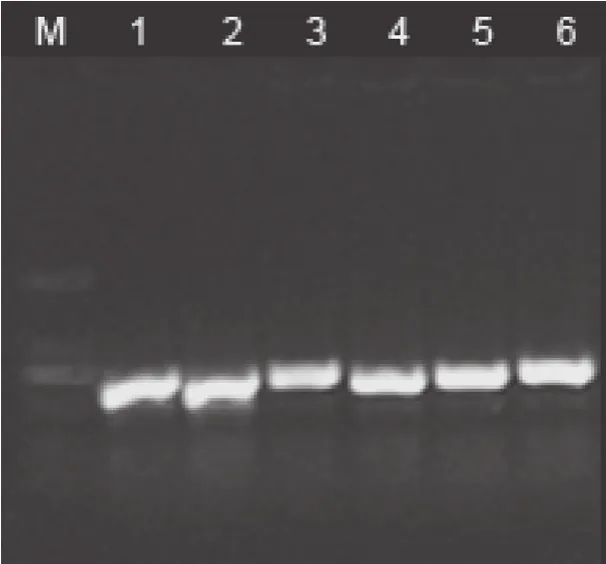
图2 PRV XJ-14株PCR检测电泳图
2.3 电镜观察结果
取离心后的XJ-14 F5代细胞毒样本,送青岛大学附属医院电镜室进行负染电镜观察。在电子显微镜下可见呈球形,有囊膜,直径约150 nm的PRV粒子(图3)。
2.4 病毒含量测定结果
经测定,XJ-14 F5代细胞毒的效价为10-7.25/0.1 mL。
2.5 免疫荧光检测
对接种XJ-14 12 h 的PK-15细胞和未接种细胞对照进行PRV荧光抗体染色,干燥、封板处理后,在荧光显微镜视野里下可见接种PRV的各孔中有特异性荧光(图4-A),而空白对照孔未见特异性荧光(图4-B)。
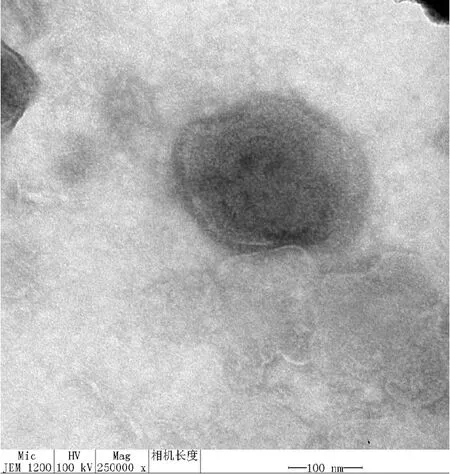
图3 XJ-14 病毒粒子电镜照片
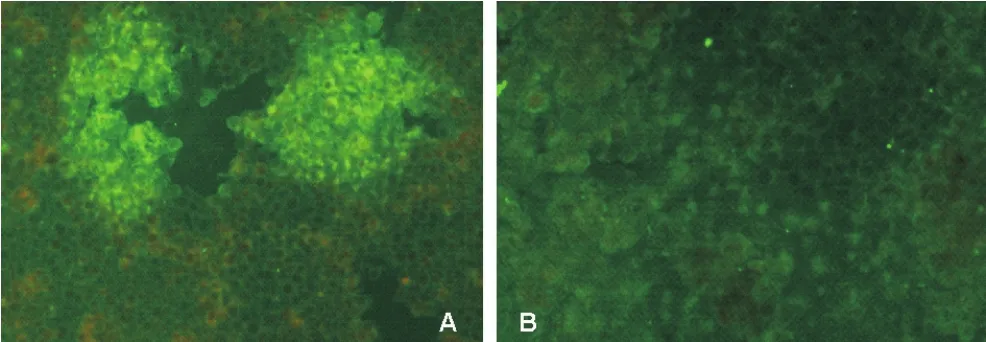
图4 免疫荧光检测结果(200×)
2.6 XJ-14株主要毒力基因测序及遗传演化分析结果
2.6.1 主要毒力基因测序结果。经电泳、切胶回收、送样测序、拼接,获得的XJ-14株gE、gC、TK基因全序列长分别为1 740 bp、1 464 bp、963 bp(图5);将序列信息上传GenBank后获得登陆号分别为KY398767、KY398801、KY398830。
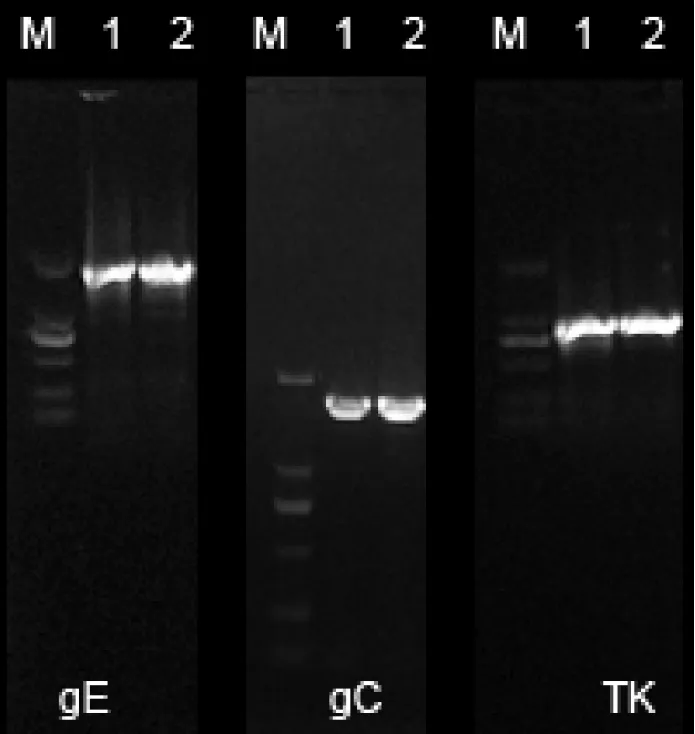
图5 XJ-14株gE、gC、TK基因PCR扩增电泳图
2.6.2 gE基因遗传演化分析结果。将所测XJ-14株gE基因序列与1.1.4节总所列参考PRV株的gE基因序列进行多序列比较,发现XJ-14与Kaplan等6个国外毒株gE基因序列和推导氨基酸序列同源性分别介于97.9%~98.2%、94.4%~96.2%,与MinA等国内毒株gE基因序列和推导氨基酸序列同源性分别介于99%~100%、98.3%~100%。基于所测序列,应用Clustal 1.83、MEGA6.0软件,采用Neighborjoining算法,构建遗传发育进化树(图6),发现XJ-14株与国内当前流行毒株处于同一进化分支G2.4,有别于MinA、LA、Ea等2010年前国内分离毒株。
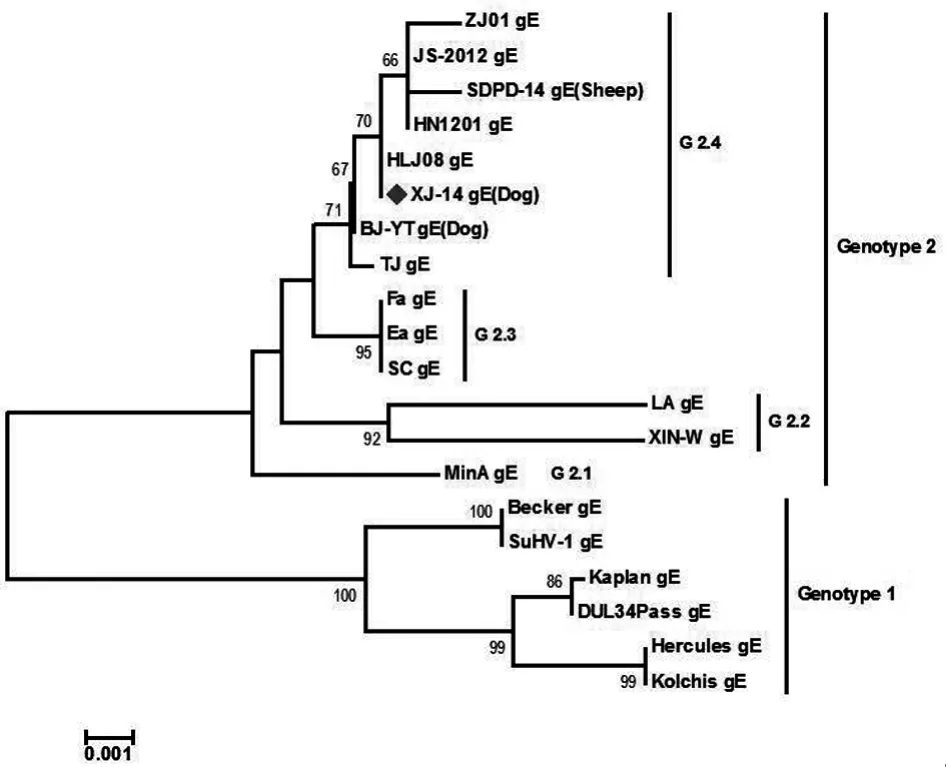
图6 基于PRV gE基因的进化树
2.6.3 gC基因遗传演化分析结果。将所测XJ-14株gC基因序列与1.1.4节总所列参考PRV株的gC基因序列进行多序列比较,发现XJ-14与Kaplan等6个国外毒株gC基因序列和推导氨基酸序列同源性分别介于95.9%~96.2%、93.1%~93.5%,与MinA等国内毒株gC基因序列和推导氨基酸序列同源性分别介于96.9~100%、94.8~100%。基于所测gE、gC基因序列,应用Clustal 1.83、MEGA6.0软件,采用Neighbor-joining算法,分别构建遗传发育进化树(图7),发现XJ-14株与国内当前流行PRV毒株处于同一进化分支G2.3,与基于gE基因构建的遗传进化树分析结果基本一致,没有明显的种群、地域、时间差异,但有别于国内早前毒株,且与国外毒株具有明显的遗传差异。

图7 基于PRV gC基因的进化树
2.6.4 主要毒力基因推导氨基酸序列变异分析。应用DNAstar软件中的Protean软件,将XJ-14的gE、gC、TK基因序列转换为氨基酸序列,并与国内外PRV毒株的相应基因推导氨基酸序列进行多序列比对,发现与国外毒株相比,XJ-14和国内毒株gE糖蛋白在48、497位各插入了1个D,gE糖蛋白其他氨基酸位点变化情况分别是G54→D54、D59→N59、N63→D63、V106→L106、A122→S122、R149→M149、T179→S179、Q/R181→L181、A215D216→L215A216、G472→R472、R474→H474;进行gC蛋白氨基酸序列变异分析,发现与国外毒株相比,XJ-14和国内毒株gC蛋白在64~70位出现了7个氨基酸(AASTPAA)插入,gC蛋白其他主要氨基酸位点变化情况分别是A16→T16、T25→S25、E43→A43、P52→S52、A55→E55、A57→V57、PEA59-61→GTT59-61、A76→V76、P87→Q87、N90→G90、A102→S102、F130→V130、Y142→C142、P187→S187、L240→V240、S243→H243、L431→M431、V437→I437、A449→T449、S457→T457、V461→T461、G467→A467、AGP485-487→SAL485-487。进行蛋白激酶TK氨基酸序列变异分析,发现与国外毒株相比,XJ-14和国内毒株TK氨基酸序列基本未发生氨基酸突变,仅在215位发生了T→V置换。
2.7 兔体接种试验结果
经观察发现,3只接种了XJ-14株的家兔在接种后48 h开始出现奇痒、撕咬注射部位、尖叫等现象,72 h内全部死亡。尸体呈角弓反张样,注射部位血肉模糊。而空白对照组健康存活,无任何异常。
3 讨论
从临床发病死亡的牧羊犬组织样品(脑组织、淋巴结)中分离到1株PRV毒株XJ-14。结合gE基因检测及测序结果,确认该毒株为野毒株,可致PK-15细胞产生细胞变圆、变亮、破碎,逐渐呈渔网样漂浮等典型细胞病变,病毒效价可达10-7.45/0.1 mL;攻击健康家兔,可使其出现奇痒、撕咬注射部位、尖叫等经典症状,并在3 d内死亡。因此,该毒株属强毒株,是导致牧羊犬发病死亡的主要致病原。这与朱玲云等[4]、张文花等[5]、冒银祥等[6]的研究结果一致。
对XJ-14株与国内外PRV毒株gE、gC、TK基因序列同源性、进化树以及推导氨基酸序列变异分析后发现,本研究分离到的这株犬源PRV与猪源的MinA株以及2011年以来先后分离到的犬源、羊源、猪源PRV在核苷酸水平上的同源性介于96.9%~100%,没有地域、物种差异。因此,推测该病例是牧羊犬捕食了鼠等媒介动物或者食入了感染羊内脏而发病死亡的[7]。比对XJ-14与其他19个参考毒株的gE基因和推导氨基酸序列,发现XJ-14株gE糖蛋白的48、497位各插入了1个D,另在gE糖蛋白的其他12个氨基酸位点发生点突变;该毒株的gC蛋白氨基酸序列与国内外早前毒株gC蛋白相比,在64~70位出现了7个氨基酸(AASTPAA)插入。这一特征性氨基酸突变与Wang等[8]发现的猪源PRV毒株的基因特点一致,说明该毒株与我国当前流行的PRV属同一基因型。至于XJ-14毒株对犬、猪、羊等动物的毒力如何,还需进行深入研究。
李峰等[9]报道山东省滨州市某波尔山羊场发生了一起PR疫情。滕金玲等[10]报道山东省莒南县某场(猪、山羊混养)因猪发生PR,导致该场饲养的山羊也发病死亡。结合国内已有的若干研究报道,自然条件下,猪、牛、羊等哺乳动物均能感染本病。这种跨物种的疫病传播多由媒介(饲养员、媒介动物等)引发[11]。因此,多种动物混养,养犬,场内有鼠类活动等极易导致PRV传播,并造成更大经济损失。因此,为加强本病的控制,应避免多种动物混养,加强养殖场的生物安全管理,消灭鼠害,加强消毒,切断病原传播途径,并切实做好疫苗免疫和疫病监测工作。
[1] CAY A B,LETELLIER C. Isolation of Aujeszky's disease virus from two hunting dogs in Belgium after hunting wild boars.[J]. Vlaams diergeneeskundig tijdschrift,2009,78(3):194-195.
[2] 向柯宇,潘慧,吉艺宽,等. 猪伪狂犬病病毒新流行株主要糖蛋白的分子特征分析[J]. 华南农业大学学报,2016,37(3):23-28.
[3] CRAMER S D,CAMPBELL G A,NJAA B L,et al. Pseudorabies virus infection in Oklahoma hunting dogs[J]. Journal of veterinary diagnostic investigation,2011,23(5):915-923.
[4] 朱玲云,张正学,郑龙龙,等. 山羊源伪狂犬病病毒的分离与鉴定[J]. 动物医学进展,2016,37(12):113-117.
[5] 张文花,和国忠,和仕良,等. 高海拔地区绵羊及牧羊犬伪狂犬病的防制[J]. 云南畜牧兽医,2011(2):19.
[6] 冒银祥,席贺全. 羊伪狂犬病与巴氏杆菌病混合感染的诊治[J]. 当代畜牧,2014,12(5):20.
[7] 钟承,张乐天,王巨实,等. 犬源伪狂犬病毒BJ/RD株的分离鉴定及gE基因分析[J]. 中国动物传染病学报,2013,21(5):1-6.
[8] WANG Y B,QIAO S L,LI X W,et al. Molecular epidemiology of outbreak-associated pseudorabies virus(PRV)strains in central China[J]. Virus genes,2015,50(3):401-409.
[9] 李峰,张文通,王玉茂,等. 波尔山羊羔羊伪狂犬病的诊治[J]. 黑龙江畜牧兽医,2013(4):96-97.
[10] 滕金玲,谭善杰. 羊伪狂犬病的诊断与防制[J]. 山东畜牧兽医,2016(1):33.
[11] 李强,毕可东,臧玉鹏,等. 犬伪狂犬病的临床诊断及防制[J]. 畜牧与兽医,2016,48(3):155.
(责任编辑:朱迪国)
Isolation,Identifcation and the Major Virulence Genes Characteristic Analysis of Pseudorabies Virus from Canine
Wu Faxing1,Zou Min2,Dong Yaqin1,Liu Shuang1,Li Xiaocheng1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. Qingdao Yebio Bioengineering Co.,Ltd.,Qingdao,Shandong 266114)
Tissue samples from a sheepdog infected with clinically suspected Pseudorabies virus(PRV)were identified by grinding,cell culture,subculture,CPE observation,PCR detection,virus titer determination,electron microscope observation,IFA assay,rabbit inoculation test gene sequencing and analysis. As a result,one PRV strain was isolated from dog successfully,named XJ-14 strain. The isolate was able to cause typical CPE in PK-15 cells,characterized by round,broken,cell mesh and floating. The result of PRV gE-PCR was positive,with the virus titer of 10-7.45/0.1 mL. The virus particles were round,with envelope,diameter about 150 nm under the electron microscope. The reaction with PRV fluorescent antibody was positive. After challenging the XJ-14 isolate,the rabbits appeared itching,paralysis and death. The major virulence genes,such as gE,TK and gC gene were sequenced and analyzed. The results showed that two Asp were inserted in the gE glycoprotein 48 and 497 amino acid site,respectively. And there were 12 amino acid sites mutation. For the gC glycoprotein sequence,there were 7 amino acids insertion(AASTPAA)in the 64~70 amino acid sites. All the results showed that the dog case was caused by PRV.
canine;Pseudorabies virus;XJ-14 strain;isolation and identification;virulence genes
S851.3
A
1005-944X(2017)09-0096-06
10.3969/j.issn.1005-944X.2017.09.026
科技部科技基础性工作专项(2012FY111000)
李晓成