儿童结节性硬化症伴胰岛素瘤
黄婷婷 姚宝珍 牛萍 张海菊 凌伟
儿童结节性硬化症伴胰岛素瘤
黄婷婷 姚宝珍 牛萍 张海菊 凌伟
目的 探讨结节性硬化症(TSC)的诊断、不同系统受累的临床表现及合并的神经内分泌肿瘤。方法 报道1例TSC患者的病史、临床表现及神经影像学资料。结果 患儿因反复低血糖症状而就诊,体格检查可见数十个色素脱失斑,头颅CT及MRI显示双侧皮层及侧脑室旁多发结节,脑电图示左侧后半球散发尖波或棘波,腹部CT显示胰体部肿块,最终确诊为TSC合并胰岛素瘤。结论 TSC是一种神经皮肤综合征,主要累及皮肤及神经系统,但硬化性结节可以累及全身多脏器和组织。反复低血糖发作的患儿应警惕TSC合并胰岛素瘤的可能。
结节性硬化症 胰岛素瘤 低血糖
结节性硬化症(tuberous sclerosis complex, TSC)是一种罕见的家族性疾病,主要累及皮肤及神经系统,呈常染色体显性遗传,且外显率较高。然而,大约只有20%的患者家族史阳性,70%~80%患者为自发性突变而导致的散发病例[1]。其典型三联征为癫痫、智能减退、皮脂腺瘤,但临床上同时具备3个条件者罕见。硬化性结节可以累及全身多脏器和组织,包括皮肤、大脑、肾脏、心脏、甲状腺、乳腺、大肠、肺、肾上腺、骨骼等。既往认为,胰腺受累概率明显高于其他脏器[2],但目前关于胰腺受累的报道并不多。本研究报道1例TSC伴胰岛素瘤患儿,同时对TSC合并不同系统受累的临床表现作一报道。
1 临床资料
患儿,女,5岁,于2016年7月因“间断头晕3年余”入院;患儿近3年来反复发作头晕,多在晨起时,白天偶有出现,发作时脸色苍白、唇无色、冒冷汗,进食后能缓解;查体:神淸,精神可,体型消瘦,腹部可见一手术疤痕,躯干可见色素脱失斑十余个,有的不规则,有的呈椭圆形;近1年来患儿智力较前有所减退,表现为反应较前迟钝,成绩较前下降。患儿近2月来头晕发作较前频繁,症状较前加重。2016年6月外院头颅CT示双侧额顶部散发低密度影、双侧侧脑室旁多发钙化灶。患儿既往曾因低血糖于2012年12月于外院发现胰岛肿块,并行胰尾切除术,术后病检显示胰岛细胞瘤;2014年4月因“抽搐4次”再次入院治疗,此后再无抽搐发作。
入院后实验室检查示血常规、尿常规、大便常规、生化及电解质、中枢神经特异蛋白S100、神经元特异性烯醇化酶NSE、血遗传代谢串联质谱均(-),但空腹血糖1.27 mmol/L。住院期间血糖监测显示空腹血糖波动在1.2~1.7 mmol/L,餐后血糖波动在1.2~3.8 mmol/L。 颅脑MRI显示双侧额颞顶枕叶多发异常信号及双侧侧脑室内多发结节(图1)。腹部CT平扫+增强示胰体部肿块(图2)。脑电图示左侧后半球散发尖波或棘波(图3)。
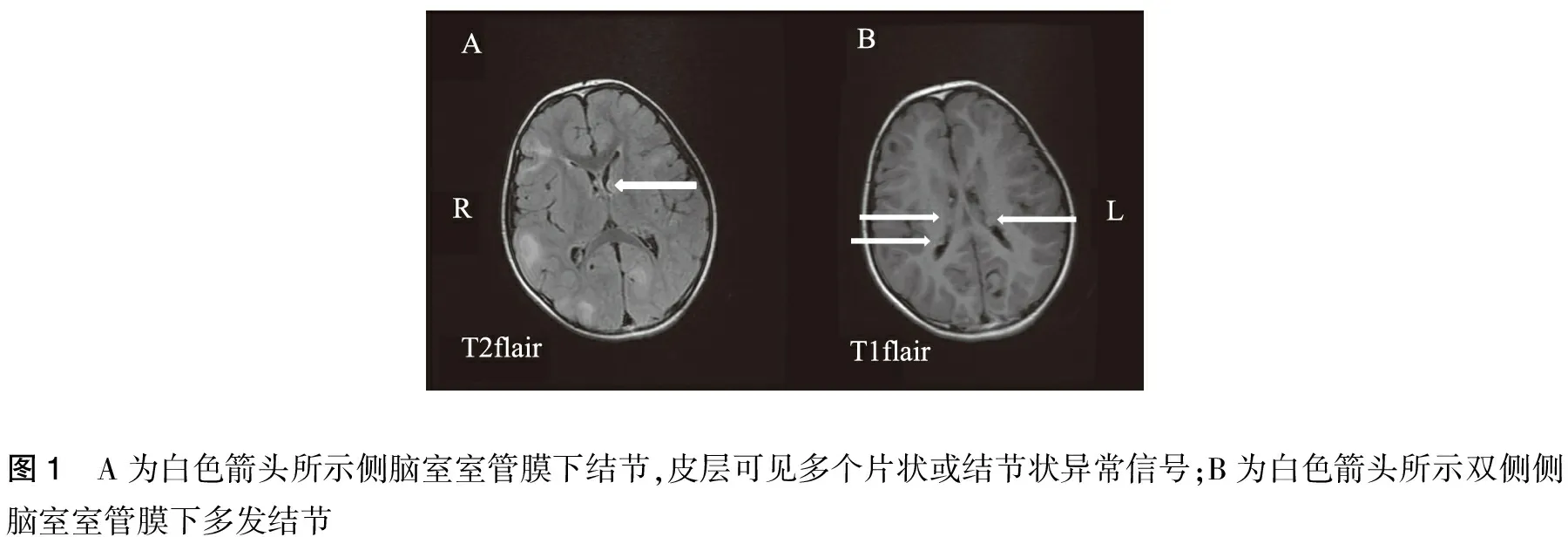
图1 A为白色箭头所示侧脑室室管膜下结节,皮层可见多个片状或结节状异常信号;B为白色箭头所示双侧侧脑室室管膜下多发结节
本例患儿存在癫痫发作、智能减退、色素脱失斑,头颅CT显示侧脑室旁钙化灶,头颅MRI显示皮层结节和侧脑室室管膜下多发结节,具备3个主要诊断标准,且影像学支持诊断,可确诊为TSC。

图2 A为CT平扫,白色箭头所示胰腺体部肿块;B为CT增强,白色箭头所示肿块增强

图3 脑电图,黑色箭头所示左侧后半球散发尖波或棘波
患儿2012年反复发作低血糖,影像学检查发现胰岛细胞瘤并手术切除,术后患儿症状缓解1年,1年后再次反复发作低血糖表现,来院时血糖多在1.5 mmol/L左右,提示胰腺内分泌肿瘤再发。
2 讨 论
TSC的诊断标准(2012年国际共识会议)[3]:确诊TSC需要符合2个主要标准或1个主要标准和≥2 个次要标准。可能诊断需要符合1个主要标准或≥2个次要标准。若存在TSC1或TSC2基因(肿瘤抑制基因)的1个致病突变,单凭此就能确诊。主要诊断标准为血管纤维瘤或前额斑块(≥3)、脱色斑(≥3)、指甲纤维瘤(≥2)、结缔组织痣、多发性视网膜错构瘤、皮层发育异常(≥3)包括皮层结节和脑白质放射状移行线、室管膜下结节、室管膜下巨细胞星形细胞瘤、心脏横纹肌瘤、肾血管平滑肌脂肪瘤和淋巴血管肌瘤病(≥2);次要标准包括牙釉小凹(≥3)、口腔纤维瘤(≥2)、非肾性错构瘤、视网膜无色性斑块、咖啡牛奶斑、多囊肾。
目前TSC的诊断标准主要涉及临床表现和影像学检查。尽管TSC是一种常染色体显性遗传病,但家族史阴性者亦不能排除诊断,因70%~80%患者为自发性基因突变而发病;其次,不存在典型TSC临床表现者亦不能排除诊断,因TSC临床表现可呈多样化,并非局限在某些症状上;最后,TSC诊断的确立并非一定需要致病基因检测,若有条件进行致病基因检测且发现存在致病性突变,则不论是否符合诊断标准,都可以确诊。
TSC的年发生率介于1/6000~1/10000人[4],可以导致全身脏器和组织产生良性肿瘤,特别是神经系统。病灶主要累及大脑皮层、侧脑室和白质,很少累及小脑和延髓。目前认为,TSC的病理机制是基因产物的表达和功能出现异常,即组织中TSC2基因的产物结节蛋白和TSC1基因的产物错构瘤蛋白。这两种蛋白相互作用形成的结节蛋白-错构瘤蛋白复合体是细胞内mTOR信号通路的重要组成部分,特别是在控制细胞生长上。近年来越来越多文献报道TSC患者合并神经内分泌肿瘤,如垂体瘤(ACTH、GH)、甲状旁腺腺瘤、甲状旁腺增生、胰岛素瘤、胰促胃液素瘤、胰岛细胞瘤、恶性胰岛细胞瘤、支气管类癌等。
2.1 中枢神经系统表现
神经系统症状是TSC最常见、致残率最高的表现。可能机制在于TSC1和TSC2基因突变导致神经细胞和神经胶质细胞的异常分化和增殖以及异常的细胞迁移。TSC最典型的中枢神经系统异常是皮质结节、室管膜下结节、室管膜下巨细胞星形胶质细胞瘤以及白质异常。约95%患者存在皮质结节,因此命名为结节性硬化。这些结节常累及皮质及皮质下,有时见于小脑,大小可由mm~cm不等。组织学上它们由排列紊乱的锥体束神经元以及形态不良的巨大星形胶质细胞组成。尽管CT可以识别结节,但最佳的评估工具是MRI。T1加权像显示为低信号,T2加权像和Flair显示为高信号。但在婴儿和儿童因白质不成熟且未髓鞘化,结节在T1加权像上显示为高信号,T2加权像显示为低信号,从而导致在T1加权像较易识别。结节一般不会出现强化,但可能会出现钙化。室管膜下巨细胞星形胶质细胞瘤更易发生在TSC2突变患者中,约2.2%TSC患者出生时已存在[5]。
TSC可以导致致残性神经系统障碍如癫痫、智能减退、自闭症等[6-7]。约92%患者出现癫痫,并构成该病病死率的1个主要原因。癫痫主要出现在婴儿时期或儿童早期,但可以发生在任何年龄。研究显示TSC患者认知功能障碍程度与癫痫发病年龄有关,而与脑内结节数量无关[8]。认知功能障碍亦被认为是TSC常见的神经系统症状。既往认为,智能减退不可避免。早期基于人群的研究显示,50%~65%患者存在认知功能障碍,但这些研究并未采用标准的心理学评估方法[9]。但最近研究显示,许多TSC患者智力正常。TSC患者的IQ主要表现为双峰分布,绝大部分患者IQ要么正常要么严重受损。即便IQ正常,与其兄弟姐妹相比,IQ值仍降低12分,提示TSC仍然对智力存在潜在影响。自闭症谱系疾病在TSC患者中亦较常见,发生率17%~61%[10]。但在自闭症谱系疾病患者中TSC患者占1%~4%[11]。这些疾病存在一些共同的临床症状如社交障碍、交流障碍、兴趣受限以及重复动作。智能减退和癫痫是自闭症谱系疾病的危险因素。伴发婴儿痉挛症者危险度越高,但单独不足以增加自闭症的风险。许多关于自闭症和结节位置的研究显示,颞叶结节与自闭症谱系疾病有关。一项近期的研究显示,颞叶结节、颞叶癫痫样放电、婴儿痉挛症病史者发展为自闭症的风险较高[11]。然而,亦有研究显示额叶、后部、小脑结节可能与自闭症有关[13]。
2.2 皮肤表现
皮肤表现在TSC患者中很常见,包括色素脱失斑、面部皮脂腺瘤、前额部斑块、鲨皮斑,通常是导致诊断的第一条线索。色素脱失斑存在于61%~97.2%患者中[14],通常在出生时即存在,且随着时间延长逐渐增多。面部皮脂腺瘤是TSC的特征性表现,超过70%的患者存在。学龄前期开始出现,大小和数量因人而异,随时间逐渐散开为丘疹样、红斑样、粉色的皮损,呈双侧对称性分布,最常见于面颊和鼻子,有时累及前额及下巴等部位[15]。目前治疗面部皮脂腺瘤的方法包括冷冻、激光、电灼、化学剥脱以及手术切除、磨削和药物治疗[16]。前额斑块与面部皮脂腺瘤相似,但更大,呈肉色或红斑样,高出皮面。出现年龄更晚,且更少见,约见于18.9%的患者[17]。
2.3 肾脏表现
大部分患者存在肾脏表现,包括血管平滑肌脂肪瘤、单纯肾囊肿、多囊肾、肾细胞癌。这些病损多数在婴儿期或儿童早期出现,随着年龄增长其大小和数量逐渐增加。血管平滑肌脂肪瘤约见于80%患者中[18],通常双侧受累,为良性肿瘤,由异常血管、不成熟平滑肌细胞和脂肪组成。血管平滑肌脂肪瘤可以逐渐长大,形成动脉瘤而破裂出血。肾囊肿在TSC中亦很常见,约17%的儿童存在,约47%的成人存在,多为双侧存在[19]。肾囊肿较血管平滑肌脂肪瘤更容易出现临床症状,可以侵犯正常肾脏组织而导致肾衰竭或高血压。TSC患者出现多囊肾可能是由于成人多囊肾基因与TSC2基因相连导致的相邻基因综合征[20]。肾脏受累是TSC患者第二常见的死亡原因。肾细胞癌较少见,约占TSC患者的3%,年龄多位于50岁以下。
2.4 心脏表现
心脏横纹肌瘤是婴儿和儿童心脏内最常见的肿瘤,与TSC密切相关。30%~50%患者存在[21],好发于心室,但也可发生于心房,常存在多个,双侧不对称,体积较大的腔内横纹肌瘤会导致流出道和流入道梗阻,从而导致心脏衰竭。横纹肌瘤是TSC的早期表现,孕22~28周就可以出现,因此可以通过胎儿超声对TSC进行诊断[22]。大多数心脏横纹肌瘤并不随着时间长大,一般维持原状或逐渐缩小。心脏横纹肌瘤可以完全消退,但具体机制不明,因此对于有症状者可以保守处理症状,手术切除可以在威胁生命时再考虑。
2.5 肺部表现
淋巴管肌瘤病被认为是TSC不常见的表现,几乎只发生于女性患者,特别是年龄介于30~35岁之间者。它是由不典型的平滑肌在肺部支气管、血管以及淋巴管周围增生导致的一种罕见疾病,被认为与TSC1和TSC2基因突变有关。临床上,淋巴管肌瘤病是一种进行性肺部疾病,可导致呼吸困难、自发性气胸、咯血、咳嗽、乳糜胸、胸痛等症状。纵单单等人报道了2例肺部淋巴管肌瘤病患者,胸部CT均显示双肺弥漫性大小不等薄壁囊腔性病变[23]。淋巴管肌瘤病最终可导致呼吸衰竭和死亡。治疗方法有限,抗雌激素治疗效果不一。多灶性结节性增生、透明细胞肿瘤也可发生于TSC患者中。
2.6 眼部表现
非视网膜表现包括眼睑血管纤维瘤、斜视、白内障、虹膜色素消失等。Freiberg等人报道了1例儿童结膜淋巴管瘤,患儿最终诊断为结节性硬化症[24]。视网膜表现中最常见的是星形细胞错构瘤,存在40%~50%的患者中[1]。三种常见的视网膜错构瘤形态如下[25]:(1) 相对平滑、非钙化、半透明、灰色病灶;(2)高出的、钙化的、桑葚样病灶;(3)过渡性病灶,介于以上两者之间。非钙化性错构瘤最常见,通常位于视网膜极点的后面。钙化的、结节样、桑葚样病灶通常位于视盘边缘。视网膜错构瘤被认为是静止性病灶,几乎不会导致视觉丧失。侯明勃等人报道了1例结节性硬化症伴视网膜星形细胞错构瘤患者,主要症状为右眼间断性视物模糊3年伴头痛[26]。OCT检查示病灶位于视网膜层间,神经纤维层增厚,病灶表面内层视网膜组织平滑,波浪状起伏,病灶呈囊样低反射灶,低反射周围大量点状高反射,呈蚕蚀样。
2.7 神经内分泌肿瘤(neuroendocrine tumours, NETs)
少数TSC患者出现垂体瘤,包括分泌生长激素、催乳素或促肾上腺皮质激素。分泌生长激素者可表现为肢端肥大症;分泌催乳素者可表现为高泌乳素血症、闭经;分泌促肾上腺皮质激素者可表现为库欣综合征、体重增长、脂肪分布异常、痤疮等。
TSC患者亦可出现甲状旁腺瘤,可表现为甲状旁腺功能亢进、高钙血症、食欲减退、偶尔恶心、呕吐、烦渴、多尿和便秘、全身性骨质疏松症。
胰腺促胃液素瘤罕见,表现为反流性食管炎和体重明显下降。此外,TSC患者可出现恶性胰岛细胞肿瘤,为腹膜后浸润性肿瘤,可伴有淋巴转移。嗜铬细胞瘤亦罕见,目前只有1例报道,患者表现为反复发热和右上腹疼痛,超声显示肾上腺肿块,活检示嗜铬细胞瘤。
TSC合并胰岛细胞瘤在过去几十年中只有6例报道,国内尚未见报道。1959年Gutman和 Leffkowitz[27]报道了1例幼时诊断为TSC的患者,18岁开始出现癫痫发作,发生在早晨,患者喜欢往茶里加很多糖。1992年Davoren和 Epstein[28]报道了1例患者,15年后再发癫痫,经过抗癫痫等多种治疗效果不佳,且易疲劳、嗜睡、对甜食需求大。1995年Kim等人[29]报道了1例28岁伴有智能减退的患者出现新的症状包括易激惹等行为改变、有时嗜睡。2001年Mohsen等人报道了1例因意识模糊、言语含糊和低血糖收入院的患者,体检发现腹部包块,手术切除后患者恢复良好,无神经系统症状复发,证实是由胰岛素瘤引起的神经系统症状。2009年Berre等[30]人报道了一例41岁男性患者因低血糖导致抽搐,最后证实是由胰岛素瘤引起。2010年Comninos[31]报道了1例67岁女性,多年前因血管肌脂瘤而行双肾切除术,术后一直行血液透析,2年来反复低血糖,CT扫描、DOTOTATE-PET扫描发现胰头肿块,组织学检查证实为胰岛素瘤。以上所有的患者均有低血糖和高胰岛素血症。
胰岛细胞瘤包括胰岛素瘤和无功能胰岛细胞瘤。胰岛素瘤是胰腺最常见的神经内分泌肿瘤,年发病率为1/1000000[4]。胰岛素瘤可引起的神经系统症状包括痫性发作、震颤、易激惹、虚弱、发汗、心动过速、人格改变、意识模糊、昏迷等。以上病例提示,TSC患者新发的神经系统症状或原始症状加重可能与胰岛素瘤导致的低血糖有关。Dworakowska等于2009年发表了一篇关于探讨NETs如垂体瘤、甲状旁腺瘤和胰岛素瘤等与TSC相关性的综述[4]。研究结论是TSC可能与胰岛细胞瘤特别是胰岛素瘤相关。
综上所述,应该对怀疑TSC的所有患儿进行痫性发作、发育迟滞和自闭症谱系疾病等全面筛查。同时应该完善眼科检查、颅脑影像(CT或MRI)、心电图、心脏彩超和肾脏彩超等检查。后续的检查则根据患者的脏器受累情况进行决定。对TSC患者,应注意是否合并NETs。
[1] Rosser Tena,Panigrahy Ashok,Mcclintock William.The diverse clinical manifestations of tuberous sclerosis complex: a review[J].Semin Pediatr Neurol,2006,13(1):27-36.
[2] Eledrisi S,Stuart A,Alshanti Mohammad.Insulinoma in a patient with tuberous sclerosis: is there an association?[J].Endocr Pract,2002,8(2):109-112.
[3] Belousova ED,Dorofeeva MY,Pivovarova AM,et al.Diagnosis of tuberous sclerosis complex[J].Zh Nevrol Psikhiatr Im S S Korsakova,2015,115(10):89-95.
[4] Dworakowska Dorota,Grossman B.Are neuroendocrine tumours a feature of tuberous sclerosis? A systematic review[J].Endocr Relat Cancer,2009,16(1):45-58.
[5] O'callaghan J,Martyn N,Renowden S,et al.Subependymal nodules, giant cell astrocytomas and the tuberous sclerosis complex: a population-based study[J].Arch Dis Child,2008,93(9):751-754.
[6] Habib L,Al-Obaidi Y,Nowacki Maciej,et al.Is mTOR inhibitor good enough for treatment all tumors in TSC patients?[J].J Cancer,2016,7(12):1621-1631.
[7] Christophe C,Sékhara T,Rypens F,et al.MRI spectrum of cortical malformations in tuberous sclerosis complex[J].Brain Dev,2000,22(8):487-493.
[8] Kaczorowska M,Jurkiewicz E,Domańska-Pakiea D,et al.Cerebral tuber count and its impact on mental outcome of patients with tuberous sclerosis complex[J].Epilepsia,2011,52(1):22-27.
[9] Joinson C,O'callaghan J,Osborne P,et al.Learning disability and epilepsy in an epidemiological sample of individuals with tuberous sclerosis complex[J].Psychol Med,2003,33(2):335-344.
[10]Dowling M,Curatolo P,In CP,(ed):tuberous sclerosis complex:from basic science to clinical phenotypes[M].[ London]: mac keith press,2003: pp 91-pp108.
[11]Smalley SL,Tanguay PE,Smith M,et al.Autism and tuberous sclerosis[J].J Autism Dev Disord,1992,22(3):339-355.
[12]Curatolo P,Cusmai R,Cortesi F,et al.Neuropsychiatric aspects of tuberous sclerosis[J].Ann N Y Acad Sci,1991,615:8-16.
[13]Weber M,Egelhoff C,Mckellop M,et al.Autism and the cerebellum: evidence from tuberous sclerosis[J].J Autism Dev Disord,2000,30(6):511-517.
[14]Vanderhooft L,Francis S,Pagon A,et al.Prevalence of hypopigmented macules in a healthy population[J].J Pediatr,1996,129(3):355-361.
[15]Vasani J.Facial angiofibromas of tuberous sclerosis treated with topical sirolimus in an Indian patient[J].Indian J Dermatol,2015,60(2):165-169.
[16]徐冉.结节性硬化病面部血管纤维瘤的治疗进展[J].组织工程与重建外科杂志,2016,12(02):134-136.
[17]O'callaghan J,Noakes J,Martyn N,et al.An epidemiological study of renal pathology in tuberous sclerosis complex[J].BJU Int,2004,94(6):853-857.
[18]Casper A,Donnelly F,Chen Bin,et al.Tuberous sclerosis complex: renal imaging findings[J].Radiology,2002,225(2):451-456.
[19]Sampson R,Maheshwar M,Aspinwall R,et al.Renal cystic disease in tuberous sclerosis: role of the polycystic kidney disease 1 gene[J].Am J Hum Genet,1997,61(4):843-851.
[20]Hinton B,Prakash Ashwin,Romp L,et al.Cardiovascular manifestations of tuberous sclerosis complex and summary of the revised diagnostic criteria and surveillance and management recommendations from the International Tuberous Sclerosis Consensus Group[J].J Am Heart Assoc,2014,3(6):e001493.
[21]Bader S,Chitayat David,Kelly Edmond,et al.Fetal rhabdomyoma: prenatal diagnosis, clinical outcome, and incidence of associated tuberous sclerosis complex[J].J Pediatr,2003,143(5):620-624.
[22]Nathan Neera,Wang an,Li Shaowei,et al.Improvement of tuberous sclerosis complex (TSC) skin tumors during long-term treatment with oral sirolimus[J].J Am Acad Dermatol,2015,73(5):802-808.
[23]纵单单,刘彩虹,石志辉,等.结节性硬化症合并肺淋巴管肌瘤病2例诊治体会[J].中南大学学报:医学版,2016,41(07):771-776.
[24]Freiberg Joyce,Kunstmann Erdmute,König Thomas,et al.Conjunctival lymphangioma in a 4-year-old girl revealed tuberous sclerosis complex[J].GMS ophthalmology cases,2016,6:Doc09.
[25]Zhang Qiao,Shen Cheng,Long Qin,et al.Sirolimus for retinal astrocytic hamartoma associated with tuberous sclerosis complex[J].Ophthalmology,2015,122(9):1947-1949.
[26]侯明勃,彭晓燕.结节性硬化症伴视网膜星形细胞错构瘤一例[J].中华眼科杂志,2016,52(08):622-624.
[27]Gutman A,Leffkowitz M.Tuberous sclerosis associated with spontaneous hypoglycaemia[J].Br Med J,1959,2(5159):1065-1068.
[28]Davoren M,Epstein T.Insulinoma complicating tuberous sclerosis[J].J Neurol Neurosurg Psychiatry,1992,55(12):1209.
[29]Kim H,Kerr A,Morehouse H.The association between tuberous sclerosis and insulinoma[J].AJNR Am J Neuroradiol,1995,16(7):1543-1544.
[30]Le Berre P,Bey Boeglin M,Duverger V,et al.Seizure and bourneville tuberous sclerosis: think about insulinoma[J].Rev Med Interne,2009,30(2):179-180.
[31]Comninos AN,Badman M,Troke R,et al.An insulinoma in a patient with tuberous sclerosis:Association or coincidence[J].Regul Pept,2010,164(1):14.
(2016-10-24收稿)
430060 武汉大学人民医院儿科[黄婷婷 姚宝珍(通信作者) 牛萍 张海菊 凌伟]
R747.8
A
1007-0478(2017)04-0359-05
10.3969/j.issn.1007-0478.2017.04.022

