芦丁、槲皮素对小麦蛋白的荧光猝灭作用
任顺成,孙晓莎,陈茹雪
(河南工业大学 粮油食品学院,河南 郑州 450001)
芦丁、槲皮素对小麦蛋白的荧光猝灭作用
任顺成,孙晓莎,陈茹雪
(河南工业大学 粮油食品学院,河南 郑州 450001)
采用荧光光谱法,研究不同浓度的芦丁和槲皮素对小麦蛋白内源荧光的猝灭作用。结果表明:随着芦丁、槲皮素溶液浓度的增加,小麦清蛋白、球蛋白、醇溶蛋白和谷蛋白的内源荧光强度均逐渐降低,猝灭类型为静态,表明芦丁、槲皮素分别和4种小麦蛋白形成了新的复合物。相比于芦丁,槲皮素对4种小麦蛋白荧光猝灭作用更强。芦丁猝灭4种小麦蛋白内源荧光强弱顺序依次为:清蛋白>谷蛋白>醇溶蛋白>球蛋白;槲皮素猝灭4种小麦蛋白内源荧光强弱顺序依次为:谷蛋白>醇溶蛋白>球蛋白>清蛋白。
荧光光谱法;芦丁;槲皮素;小麦蛋白
0 引言
药理研究表明,苦荞麦具有治疗糖尿病、降血糖、降低血脂以及抗氧化等作用[1-2],作为苦荞麦中的重要黄酮物质——芦丁和槲皮素,被证实对人体具有医疗保健的功效,被广泛应用于食品和医药开发[3-4]。
小麦蛋白包括清蛋白、球蛋白、醇溶蛋白和谷蛋白,在不同溶剂中,4种蛋白质的溶解性不同。由于荞麦粉常被用来和小麦粉混合食用,荞麦中的芦丁和槲皮素与小麦蛋白之间的相互作用,会引起小麦蛋白结构特性和功能特性的改变,如起泡性和乳化性。这种相互作用使得黄酮类化合物与蛋白质的氨基酸侧链形成复合物,主要结合力类型是氢键和疏水作用[5],且两者之间的相互作用受到黄酮类化合物的水溶性[6]、大小和结构[7]、蛋白质的大小、氨基酸组成以及结构[8-9]等多种因素的影响。
由于蛋白质分子具有荧光性,因此利用荧光光谱分析蛋白质结构、特性的研究越来越多。分子荧光光谱分析具有灵敏度高、选择性强、用量少、操作简便等特点[10],在生命科学中的应用较多,如多种氨基酸的分析[11]、酶[12]和蛋白质[13]作用研究等。但目前有关芦丁和槲皮素对小麦蛋白的荧光猝灭研究较少,因此此次利用荧光光谱法,研究不同浓度芦丁和槲皮素分别对4种小麦蛋白质——清蛋白、球蛋白、醇溶蛋白和谷蛋白的荧光猝灭类型和猝灭强度差异,比较两者结合作用的强弱,为了解芦丁和槲皮素与小麦蛋白的相互作用,以及两者在小麦蛋白质制品中的应用提供理论依据。
1 材料与方法
1.1 试验材料
芦丁(97%)、槲皮素(95%):上海源叶生物有限公司;甲醇(AR):天津市科密欧化学试剂有限公司;Tris(AR):上海山浦化工有限公司;盐酸(36.0%~38.0%):洛阳昊华化学试剂有限公司。
1.2 仪器与设备
RF-5301PC型荧光分光光度计:日本岛津公司;PHS-3C型雷磁酸度计:上海仪电科学仪器股份有限公司;HZT-B5000型电子天平:福州华志科学仪器有限公司;FA1004数显电子分析天平:上海上平仪器公司;GL-88B型漩涡混匀器:海门市其林贝尔仪器制造有限公司。
1.3 试验方法
1.3.1 小麦蛋白的分离提取
以小麦面粉为试验原料,利用Osborne法分级提取小麦蛋白,试验流程如图1所示。采用磁力搅拌器搅拌并控制试验过程温度。上清液A、B、C、D中分别含有小麦清蛋白、球蛋白、醇溶蛋白和谷蛋白。采用旋转式蒸发器蒸发浓缩蛋白提取液。

图1 Osboren法分级提取小麦蛋白流程Fig.1 The flow chart of wheat protein extracted by Osboren method
1.3.2 芦丁和槲皮素对小麦蛋白的荧光猝灭光谱和猝灭效应的Stern-Volmer曲线测定
用少量乙醇溶解一定量的芦丁和槲皮素,将其配制成1×10-5mol/L溶液;将4种蛋白溶液稀释配制成质量分数为0.5%的分散溶液,置于4℃下冷存,备用。取9支试管,均加入1 mL质量分数为0.5%的小麦蛋白溶液后,每支试管再分别加入0~8 mL的芦丁溶液,最后用Tris-HCl(pH=7.40)缓冲液稀释定容至10 mL;系列浓度的槲皮素溶液配制同芦丁。用漩涡混匀器混匀后,置于37℃恒温水浴锅中温浴45 min,固定激发波长为280 nm,荧光激发和发射狭缝均设为5 nm,扫描290~450 nm范围内的荧光光谱,测荞麦芦丁、槲皮素溶液对小麦蛋白的内源荧光猝灭光谱。
2 结果与分析
2.1 槲皮素和芦丁对小麦蛋白的荧光猝灭光谱测定
图2—图9为槲皮素和芦丁分别对4种小麦蛋白的荧光强度猝灭光谱图。由图2—图9可知,小麦蛋白溶液的浓度不变,随着槲皮素、芦丁溶液浓度的增加,清蛋白、球蛋白、醇溶蛋白和谷蛋白的内源荧光强度均逐渐降低,表明荞麦槲皮素、芦丁能有效猝灭小麦蛋白的内源荧光;最大发射峰位置蓝移,表明槲皮素、芦丁与小麦蛋白发生了相互作用,使小麦蛋白分子的荧光发色团微环境和空间构象发生了变化,进而使色氨酸周围的微环境疏水性更强,肽链伸展性降低[14]。分别对比图2和图 3、图 4和图 5、图 6和图 7、图 8和图 9,可知槲皮素对4种小麦蛋白荧光强度的猝灭程度均强于芦丁。
早期研究表明多酚和蛋白质的结合主要形式为氢键,然而深入研究发现,两者的结合方式不止为氢键相互作用,疏水键也为一种重要的相互作用形式。影响两者结合的影响因素包括蛋白质和多酚两个层面:分子质量较大,结构开放松散,脯氨酸或其他疏水性氨基酸含量高的蛋白质和多酚亲和性较高[15];多酚的酚羟基和疏水基数量多者,具有柔性的分子构型者以及水溶性低者,亲和性较高,同时多酚的分子大小也会影响亲和性[6]。由于槲皮素较芦丁的水溶性更低,但酚羟基含量相同,因此前者对4种小麦蛋白的荧光强度影响较大。同时,有研究表明:植物多酚和蛋白质的共价或非共价结合可使蛋白质免于自由基的攻击,两者是通过氨基酸侧链和多酚芳香环之间的各种弱作用力,一般是疏水相互作用,因此结合主要发生在暴露的疏水性表面[16-17]。蛋白质的荧光发色基团主要为能吸收270~300 nm紫外光的酪氨酸、色氨酸或苯丙氨酸残基[10]。
有研究表明:多酚能够增强蛋白质的多种功能特性,可作为奶制品的功能特性改良剂[6],如儿茶素与蛋白质形成了疏水键和氢键,因而有效增强了β-乳球蛋白的发泡能力和泡沫稳定性,咖啡酸能增强牛奶的稳定性;作为供体的多酚和作为受体的蛋白质的结合是分子识别的典型例子;在食品工业方面,利用两者的络合作用可实现对多种蛋白质的回收。因此,芦丁和槲皮素与蛋白质的相互作用可有效改善小麦蛋白的多种功能特性,大大提高小麦蛋白资源的利用率。
2.2 芦丁和槲皮素对小麦蛋白荧光猝灭效应的Stern-Volmer曲线测定
荧光猝灭过程可分为动态猝灭和静态猝灭。动态猝灭是激发态荧光分子与猝灭剂碰撞使光的强度减弱,而静态猝灭是指处于基态荧光分子与猝灭剂之间形成不发光的复合物。动态猝灭可由Stern-Volmer方程表示。
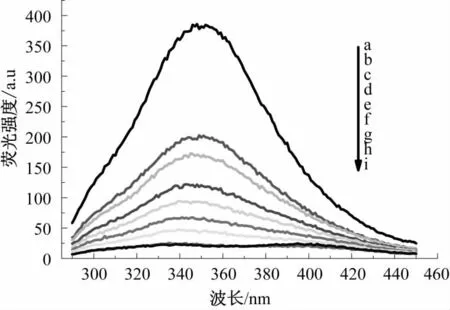
图2 槲皮素溶液浓度对清蛋白荧光强度的影响Fig.2 Effect of quercetion solution concentration on the fluorescence intensity of wheat albumin

图3 芦丁溶液浓度对清蛋白荧光强度的影响Fig.3 Effect of rutin solution concentration on the fluorescence intensity of wheat albumin
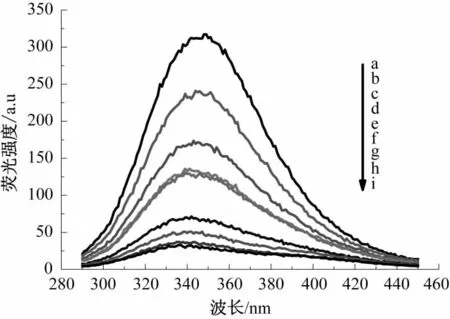
图4 槲皮素溶液浓度对球蛋白荧光强度的影响Fig.4 Effect of quercetion solution concentration on the fluorescence intensity of wheat globulin

图5 芦丁溶液浓度对球蛋白荧光强度的影响Fig.5 Effect of rutin solution concentration on the fluorescence intensity of wheat globulin
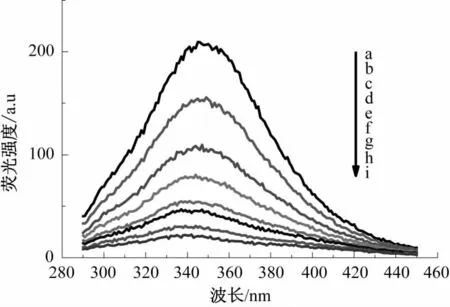
图6 槲皮素溶液浓度对醇溶蛋白荧光强度的影响Fig.6 Effect of quercetion solution concentration on the fluorescence intensity of wheat gliadin
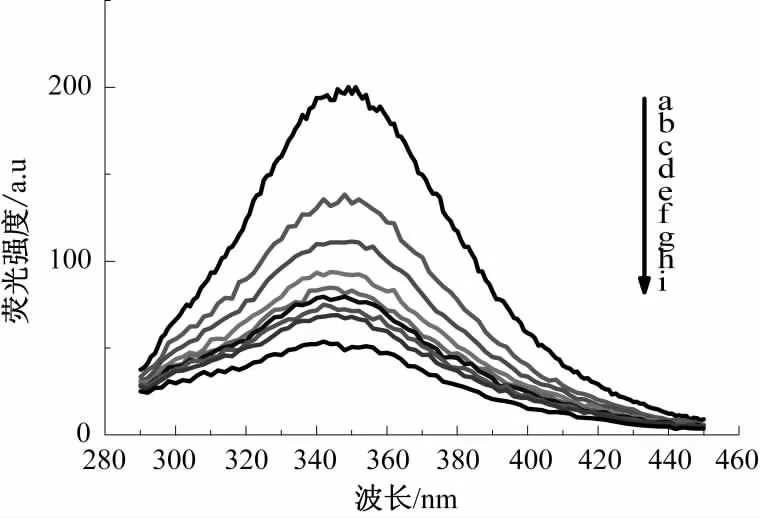
图7 芦丁溶液浓度对醇溶蛋白荧光强度的影响Fig.7 Effect of rutin solution concentration on the fluorescence intensity of wheat gliadin

图8 槲皮素溶液浓度对谷蛋白荧光强度的影响Fig.8 Effect of quercetion solution concentration on the fluorescence intensity of wheat glutenin
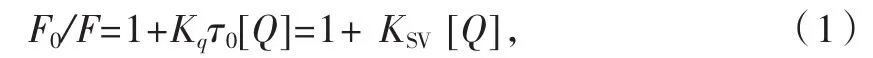

图9 芦丁溶液浓度对谷蛋白荧光强度的影响Fig.9 Effect of rutin solution concentration on the fluorescence intensity of wheat glutenin
式中:F0为无猝灭剂情况下的荧光强度;F为猝灭剂存在时的荧光强度;Kq为双分子猝灭速率常数,L·mol-1·s-1,τ0为猝灭剂不存在时荧光体的寿命,生物大分子的平均寿命约为10-8s[18];KSV为Stern-Volmer常数;[Q]为猝灭剂(芦丁或槲皮素)溶液的浓度。Stern-Volmer方程表明,F0/F与猝灭剂的浓度具有线性关系,若以F0/F对[Q]作图可得一条直线,从而求出直线的斜率KSV。
静态猝灭的方程为:

这个关系式与动态猝灭的相似,只是猝灭常数被配合物的形成常数K所替代。两种猝灭方式的区别是:动态猝灭只影响荧光分子的激发态,所以其吸收光谱不改变,但基态配合物却能引发荧光物质吸收光谱的变化。
先假设芦丁、槲皮素和小麦蛋白的相互作用为动态猝灭方式,根据Stern-Volmer方程,以[Q]为自变量,F0/F为因变量,通过线性拟合得图10、图11,由图中直线的斜率和τ0可得到不同浓度下芦丁和槲皮素与小麦蛋白相互作用的KSV和Kq,结果见表1。
结合图10、图11、表1可看出,芦丁和槲皮素对小麦面粉中的4种蛋白溶液内源荧光均有猝灭作用,但猝灭强度不同。芦丁和槲皮素对小麦蛋白的双分子猝灭常数Kq均远远大于各类猝灭剂对生物大分子的最大扩散常数 2.00×1010L·mol-1·s-1,因此,其猝灭类型为静态猝灭。动态猝灭是激发态荧光分子与猝灭剂碰撞使光的强度减弱,两者之间并不形成复合物,而静态猝灭是指处于基态荧光分子与猝灭剂之间形成不发光的复合物,由此可知,芦丁和槲皮素均与4种小麦蛋白发生了化学作用,形成了新的复合物。芦丁对小麦4种蛋白的结合作用强度强弱为清蛋白>谷蛋白>醇溶蛋白>球蛋白;槲皮素对小麦4种蛋白的结合作用强度强弱为谷蛋白>醇溶蛋白>球蛋白>清蛋白。
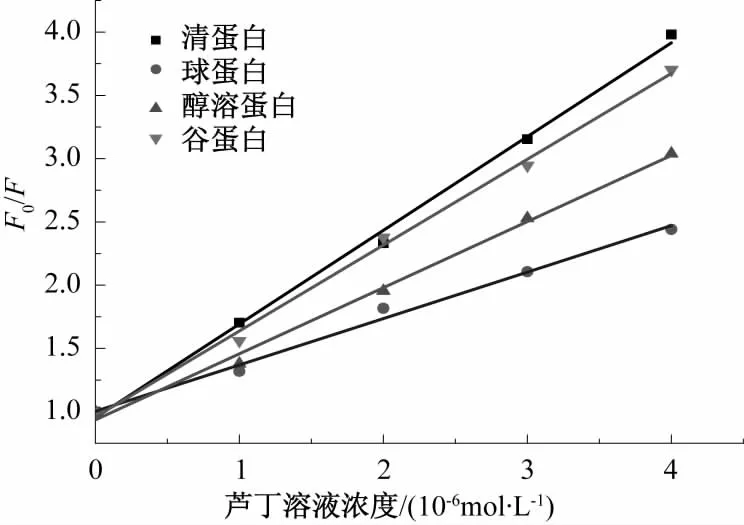
图10 芦丁溶液对小麦蛋白荧光猝灭的Stern-Volmer方程曲线Fig.10 The Stern-Volmer linear plot of fluorescence quenching of wheat protein by rutin solution
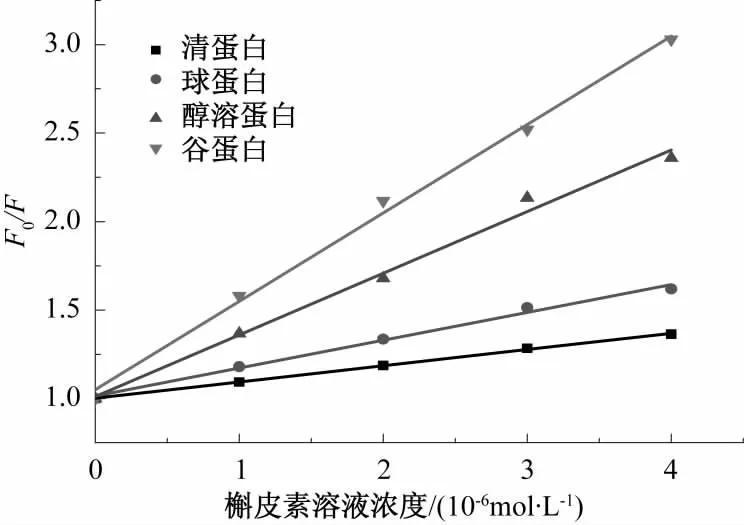
图11 槲皮素溶液对小麦蛋白荧光猝灭的Stern-Volmer方程曲线Fig.11 The Stern-Volmer linear plot of fluorescence quenching of wheat protein by quercetion solution
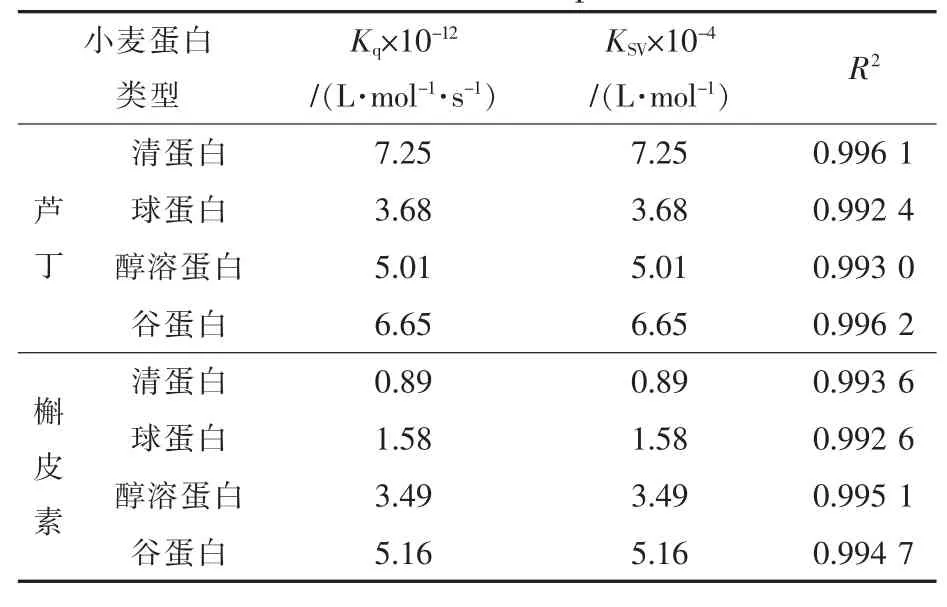
表1 芦丁、槲皮素与小麦蛋白相互作用的Kq与KSV值Table 1 The Kqand KSVof rutin and quercetion interact with wheat protein
比较芦丁对4种蛋白荧光猝灭强度可知,芦丁对清蛋白的内源荧光猝灭强度最大,其次是谷蛋白和醇溶蛋白,对球蛋白的荧光猝灭强度最小。同种多酚对不同蛋白质的亲和力不同,分子质量较大,结构开放松散,脯氨酸或其他疏水性氨基酸含量高的蛋白质和多酚亲和性较高,清蛋白分子呈球形,表面有孔,且溶解度大;谷蛋白分子质量较大,呈纤维状,不溶于水[19],是大分子聚合体,结构松散;醇溶蛋白分子质量较小,呈球状,是单体蛋白,组成多为非极性氨基酸,分子内有二硫键;球蛋白表面疏松,分子质量较小,易溶于水,经侧链环境分析得知酪氨酸残基趋于全部暴露于溶剂中,而其色氨酸趋向于埋藏。由此可知,芦丁对分子质量大的蛋白荧光猝灭效果更加明显,可归因于此类蛋白质中显色基团较多;槲皮素对不溶于水的蛋白质猝灭效果更加明显,因此槲皮素对疏水性氨基酸含量高的小麦蛋白亲和性较强。
3 结论
采用荧光光谱法研究芦丁和槲皮素对小麦蛋白的荧光猝灭作用。结果表明:随着芦丁、槲皮素溶液浓度的增加,小麦清蛋白、球蛋白、醇溶蛋白和谷蛋白的内源荧光强度均逐渐降低,猝灭类型为静态,槲皮素较芦丁对小麦蛋白的荧光猝灭作用更强。芦丁猝灭4种小麦蛋白内源荧光强弱顺序依次为清蛋白>谷蛋白>醇溶蛋白>球蛋白;槲皮素猝灭的强弱顺序依次为谷蛋白>醇溶蛋白>球蛋白>清蛋白。
[1] S MITH J B,STASHWICK C,POWELL D J.B7-H4 as a potential target for immunotherapy for gynecologic cancers:A closer look[J].Gynecologic Oncology,2014,134(1):181-189.
[2] DANGAJ D,SCHOLLER N.Blocking the B7-H4 pathway with novel recombinant antibodies enhances T cell-mediated antitumor responses[J].Oncoimmunology,2013,2(8):e25913.
[3] WESTON L A,MATHESIUS U.Flavonoids:their structure,biosynthesis and role in the rhizosphere,including allelopathy [J].Journal of Chemical Ecology,2013,39(2):283-297.
[4] 王飞,樊金拴,冯慧英,等.青扦针叶总黄酮超声提取及抗氧化活性[J].西北林学院学报,2016,31(1):243-249.
[5] 綦菁华,蔡同一,庞美霞,等.影响蛋白质-酚类聚合物形成的因素研究[J].中国食品学报,2009,9(6):78-82.
[6] 覃思,吴卫国.茶多酚对蛋白质功能特性影响研究初探[J].中国食物与营养,2005(5):32-33.
[7] WU X,WU H,LIU H,et al.Analysis of binding interaction between(-)-epigallocatechin(EGC) and β lactoglobulin by multi spectroscopic method[J].Spectrochimica ActaPart A:Molecular and Biomolecular Spectroscopy,2011,82:164-168.
[8] SHI B,HE X,HASLAM E.Polyphenol-gelation interaction [J].Journal of the American Leather Chemists Association,1994,89(4):98-104.
[9] 阚茗铭,叶发银,赵国华.多酚-蛋白质共价作用及其对食品体系的影响研究进展[J].食品科学,2015,36(1):245-249.
[10] 吕品.一些与生物相关分子作用的荧光猝灭光谱分析[D].长沙:长沙理工大学,2011.
[11] 陈彦国,何治柯.水溶性荧光聚合物用于测定聚赖氨酸[J].高等学校化学学报,2005,26(8):1428-1431.
[12] 张丽莉,武志杰,陈利军,等.微孔板荧光法对土壤糖酶活性的测定研究[J].光谱学与光谱分析,2009,29(5):1341-1344.
[13] 崔凤灵,闫迎华,张强斋,等.同步荧光法测定生物样品中蛋白含量的研究[J].光谱学与光谱分析,2009,29(12):2531-2534.
[14] 刘勤勤,朱科学,郭晓娜,等.茶多酚与大豆分离蛋白的相互作用[J].食品科学,2015,36(17):43-47.
[15] ASQUITH T N,BUTLER L G.Interactions of condensed tannins with selected proteins[J].Phytochemistry,1986,25(7):1591-1593.
[16] VON STASZEWSKI M,JAGUS R J,PILOSOF A M R.Influence of green tea polyphenols on the colloidal stability and gelation of WPC[J].Food Hydrocolloids,2011,25(5):1077-1084.
[17] 王乐田,贾娜.植物多酚对肉制品脂肪氧化和蛋白氧化的抑制机理及应用[J].中国食品学报,2016(8):205-210.
[18] WANG Q S,ZHANG X L,ZHOU X L,et al.Interaction ofdifferentthiol-capped CdTe quantum dots with bovine serum albumin[J].Journal of Luminescence,2012,132(7):1695-1700.
[19] 贾光锋,范丽霞,王金水.小麦面筋蛋白结构、功能性及应用[J].粮食加工,2004,29(2):11-13.
FLUORESCENCE QUENCHING OF WHEAT PROTEIN BY RUTIN AND QUERCETIN
REN Shuncheng,SUN Xiaosha,CHEN Ruxue
(School of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
The interaction between rutin and quercetin and wheat protein can cause the changes of structural and functional characteristics of wheat protein,such as foaming and emulsifying properties.The effect of different concentrations of rutin and quercetin on endogenous fluorescence quenching of wheat protein was investigated by fluorescence spectroscopy.The results showed that the endogenous fluorescence intensity of wheat albumin,globulin,gliadin and glutenin decreased gradually with the increase ofrutin and quercetin solution concentrations,and the quenching type was static,which indicating that a new complex formed with rutin or quercetin and wheat proteins.Compared with rutin,quercetin had stronger effect on fluorescence quenching of four wheat proteins.The order of endogenous fluorescence intensity of four kinds of wheat protein quenching by rutin was as follows:albumin> glutenin> gliadin> globulin;while the order of endogenous fluorescence intensity quenching by quercetin was as follows:glutenin>gliadin>globulin>albumin.Therefore,the fluorescence quenching effect of rutin was more obvious on the protein with higher relative molecular weight;which was attributed to this type of protein with more color groups;the quenching effect of quercetin on the protein insoluble in water was better,suggesting that the affinity of quercetin to wheat protein with high hydrophobic amino acid content was stronger.
fluorescence spectroscopy;rutin;quercetin;wheat protein
TS201.2
:B
1673-2383(2017)04-0001-05
http://kns.cnki.net/kcms/detail/41.1378.N.20170828.0857.002.html
网络出版时间:2017-8-28 8:57:11
2016-12-06
任顺成(1963—),男,山东东明人,教授,研究方向为食品营养与功能食品。

