不同体积分数CO2对红叶石楠试管苗生长的影响
刘保国,李小娟,何松林,2*,王 政,尚文倩,王慧霞,贺 丹
(1.河南农业大学 林学院,河南 郑州 450002; 2.河南科技学院,河南 新乡 453003)
不同体积分数CO2对红叶石楠试管苗生长的影响
刘保国1,李小娟1,何松林1,2*,王 政1,尚文倩1,王慧霞1,贺 丹1
(1.河南农业大学 林学院,河南 郑州 450002; 2.河南科技学院,河南 新乡 453003)
为提高红叶石楠试管苗的质量,以红叶石楠品种红罗宾(Photiniafraseri‘Red Robin’)试管苗为材料,在无糖培养条件下,研究组织培养微环境中不同体积分数CO2[0(CK)、0.1‰、0.2‰、0.3‰]对红叶石楠试管苗生长的影响。结果表明:当CO2体积分数为0.2‰时,红叶石楠试管苗的株高、叶数、叶长、根数、根长、鲜质量、干质量、叶绿素指数、根系活力等指标均达到最大值;CK的叶幅最大,但与其他处理差异不显著;红叶石楠试管苗的地上部干物率随着CO2体积分数增加而下降,而根部干物率随着CO2体积分数增加而上升;气孔密度与气孔面积呈负相关,CO2体积分数为0.2‰时,气孔密度最大,气孔面积最小。综合而言,对红叶石楠试管苗进行无糖培养时,CO2体积分数为0.2‰最适宜生长。
组织培养; 红叶石楠; CO2体积分数
红叶石楠(Photiniafraseri)属蔷薇科石楠属(Photinia),由中国产的石楠(Ph.serrulate)与光叶石楠(Ph.glabra)杂交而成,为常绿小乔木,因其新梢和嫩叶鲜红而得名,被誉为“绿篱之王”“红叶贵妃”等[1],尤其是冬季景观效果好,深受人们的喜爱。近年来,国内外相继开展了红叶石楠的扦插快繁技术和组培快繁技术研究[2-6]。但传统的组织培养,特别是针对木本植物,普遍存在许多问题,如污染率高、移栽成活率低、培养周期长等[7-8]。因此,提高试管苗的光合自养能力,并加快其生长是完善红叶石楠组培技术、缩短生产周期的一种有效途径。
组培环境主要有培养基成分、瓶内气体(CO2及乙烯)、碳源、光照、湿度等[9-10],其中,CO2是植物光合作用所需碳源的主要来源,但是传统的组培容器多采用密封性较好的材料封闭容器口,限制了容器内外的气体交换,使培养物在光照期间处于CO2饥饿状态,进而对植物产生不利影响[11-12]。有研究表明,增施CO2条件下,大花蕙兰、葡萄、彩色马蹄莲、梨、甘薯、非洲菊等[11,13-17]植物的试管苗均提高了光合自养能力,其形态指标(叶长、根长、株高等)以及叶绿素含量、叶片气孔密度等生理生化指标均高于无CO2施用处理。近年来,有关红叶石楠组织培养的报道主要集中在外植体消毒、培养基选择、愈伤组织诱导[1-3]等方面,而有关微环境中CO2体积分数变化对红叶石楠试管苗生长的影响研究未见报道。鉴于此,研究组织培养微环境中不同体积分数CO2对红叶石楠试管苗生长的影响,以期寻求其最佳的培养条件,提高其商品苗质量,为加快其产业化进程提供一定的理论依据和技术支持。
1 材料和方法
1.1材料
1.1.1 试验材料 供试红叶石楠品种为红罗宾(Photiniafraseri‘Red Robin’),试管苗(约1.5 cm高)由鄢陵北方花卉集团提供。将试管苗增殖培养30 d左右,并选取生长状况一致的试管苗作为试验材料。
1.1.2 树脂膜培养容器 CO2施肥培养容器(culture pack,CP)[18]由日本川大香学农学部提供,该容器以高分子树脂膜为材料制作而成,树脂膜厚度为25 μm。
1.2方法
1.2.1 培养方式与条件 参考何松林等[19]的塑膜·岩棉(culture pack rockwool system,CP·RW)培养方式。首先将培养容器和作为培养基支持体的岩棉块灭菌,其中培养容器于121 ℃高压蒸汽灭菌17 min,岩棉块于150 ℃恒温干燥箱内灭菌90 min,之后在超净工作台内将岩棉块移入培养容器内,并注入已灭菌的液体培养基。将红叶石楠试管苗接种完成后,用容器盖封口,即可放入培养室培养,光照强度为25 μmol/(m2·s),光照时数为14 h/d(6:00—20:00),培养温度为(25±1) ℃,培养时间为60 d。
1.2.2 接种方法 从三角瓶中挑选出大小均一的试管苗(株高约2.5 cm),在无菌条件下接入CP培养容器内(每孔接种1株)。每容器接种25株试管苗,每处理重复3次。
1.2.3 CO2体积分数处理设置 培养箱内CO2体积分数由CO2控制仪进行控制,其体积分数分别设置为0(CK)、0.1‰、0.2‰、0.3‰,将红叶石楠试管苗接种于岩棉支持体上进行生根诱导,生根培养基为1/2MS+NAA 0.5 mg/L+IAA 0.5 mg/L,培养基用量为180 mL,pH=5.8。
1.2.4 形态及生理指标的测定
1.2.4.1 形态指标 形态指标分别为株高、叶数、叶长(试管苗自下而上的第3片叶)、叶幅、根数、最长根长,整株鲜质量与干质量、地上部鲜质量与干质量、根部鲜质量与干质量,整株干物率、地上部干物率和根部干物率。以上各指标在试管苗培养60 d后,随机选取15株样品测定,测定干质量时,用剪刀将试管苗的根全部剪下后,分地上部和根部分别进行烘干和称质量。烘干时首先将植物材料在105 ℃条件下杀青30 min,之后移入恒温干燥箱,在60 ℃条件下继续加热干燥48 h后测定。
整株干物率=总干质量/总鲜质量×100%,
地上部干物率=地上部干质量/地上部鲜质量×100%,
根部干物率=根部干质量/根部鲜质量×100%。
1.2.4.2 叶绿素含量(SPAD值) 使用MINOITA SPAD 502 叶绿素仪测定SPAD值,在培养60 d时,用叶绿素仪测量头夹住试管苗自下而上第3片叶,每片叶均重复3次,取其平均值。
1.2.4.3 叶片下表皮气孔的观察 采用Dami等[20]的指甲油印模法。在40×光学显微镜下,每个处理随机选取10个视野,统计气孔密度。在100×光学显微镜下,每处理随机选取10个气孔器,测定其长度和宽度,计算气孔面积,气孔面积(μm2)=长(μm)×宽(μm)。
1.2.4.4 根系活力 根系活力测定采用氯化三苯基四氮唑(TTC)法[21]。
1.2.5 数据分析 采用邓肯氏新复极差测验法(SSR法)测验不同处理的差异显著性,显著水平P<0.05。采用DPS软件7.05和Excel 2003进行数据处理。
2 结果与分析
2.1不同体积分数CO2对红叶石楠试管苗形态的影响
从表1可以看出,CO2体积分数为0.2‰时株高达到最大,且与其他处理差异显著;0.2‰ CO2处理和CK的试管苗叶数均最大;随着CO2体积分数的增加,叶长呈先升高后降低的趋势,且在0.2‰ CO2处理下达到最大值;叶幅以CK最大,但与其他处理差异不显著;随着CO2体积分数的增加,根数呈先上升后下降的趋势,0.2‰ CO2处理根数达到最多,但与其他处理差异不显著;0.2‰ CO2处理根长最大,且与其他处理差异显著。综合而言,红叶石楠试管苗的形态指标均以0.2‰ CO2处理最好,在0.3‰ CO2处理时,虽然CO2体积分数增加,但是其形态指标反而没有0.2‰ CO2处理好,说明适宜浓度的CO2可以使红叶石楠试管苗生长良好,浓度过高反而不利于其生长。

表1 不同体积分数CO2对红叶石楠试管苗形态的影响
注:同列不同小写字母表示处理间差异显著(P<0.05)。下表同。
2.2不同体积分数CO2对红叶石楠试管苗鲜质量、干质量及干物率的影响
如表2所示,随着CO2体积分数增加,红叶石楠试管苗整株、地上部及根部的鲜质量和干质量呈先升高后降低趋势,均以0.2‰ CO2处理最大。如图1所示,整株干物率均随着CO2体积分数的增加先下降后上升,但处理间差异不显著;地上部干物率随CO2体积分数的增加而下降,而根部干物率与地上部干物率呈负相关,即根部干物率随着CO2体积分数增加而上升,在0.3‰ CO2处理达到最大,说明CO2体积分数增加对植物根部干物质积累起促进作用。

表2 不同体积分数CO2对红叶石楠试管苗鲜质量、干质量的影响

不同字母表示同一指标不同处理间差异显著(P<0.05),下图同图1 不同体积分数CO2对红叶石楠试管苗干物率的影响
2.3不同体积分数CO2对红叶石楠试管苗叶绿素含量的影响
如图2所示,CO2体积分数为0、0.1‰、0.2‰时,红叶石楠试管苗SPAD值差异不显著,但在0.2‰ CO2处理时SPAD值最高。植物进行光合作用的能量来源主要来自光合色素捕获的光能,所以叶绿素的高低与光合作用密切相关,增施CO2可以增加叶绿素总含量,降低叶绿素a/b值,更好地利用散射光,进一步提高光能利用率以提高光合作用[22]。当CO2体积分数为0.3‰时,SPAD值最低,且与其他3个处理差异显著,说明适宜浓度的CO2可以提高植株叶绿素含量,浓度过高则可能导致植物无氧呼吸,抑制光合作用,从而降低叶绿素含量。

图2 不同体积分数CO2对红叶石楠试管苗SPAD值的影响
2.4不同体积分数CO2对红叶石楠试管苗根系活力的影响
如图3所示,随着CO2体积分数的增加,试管苗的根系活力呈先上升后下降趋势,体积分数为0.2‰时根系活力最高,且与其他处理差异显著。环境中CO2的浓度越高,植物的光合作用越强,因为植株地下根部要吸收营养以供地上部分生长,所以植株根系活力较强[23]。但是CO2体积分数增加到0.3‰时,根系活力降低且最低,说明施加的CO2浓度过高反而会引起其根系活力降低。
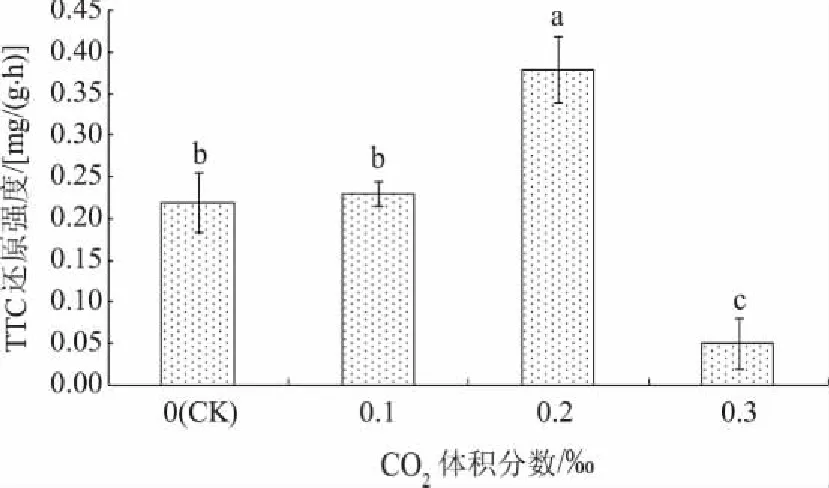
图3 不同体积分数CO2对红叶石楠试管苗根系活力的影响
2.5不同体积分数CO2对红叶石楠试管苗叶片气孔特征的影响
如表3和图4所示,随着CO2体积分数的升高,红叶石楠试管苗叶片下表皮细胞的气孔密度先升高后降低,CK最小,0.2‰ CO2处理最大,0.3‰ CO2处理的气孔密度反而降低;CK的气孔面积较大,气孔面积随CO2体积分数的升高呈先降低后升高趋势,0.2‰ CO2处理最小,而CO2体积分数增加到0.3‰时气孔面积又呈增大趋势。表明气孔密度与气孔面积呈负相关,即气孔密度越小则气孔面积越大,反之则相反。
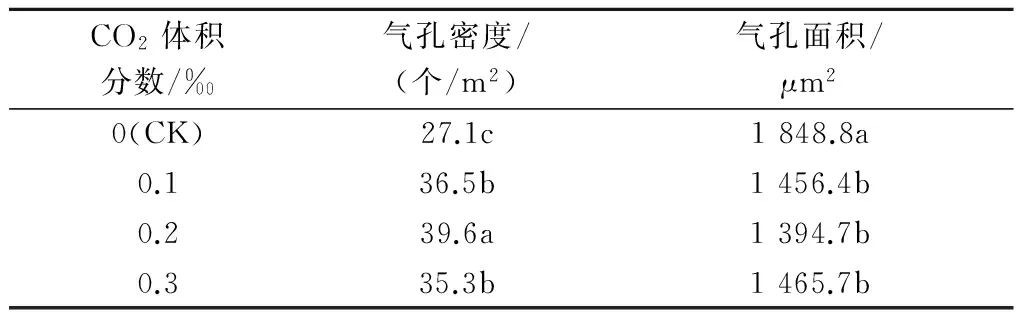
表3 不同体积分数CO2对红叶石楠试管苗叶片气孔特征的影响

A.0(CK); B.0.1‰ CO2; C.0.2‰ CO2; D.0.3‰ CO2图4 不同体积分数CO2处理下红叶石楠试管苗叶片的气孔特征(100×)
3 结论与讨论
传统组培容器由于是密闭环境,其CO2浓度通常小于大气中的CO2浓度,相对抑制了容器内试管苗的光合作用。Kitaya等[24]发现,试管苗的光合速率低是因为照光期间容器内的CO2浓度处于负平衡状态所导致的。因此,可以通过增加CO2浓度改善组织培养的微环境,进而提高试管苗的光合自养能力[12]。
本研究发现,无糖培养条件下,0.2‰ CO2处理的红叶石楠试管苗除叶幅外其他形态指标(株高、叶数、叶长、根数、根长)均优于0、0.1‰、0.3‰ CO2处理,说明适宜浓度的CO2可以提高植株的光合能力,促进其生长发育。0.2‰ CO2处理红叶石楠试管苗的鲜质量、干质量显著高于其他处理,但其整株干物率和地上部干物率却低于CK,这是由于适宜的CO2浓度有利于植物光合作用,生长健壮,生理代谢活动比较旺盛,含水量较高,所以干物率会降低。根部干物率随着CO2体积分数增加在0.3‰处理达到最大,说明增施CO2可以有效促进植物根部的干物质积累。由此可见,外施适宜浓度的CO2能有效促进红叶石楠试管苗的生长发育、提高光合作用能力、促进加光合产物的积累,即光合自养能力得到提高。这与Kozai等[25]的研究结果一致。Ticha等[26]在烟草、Cournac等[27]在马铃薯组培苗的研究上也得到类似的结果。但也有研究表明,组培生长环境中的CO2浓度过高会对试管苗的光合作用产生相对抑制作用。Mackowiak等[28]发现,在超高的CO2浓度下,马铃薯的光合速率下降,生长停滞,产量减少,且在发育晚期叶片出现缺氯、畸形等生长发育不良现象,说明施用CO2浓度超过了植株的CO2浓度饱和点,如果继续提高CO2浓度,将会形成高浓度的CO2胁迫微环境,导致光合作用强度下降。本试验中也发现,0.3‰ CO2处理的红叶石楠试管苗的部分形态指标以及鲜质量、干质量、叶绿素含量、根系活力等生理指标均低于0.2‰ CO2处理,说明过高的CO2浓度也不利于红叶石楠试管苗的生长,这与Mackowiak等[28]的研究结论一致。
在不同体积分数CO2对红叶石楠试管苗叶片气孔特征的影响方面,本试验结果发现,CO2体积分数为0.2‰时,气孔密度最大,气孔面积最小,气孔密度与气孔面积呈负相关,符合植物生理的小孔扩散规律[29],即水分子通过小孔扩散的速率与小孔周长呈正比,不与小孔面积呈正比。小孔数量多,密度大,周长越大,水蒸气通过气孔扩散的速率就越快,光合速率越高。但是随着CO2体积分数增加到0.3‰时,气孔密度反而降低,单孔面积增大,在气孔解剖结构水平上也说明了CO2浓度过高抑制了试管苗的光合速率及生长。
综上所述,当红叶石楠试管苗进行无糖培养时,0.2‰ CO2最有利于提高其产量和质量。
[1] 刘君宜.小叶红叶石楠组培快繁体系建立及愈伤组织诱导[D].武汉:华中农业大学,2013.
[2] 李素华.石楠和红叶石楠组织培养与扦插繁殖研究[J].武汉:华中农业大学,2008.
[3] 杨雪,吴国盛,范加勤.红叶石楠组培苗玻璃化影响因子及其克服技术研究[J].江西农业大学学报,2009,31(5):906-910.
[4] 李际红,韩小娇,卢胜西,等.红叶石楠生根培养与根系活力的研究[J].园艺学报,2006,33(5):1129-1132.
[5] Llorente B E,Larraburu E E.Invitropropagation of fraser photinia usingAzospirillum-mediated root development[J].Methods in Molecular Biology,2013,5:245-258.
[6] 王迅,谢云军,蔡金术,等.红叶石楠离体培养体系的构建[J].湖南农业科学,2013(1):108-110.
[7] 刘桂珍,梁国平,王兰岚,等.巴西木的组织培养和快速繁殖研究[J].园艺学报,1997,24(3):303-304.
[8] 郑玉梅,刘青林.木本观赏植物离体快速繁殖技术的进展[J].北京林业大学学报,2001,23(S2):75-82.
[9] 徐志刚.组培微环境与规模化育苗设施环境调控的研究[D].南京:南京农业大学,2002.
[10] 孙冬青.组培微环境对球根花卉试管苗生长影响及移栽技术研究[D].咸阳:西北农林科技大学,2008.
[11] 何松林,蒋要卫,孔德政,等.CO2施用对大花蕙兰试管苗生长和叶片气孔特征的影响[J].河南农业大学学报,2008,42(2):162-166.
[12] Kanechi M,Ochi M,Abe M,etal.The effects of carbon dioxide enrichment,natural ventilation,and light intensity on growth,photosynthesis,and transpiration of cauliflower plantlets culturedinvitrophotoautotrophically and photomixotrophically[J].Journal of the American Society for Horticultural Science,1998,123(2):1-18.
[13] 崔瑾,丁永前,李式军,等.增施CO2对葡萄组培苗生长发育和光合自养能力的影响[J].南京农业大学学报,2001,24(2):28-31.
[14] 屈云慧,熊丽,张素芳,等.彩色马蹄莲组织苗无糖生根培养的环境控制[J].植物遗传资源学报,2004,5(2):166-169.
[15] 李晓玲,由继红,杨文杰.“苹博一号”梨试管苗的光自养生长和光混合营养生长[J].特产研究,2000(1):11-12.
[16] 崔瑾,徐志刚,李式军,等.CO2浓度和光量子通量密度对叶用甘薯组培苗光合自养和过氧化物酶活力的影响[J].应用环境生物学报,2003,9(5):482-484.
[17] 廖飞雄,李玲,姚翠娴,等.无蔗糖培养和不同封口膜对非洲菊组培苗生长的影响研究[J].中国农学通报,2004,20(4):211-214.
[18] 何松林,任凝辉,潘会堂,等.高分子树脂膜培养容器在文心兰试管苗培养中的应用[J].北京林业大学学报,2002,24(4):93-96.
[19] 何松林,蒋要卫,孔德政.不同培养方式对大花蕙兰试管苗生长的影响[J].河南农业大学学报,2007,41(6):619-622.
[20] Dami I,Hughes H G.Effects of PEG-induced water stress oninvitro,hardening of ‘Valiant’ grape[J].Plant Cell,Tissue and Organ Culture,1997,47(2):97-101.
[21] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[22] 刘金泉,崔世茂.CO2施肥对黄瓜光合作用及相关生理过程的影响研究进展[J].内蒙古农业大学学报(自然科学版),2007,28(3):322-326.
[23] 路娜,胡维平,邓建才,等.大气CO2浓度升高对植物影响的研究进展[J].土壤通报,2011,42(2):477-482.
[24] Kitaya Y,Fukuda O,Kozai T,etal.Effects of light intensity and lighting direction on the photoautotrophic growth and morphology of potato plantletsinvitro[J].Sci Hortic,1995,62(1/2):15-24.
[25] Kozai T,Kubota C.Developing a photoautotrophic micropropagation system for woody plants[J].Journal of Plant Research,2001,114(4):525-537.
[26] Ticha I,Cap F,Pacovská D,etal.Culture on sugar medium enhances photosynthetic capacity and high light resistance of plantlets growninvitro[J].Physiologia Plantarum,2010,102(2):155-162.
[27] Cournac L.Growth and photosynthetic characteristics ofSolanumtuberosumplantlets cultivatedinvitroin different conditions of aeration,sucrose supply,and CO2enrichment[J].Plant Physiology,1991,97(1):112-117.
[28] Mackowiak C L,Wheeler R M.Growth and stomatal behavior of hydroponically cultured potato(SolanumtuberosumL.) at elevated and super-elevated CO2[J].Journal of Plant Physiology,1996,149(2):205-210.
[29] 张志良,瞿伟菁.植物生理学实验指导[M].3版.北京:高等教育出版社,2003.
Effect of Different CO2Volume Fraction on the Growth ofPhotiniafraseriPlantletsinVitro
LIU Baoguo1,LI Xiaojuan1,HE Songlin1,2*,WANG Zheng1,SHANG Wenqian1,WANG Huixia1,HE Dan1
(1.College of Forestry,Henan Agricultural University,Zhengzhou 450002,China;2.Henan Institute of Science and Technology,Xinxiang 453003,China)
In order to improve the quality ofPhotiniafraseriplantletsinvitro,with thePhotiniafraseri‘Red Robin’ plantletsinvitrofor material,we explored the effects of different CO2volume fraction [0(CK),0.1‰,0.2‰,0.3‰]of tissue culture microenvironment on the growth ofPhotiniafraseriplantletsinvitrounder the condition of sugar-free.The results showed that the plant height,leaf number,leaf length,root number,root length,fresh weight,dry weight,chlorophyll index,root activity ofPhotiniafraseriplantletsinvitroall reached the maximum when the CO2volume fraction was 0.2‰.The leaf width was the largest under CK treatment,but there was no significant difference between the treatments; In respect of dry matter rate,the dry matter rate of above-ground ofPhotiniafraseriplantletsinvitrowere decreased with the increase of CO2volume fraction,while the dry matter rate of root was increased with the increase of CO2volume fraction; In terms of stomata,stomata density was negatively correlated with the single hole size and area.The stomata density was the largest and the single hole area were the smallest when the volume fraction of CO2was 0.2‰.In summary,the tissue culture seedling ofPhotiniafraseriwere cultured without sugar and the CO2volume fraction was 0.2‰,which was the most suitable condition for the growth of plantlets.
tissue culture;Photiniafraseri; CO2volume fraction
2017-05-20
国家科技成果转化资金项目(2012D0001018);河南省产学研项目(16210700687);河南省高校科技创新团队支持计划项目(13IRTSTHN005)
刘保国(1975-),男,河南中牟人,讲师,硕士,主要从事风景园林植物应用研究。E-mail:1152492422@qq.com
*通讯作者:何松林(1963-),男,河南淮阳人,教授,主要从事园林植物生物技术研究。E-mail:hsl213@163.com
S687
: A
: 1004-3268(2017)09-0118-06

