紫叶加拿大紫荆试管苗两步生根培养技术研究
李艳敏,王利民,王慧娟,孟月娥,张和臣,董晓宇,符真珠
(河南省农业科学院 园艺研究所,河南 郑州 450002)
紫叶加拿大紫荆试管苗两步生根培养技术研究
李艳敏,王利民,王慧娟,孟月娥,张和臣,董晓宇,符真珠
(河南省农业科学院 园艺研究所,河南 郑州 450002)
为了解决紫叶加拿大紫荆试管苗生根难题,提高其生根率和生根质量,以紫叶加拿大紫荆试管苗为试验材料,采用两步生根法,研究了诱导时间、IBA和NAA质量浓度、苗高及继代周期对生根的影响。结果表明,继代周期为30 d、长度超过4 cm的试管苗,在附加IBA 5 mg/L和NAA 0.5 mg/L的1/2MS培养基上,黑暗诱导11 d后转入空白培养基进行光照培养30 d,生根率最高可达95.4%,生根数为7.71条,根长达到3.56 cm。
紫叶加拿大紫荆; 离体培养; 两步生根法
紫叶加拿大紫荆(Cerciscanadensis‘Forest Pansy’)为加拿大紫荆的一个变种[1],属豆科紫荆属落叶小乔木或灌木,其蝶形花粉红绚丽,先叶开放,叶形宽大、冠形优美、色彩明艳,春夏秋均呈鲜亮的紫红色,长势强健,适宜种于路边、庭院、草坪等处,单株或成片种植都具有很好的景观效果,是不可多得的花叶俱佳的优良彩叶树种。紫叶加拿大紫荆扦插难以生根,压条虽然能生根,但是植株长势较弱,抗病虫害能力也差,目前主要是以普通紫荆嫁接繁殖[2],存在嫁接成活率低、受季节所限等缺点,严重阻碍其发展和推广。利用植物组织培养技术可以达到快速繁殖紫叶加拿大紫荆的目的,为了解决其组培快繁中存在的生根困难、试管苗长势弱、新叶萌发率低等问题,采用两步生根法,对其中的关键因素进行筛选,以提高紫叶加拿大紫荆试管苗生根率和生根质量,实现紫叶加拿大紫荆的规模化、工厂化生产,加快其繁育速度,满足市场及景观建设的需求。
1 材料和方法
1.1材料
以紫叶加拿大紫荆无菌试管苗为试验材料。
1.2方法
采用两步生根法进行紫叶加拿大紫荆试管苗生根试验:第1步是根诱导阶段,在黑暗条件下进行,在培养基中添加生长素,培养一定时间使试管苗基部产生根原基;第2步是根伸长阶段,需要在光照条件下培养,光照时间为12 h/d,将经过诱导培养的试管苗转入空白培养基中继续培养30 d,使试管苗生根。分别对诱导时间、NAA和IBA质量浓度、试管苗苗高、继代周期进行筛选试验,观察其对试管苗生根的影响。
紫叶加拿大紫荆试管苗根诱导培养基为1/2MS+IBA 5 mg/L+NAA 0.5 mg/L+蔗糖20 g/L+琼脂6.5 g/L(NAA和IBA质量浓度筛选试验除外),根伸长培养基为MS+蔗糖30 g/L+琼脂6.5 g/L。培养温度为(25±2)℃。培养1个月后分别统计生根率、根数、根长,试验数据用DPS软件进行分析。
1.2.1 诱导时间对试管苗生根的影响试验 对第1步诱导生根需要的时间进行筛选,在诱导培养基中分别培养3、5、7、11、15 d后,将试管苗转入根伸长培养基继续培养,观察不同诱导时间对试管苗生根的影响。
1.2.2 NAA质量浓度对试管苗生根的影响试验 在根诱导培养基中添加不同质量浓度的NAA,质量浓度分别为2、5、8、10 mg/L,IBA质量浓度为 0.5 mg/L,接种后11 d转入第2步根伸长培养基中继续培养,观察不同质量浓度NAA对试管苗生根的影响。
1.2.3 IBA质量浓度对试管苗生根的影响试验 在根诱导培养基中添加不同质量浓度的IBA,质量浓度分别为2、5、8、10 mg/L,NAA质量浓度为 0.5 mg/L,接种后11 d转入第2步根伸长培养基中继续培养,观察不同质量浓度IBA对试管苗生根的影响。
1.2.4 试管苗苗高对生根的影响试验 分别选取高度为2、3、4、5、6 cm的试管苗进行两步生根培养,观察苗高对紫叶加拿大紫荆生根的影响。
1.2.5 继代周期对试管苗生根的影响试验 分别取培养25、30、35、40、45 d的试管苗进行两步生根试验,观察继代周期对紫叶加拿大紫荆生根的影响。
2 结果与分析
2.1诱导时间对试管苗生根的影响
诱导时间是将紫叶加拿大紫荆试管苗放进附加生长素的培养基中诱导根原基产生需要的时间。从表1可以看出,诱导时间对紫叶加拿大紫荆试管苗生根有显著影响。当诱导时间在3~5 d时,试管苗的生根时间发生在转入空白培养基后14 d;当诱导时间在7~15 d时,生根时间提前3 d,在转入空白培养基后11 d生根,各处理的生根时间差异不显著。当诱导时间为3 d时,生根率仅为2.8%,根数为1.25条,显著低于其他处理,此后随着诱导时间的增加,生根率、根数及根长均有所增加;当诱导时间为11 d时,生根率和根长均达到最大,分别为73.4%和8.7 cm,其生根率显著高于其他处理(诱导7 d处理除外),根长则与其他处理差异显著,根数(4.0条)与其他处理根数差异显著(诱导15 d处理除外);诱导时间为15 d时生根率急剧降至35.0%,主要是因为在诱导培养基中培养时间过长,高质量浓度的生长素抑制试管苗生长,基部形成大量的疏松愈伤组织,阻碍试管苗基部根原基的形成。因此,第1步根诱导时间以11 d最合适。

表1 诱导时间对试管苗生根的影响
注:同列不同小写字母表示差异显著(P<0.05),下同。
2.2NAA质量浓度对试管苗生根的影响
从表2可以看出,NAA可以促进紫叶加拿大紫荆试管苗生根,随着NAA质量浓度的增加,生根率逐渐上升,处理1的生根率为56.4%,显著低于其他处理,处理2为83.8%,处理3为89.3%,处理4为95.9%,三者之间差异不显著;根数呈现先增加后减少的趋势,处理3根数最多,为5.13条,显著高于处理1,与处理2和处理4差异不显著;根长随着NAA质量浓度的增加呈现减少的趋势,处理1根长最长,为4.05 cm,与处理2差异不显著,与处理3和处理4差异显著;NAA质量浓度对紫叶加拿大紫荆的新叶生长起抑制作用,当NAA质量浓度逐渐增加时,试管苗的新叶率逐渐降低,处理1新叶率为54.6%,处理2为48.7%,处理3和处理4 的新叶率分别降至34.5%和31.8%;NAA质量浓度逐渐增加时,苗基部的愈伤组织逐渐增大,抑制了新叶的生长,根系多从愈伤组织长出,因此认为NAA不适合紫叶加拿大紫荆生根诱导。
2.3IBA质量浓度对试管苗生根的影响
IBA是生根常用的一种生长素,对紫叶加拿大紫荆的生根也有一定的影响。从表3可以看出,4个处理的生根率介于74.3%~89.7%,差异不显著,处理D的生根率最高,其次是处理B,生根率为83.3%;随着IBA质量浓度的提高,根数呈增加趋势,处理D最多,为10.31条,其次是处理C(9.47条),二者差异不显著,但均显著高于处理A和处理B;随IBA质量浓度增加,根长呈先增加后减少的趋势,其中以处理B的根长最长,为4.25 cm,其次是处理C,根长为3.92 cm,二者差异不显著,但显著高于其他2个处理;在新叶生长方面,新叶率随IBA质量浓度增加呈先升后降的趋势,处理C最高,为77.2%,其次是处理B,为57.6%,二者差异不显著,处理D最低,仅34.0%。综上,IBA质量浓度以5~8 mg/L为宜。
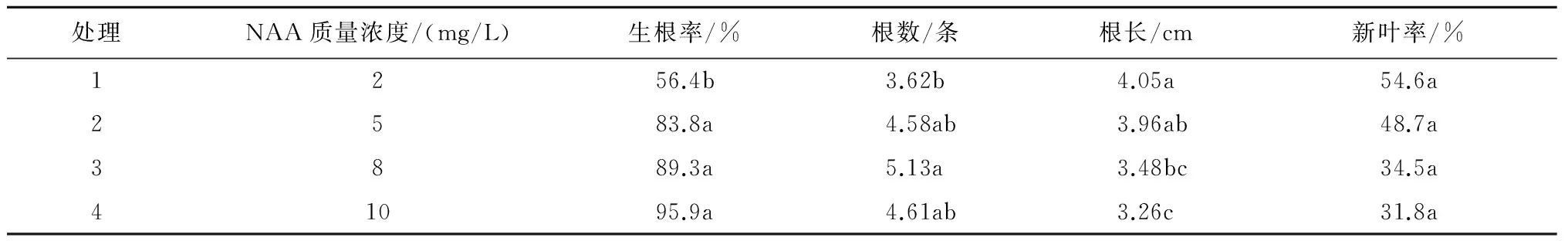
表2 NAA质量浓度对试管苗生根的影响

表3 IBA质量浓度对试管苗生根的影响
2.4试管苗苗高对生根的影响
苗高是衡量试管苗生长好坏的一个指标,一般而言,生长状态好的试管苗生根效果也好。从表4可以看出,当苗高为2 cm时,生根率为39.3%,当苗高超过4 cm时,生根率均超过80%,显著高于2 cm时的生根率;根数随着苗高的增加而增加,当苗高为2 cm时根数为3.56条,显著低于苗高为4~6 cm时的根数;根长也呈现随苗高增加而增长的变化趋势,在苗高达到6 cm时最长,为3.81 cm,但是各处理差异不显著。因此,苗高超过4 cm的试管苗适合紫叶加拿大紫荆的生根培养。

表4 试管苗苗高对生根的影响
2.5继代周期对试管苗生根的影响
从表5可以看出,继代周期对紫叶加拿大紫荆生根率、根数和根长的影响达到显著水平。随着继代周期的延长,生根率呈现先增加后减少的趋势,以继代周期为30 d的生根率最高,达到95.4%;根数随着继代周期的延长呈下降趋势,继代周期为25 d时根数最多,为9.33条,其次是30 d,为7.71条,二者差异不显著,与其他处理差异显著;根长表现为先增加后减少的趋势,25 d时根长为3.17 cm,30 d的根长最长,达到3.56 cm,二者差异不显著,但均显著高于35~45 d的根长。因此,紫叶加拿大紫荆的最佳继代周期为30 d。

表5 继代周期对试管苗生根的影响
3 结论与讨论
本试验结果表明,采用两步生根法进行紫叶加拿大紫荆试管苗生根时,诱导时间、 IBA和NAA质量浓度、试管苗苗高及继代周期都会对生根产生显著影响。试管苗培养30 d时,选择苗高超过4 cm的试管苗进行两步生根培养,先在1/2MS+IBA 5 mg/L+NAA 0.5 mg/L+蔗糖20 g/L+琼脂6.5 g/L的诱导培养基上,黑暗培养11 d诱导产生根原基,然后将试管苗转入空白培养基中,在光照时间12 h/d条件下培养30 d,生根率最高可达95.4%,同时根数为7.71条,根长为3.56 cm。
紫叶加拿大紫荆试管苗生根比较困难,目前在已发表的加拿大紫荆[3-6]、巨紫荆[7]、墨西哥紫荆[8]、东部紫荆[9]等的组织培养报道中,均采用一步生根培养,存在生根率低的问题,采用常规的方法进行生根培养,生根质量差,在苗基部形成大的愈伤组织[5],生根时间长,转接50 d左右形成完整小植株[6]。采用两步生根法进行紫叶加拿大紫荆试管苗生根,可以提高其试管苗的生根率,最高可达95.4%,并且基部愈伤组织小,生根质量好,这与徐孝方等[9]在柃木生根培养中的结论一致。
诱导时间对紫叶加拿大紫荆生根的影响比较明显,当诱导时间在11 d之内时,随着诱导时间的增加,生根率也在增加,说明植株体内的生长素也在逐渐积累,生长素的积累促进了根原基的发生,当诱导时间进一步延长,植株基部产生较大的愈伤组织,影响了根原基的发生,降低了生根率,这与杨锋利等[10]在栓皮栎上的研究结果一致。
在本次试验中,生长素NAA和IBA均可以促进紫叶加拿大紫荆生根,在用量分别为5 mg/L时,二者的生根率分别为83.8%和83.3%,相差不大,但是二者对试管苗的影响主要表现在茎叶生长上,将NAA诱导的根原基转入空白培养基后,试管苗基部愈伤组织大,叶片脱落,顶芽会变褐死亡,影响生根苗质量,这与杨雪等[11]在红叶石楠中的研究结果一致; 将IBA诱导的根原基转入空白培养基后,基部的愈伤组织很小,并且能够同时促进根原基和新叶生长,IBA质量浓度为2~8 mg/L时,随着其质量浓度的增加,生根率逐渐提高,新叶率也逐渐增加,说明IBA适合紫叶加拿大紫荆的生根诱导,这与师校欣等[3]的研究结果相反,师校欣等[3]认为IBA对促进生根作用不大。分析其中原因,认为与试管苗的生理状态、采用的生根方法、IBA质量浓度有关。
[1] 李进章.紫叶加拿大紫荆[J].中国花卉盆景,2004 (9):35.
[2] 兑宝峰.加拿大红叶紫荆的栽培与繁殖[J].中国花卉园艺,2007,8(16):43.
[3] 师校欣,高仪,杜国强,等.红叶加拿大紫荆离体快繁技术研究[J].西北植物学报,2008,28(10):2132-2137.
[4] 贾晓梅,曹柳青.紫荆组织培养初探[J].保定学院学报,2008,4(2):42-43.
[5] 孟月娥,李艳敏,赵秀山,等.紫叶加拿大紫荆组织培养研究[J].河南农业科学,2010,39(12):114-117.
[6] 李久亮,苑兆和,招雪晴,等.加拿大紫荆‘森林火焰’组培快繁技术研究[J].中国农学通报,2011,27(6):64-67.
[7] Mackay W A,Tipton J L,Thompson G A.Micropropagation of Mexican redbud(Cerciscanadensis‘mexicana’) [J].Plant Cell,Tissue and Organ Culture,1995,43(3):295-299.
[8] Geneve R L,Kester S T,Yusnita S.Micropropagation of eastern redbud(CerciscanadensisL.)[J].Plant Cell,Tissue and Organ Culture,1992,42(5):417-420.
[9] 徐孝方,梁训义,许叶军,等.柃木的组织培养与快速繁殖技术[J].浙江农业学报,2010,22(2):202-206.
[10] 杨锋利,杜保国,张存旭.成龄栓皮栎组培苗生根影响因素研究[J].绵阳师范学院学报,2006,25(5):79-82,95.
[11] 杨雪,吴国盛,张雯雯,等.红叶石楠组织培养技术比较研究[J].安徽农业科学,2009,37(16):7337-7340.
Study on Two-step Rooting Culture ofCerciscanadensis‘Forest Pansy ’ SeedlingsinVitro
LI Yanmin,WANG Limin,WANG Huijuan,MENG Yuee,ZHANG Hechen,DONG Xiaoyu,FU Zhenzhu
(Horticulture Institute of Henan Academy of Agricutural Sciences,Zhengzhou 450002,China)
To solve the rooting problem ofCerciscanadensis‘Forest Pansy’ seedlingsinvitro,and improve rooting rate and the quality of its roots,we used test-tube seedlings ofCerciscanadensis‘Forest Pansy’ as experimental material and adopted a two-step rooting method to study the effects of induction time,concentration of IBA and NAA,seeding height and transopenerational cycle on the rooting.The results indicated that the best induction root was achieved by the two-step rooting method:firstly the plantletsinvitrocultured for 30 d and more than 4 cm were incubated on 1/2MS medium with 5 mg/L IBA and 0.5 mg/L NAA in the dark for 11 days,and then the shoots were transferred to the MS medium without plant growth hormone in the normal light conditions for 30 d.As a result,95.4% of the rooting rate was obtained under above conditions,and the rooting number was 7.71,rooting length was 3.56 cm.
Cerciscanadensis‘Forest Pansy ’;invitroculture; a two-step rooting method
2017-03-20
河南省科技攻关项目(162102110103);河南省财政预算项目(豫财预[2016]78号)
李艳敏 (1978-),女,河南汤阴人,副研究员,硕士,主要从事园林植物组培快繁技术研究。 E-mail:minzili@126.com
S685.99
: A
: 1004-3268(2017)09-0114-04

