黄颡鱼MHC class II基因全长的克隆及饲料维生素D3对其组织表达的影响
冯美惠 陈 沛 雷 文 李大鹏 王春芳
(华中农业大学水产学院, 淡水水产健康养殖湖北省协同创新中心, 池塘健康养殖湖北省工程实验室, 武汉 430070)
黄颡鱼MHC class II基因全长的克隆及饲料维生素D3对其组织表达的影响
冯美惠 陈 沛 雷 文 李大鹏 王春芳
(华中农业大学水产学院, 淡水水产健康养殖湖北省协同创新中心, 池塘健康养殖湖北省工程实验室, 武汉 430070)
为进一步丰富鱼类MHC class II基因的研究, 同时也为进一步探讨低磷饲料中添加维生素D3对鱼类免疫功能可能的影响, 实验利用RACE (Rapid-amplification of cDNA ends) 即cDNA末端快速扩增技术, 成功克隆出黄颡鱼(Pelteobagrus fulvidraco)主要组织相容性复合体(Major histocompatibility complex, MHC) class II基因, 全长1074 bp, 其中ORF (Open reading frame)708 bp, 编码236个氨基酸, 5′UTR (5′端非翻译区)78 bp, 3′UTR (3′端非翻译区)259 bp。进行氨基酸序列比对分析得到: 黄颡鱼MHC class II基因ORF氨基酸序列与长吻逘(Leiocassis longirostris)的氨基酸序列相似度最高为69.5%, 与锦鲤(Cyprinus carpio)的氨基酸序列相似度最低为50.4%。利用qPCR对黄颡鱼MHC class II基因进行组织表达分析, 结果表明MHC class II在小肠、肝脏、鳃中表达较高; 在肌肉、鳍条中表达较低; 而在肾、脾脏、脑、头肾中表达量极低(几乎检测不到)。在低磷饲料中添加维生素D3显著诱导了该基因的上调表达。研究结果展示了黄颡鱼MHC class II基因的分子结构、组织表达以及维生素D3的作用, 在降低磷排放的同时, 为今后黄颡鱼免疫抗病及分子选育等方向的深入研究及免疫型饲料的使用奠定了基础。
黄颡鱼; MHC class II; 饲料维生素D3; 基因表达
主要组织相容性复合体(Major histocompatibility complex, MHC) 可抵抗致病菌的侵入, 在脊椎动物免疫系统中扮演着十分重要的角色[1], 主要分为MHC class I和MHC class II两大类, 研究表明由MHC编码的细胞表面转膜蛋白与抗原结合后, 呈递给T淋巴细胞CD4+和CD8+, 从而激发机体免疫反应[2]。早在20世纪初期, 就已经发现了这一人类红细胞同种抗原, 然而在20世纪30—40年代, Gorer等[3]才发现小鼠H-2系统及其与组织移植的关系, 并正式命名为MHC, 这也是主要组织相容性复合体这一概念的首次出现。随后, 众多学者对于MHC的研究也逐渐深入, 其在人类[4]及家禽[5]中的研究也慢慢走入人们的视线。而对于水产动物MHC真正意义上的研究, 是时隔近百年时间Hashimoto等[6]于1990年通过比较其他动物的MHC基因结构,分析其保守区序列特点, 从而设计兼并引物扩增出鲤的部分MHC序列, 为水产动物MHC的研究打开了一扇新的大门, 目前在鱼类中MHC class II基因的研究还有待更进一步丰富。
黄颡鱼(Pelteobagrus fulvidraco)是我国重要的小型淡水经济名优养殖品种, 近几年来生产者不断地加大黄颡鱼的养殖力度, 创造出了极大的经济价值[7,8]。水温过高且水体质量差时, 黄颡鱼易患“红头病”、“细菌性烂鳃病”、“肠炎病”、“车轮病”等疾病, 常伴有其他病症并发[9]。目前对于黄颡鱼疾病防控的研究还主要停留在化学药物中, 但这类治疗方法因药物残留、抗药性等水产品安全问题, 受到国内外广泛关注; 而现流行的疫苗预防法, 由于其特异性和操作性困难, 使其存在较大局限性[10]。近年来, 通过合理饲料配方等营养免疫措施, 来提高鱼类自身疾病抵抗力和抗应激能力, 从而预防疾病发生, 因其对环境污染小且安全可靠, 而成为研究热点[11]。有研究表明[12], 通过饲料中氨基酸、脂肪酸、维生素以及营养性添加物等可以提高鱼类对疾病的抵抗力及免疫力。与氨基酸、脂肪酸等营养成分相比, 动物对维生素的需求量甚微, 但对免疫系统的影响似乎更加深刻而广泛[13]。
维生素D在动物生长发育过程中有着极为重要的作用, 其有内分泌、旁分泌和自分泌的功能, 其中内分泌功能主要在维持动物体内钙磷平衡方面起着重要作用, 旁分泌和自分泌功能依赖于表达核维生素D受体(VDR)的不同细胞独特的基因转录调节功能, 作用于抑制细胞增殖, 促进细胞分化和凋亡[14]。在哺乳动物中, 维生素D与免疫系统的相互作用也逐渐被证实[15], 有研究报道VDR在许多免疫细胞(T细胞、B细胞、巨噬细胞、树突状细胞)中存在, 其具有调节先天及适应性免疫系统的功能[16,17]。人类医学研究显示在抵御流感病毒时, 补充维生素D比抗病毒药物和疫苗更有效果[18]。维生素D3能够抑制肿瘤生长[19]、临床乳腺癌的转移[20],并且具有抗肿瘤血管生成作用[21], 与此同时维生素D3还参与了多条免疫相关通路, 如PKC、MAP kinases、phos-phoinositides 和 cAMP[22—24], 动物细胞实验也证明维生素D有直接抗病毒作用[25]。目前, 维生素D3对水产动物分子免疫方面相关研究还为数不多, 当下研究显示, 饲料中添加维生素D3对多种水产动物松浦镜鲤(Cyprinus carpio)[26]、草鱼(Ctenopharyngodon idella)[27]、黄颡鱼(Pelteobagrus fulvidraco)[28]、黄鳝(Monopterus albus)[29]等的生长、基础生理免疫等指标都存在一定的影响,而在分子水平上对于维生素D3和鱼类免疫方面的研究还很少见到, 其对鱼类营养免疫的作用机理有待深入探索。
本研究利用RACE技术扩增出黄颡鱼MHC class II基因, 比较其与其他物种氨基酸序列的相似性, 分析其基因序列特点, 并分析了其组织分布情况以及饲料中添加维生素D3对其组织分布及表达产生何种影响, 为水产动物MHC class II基因的深入研究提供了一定依据, 同时也为进一步探讨低磷饲料中添加维生素D3对鱼类免疫功能可能的影响,为实现既能降低磷排放又能提高免疫力的饲料制作的目标奠定研究基础。
1 材料与方法
1.1 实验材料
养殖试验鱼苗购于武汉正好渔场, 实验前先于华中农业大学水产实验创新中心实验基地暂养, 待鱼体大小适中至2 g左右, 开始为期2个月的养殖实验(表 1), 共分为2组(对照组维生素的添加水平为0,实验组维生素的添加水平为5000 IU/kg), 每组设置3个平行缸, 每缸30尾鱼。实验采取饱食性投喂策略, 每天投喂2次(8:30和14:30)。在实验结束后, 分别取对照及处理组黄颡鱼的肠、肾、肝3种组织及普通黄颡鱼的肠、肾、肝、鳍条、肌肉、皮肤、鳃、脑和头肾9种组织于1.5 mL EP管并迅速置于液氮中, 最后放在–80℃冰箱中保存。
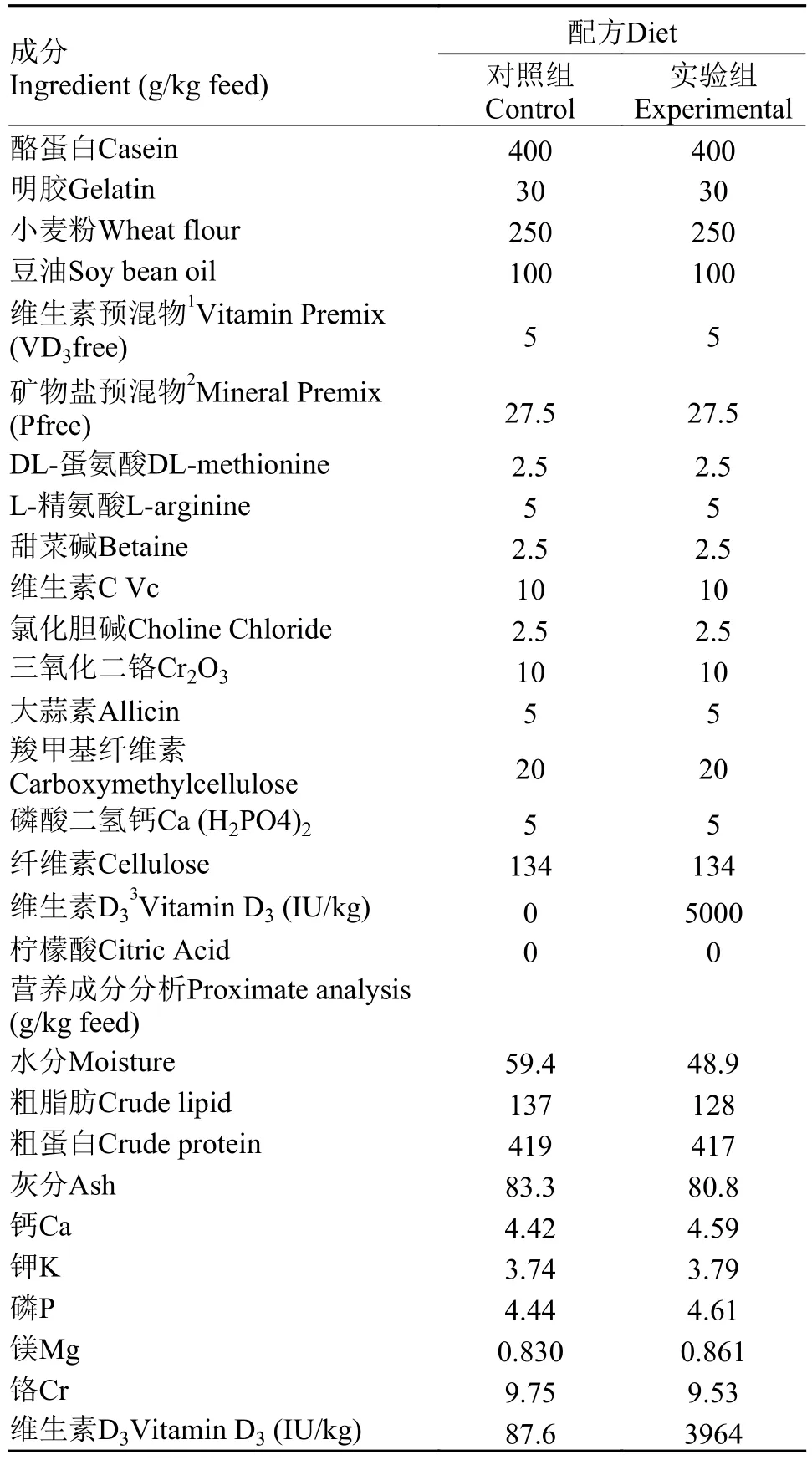
表 1 实验用饲料化学组成及营养成分Tab. 1 Formulation and chemical composition of experimental diets
1.2 RNA提取及cDNA的合成(qPCR)
实验器材(解剖工具等)预先用双蒸水浸泡后高温灭菌8h, 实验采取RNA提取经典TRIZOL法, 将盛有各组织的1.5 mL EP管中加入1 mL Trizol, 使用匀浆机进行研磨。实验方法完全按照说明书进行, 得到RNA后进行琼脂糖凝胶电泳并使用NANODROP (Applied Biosystems#9902 VeritiTM96-Well Thermal Cycler)检测其完整度、浓度及相关比值(A260/280=2.08)。使用TaKaRa公司的RNA反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)。
1.3 引物设计
根据本课题组获得的黄颡鱼转录组数据(Accession No.SRR2239572), 利用软件primer 5.0设计引物(MHC-F, MHC-R), 克隆获得核心序列, 并根据核心序列设计特异性引物(MHC-SP1和MHCSP2)进行后续cDNA全长的扩增, 荧光定量PCR以β-actin (EU161066.1)作为内参基因, 扩增引物为actin-F和actin-R。引物均由武汉天一辉远公司合成, 具体信息见表 2。
1.4 黄颡鱼MHC class II基因cDNA全长的克隆
反转录实验使用Clontech公司SMARTer®RACE 5′/3′Kit, 取浓度为1 μg/μL RNA作为模版, 按照说明书进行, 最终cDNA产物根据要求进行稀释(本实验5倍稀释)。实验采用试剂盒中兼并引物UPM, 特异性引物MHC-SP1和MHC-SP2进行PCR扩增, 序列5′端使用TaKaRa LA Taq通过普通温度梯度PCR得到, 3′端则使用SMARTer®RACE 5′/3′试剂盒中试剂通过touchdown PCR得到。普通PCR程序为: 94℃变性30s, 60—68℃退火30s, 72℃延伸1—2min, 25—30个循环。Touchdown PCR程序为: 94℃变性30s, 72℃退火30s, 72℃延伸1—2min, 5个循环; 94℃变性30s, 70℃退火30s, 72℃延伸1—2min, 5个循环; 94℃变性30s, 68℃退火30s, 72℃延伸1—2min, 25个循环。PCR得到目的片段后将其回收并克隆, 挑选多个阳性克隆, 最终送往武汉擎科公司进行测序。测序后找到特异性引物并使用Seqman软件将两端序列和核心序列拼接, 得到cDNA序列全长。
1.5 序列生物信息学分析
使用Editseq软件预测黄颡鱼MHC class II序列ORF (开放阅读框)并进行氨基酸翻译, 并将其与其他10个物种的16条氨基酸序列进行相似度比较, 利用MegAlign软件进行氨基酸相似度分析, Prot-Param tool (http://www.expasy.org/)对其编码蛋白质的分子量、等电点等基本性质进行理论预测; 利用MEGA5.05采用NJ法(Neighbor-joining method)建立系统发育进化树, 自展值(Boot-strap)重复1000次。
1.6 荧光定量PCR
模版采用1.2中合成的cDNA, 使用Easydilution稀释5倍后, 取2 μL作为荧光定量PCR模版, 阴性对照同样取2 μL无菌水为模版, 均设置3个重复。选取黄颡鱼β-actin为内参基因, 内参基因引物采用表 2中出现的actin-F和actin-R, 根据MHC class II保守区设计出特异性定量引物QMHC-F和QMHC-R。实验仪器为Roter-GeneQ (QIAGEN, GERMAN), PCR反应体系为: 模版2 μL, 上下游引物各0.5 μL, TaKaRa公司SYBR®Premix EX TaqTMII 10 μL,无菌水7 μL, 共20 μL。反应程序为: 95℃变性30s, 95℃变性5s, 60℃退火20s, 72℃延伸30s, 40个循环。目的基因和内参基因的标准曲线R2均大于0.99, 扩增效率(E)均大于90%, 最后进行溶解曲线的测定。所有目的基因相对表达量的数据结果采用双标曲法计算得到, 其数值用平均值±标准误表示。使用GraphPad Prism.v 5.0软件作柱状图, 并用SPSS 21.0软件进行单因素方差分析(one-way ANOVA), Duncan′s multiple-range test比较各组之间表达差异, 存在显著差异用(P<0.05)表示。
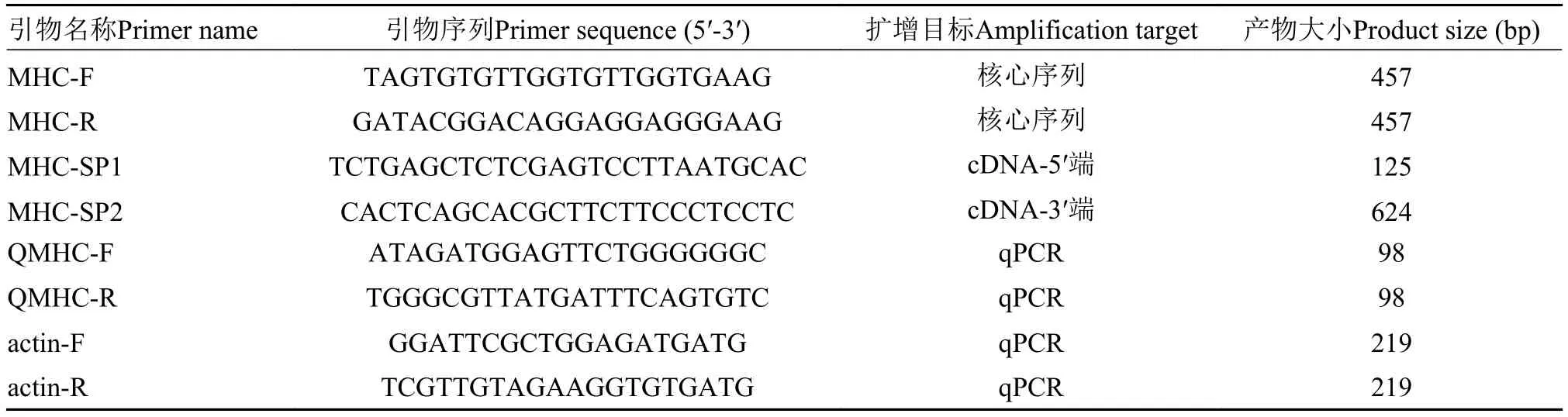
表 2 本研究使用所有引物序列Tab. 2 Primers used in the study
2 结果
2.1 基因cDNA全长的克隆及序列分析
根据课题组已获得黄颡鱼转录组序列, 得到长度为515 bp的黄颡鱼MHC class II基因序列。根据此序列设计特异性引物对其进行验证, 得到长度为457 bp的核心序列, 再根据核心序列设计RACE特异性引物MHC-F和MHC-R, 扩增得到长度分别为125 bp和624 bp的基因5′端和3′端。最后使用Seqman软件拼接后得到长度为1078 bp的黄颡鱼MHC class II基因全长(KX532169)。NCBI Blast比对发现, 黄颡鱼MHC class II基因与长吻逘MHC class II基因相似性高达91%。根据ProtParam tool预测黄颡鱼MHC class II蛋白分子式为C1178H1808N306O362S10、分子量大小为26.37 kD、等电点为4.97、总平均疏水指数(GRAVY)为–0.323。ProtParam tool发现MHC class II蛋白含有免疫球蛋白(aa119—190)及MHC蛋白信号(aa22—101), 且具有5个N-豆蔻酰化位点(N-myristoylation sit)(G-E/D/R/K/H/P/F/Y/WX-X-S/T/A/G/C/N)aa29—34: GCseSE, aa117—122: GSqnTL, aa188—193: GSadTR, aa213—218: GLfvGL, aa220—225: GVatGT, 5个酪蛋白激酶II磷酸化位点(Casein kinase II phosphorylation site)(S/T-X-X-D/E) aa31—34: SesE, aa33—36: SekE, aa76—79: SvsE, aa78—81: SeqD, aa171—174: TpqE, 3个蛋白激酶C磷酸化位点(Protein kinase C phosphorylation site) (S/T-X-R/K) aa33—35: SeK, aa126—128: SaR, aa146—148: TvK。
使用Megalign软件对黄颡鱼MHC class II氨基酸ORF序列与其他硬骨鱼类进行比较, 得到其与长吻逘的氨基酸序列相似度最高为69.5%, 与锦鲤的氨基酸序列相似度最低为50.4%(表 3)。
2.2 黄颡鱼MHC class II系统进化树的构建
在NCBI中选取了12种水产动物已知或预测MHC class II蛋白序列进行系统进化树的构建, 发现黄颡鱼与长吻逘、斑点叉尾亲缘关系较近, 属于同一分支(图 1)。
2.3 黄颡鱼MHC class II的组织差异表达
实验共选取了黄颡鱼9种组织, 包括: 小肠、肾、肝、鳍条、肌肉、脾脏、鳃、脑和头肾。其中在小肠、鳍条、肌肉、肝脏和鳃5种组织中MHC class II基因有表达, 且小肠、肝脏和鳃3种组织中表达量相对较高, 肌肉和鳍条表达量相对较低, 而在脾脏、头肾、肾脏、和脑中未检测到表达(图 2)。
2.4 饲料维生素D3对黄颡鱼典型组织中MHC class II的表达影响
养殖实验对照组和处理组取小肠、肾脏和肝脏3种组织, 实验结果显示, 小肠和肾脏对照组无表达, 但在处理组(饲料中添加维生素D3组)中显著表达(P<0.05); 肝脏对照及处理组均无表达(图 3)。
3 讨论
MHC基因家族广泛存在于脊椎动物中, 具有极高的基因多态性, 在遗传育种、免疫抗病等方面的研究中备受青睐, 目前主要研究热点为I、II两类, MHC-I类基因区包括经典的A、B、C基因和非经典的E、F、G基因; MHC-II类基因被命名为MHCD, 并划分为MHC-DR、MHC-DQ、MHC-DP等亚区, 此外还有DMA、DMB、LMP2、LMP7、TAP及TAP2等基因位点[30]。目前在水产动物中MHC class II基因的研究已较为广泛, 现已得到多种鱼类MHC class II类基因cDNA全长, 其中包括: 斑马鱼(Danio rerio)[31]、军曹鱼(Rachycentron canadum)[32]、牙鲆(Paralichthys olivaceus)[33]、草鱼[34]、大西洋鲑(Salmo salar)[35]、大菱鲆(Scophthatmus maximus)[36]、虹鳟(Oncorhynchus mykiss)[37]等, 但相较于哺乳动物和家禽类的研究, 还显得有些匮乏, 尤其是小型经济鱼类研究并不十分常见。本文使用Race技术,扩增得到MHC class II基因cDNA全长1074 bp, 编码235个氨基酸, 具有明显的转录终止信号AATAAA及poly A尾巴。通过将黄颡鱼MHC class II基因的ORF与其他多种水产动物的MHC class II氨基酸序列比较后发现, 存在明显的MHC class II alpha蛋白结构、Ig免疫球蛋白结构以及保守蛋白结构, 氨基酸C段相似性极高, 且转膜区附近保守性较高, 转膜区高度保守。建立进化树结果显示, 黄颡鱼MHC class II基因和长吻逘、斑点叉尾亲缘关系更近。
MHC基因群与免疫有着密不可分的联系, 关于哺乳动物[38,39]、家禽[40,41]、水产动物[42,43]MHC基因研究表明MHC基因家族在动物遗传多样性分析、动物遗传结构分析、动物抗病能力、异种移植、基因治疗等方面都发挥了极大的作用[30,44]。而较MHC I类基因, II类基因的研究相对较少, 研究发现在不同鱼类中, MHC II类基因的组织表达也具
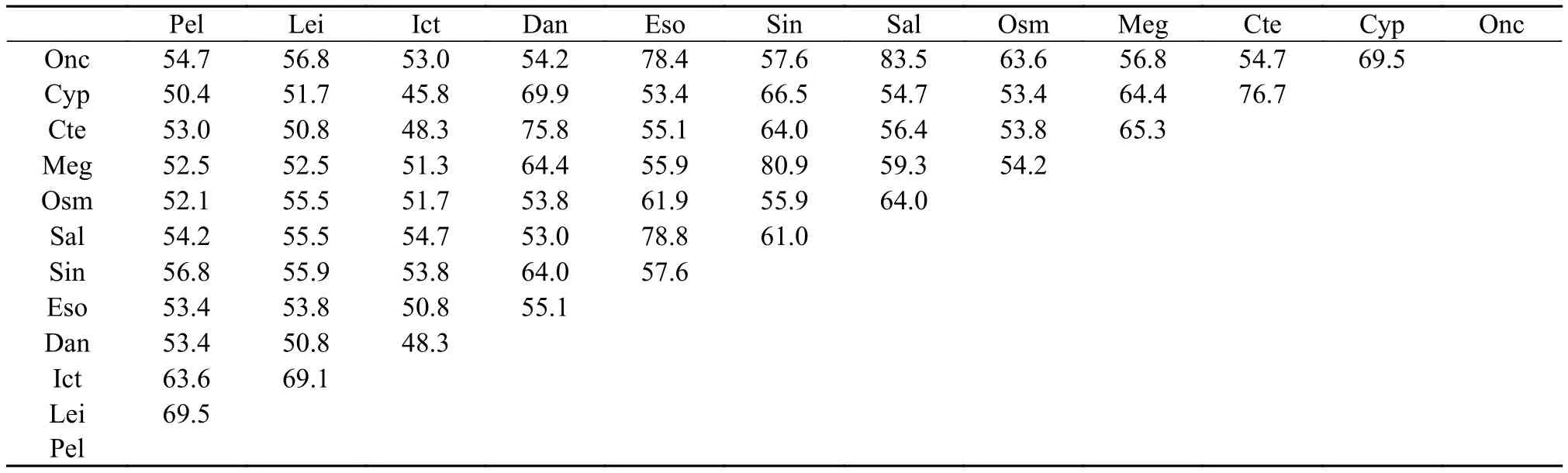
表 3 12种鱼类MHC-II氨基酸序列相似度比较Tab. 3 Alignment of MHC-II amino acid sequence identity of 12 species
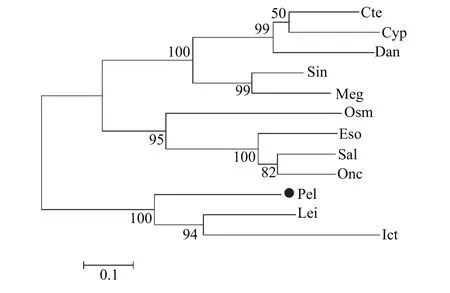
图 1 MHC class II基因系统进化树Fig. 1 Phylogenetic tree of MHC class II gene
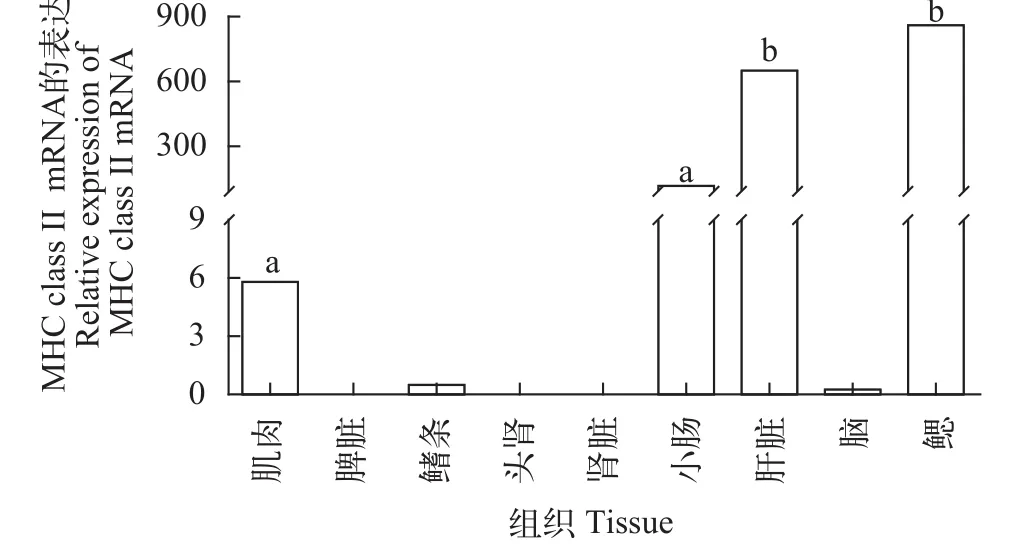
图 2 黄颡鱼MHC class II mRNA的组织分布
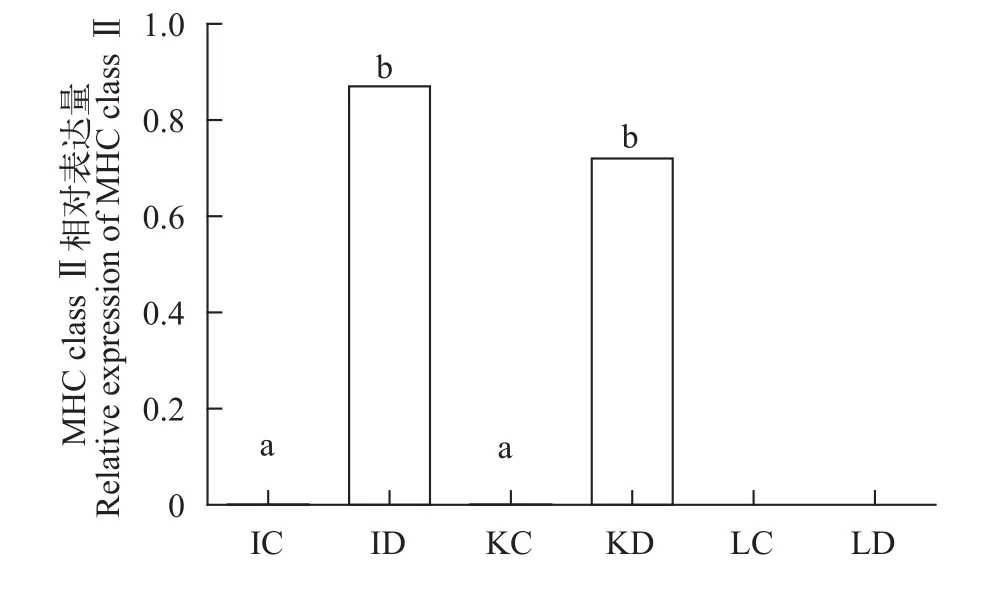
图 3 在饲料中添加VD3后黄颡鱼MHC class II mRNA在肠和肾中的相对表达Fig. 3 Relative mRNA level of MHC class II in intestine and kidney of yellow catfish by feeding VDIC、ID分别表示小肠对照组及VD3处理组; KC、KD分别表示肾脏对照组及VD3处理组; LC、LD 分别表示肝脏对照组及VD3处理组IC. intestinal control; ID. intestinal deal; KC. kidney control; KD. kidney deal; LC. liver control; LD. liver deal
注: Onc. Oncorhynchus mykiss虹鳟(CAB96451.1); Cyp. Cyprinus carpio锦鲤(CAA64708.1); Cte. Ctenopharyngodon idella草鱼(ABW37740.1); Meg. Megalobrama amblycephala团头鲂(AGV52142.1); Osm. Osmerus mordax胡瓜鱼(ACO09715.1); Sal. Salmo salar大马哈鱼(AGH92604.1); Sin. Sinocyclocheilus anshuiensis金线鲃(XP_016360726.1); Eso. Esox lucius白斑狗(XP_010894456.1); Dan. Danio rerio斑马鱼(NP_571565.1); Ict. Ictalurus punctatus斑点叉尾(AAD39869.1); Lei. Leiocassis longirostris长吻逘(AEI55830.1); Pel. Pelteobagrus fulvidraco黄颡鱼(AOO96598.1); 下同The same applies below有差异性[32,45,46]。根据实时荧光定量PCR结果显示, 本实验得到黄颡鱼MHC class II基因在肌肉、鳍条、小肠、肝脏、鳃5种组织中都有表达, 且小肠、肝脏、鳃3种组织中表达量相对较高, 肌肉、鳍条表达量相对较低。小肠、肝脏、鳃都是与免疫密切相关的组织器官, 肌肉和鳍条在先前的研究中未见表达或表达量低, 推测原因是实验操作过程中肌肉和鳍条极易接触体液, 沾染部分体表黏液所致。非特异性免疫因子存在于鱼体血液及黏液中,而MHC class II基因参与细胞及体液免疫过程, 因此导致MHC class II基因在2种组织中发生表达。在饲料中添加VD3后, 荧光定量结果显示, MHCclass II基因小肠和肾脏处理组(饲料中添加维生素D3组)中显著表达(P<0.05); 肝脏对照及处理组均无表达, 猜测原因是MHC class II组织表达实验中(图2)使用普通黄颡鱼即投喂商品饲料的暂养黄颡鱼,而取小肠、肾脏、肝脏实验用黄颡鱼(图 3)投喂的是低磷饲料(表 1), 且黄颡鱼不属同一批, 内部及各个外部环境的差异也会对结果产生一定影响。研究结果表明, 在低磷饲料中添加VD3对黄颡鱼小肠、肾脏中MHC class II基因的表达有显著促进作用, 维生素D3不仅可以调节机体的钙、磷平衡[44],还具有免疫调节效应, 这种免疫调节效应既发生于多种免疫细胞中, 如: 巨噬细胞、B淋巴细胞、T淋巴细胞等, 其中对于T淋巴细胞的直接作用表现在其对细胞和多种细胞因子产生的调节作用, 包括: IL-1、IL-2、IL-4、IL-6、IL-10、IL-17、(TNF)-α and interferon (IFN)-γ[47—50]等, 与此同时, 在转录组水平上, 维生素D3也参与了多种信号通路[51], 但具体作用机制还需进一步深入研究。
本研究获得了黄颡鱼MHC class II基因的全长,对其基因序列及结构、氨基酸序列及特点进行了分析, 构建进化树, 对水产动物MHC class II物种进化进行了阐述, 丰富了MHC class II基因库; 通过荧光定量PCR分析发现低磷饲料中添加维生素D3对小肠和肾脏MHC class II基因显著表达, 显示该基因表达受到饲料维生素D3的影响, 为制作既能降低磷排放, 又能提高鱼类免疫饲料提供研究基础。
[1]Grimholt U. MHC and evolution in teleosts [J]. Biology, 2016, 5(1): 6
[2]Adriana R. M, Joao G M, Sebastian A, et al. Presentation of phagocytosed antigens by MHC class I and II [J]. NIH Public Access, 2013, 14(2): 135—152
[3]Wang C Q. The Foundation of the Molecular Immunology [M]. Beijing: Beijing University Press. 1997, 139—140 [王重庆. 分子免疫学基础. 北京: 北京大学出版社. 1997, 139—140]
[4]Du J Y, Ding S X, Zhang Z W, et al. The progress of major histocompatibility complex (MHC) gene researches in fish [J]. Journal of Xiamen University (Natural Science), 2006, 45(2): 116—124 [杜佳莹, 丁少雄, 张之文, 等. 鱼类MHC基因的研究进展. 厦门大学学报(自然科学版), 2006, 45(2): 116—124]
[5]Schierman L W, Nordskog A W. Relationship of blood type to histocompatibilityin chickens [J]. Science, 1961, 134(3484): 1008—1009
[6]Hashimoto K, Nakanishi T, Kurosawa Y. Isolation of carp genes encoding major histocompatibility complex antigens [J]. Proceedings of the National Academy of Sciences, 1990, 87(17): 6863—6867
[7]Zhao X W, Yuan X C, Zhao W W, et al. China Fishery Statistical Yearbook [M]. Beijing: China Agriculture Press. 2015, 30—31 [赵兴武, 袁晓初, 赵文武, 等. 中国渔业统计年鉴. 北京:中国农业出版社, 2015, 30—31]
[8]Ma L Q, Li D P, Tian X, et al. The muscular nutritional components and flesh quality of farmed Pelteobagrus fulvidraco yearlings [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 193—196 [马玲巧, 李大鹏, 田兴, 等. 1龄黄颡鱼的肌肉营养成分及品质特性分析. 水生生物学报, 2015, 39(1): 193—196]
[9]Guo H S, Zhang H L. Diagnosis and treatment technology of yellow catfish common diseases [J]. Journal of Aquaculture, 2014, 35(8): 44—46 [郭海山, 张洪利. 黄颡鱼常见疾病的诊断与防治技术. 水产养殖, 2014, 35(8): 44—46]
[10]Ai Q H, Mai K S. Advance on nutiritional immunity of fish [J]. Acta Hydrobiologica Sinica, 2007, 31(3): 425—430 [艾庆辉, 麦康森. 鱼类营养免疫研究进展. 水生生物学报, 2007, 31(3): 425—430]
[11]Zuo R T, Ai Q H, Mai K S. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irr) [J]. Fish & Shellfish Immunology, 2012, 32(2): 249
[12]Zhou X Q, Feng L, Jiang W D, et al. Advanced research in nutrition and fish immunity [J]. Chinese Journal of Animal Nutrition, 2014, 26(10): 3175—3184 [周小秋, 冯琳,姜维丹, 等. 营养与鱼类免疫研究进展. 动物营养学报, 2014, 26(10): 3175—3184]
[13]Mora J R, Iwata M, von Andrian U H. Vitamin effects on the immune system: vitamins A and D take centre stage [J]. Nature Reviews Immunology, 2008, 8(9): 685—698
[14]Mostafa W Z, Hegazy R A. Vitamin D and the skin: focus on a complex relationship: A review [J]. Journal of Advanced Research, 2015, 6(6): 793—804
[15]Lai Y X, Fang D Z. Recent advanced in vitamin D [J]. Internal Medicine, 2014, 25: 7—14 [赖宇轩, 方德昭. 维生素D的最新进展. 内科学志, 2014, 25: 7—14]
[16]Calton E K, Keane K N, Newsholme P, et al. The impact of vitamin D levels on inflammatory status: a systematic review of immune cell studies [J]. PloS One, 2015, 10(11): e0141770
[17]Aranow C. Vitamin D and the immune system [J]. Journal of Investigative Medicine, 2011, 59(6): 881—886
[18]Torres M. Vitamin D proven more effective than both anti-viral drugs and vaccines at preventing the flu. 2016, 1, 10. http://www.worldhealth.net/forum/thread/99358/ vitamin-d-proven-more-effective-than-bo/?page=1
[19]Deeb K K, Trump D L, Johnson C S. Vitamin D, signalling pathways in cancer: potential for anticancer therapeutics [J]. Nature Reviews Cancer, 2007, 7(9): 684—700
[20]Welsh J. Vitamin D and prevention of breast cancer [J]. Acta Pharmacologica Sinica, 2007, 28(9): 1373—1382
[21]Bernardi R J, Johnson C S, Modzelewski R A, et al. Antiproliferative effects of 1α, 25-dihydroxyvitamin D3and vitamin D analogs on tumor-derived endothelial cells [J]. Endocrinology, 2002, 143(7): 2508—2514
[22]Norman A W. Receptors for 1-α, 25(OH)2D3: past, present, and future [J]. Journal of Boneand Mineral Research, 1998, 13(9): 1360—1369
[23]Schwartz Z, Ehland H, Sylvia V L, et al. 1α, 25-dihydroxyvitamin D3and 24R, 25-dihydroxyvitamin D3modulate growth plate chondrocyte physiology via protein kinase C-dependent phosphorylation of extracellular signal-regulated kinase 1/2 mitogen-activated protein kinase [J]. Endocrinology, 2002, 143(7): 2775—2786
[24]Fleet J C. Rapid, membrane-initiated actions of 1,25-dihydroxyvitamin D: what are they and what do they mean? [J]. Journal of Nutrition, 2004, 134(12): 3215—3218
[25]Beard J A, Bearden A, Striker R. Vitamin D and the antiviral state [J]. Journal of Clinical Virology, 2011, 50(3): 194—200
[26]Zhang T, XU Q Y, Xu H, et al. Effects of dietary vitamin D3supplementation on body composition and activity of alkaline phosphatase in the serum of juvenile mirror carp (C. carpio Songpu mirror carp) [J]. Acta Agriculturae Boreali-Sinica, 2011, 26(Suppl1): 258—263 [张桐, 徐奇友, 许红, 等. 饲料中维生素D3对松浦镜鲤幼鱼体成分和血清碱性磷酸酶的影响. 华北农学报, 2011, 26(增刊1): 258—263]
[27]Jiang M, Wu F, Wen H, et al. Effects of dietary vitamin D3supplementation on growth and body composition of juvenile grass carp (Ctenopharyngodon idellus) [J]. Freshwater Fisheries, 2009, 39(5): 38—42 [蒋明, 吴凡,文华, 等. 饲料中添加不同水平的维生素 D3对草鱼幼鱼生长和体成分的影响. 淡水渔业, 2009, 39(5): 38—42]
[28]Duan M M, Wang C F, Xie C X. Effects of dietary vitamin D3on antioxidant andimmune capacity of juvenile Pelteobagrus fulvidraco [J]. Freshwater Fisheries, 2014, 44(3): 80—84 [段鸣鸣, 王春芳, 谢从新. 维生素D3对黄颡鱼幼鱼抗氧化能力及疫功能的影响. 淡水渔业, 2014, 44(3): 80—84]
[29]Li D B, Li C, Zhang G W, et al. Effects of dietary vitamin D3level on expression of antimicrobial peptide hepcidin gene in Monopterus albus [J]. Chinese Journal of Animal Nutrition, 2012, 24(8): 1520—1526 [黎德兵, 李超,张龚炜, 等. 饲料中维素D3水平对黄鳝抗菌肽hepcidin基因表达的影响. 动物营养学报, 2012, 24(8): 1520—1526]
[30]Kang L Z, Erdemtu, Jiang J Q, et al. Research progress on major histocompatiblity complex (MHC) gene [J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(5): 28—33 [亢孝珍, 额尔敦木图, 姜建强, 等. 主要组织相容性复合体(MHC)基因研究进展. 中国畜牧兽医, 2014, 41(5): 28—33]
[31]Hideki O, Dagmar K, Vladimir V, et al. Major histocompatibility complex class II genes of zebrafish [J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(24): 11886—11890
[32]Mao L N, Feng J, Li Y G, et al. Full length cDNA cloning and tissue expression of major histocompatibility complex (MHC)-Ⅱα from Cobia (Rachycentron canadum) [J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(10): 48—56 [茅莉娜, 冯娟, 李玉谷, 等.军曹鱼MHC-Ⅱα基因全长cDNA的克隆及其组织表达分析. 中国畜牧兽医, 2010, 37(10): 48—56]
[33]Prapansak S, Tsuyoshi O, Ikuo H, et al. Cloning, characterization and expression of cDNA containing major histocompatibility complex class I, IIa and IIb genes of Japanese flounder Paralichthys olivaceus [J]. Fisheries Science, 2004, 70(2): 264—276
[34]VanErp S H M, Egberts E, Stet R. Characterization of major histocompatibility complex class IIA and B genes in gynogenetic carp clone [J]. Immunogenetics, 1996, 44(3): 192—202
[35]Hordvik I, Grimholt U V M, Lie F, et al. Cloning and sequence analysis of cDNA sencoding the MHC class II chain in Altlantic salmon (Salmon salar) [J]. Immunogenetics, 1993, 37(6): 437—441
[36]Zhang Y X, Chen S L. Molecular identification, polymorphism, and expression analysis of major histocompatibility complex class IIA and B genes of turbot (Scophthal musmaximus) [J]. Marine Biotechology, 2006, 8(6): 611—623
[37]Dorschner M O, Duris T, Bront C R, et al. High levels of MHC class II allelic diversity in lake trout from lake superior [J]. Heredity, 2000, 91(5): 359—363
[38]Katarzyna K, Wiesław B, Katarzyna B, et al. Evolution of major histocompatibility complex class I and class II genes in the brown bear [J]. BMC Evolutionary Biology, 2012, 12: 197
[39]Łopucki R, Mróz I. An assessment of non-volant terrestrial vertebrates response to wind farms-a study of small mammals [J]. Environmental Monitoring and Assessment, 2016, 188(2): 122
[40]Zhou H J, Lamont J. Chicken MHC class I and II gene effects on antibody response kinetics in adult chickens [J]. Immunogenetics, 2003, 55(3): 133—140
[41]Hou Z C, Yang N. Advances in major histocompatibilitycomplex research in poultry [J]. Hereditas (Beijing), 2002, 24(1): 72—76 [侯卓成, 杨宁. 家禽主要组织相容性复合体的研究进展. 遗传, 2002, 24(1): 72—76]
[42]Ruan R, Ruan J, Wan X L, et al. Organization and characteristics of the major histocompatibility complex class II region in the Yangtze finless porpoise (Neophocaenaasiaeorientalis asiaeorientalis) [J]. Scientific Reports, 2016, 6: 22471
[43]Johannes M D, Unni G, Jong L, et al. Comprehensive analysis of MHC class II genes in teleost fish genomes reveals dispensability of the peptide-loading DM system in a large part of vertebrates [J]. BMC Evolutionary Biology, 2013, 13: 260
[44]Ma L Y, Yue B F. Advances in research on major histocompatibility complex [J]. Chinese Journal of Comparative Medicine, 2005, 15(3): 182—185 [马丽颖, 岳秉飞.主要组织相容性复合体(MHC)研究进展. 中国比较医学杂志, 2005, 15(3): 182—185]
[45]Liu Y, Kasshara M, Rumfelt L L, et al. Xenopous classⅡ A genes: studies of genetic, polymorphism, and expression [J]. Developmental and Comparative Immunology, 2002, 26(8): 735—750
[46]Chen S L, Xu M Y, Hu S N, et al. Molecular polymorphism and expression analysis of MHC class IIB gene from red sea bream (Chrysophrys major) [J]. Developmental and Comparative Immunology, 2006, 30: 407—418
[47]Michelino D R, Michele M, Ferdinando N. Vitamin D3: a helpful immunomodulator [J]. Immunology, 2011, 134: 123—139
[48]Martin E, O’sullivan B, Low P, et al. Antigen-specific suppression of a primed immune response by dendritic cells mediated by regulatory T cells secreting in terleukin-10 [J]. Immunity, 2003, 18(1): 155—167
[49]Qi X P. Immunomodulatory effects of 1,25-dihydroxyvitamin D3[J]. Parenteral & Enteral Nutrition, 2006, 13(2): 105—108 [祁晓平. 1,25-二羟维生素D3的免疫调节作用. 肠外与肠内营养, 2006, 13(2): 105—108]
[50]LeibundGut-Landmann S, Waldburger J M, Krawczyk M, et al. Mini-review: Specificity and expression of CIITA, the master regulator of MHC class II genes [J]. European Journal of Immunology, 2004, 34(6): 1513—1525
[51]Mari O H, Yohei M, Mari M Y, et al. Cutting edge: requirement of MARCH-I-mediated MHC II ubiquitination for the maintenance of conventional dendritic cells [J]. In The Journal of Immunology, 2009, 183(11): 6893—6897
FULL-LENGTH cDNA CLONING AND THE EFFECT OF DIETARY VITAMIN D3ON TISSUE EXPRESSION OF MAJOR HISTOCOMPATIBILITY COMPLEX-ⅡIN YELLOW CATFISH (PELTEOBAGRUS FULVIDRACO)
FENG Mei-Hui, CHEN Pei, LEI Wen, LI Da-Peng and WANG Chun-Fang
(Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Hubei Provincial Engineering Laboratory for Pond Aquaculture, the College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China)
To study the relationship between vitamin D3(VD3) and the major histocompatibility complex (MHC) class II gene, the MHC class II antigen gene of yellow catfish was cloned by rapid-amplification of cDNA ends. The fulllength cDNA of MHC class II is 1074 bp long and comprises a 78 bp 5′ untranslated region (UTR_, 259 bp 3′UTR, and a 708 bp open reading frame that encodes 236 amino acids. The deduced amino acid sequence showed the highest identity (69.5%) and the lowest identity (50.4%) with Leiocassis longirostris and Cyprinus carpio, respectively. Expression of the MHC class II antigen gene was relatively high in the small intestine, liver, and gill, but low in muscles and tail. It was nearly undetectable in the other tissues. Vitamin D3(0, 5000 IU/kg) was added to low phosphorus diets in the growth trial. The addition of dietary VD3significantly stimulated MHC class II gene expression in the small intestine and kidney. This study describes the molecular structure, tissue expression of the MHC class II antigen gene, and possible effects of dietary VD3on tissue expression of the MHC class II gene in yellow catfish, providing useful information for further studies of the function of this gene in yellow catfish.
Yellow catfish; MHC class II; Dietary VD3; Gene expression
S965.1; Q344+.1
A
1000-3207(2017)05-0992-08
10.7541/2017.124
2016-09-30;
2017-03-15
国家自然科学基金(31172421和31672667); 现代农业产业技术体系建设专项基金(CARS-46)资助 [Supported by the National Natural Science Foundation of China (31172421, 31672667); the Earmarked Fund for China Agriculture Research System (CARS-46)]
冯美惠(1991—), 女, 天津人; 硕士; 主要研究方向为分子营养免疫。E-mail: f03011018@163.com
王春芳(1975—), 副教授; 主要研究方向为鱼类营养与环境。E-mail: cfwang@mail.hzau.edu.cn
- 水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE

