柚皮素-β-环糊精包合物的制备及表征
郭亚宁
(宝鸡文理学院 化学化工学院,陕西省植物化学重点实验室,陕西 宝鸡 721013)
柚皮素-β-环糊精包合物的制备及表征
郭亚宁*
(宝鸡文理学院 化学化工学院,陕西省植物化学重点实验室,陕西 宝鸡 721013)
采用溶液-搅拌法制备了柚皮素-β-环糊精包合物,利用紫外光谱、红外光谱、X射线衍射法、差热分析法对其进行结构表征分析,并对其水溶性进行测试. 结果表明包合物的形成提高了柚皮素的水溶性,从而改善了黄酮类化合物水溶性差的问题,有望提高该类化合物的生物利用度,为研发黄酮类新剂型提供理论基础.
β-环糊精;柚皮素;包合物;溶解度
β-环糊精(β-CD)是一类环状的、由7 个β-吡喃葡萄糖单元通过α-1,4-糖苷键连接而成的低聚糖,具有“内疏水、外亲水”的刚性锥形空腔结构,其能够与少许极性、大小、外形及性质相匹配的客体分子或某些客体分子的疏水性基团构成包合物,经常用于增加药物稳定性、提高药物溶解度、提高生物利用度和控制药物释放速度的作用[1-3].
柚皮素是二氢黄酮类化合物,在医学、食品化学,农学及食品科学等领域都有很广泛的应用,具有抗菌[4-5]、抗氧化[6]、抗肿瘤、抗心律失常、预防动脉粥样硬化[7]等生物活性. 但由于其水溶性较差,热稳定性低,导致其生物利用度较低. 为了增强该类化合物的水溶性,改善其药物活性,研究者采用环糊精及其衍生物与药物包合的方式对一些天然产物进行修饰以提高生物利用度,取得了一定的效果[8-10]. 为了进一步拓展该类化合物的研究范围,本文采用溶液-搅拌法制备柚皮素-β-环糊精包合物,利用紫外光谱、红外光谱、X-射线衍射法、差热分析法对其进行结构表征分析,并对其水溶性进行测试. 结果表明包合物的形成提高了柚皮素的水溶性,改善了黄酮类化合物水溶性差的问题,有望提高该类化合物的生物利用度,为研发黄酮类新剂型提供理论基础.
1 实验部分
1.1 主要仪器与试剂
UV-2550型紫外分光光度计(日本岛津公司)、X射线衍射仪-UItima Ⅳ(日本理学公司)、电热恒温鼓风干燥箱(上海跃进医疗器械有限公司)、Nicolet 170SX FT-IR傅立叶变换红外光谱仪(赛默飞世尔科技(中国)有限公司);柚皮素(陕西慧科植物开发有限公司)、β-环糊精(陶湾化工厂)、无水乙醇、甲醇. 所用试剂均为分析纯.
1.2 柚皮素-β-CD包合物的制备
称取0.50 g柚皮素,用少量乙醇溶解. 按1∶1摩尔比准确称取β-环糊精2.08 g并加水制成饱和溶液. 然后缓慢加入柚皮素的乙醇溶液,混合均匀,于60 ℃下搅拌30 min,停止加热并继续搅拌5 h,冷却,4 ℃冷藏静置过夜,过滤. 固体在40 ℃真空干燥箱中干燥24 h,得柚皮素-β-CD包合物2.06 g,产率为79.8%.
1.3 标准曲线以及包合物溶解度、包合率的测定
1.3.1 柚皮素标准曲线
称取柚皮素3.86 mg,置10 mL容量瓶中,用乙醇溶解并定容,量取1 mL并稀释到10倍,之后每次稀释到之前溶液的5/6,用乙醇定容,摇匀,贮藏,备用. 分别测定不同浓度的柚皮素溶液的吸光度(A). 以吸光度对浓度进行线性回归,得回归方程为A=58.659 16ρ+0.013 59(R2=0.999 97),不同浓度的柚皮素紫外吸收光谱如图1.
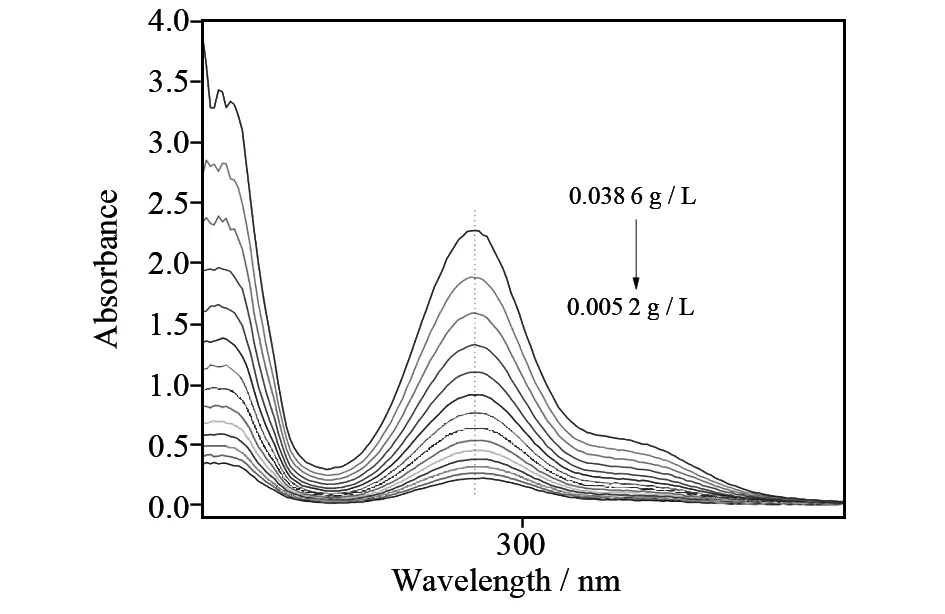
图1 不同浓度柚皮素的紫外吸收光谱Fig.1 Ultraviolet absorption spectra of different concentrations for naringenin
由图1可知,浓度对柚皮素的紫外吸收具有较大的影响,其吸收强度随柚皮素浓度的增加而增加.
以吸光度A为纵坐标,柚皮素浓度为横坐标,做标准曲线图,如图2.

图2 柚皮素标准曲线Fig.2 Standard curve of naringenin
结果表明,柚皮素质量浓度在5.2~38.6 mg/L范围内与A呈良好线性关系.
1.3.2 包合物在水中溶解度的测定
称取5.00 mg柚皮素和5.00 mg的柚皮素-β-环糊精包合物分别悬浮于15 mL的蒸馏水中,在恒温磁力搅拌器上搅拌30 min,分别制得柚皮素和柚皮素-β-环糊精包合物的过饱和溶液. 分别移取上述清液各5 mL转入50 mL的容量瓶中,再加入无水乙醇进行稀释、定容. 然后以无水乙醇作为参比溶液,在288 nm处测定吸光度A,如图3. 将A代入标准曲线计算出柚皮素单体中柚皮素的含量为4.26 mg/L,包合物饱和水溶液中柚皮素的含量为38.6 mg/L,相当于柚皮素-β-环糊精包合物199.49 mg/L(以包合比1∶1计算).
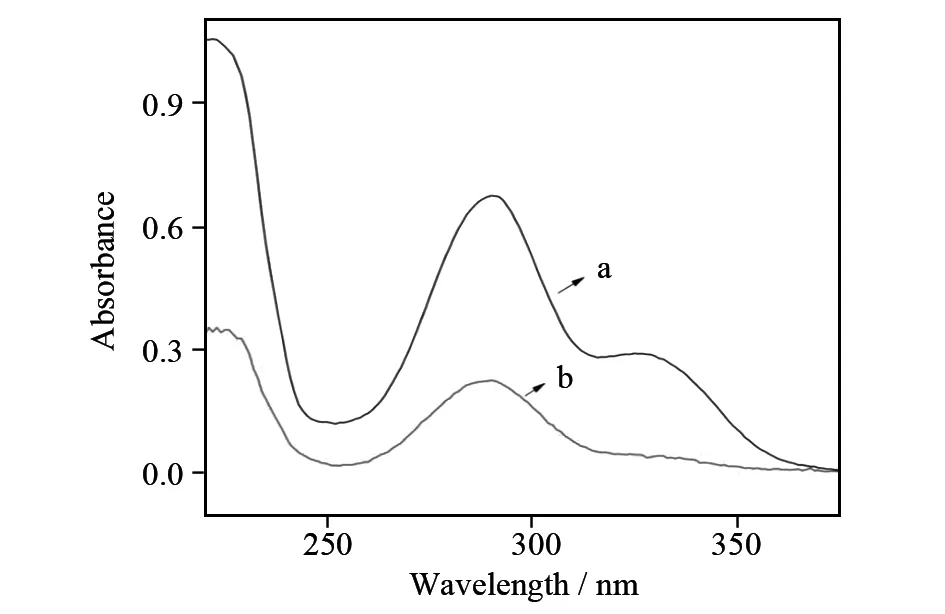
a-槲皮素;b-包合物.图3 柚皮素及其包合物在水中的溶解度测定Fig.3 Solubility in water of naringenin and its inclusion compound
1.3.3 包合物中柚皮素含量的测定[11]
称取3.72 mg的柚皮素-β-环糊精包合物配成0.037 2 g/L的溶液,以无水乙醇作为参比,在288 nm处测定其吸光度A,如图4. 将A代入标准曲线计算包合物中柚皮素的含量为15.37%,然后根据所含β-环糊精的量推算出该包合物的包合比为1∶1. 以柚皮素和β-环糊精物质的量之比为1∶1完全包合时为基准,比较得该包合物的包合率为63.32%.
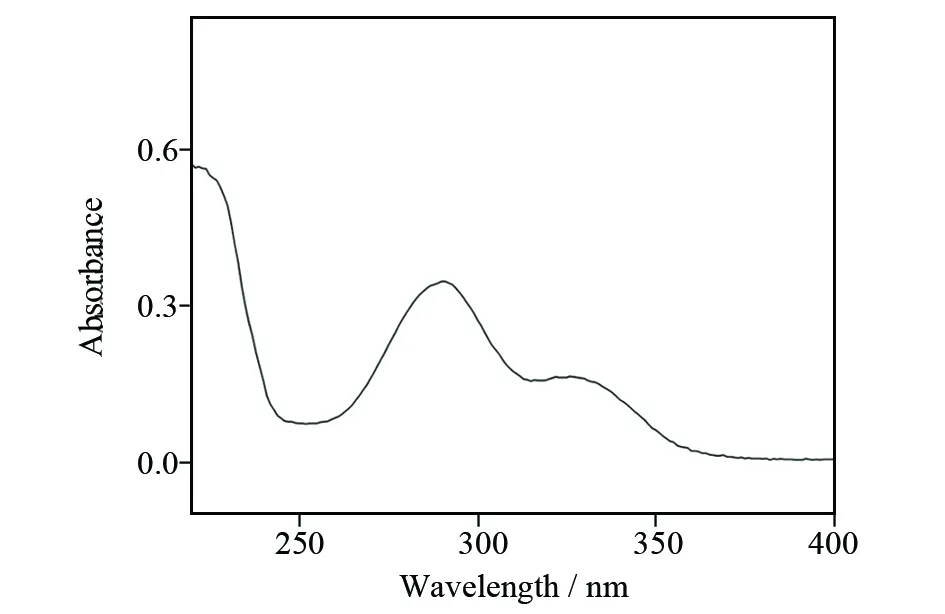
图4 包合物中柚皮素含量测定图Fig.4 Content of naringenin in inclusion compound
2 结果与讨论
2.1 红外光谱分析
分别取少量柚皮素、β-环糊精、柚皮素与β-环糊精的混合物、柚皮素-β-环糊精包合物进行红外光谱测定,其光谱图如图5. 从图5可以看出:包合物和物理混合物的图谱有着明显的差异. 包合物在1 599.90、1 155.09和830.63 cm-1处有很强的吸收信号. 并且有5个峰发生了红移,分别是1 626.92、1 586.71、1 247.31、889.82和665.94 cm-1. 同时有3个峰消失,分别是970.00、867.19和728.13 cm-1. 图中柚皮素-β-环糊精物理混合物的光谱可以明显看出是柚皮素和β-环糊精二者叠加的.
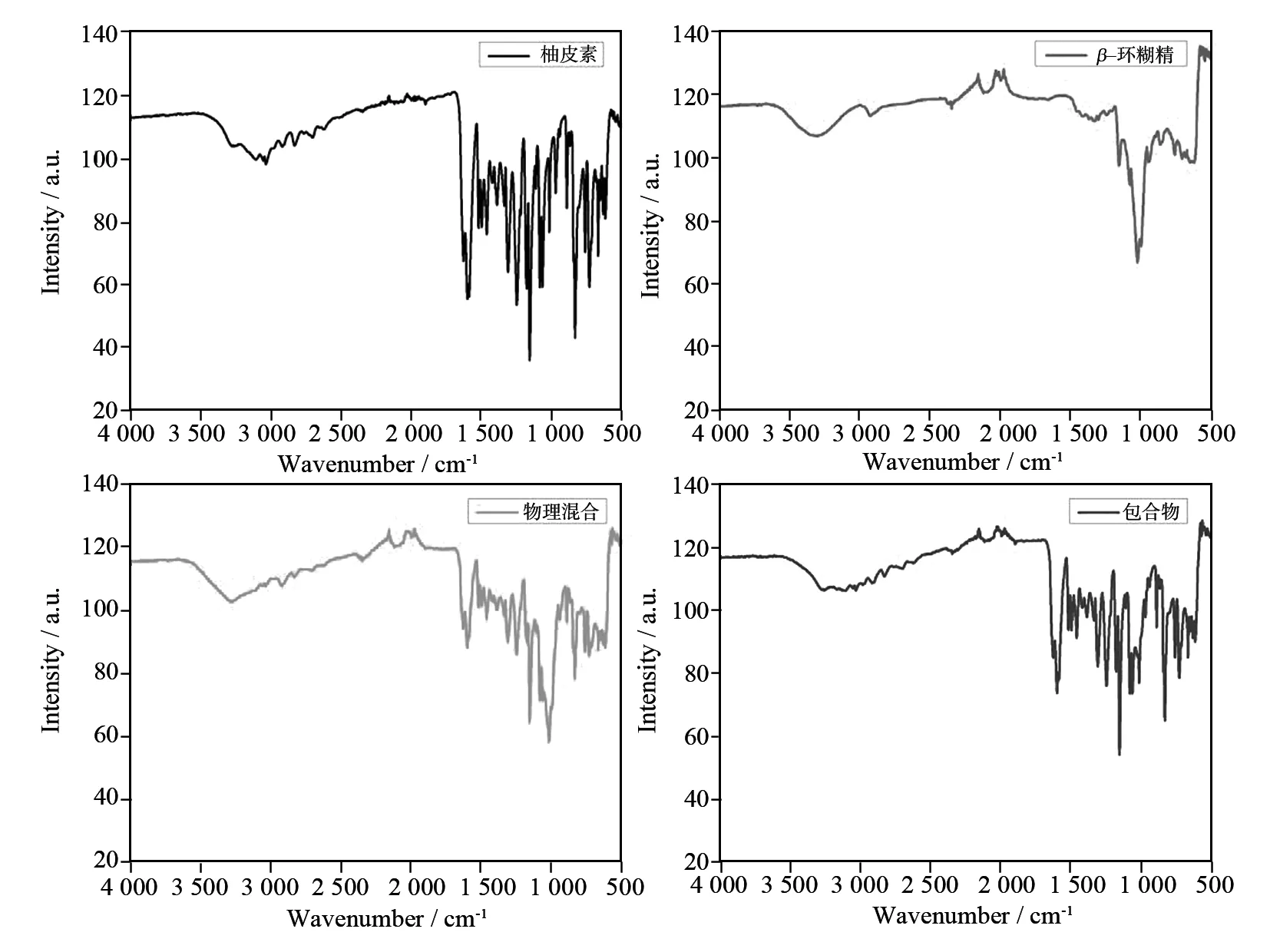
图5 不同柚皮素样品的红外光谱图 Fig.5 FTIR spectrograms of different samples
2.2 X-射线衍射分析
取少量柚皮素、β-环糊精、柚皮素与β-环糊精的混合物、柚皮素-β-环糊精包合物,在Cu-Co辐射,管电压40 kV,管电流40 mA条件下进行X射线衍射分析,如图6所示. 从图6中可以看出柚皮素-β-环糊精包合物已经形成一个新的衍射峰. 它的峰值既不同于物理混合物也跟柚皮素、β-环糊精存在区别. 图中柚皮素在3.0°、4.98°、15.54°、17.86°、19.56°、21.88°、24.94°、25.0°、27.42°有较强的衍射峰,可以表现出其晶体性质.β-环糊精在3.14°、10.78°、12.64°、17.82°、18.88°、24.2°、32.98°有几组较宽的吸收峰说明其无定形性. 物理混合物在3.0°、10.74°、12.6°、18.02°、22.22°、25.08°有较强的衍射峰,包合物在3.04°、4.44°、8.74°、10.6°、12.32°、15.62°、17.92°、23.56°、29.94°有较强的衍射峰. 包合物中柚皮素的特征峰消失,存在两组β-环糊精较宽的衍射峰,说明柚皮素已被β-环糊精包合.
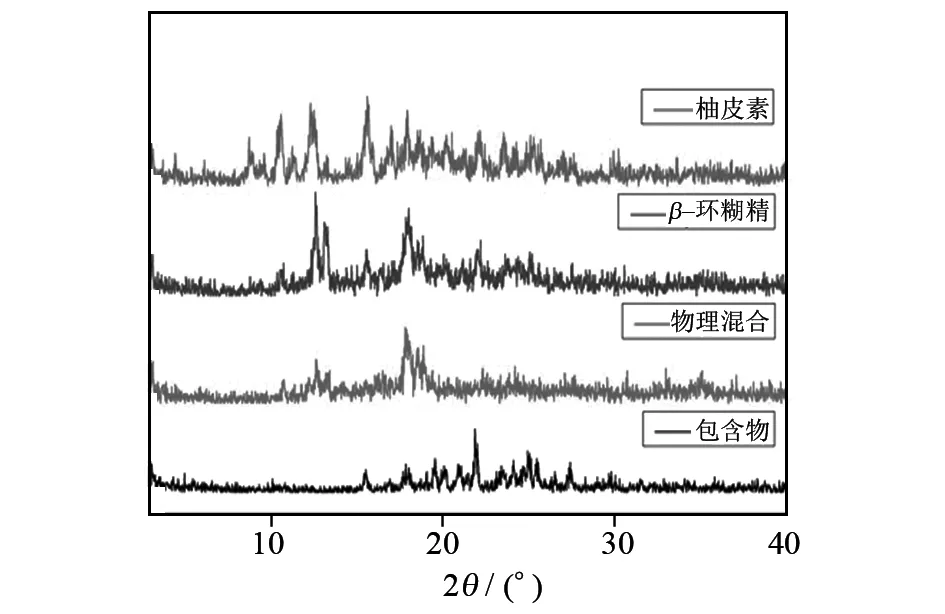
图6 不同柚皮素样品的X射线衍射图Fig.6 X-ray diffraction patterns of different naringenin samples
2.3 差热图谱分析
以空白作参比,升温速率为10 ℃/min,升温范围为20~400 ℃,分别取少量柚皮素、β-环糊精、柚皮素与β-环糊精的混合物、柚皮素-β-环糊精包合物进行差热分析,如图7. 由此可看出,包合物和物理混合物存在较为明显的差异. 图中可知物理混合物在250 ℃和307 ℃存在两组较强的吸热峰,在337 ℃有一组放热峰. 而包合物的这两组吸热峰则移至251 ℃和304 ℃,前后者均强度增加,放热峰基本消失,并且在137 ℃形成一组较弱的新吸热峰,说明包合物已经形成一种新的物相.

图7 柚皮素不同样品的差热分析图 Fig.7 Differential scanning calorimetric analysis of different samples
3 结论
以柚皮素为原料,采用溶液-搅拌法与β-环糊精进行包合,制得柚皮素-β-环糊精包合物,采用紫外光谱法、X-射线衍射法、红外光谱法、差热分析等方法对包合物进行结构表征分析,并对其包合率、包合比以及溶解度进行测定. 结果表明包合物中柚皮素的含量为15.37%,包合率为63.32%,包合比为1∶1,且包合物的生成明显提高了柚皮素的水溶性,有效的解决了其利用率低的难题. 这为进一步研发水溶性强、高效低毒的黄酮类药物提供理论基础.
[1] 李姝静, 胡杰. 环糊精构筑超分子体系基础及应用 [M]. 北京: 化学工业出版社, 2014.
LI S J, HU J. The basis and application of supramolecular system constructed by cyclodextrin [M]. Beijing: Chemical Industry Press, 2014.
[2] 杨波, 杨光, 李代禧, 等. 苯乙醇香精与β-环糊精包合物的制备工艺研 [J]. 食品工业科技, 2007, 28(1): 210-212.
YANG B, YANG G, LI D X, et al. Study on preparation procedure ofβ-cyclodextrin inclusion complex for phenethyl alcohol [J]. Science and Technology of Food Industry, 2007, 28(1): 210-212.
[3] 杨小云, 付丽娜, 陈洪轩, 等. 饱和水溶液法制备莫能菌素-β-环糊精包合物的研究 [J]. 中国畜牧兽医, 2017, 44(1): 289-295.
YANG X Y, FU L N, CHEN H X, et al. Study on preparation ofβ-cyclodextrin inclusion compound of monensin by saturated water solution method [J]. China Animal Husbandry & veterinary Medicine, 2017, 44(1): 289-295.
[4] 霍平, 刘万云. 柚皮素芳酰腙化合物的微波合成与抑菌活性研究 [J]. 化学试剂, 2012, 34(4): 193-195.
HUO P, LIU W Y. Microwave assisted synthesis and antibacterial activity of naringenin aromatic hydrazone compounds [J]. Chemical Reagents, 2012, 34(4): 193-195.
[5] ZHANG Y, WANG J F, DONG J, et al. Inhibition ofα-toxin production by subinhibitory concentrations of naringenin controls Staphylococcus aureus pneumonia [J]. Fitoterapia, 2013, 86: 92-99.
[6] MOHAMMAD A E, MOSTAFA A. Naringenin attenuates CCl4-induced hepatic inflammation by the activation of an Nrf2-mediated pathway in rats. [J]. Clinical & Experimental Pharmacology & Physiology, 2014, 41(6): 416-422.
[7] 杨颖, 罗晖, 吕湛. 柚皮苷与柚皮素对ApoE-/-小鼠主动脉粥样硬化斑块形成的作用 [J]. 医药导报, 2016, 35(11): 1181-1185.
YANG Y, LUO H, LV Z. Effect of naringin and naringenin on atherosclerotic plaque development aorta in apoE-/-mice [J]. Herald of Medicine, 2016, 35(11): 1181-1185.
[8] 马水仙. 三种天然黄酮与环糊精的包合行为及性质研究 [D]. 昆明: 云南民族大学, 2012.
MA S X. Studies on the inclusion behavior and characte-rization of three flavonoids with cyclodextrins [D]. Kunming: Yunnan Minzu University, 2012.
[9] 解春英. 羟丙基-β-环糊精包合对柚皮素增溶作用研究 [D]. 杭州: 浙江大学, 2011.
XIE C Y. Study on solubility enhancement of naringenin by inclusion complex with hydroxypropyl-β-cyclodextrin [D]. Hangzhou: Zhejiang University, 2011.
[10] SHULMAN M, COHEN M, SOTO-GUTIERREZ A, et al. Enhancement of naringenin bioavailability by complexation with hydroxypropoyl-β-cyclodextrin [J]. PLos One, 2011, 6(4): 1-6.
[11] 罗兰, 孙殿甲, 苗爱东, 等. 甲苯米哇书-环糊精包合物质量标准的研究 [J]. 新疆医科大学学报, 2001, 24(1): 66-67.
LUO L, SUN D J, MIAO A D, et al. Quality control of mebendazole-β-CD complex [J]. Journal of Xin Jiang Medical University, 2001, 24(1): 66-67.
[责任编辑:张普玉]
Preparation and characterization of naringenin-β-cyclodextrin inclusion compound
GUO Yaning*
(CollegeofChemistry&ChemicalEngineering,ShaanxiKeyLaboratoryofPhytochemistry,BaojiUniversityofArtsandSciences,Baoji721013,Shaanxi,China)
Naringenin-β-cyclodextrin inclusion compound was prepared by solution-stirring method, and its structure was characterized by UV spectroscopy, infrared spectroscopy, X-ray diffraction and differential thermal analysis. The test of water-solubility showed that the formation of inclusion compound significantly increased the water-solubility of naringenin, thus improves the water-solubility and bioavailability of flavonoids. This research provides theoretical basis for research and development on new dosage forms of flavonoids.
β-cyclodextrin; naringenin; inclusion compound; solubility
2017-01-17.
宝鸡市科技计划项目(16RKX1-11); 宝鸡文理学院重点项目(ZK15085).
郭亚宁(1977-), 女, 副教授. 研究方向为有机合成及天然产物修饰与改性.*
, E-mail:ggyn1997@163.com.
R943
A
1008-1011(2017)04-0457-05