不同年龄2型糖尿病患者维生素D水平与糖尿病周围神经病变的相关性
蒋韬 朱东林 高国芹 田伊茗 马宁 刘悦 陆强
·论著·
不同年龄2型糖尿病患者维生素D水平与糖尿病周围神经病变的相关性
蒋韬 朱东林 高国芹 田伊茗 马宁 刘悦 陆强
目的探讨不同年龄组2型糖尿病患者25-羟维生素D[25(OH)D]与糖尿病周围神经病变(diabetic peripheral disease,DPN)的相关性。方法选取589例2型糖尿病患者进行横断面研究,按年龄将入组患者分为青年组(24~44 岁)、中年组(45~64 岁)、老年组(≥65 岁),收集所有患者年龄、性别、病程、吸烟史、家族史、体重指数(BMI)、空腹血糖、空腹胰岛素、三酯甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、糖化血红蛋白(HbA1c),25(OH)D等临床资料,根据密歇根神经病变评分系统(MNSI)结合神经电生理检查诊断DPN,并进行统计学分析。结果3组之间性别、体重指数、吸烟史、家族史、HbA1c、TG、LDL-C、空腹血糖、空腹胰岛素差异均无统计学意义(P>0.05)。25(OH)D水平随2型糖尿病患者年龄的增加逐渐下降。青、中年组非DPN患者25(OH)D水平均较DPN患者显著升高(P=0.013;P=0.043),老年组患者DPN与非DPN组之间25(OH)D水平比较差异无统计学意义(P>0.05)。二元Logistic回归分析显示低25(OH)D为青、中年2型糖尿病患者DPN的危险因素,在老年患者中差异无统计学意义(P<0.05)。结论25(OH)D是青中年2型糖尿病患者DPN的保护因素,由于25(OH)D在老年组DPN患者中水平较低,未发现维生素D对老年DPN患者存在保护作用。
糖尿病;2型;维生素D;糖尿病神经病变
近年来,糖尿病(diabetes mellitus,DM)逐渐成为世界性的公共健康问题,DM的患病率逐渐增加[1],糖尿病性周围神经病变(diabetic peripheral neuropathy,DPN)在DM患者中发病率较高,在吸烟、年龄超过40岁以及血糖控制差的DM患者中DPN的患病率更高,有文献报道其发病率达50%~70%[2],导致DPN患病率差异较大的原因之一在于诊断方法的不同。2001年中国流行病学调查发现,61.8%的2型糖尿病患者并发神经病变,严重影响患者的生存质量,增加糖尿病足的发病风险,增加医疗费用,DPN已成为威胁DM患者生活质量的一个公共卫生问题。DPN的典型表现为双下肢麻木、感觉异常、痛觉过敏并在夜间加重,导致严重的睡眠功能紊乱。尽管国内外各指南均推荐了DPN的治疗方案,良好的血糖控制可以减少糖尿病神经病变的发生,并防止其进一步发展,然而临床上仅控制血糖对大部分患者神经病变症状的改善并不明显,故往往需联合使用针对病因治疗糖尿病周围神经病变的药物,但最好的治疗效果仅使患者的症状改善约50%,治疗效果受到药物副作用的限制[3]。许多研究试图揭开DPN发生机制的面纱,然而DPN的发病机制仍未被完全阐明。血糖控制不佳是公认的DPN最大的危险因素[4],此外如年龄、高血压、糖尿病病程、血脂等均在DPN的发生发展中起一定作用。维生素D是一种类固醇激素,在钙磷和骨代谢方面发挥重要作用,25-羟维生素D[25(OH)D]是维生素D在体内储存的主要形式。越来越多的研究证明,维生素D与受体结合后产生抗炎、抗氧化应激、免疫调节等多种生物学效应,能够维持体内血糖稳态,影响糖尿病及其并发症的发生发展[5]。维生素D核受体和胰腺β细胞1α羟化酶的表达增加,通过基因启动子区域维生素D反应元件的出现调节胰岛素受体基因[6],说明维生素D有调节胰岛素分泌、改善胰岛素敏感性的潜能。25(OH)D是血液循环中维生素D的主要存在形式,血液浓度较稳定,因此25(OH)D普遍作为评价体内维生素D营养状况的指标。国内外已有研究证实25(OH)D是DPN的影响因素之一,许多大规模的临床研究均证实维生素D与2型DM之间存在显著负相关关系[7-9],一些报道还显示补充维生素D能够改善DM患者的血糖控制和胰岛素抵抗[10]。维生素D可能通过调节血钙水平间接影响胰岛素抵抗,因为钙离子在胰岛素介导的对靶器官的功能中起重要作用[11]。多数研究认为DPN同时与年龄、糖尿病病程相关[12-15],同时有报道显示,25(OH)D与年龄存在明显相关性[16,17],因此年龄的混杂因素不可忽视。本文对2型糖尿病患者的年龄进行分层,探讨不同年龄段患者25(OH)D水平与DPN的相关性。
1 资料与方法
1.1 一般资料 选择2015年至2015年在秦皇岛市第一医院内分泌科住院治疗的2型糖尿病患者589例,其中男313例,女276例;平均年龄(55.64±13.66)岁,患者分为青年组120例(24~44 岁),中年组319例(45~64 岁),老年组150例(≥65 岁)。所有患者均符合符合1999年世界卫生组织(WHO)的2型糖尿病诊断标准。排除严重肝肾功能不全,1型糖尿病,妊娠期糖尿病,糖尿病急性并发症(如:酮症或酮症酸中毒、高渗性昏迷)、甲状腺及甲状旁腺疾病、恶性肿瘤及代谢性骨病等,所有患者否认近期服用维生素D类药物。
1.2 方法
1.2.1 详细收集所有入组患者的临床资料:年龄、性别、病程、吸烟史、家族史、体重指数(BMI)、空腹血糖、空腹胰岛素、三酯甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、糖化血红蛋白(HbA1c),25(OH)D由艾狄斯公司提供的检测试剂盒采用ELISA方法检测(批内变异系数5.3%,批间变异系数4.6%。
1.2.2 DPN的诊断标准:根据密歇根神经病变评分系统(MNSI)结合神经电生理检查进行诊断,当患者肌电图显示运动传导速度或感觉传导速度减慢(≥2项)及MNSI评分(≥3分)分并有感觉异常、麻木、疼痛、刺痛,并排除其他病因后可诊断。
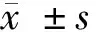
2 结果
2.1 不同年龄组间临床资料和生化指标比较 3组间性别比、BMI、吸烟史、家族史、HbA1c、TG、LDL-C、空腹血糖、空腹胰岛素差异均无统计学意义(P>0.05)。随3组患者年龄的增加,糖尿病病程逐渐延长,25(OH)D水平逐渐下降(P<0.05)。见表1。
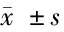
表1 不同年龄组2型糖尿病患者临床资料比较
2.2 不同年龄组间25(OH)D水平与DPN的关系 青年组、中年组非DPN患者25(OH)D水平均较DPN患者显著升高,差异有统计学意义(P<0.05)。而老年组非DPN与DPN患者25(OH)D水平差异无统计学意义(P>0.05)。见表2。
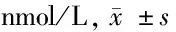
表2 不同年龄组间25(OH)D水平与DPN的关系
2.3 不同年龄组间DPN危险因素二元Logistic回归分析 以DPN为因变量,年龄、性别、体重指数、吸烟史、家族史、HbA1c、TG、LDL-C、空腹血糖、空腹胰岛素、糖尿病病程、25(OH)D水平为自变量,分别对3组患者进行二元Logistic回归分析,老年患者仅病程为DPN的独立危险因素(OR 1.086,95%CI:1.036~1.138,P=0.001),青年、中年患者病程(OR 1.142,95%CI:1.085~1.201,P=0.005;OR 1.065,95%CI:1.007~1.126,P=0.027)、25(OH)D水平(OR 1.207,95%CI:1.058~1.375,P<0.001;OR 1.183,95%CI:1.044~1.339,P=0.008)均为DPN的独立危险因素。见表3。
3 讨论
维生素D最经典的生理作用是促进人体钙磷吸收,而最近的很多报道提示维生素D还与心血管疾病、肿瘤、多发性硬化、细菌感染、自身免疫病和阿尔兹海默症等疾病相关[18]。维生素D缺乏非常普遍,美国成人的患病率在25%~57%,维生素D缺乏在一定程度上增加1型和2型糖尿病的患病率,DM患者的维生素D缺乏也更佳普遍,同时维生素D缺乏还能够增加DM患者的微血管病变风险[19]。Jung等[20]的研究认为维生素D缺乏在不同性别的DM患者中微血管并发症风险不同,男性维生素D缺乏者DPN风险增加,而女性维生素D缺乏者糖尿病肾病风险增加。
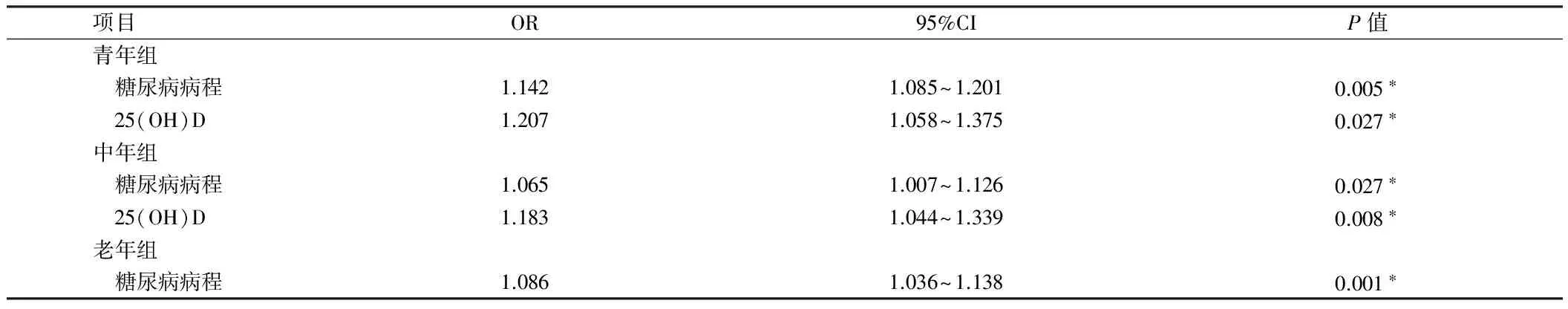
表3 不同年龄组间DPN危险因素二元Logistic回归分析
糖尿病神经病变(diabetic neuropathy,DN)是DM最常见也是最复杂的并发症之一,是长期慢性高血糖、体内代谢紊乱、微循环障碍造成神经缺血、缺氧,最终导致神经损伤而引起的并发症,病变涉及全身各部位的神经,但主要分为中枢神经系统(脑、脊髓)及周围神经系统,以后者(DPN)较为常见[21]。而自主神经病变(diabetic autonomic neuropathy,DAN)是DN中最棘手的一种类型,可累及循环、消化、泌尿、生殖、泌汗等多个系统,使足部溃疡、非创伤性截肢、抑郁焦虑甚至自杀等发病率显著升高,严重影响DM患者的生活质量,甚至增加致残率和病死率[22],增加DM患者治疗及护理的经济负担[24]。根据不同诊断方法,DN的发病率波动在5%~100%[23]。我国新发DM患者中DN的患病率在8%左右,在长病程DM患者中患病率高达50%,住院DM患者患病率约60%[24]。
DPN的发病机制尚未完全阐明[25],DM患者高浓度的葡萄糖激活醛糖还原酶,诱导多元醇代谢通路增加,使山梨醇堆积[26],引起神经细胞肿胀及纤维变性,最终导致神经病变的发生。大量体内、外研究已证实,急性和慢性高血糖都会引起外周神经系统的氧化应激,即线粒体呼吸链中氧自由基生成过多的结果。高血糖可引起细胞内线粒体ROS生成增加,导致DNA损伤[27],糖酵解转向糖代谢支路,激活下游经典通路,引起细胞功能紊乱、内皮损伤,从而导致包括糖尿病神经病变在内的各项并发症的发生[28]。血管病变是引起糖尿病周围神经病变的另一主要因素。糖尿病机体组织血液增加和高灌注状态,使大分子蛋白经微血管外流,沉积于血管壁,随着病情发展,会出现微血管透明变性、增生,管壁内脂肪及糖蛋白沉积,管腔狭窄,导致微循环障碍,缺血、缺氧、神经失去营养[29]。
目前已经报道的DPN的独立危险因素包括年龄、病程、HbA1c、吸烟、25(OH)D等[9,13,14],DPN与维生素D缺乏的关系越来越受到重视,我国的研究认为维生素D水平[25(OH)D<16.01 ng/ml]能够预测DPN的发生[19]。而年龄与25(OH)D之间存在显著相关性[10,15],因此年龄这一混杂因素需进一步加以鉴别。本文将2型糖尿病患者划分为不同年龄组,以期消除年龄这一混杂因素的影响,进一步明确25(OH)D与DPN的相关性。
在本研究中,25(OH)D水平在青、中、老年患者中逐渐下降(44.54±19.20 vs 41.97±17.34 vs 37.71±19.08,P=0.039),与既往研究结果[10,15]一致,提示随着年龄的增加,维生素D的合成能力和生物活性均显著下降。
多数研究显示25(OH)D在DPN患者中较非DPN患者中显著升高[7,16]。一项大规模的前瞻性临床试验提示,大剂量维生素D(600 000 U,IM)能够在短期内显著改善痛性糖尿病神经病变患者的临床症状[17],因此维生素D在神经保护方面的作用毋庸置疑,但其作用机制仍未完全明确。DM的神经病理学证实,DPN病变的主要病理变化是轴突萎缩变性,甚至消失,髓鞘阶段性或弥散性皱缩或脱髓鞘,以及郎飞结结间长度改变,这也是甲钴胺等神经营养药物治疗DPN等理论基础。Zhou等[30]近期的体外实验表明,1,25(OH)2D3能增加大鼠神经生长因子(NGF)的表达,而高糖状态可能会增加CYP24A1的表达,抑制1,25(OH)2D3的作用从而使大鼠Schwann细胞的NGF表达下降,导致神经损伤。目前的相关研究仅停留在体外阶段,尚无动物实验及体内试验的相关报道。
本研究根据年龄分组后,青、中年2型糖尿病组患者所得结果与上述报道一致,提示25(OH)D是青中年2型糖尿病患者的保护因素。然而,老年组2型糖尿病患者25(OH)D水平在DPN与非DPN组之间无显著差异,相反,老年组非DPN患者25(OH)D均值稍高于DPN患者,但差异无统计学意义(P=0.242),二元Logistic回归分析提示25(OH)D并非老年DPN患者的独立危险因素。Jung等[20]的报道显示,25(OH)D缺乏(<10 ng/ml)是男性2型糖尿病患者DPN的独立危险因素,Esteghamati等[31]的报道则提示维生素D与DPN存在非线性关系,25(OH)D水平在30~40 ng/l之间时DPN患者获益最大,提示维生素D对DPN的保护作用存在剂量依赖性。因此,在老年2型糖尿病患者维生素D水平普遍降低的情况下,维生素D可能并非DPN的保护因素。然而,本研究为观察性研究,老年患者是否可以由维生素D的补充中获益,仍需科学设计的大规模、前瞻性、多中心、严格对照的临床试验加以证实。
综上所述,维生素D水平与年龄存在负相关关系。25(OH)D是青中年2型糖尿病患者DPN的保护因素,由于25(OH)D在老年组DPN患者中水平较低,本研究未发现维生素D对老年DPN患者存在保护作用。
1 Yang SH,Dou KF,Song WJ.Prevalence of diabetes among men and women in China.N Engl J Med,2010,362:1090-1101.
2 Tesfaye S,Blulton AJ,Dyck PJ, et al.Diabetic neuropathies:update on definitions,diagnostic criteria,estimation of severity,and treatments.Diabetes Care,2010,33:2285-2293.
3 Basit A,Basit KA,Fawwad A,et al.Vitamin D for the treatment of painful diabetic neuropathy.BMJ Open Diabetes Res Care,2016,4:e000148.
4 Franklin G M,Shetterly SM,Cohen JA,et al.Risk factors for distal symmetric neuropathy in NIDDM.The San Luis Valley Diabetes Study.Diabetes Care,1994,17:1172-1177.
5 Alam U, Arul-Devah V,Javed S,et al.Vitamin D and Diabetic Complications:True or False Prophet Diabetes Ther,2016,7:11-26.
6 Maestro B,Davila N,Carranza MC,et al.Identification of a Vitamin D response element in the human insulin receptor gene promoter.J Steroid Biochem Mol Biol,2003,84:223-230.
7 Alamdari A,Mozafari R,Tafakhori A,et al.An inverse association between serum vitamin D levels with the presence and severity of impaired nerve conduction velocity and large fiber peripheral neuropathy in diabetic subjects.Neurol Sci,2015,36:1121-1126.
8 Herrmann M,Sullivan DR,Veillard AS,et al.Serum 25-hydroxyvitamin D:a predictor of macrovascular and microvascular complications in patients with type 2 diabetes.Diabetes Care,2015,38:521-528.
9 Shehab D,AI-Jarallah K,Abdella N,et al.Prospective evaluation of the effect of short-term oral vitamin d supplementation on peripheral neuropathy in type 2 diabetes mellitus.Med Princ Pract,2015,24:250-256.
10 von Hurst PR,Stonehouse W,Cood J.Vitamin D supplementation reduces insulin resistance in South Asian women living in New Zealand who are insulin resistant and vitamin D deficient - a randomised,placebo-controlled trial.Br J Nutr,2010,103:549-555.
11 Pilz S,Kienreich K,Rutters F,et al.Role of vitamin D in the development of insulin resistance and type 2 diabetes.Curr Diab Rep,2013,13:261-270.
12 Soderstrom LH,Johnson SR,Diaz,VA,et al.Association between vitamin D and diabetic neuropathy in a nationally representative sample:results from 2001-2004 NHANES.Diabet Med,2012,29:50-55.
13 佘敦敏,朱妍,冯尚勇,等.血清25羟维生素D-3与2型糖尿病周围神经病变的相关性.中华骨质疏松和骨矿盐疾病杂志,2014,7:240-243.
14 崔丽娟,常向云,朱凌云,等.血清维生素D水平与糖尿病周围神经病变的相关性研究.中国现代医学杂志,2015,25:57-60.
15 Popescu S,Timar B,Baderca F,et al.Age as an independent factor for the development of neuropathy in diabetic patients.Clin Interv Aging,2016,11:313-318.
16 郭燕燕,刘泽,刘坚,等.178例老年男性骨密度及25羟维生素D水平分析.中华骨质疏松和骨矿盐疾病杂志,2012,5:25-29.
17 李斌,陈平,张敏,等.老年2型糖尿病患者血清25-羟维生素D3水平与胰岛功能、胰岛素抵抗、外周血管病变以及氧化应激的相关性研究.川北医学院,2013.
18 Makariou S,Liberopoulos EV,Elisaf M,et al.Novel roles of vitamin D in disease:what is new in 2011 Eur J Intern Med,2011,22:355-362.
19 He R,Huy,zeng H,et al.et al.Vitamin D deficiency increases the risk of peripheral neuropathy in Chinese patients with Type 2 diabetes.Diabetes Metab Res Rev,2017,33:epub.
20 Jung C H,Kim KJ,Kim BT,et al.Relationship between vitamin D status and vascular complications in patients with type 2 diabetes mellitus.Nutr Res,2016,36:117-124.
21 Pop-Busui R,Braffett PH,Zinman B,et al.Cardiovascular autonomic neuropathy and cardiovascularoutcomes in the diabetes control and complications trial/epidemiology of diabetes interventions and complications (DCCT/EDIC)study J.Diabetes Care,2017:94-400.
22 潘长无主编.Joslin糖尿病学.第1版.北京:人民卫生出版社,2015.987-988.
23 Dell G,Bosnyak E,Pusch G,et al.Dia-betic neuropathies:diagnosis and managementⅡ.Neuroendocrinology,2013,98:267-280.
24 Vinik AI,Nevoret ML,Casellini C,et al.Diabetic neu-ropathyⅡ Endocrinol Metab Clin North Am,2013,42:747-787.
25 聂琛,鲍海萍.糖尿病周围神经病变的相关危险因素分析.中华实验和临床病毒学杂志,2012,26:467-469.
26 Oates PJ.Polyol pathway and diabetic peripheral neuropathy.Int Rev Neurobiol,2002,50:325-392.
27 King RH.The role of glycation in the pathogenesis of diabetic polyneuropathy.Mol Pathol,2001,54:400-408.
28 施君,张文川.糖尿病周围神经病变发病机制的研究进展.上海交通大学学报:医学版,2012,32:116-119.
29 王国凤,徐宁,尹冬,等.糖尿病周围神经病变的诊断和治疗新进展.中国全科医学,2012,15:1661-1663,1667.
30 Zhou YK,Liang Z,Guo Y,et al.High glucose upregulates CYP24A1 expression which attenuates the ability of 1,25(OH)2D3 to increase NGF secretion in a rat Schwann cell line RSC96.Mol Cell Endocrinol,2015,404:75-81.
31 Esteghamati A,Fotouhi A,Faghihi-Kashami S,et al.Non-linear contribution of serum vitamin D to symptomatic diabetic neuropathy:A case-control study.Diabetes Res Clin Pract,2016,111:44-50.
10.3969/j.issn.1002-7386.2017.18.033
项目来源:河北省科学技术研究与发展计划项目(编号:132777626)
066000 河北省秦皇岛市第一医院
陆强,066000 河北省秦皇岛市第一医院;
E-mail:13933909066@126.com
R 587.1
A
1002-7386(2017)18-2838-04
2017-02-15)

