茶黄素对白介素-1β诱导的大鼠软骨细胞炎性退变的影响
周盈,黄倩,王帅,陈萍
(1.浙江大学农业与生物技术学院茶学系,杭州310058;2.浙江大学基础医学院,杭州310058)
茶黄素对白介素-1β诱导的大鼠软骨细胞炎性退变的影响
周盈1†,黄倩2†,王帅2,陈萍1*1
(1.浙江大学农业与生物技术学院茶学系,杭州310058;2.浙江大学基础医学院,杭州310058)
采用白介素-1β(interleukin-1β,IL-1β)对体外培养的正常大鼠软骨细胞进行诱导,构建骨关节炎(osteoarthritis,OA)炎性退变细胞模型,探讨茶黄素(theaflavins,TFs)治疗骨关节炎的可行性。通过甲苯胺蓝及免疫荧光染色对细胞进行鉴定,利用CCK-8细胞活力检测筛选TFs药物浓度;取第2代生长状况良好的大鼠膝关节软骨细胞,根据所加培养物的不同将实验分为3组:空白组G0、模型组G1(10 ng/mL IL-1β刺激)、TFs组G2(不同浓度的TFs+10 ng/mL IL-1β刺激),通过实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)检测各组Ⅱ型胶原(typeⅡcollagen,ColⅡ)、蛋白聚糖(aggrecan,ACAN)、基质金属蛋白酶-13(matrix metalloproteinases-13,MMP-13)、IL-1β及环氧合酶-2(cyclooxygenase-2,COX-2)mRNA的表达。结果表明,甲苯胺蓝及免疫荧光染色结果呈阳性,证实体外分离培养的细胞为软骨细胞。CCK-8检测结果显示:TFs质量浓度在100 μg/mL时,细胞活力较空白组明显减弱(P<0.05);TFs质量浓度在0~75 μg/mL时不影响软骨细胞活力。qRT-PCR结果表明:与空白组相比,模型组中合成因子ColⅡ和ACAN mRNA表达量极显著降低(P<0.01),分解因子MMP-13、炎症细胞因子IL-1β及炎症诱导酶COX-2 mRNA表达量极显著增加(P<0.01);与模型组相比,TFs组能抑制IL-1β引起的炎症相关因子mRNA的表达,且呈浓度依赖性(P<0.05)。综上所述,茶黄素可通过增强软骨细胞合成因子活性、减弱分解因子活性并抑制细胞炎症反应,有效延缓大鼠软骨细胞炎性退变进程,对炎症软骨细胞有一定的保护作用。
茶黄素;骨关节炎;软骨细胞;白介素-1β;环氧合酶-2;炎性退变
Summary Osteoarthritis(OA)is a degenerative joint disease with an obviously increasing morbidity as age increases,which seriously affects old people’s joint function and life quality.The key to pathological changes in OA is the damage and loss of articular cartilage.Inflammatory cytokines,such as interleukin-1β(IL-1β),could induce cartilage degeneration and inflammatory reaction through a series of cascade reactions,especially in cartilage lesions.Theaflavins(TFs)are the main active ingredients of black tea polyphenols with anti-inflammation and antioxidant functions.This study focuses on the protective effects of TFsagainst inflammatory degeneration of rat chondrocytes and evaluates the feasibility of TFs in the treatment of OA.
Male Sprague-Dawley rat’s knee articular chondrocytes were isolated and cultured in vitro,which were identified by toluidine blue staining and typeⅡcollagen immunofluorescence staining.To select the concentration levels of TFs,cell viability was analyzed with a cell counting kit-8(CCK-8)assay.Three groups were set in this experiment according to different cultures: blank control group G0,model group G1(10 ng/mL IL-1β)and TFs group G2(different concentrations of TFs+10 ng/mL IL-1β). The changes in the mRNA expression levels of two anabolic factors ColⅡ(typeⅡcollagen)and ACAN(aggrecan),the main catabolic factors MMP-13(matrix metalloproteinases-13),IL-1β,and COX-2(cyclooxygenase-2)in rat chondrocytes were detected by quantitative real-time polymerase chain reaction(qRT-PCR).
It can be found from the inverted phase contrast microscopy that IL-1β obviously impaired normal rat chondrocyte morphology.It can be seen from the fluorescent microscope that the cell nucleus was stained to be blue and cytoplasm was stained to be green by typeⅡcollagen immunofluorescence staining,and the extracellular matrix of cells was stained to be blue-purple by toluidine blue staining,which means the cultured cells in the experiment are chondrocytes.The CCK-8 assay indicated that 100 μg/mL TFs significantly decreased the cell viability of normal rat chondrocytes(P<0.05),but 0-75 μg/mL TFs had no significant cytotoxicity to chondrocytes.The results of qRT-PCR showed that compared with the control group,the mRNA expression levels of chondrocyte markers(ColⅡand ACAN)were obviously down-regulated in the model group(P<0.01),and the mRNA expression levels of MMP-13,IL-1β and COX-2 increased obviously in the model group(P<0.05).For the changes,however,the gene expressions of these inflammatory related factors were significantly inhibited by TFs in a dose-dependent manner compared with the model group(P<0.05).
In conclusion,TFs could effectively alleviate the inflammatory degeneration of rat chondrocytes,via up-regulating anabolic activity,down-regulating catabolic activity and inhibiting inflammatory reaction,so as to protect rat chondrocyts from OA induced by IL-1β.This study provides the first evidence that TFs can significantly inhibit OA disease progression and exert a palliative effect.
骨关节炎(osteoarthritis,OA)是一种常见的慢性关节疾病,主要是由关节磨损退化而引起的关节软骨退行性变和继发性骨质增生[1]。据世界卫生组织统计,OA多见于65岁以上人群,发病率高达80%,临床表现为关节疼痛、僵硬、肿胀、活动受限甚至畸形等,是老年人关节疼痛和致残的主要原因[2-3]。软骨细胞是关节软骨中唯一的细胞,在软骨形成、代谢修复中起着重要的作用。骨关节炎最重要的病理变化是软骨退变。相关研究报道表明,驱动关节软骨退变进程的主要因素是慢性炎症及关节软骨细胞外基质(extracellular matrix,ECM)的降解[4]。炎症细胞因子通过改变软骨细胞微环境,引起ECM合成和分解代谢失衡,致使关节软骨退变,进而促进OA发展进程[5-6]。大量研究证实,白介素-1β(interleukin-1β,IL-1β)在OA软骨基质合成分解代谢中起到关键作用,可通过促进ECM基质降解[7],刺激软骨细胞分泌更多的促炎因子和炎症介质[8],进一步干扰细胞功能,在细胞与细胞外基质之间形成一种正反馈通路,促进OA发展。
茶叶起源于我国,至今已有近3 000年历史,其药用价值也早有记载。茶黄素(theaflavins,TFs)是红茶中决定色香味及品质的主要功能成分,是一种极具开发潜力的药物资源。TFs属于红茶多酚,主要由儿茶素和没食子酸等酚类物质氧化形成,其主要的单体有4种:茶黄素、茶黄素-3-没食子酸酯、茶黄素-3′-没食子酸酯及茶黄素双没食子酸酯,分子结构如图1所示。近年来,TFs抗炎生理活性研究受到广泛关注,现已证实其在肝炎[9]、类风湿性关节炎[10]、肺炎[11]及慢性疾病[12]中表现出一定的抗炎活性。但关于TFs在骨关节炎症中的抗炎活性及机制研究尚未见报道。由于OA疾病产生的原因包括促炎因子引起的软骨细胞功能障碍及其产生的炎症反应[13],因此,探究TFs的抗炎机制可为防治骨关节炎疾病提供一定的理论基础。本实验采用IL-1β诱导体外培养的正常大鼠软骨细胞,构建OA炎性退变细胞模型,首次研究茶黄素在软骨细胞合成及分解代谢中对ECM稳态的保护作用及抗炎功效,为其对骨关节炎防治作用的研究提供理论参考。
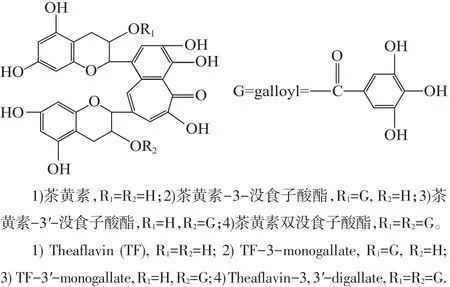
图14 种主要茶黄素单体的化学结构式Fig.1Chemical structures of four theaflavin monomers
1 材料与方法
1.1 材料与试剂
茶黄素,来源于红茶提取物,纯度80%,货号T5550,购自美国Sigma公司;重组大鼠IL-1β购自英国Peprotech公司;胎牛血清(fetal bovine serum,FBS)、双抗溶液(青霉素/链霉素)、磷酸盐缓冲液(phosphate buffer saline,PBS)和DEME/F 12培养液均购自美国Gibco公司;CCK-8试剂盒购自日本同仁化学研究所;抗荧光淬灭封片液和4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)细胞染色液均购自上海碧云天公司;Ⅱ型胶原(typeⅡcollagen, ColⅡ)抗体购自美国Santa Cruz公司;基质金属蛋白酶-13(matrix metalloproteinases-13,MMP-13)抗体、β-actin抗体、辣根过氧化物酶标记的抗兔和抗小鼠IgG抗体均购自美国CST公司;山羊抗兔Dylight 488荧光二抗购自美国Abcam公司;Trizol试剂购自美国Invitrogen公司;SYBR®Green Supermix试剂盒购自美国Bio-Rad公司;ReverTra Ace®购自日本ToYoBo公司;荧光定量聚合酶链式反应引物购自上海生物工程技术有限公司。
实验动物采用清洁级雄性SD(Sprague-Dawley)大鼠,体质量120~150 g,来源于浙江省实验动物中心。所有动物实验的操作均经过浙江大学动物中心伦理委员会批准。
1.2 仪器与设备
JB-CJ-1FX超净工作台(苏州佳宝净化工程设备有限公司);Galaxy系列二氧化碳培养箱(英国RS Biotech公司);Nikon倒置相差显微镜(日本Nikon公司);Western blot电泳转膜装置(美国Bio-Rad公司);NanoDrop蛋白核酸定量仪(美国NanoDrop公司);480Ⅱ荧光定量PCR仪(美国Roche公司);G:BOX化学发光成像仪(英国Syngene公司)。
1.3 方法
1.3.1 软骨细胞分离、培养及传代
用6 mg/mL戊巴比妥钠对SD大鼠麻醉致死后,将其浸泡于75%乙醇10 min。在无菌条件下打开膝关节,分离关节软骨面,转移至超净工作台,用灭菌手术刀削下软骨碎片,剪碎转移至含有2 mL 0.2%胶原酶的6 cm培养皿中消化;30 min后,在原6 cm培养皿中补加3 mL完全培养基(含10%FBS及1%青、链霉素),转移至37℃、5%CO2培养箱中进行常规培养;24 h后,将组织悬液转移至15 mL离心管内,1.2万r/min离心5 min后弃上清液,用完全培养基将细胞吹打均匀,接种至原培养皿中培养。待细胞贴壁长满至80%~90%后进行传代,期间每隔2 d进行细胞换液,于倒置相差显微镜下观察细胞生长状况。
1.3.2 甲苯胺蓝染色鉴定软骨细胞
取大鼠第1代软骨细胞,胰酶消化后以2×104个/孔细胞密度接种到铺有多聚赖氨酸盖玻片的24孔板中,置于培养箱中常规培养细胞爬片24 h。取出制备好的第2代细胞爬片,用95%乙醇固定20 min,PBS漂洗3次,用体积分数为1%的甲苯胺蓝乙醇液染色20 min,PBS清洗2次,无水乙醇漂洗,在空气中干燥后用中性树胶封片,于倒置荧光显微镜下观察并拍照。
1.3.3ColⅡ免疫荧光染色鉴定软骨细胞
细胞爬片的制备方法同上。取出已制备好的细胞爬片进行免疫细胞荧光染色。具体步骤如下:用PBS-BSA[用PBS配制1%牛血清白蛋白(bovine serum albumine,BSA)]孵育细胞15 min,PBS漂洗2次,在4%多聚甲醛中固定细胞20 min;弃液体,PBS漂洗3次,用0.2%Triton-X-100通透细胞10 min;PBS漂洗3次,PBS-BSA孵育15 min;PBS漂洗2次,ColⅡ抗体4℃孵育过夜;次日,PBS漂洗3次,用PBS-BSA孵育15 min;PBS漂洗2次,加入山羊抗兔Dylight 488荧光二抗孵育1 h;PBS清洗3次后,用DAPI染色30 min;滴入防淬灭剂,封片,于倒置荧光显微镜下观察并拍照。
1.3.4 实验分组
待第1代细胞贴壁长满至80%~90%时,经胰酶消化重悬后接种至6孔板,置于37℃、5%CO2培养箱中进行常规培养。IL-1β按照说明书用0.1%BSA溶解,TFs用PBS溶解稀释成不同浓度,-20℃避光保存,备用。实验分为3个处理组:空白组(无干预无刺激,G0)、模型组(10 ng/mL IL-1β刺激,G1)和TFs干预组(G2)。待细胞长满至80%~90%时,干预组在不同浓度的TFs中预处理2h后加入终质量浓度为10ng/mL的IL-1β,模型组仅加入IL-1β和PBS,对照组加入PBS,各组细胞培养基总体积一致,培养24 h后,收集细胞进一步分析。
1.3.5 细胞活性检测
采用CCK-8试剂盒测定TFs对SD大鼠软骨细胞是否有毒性作用[14]。第1代细胞经胰酶消化后吹打均匀,以1×104个/孔细胞密度接种至96孔板中培养。待第2代软骨细胞长满至80%~90%时,分别加入0、25、50、75、100 μg/mL的TFs干预24 h,每组设置5个重复孔。更换新鲜完全培养基,每孔加入10 μL CCK-8溶液,轻轻振荡混匀后常规培养2 h。用酶标仪检测在450 nm波长处的光密度值,以无细胞孔作为空白组,无TFs干预孔作为对照组。定义对照组(TFs质量浓度为0 μg/mL)细胞存活率为100%,其余各实验组细胞活性按下式计算,确定TFs对细胞的无毒性剂量。

1.3.6 荧光定量聚合酶链式反应
用Trizol收取各组细胞,抽提软骨细胞总RNA,并用NanoDrop蛋白核酸定量仪检测RNA浓度。取1 μg RNA,采用ReverTra Ace®反转录试剂盒制备cDNA模板,构建荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)体系(10 μL)。反应条件如下:95℃变性10 s,95℃退火5 s,60℃延伸
30 s,共40个循环。选用大鼠管家基因GAPDH为内参,
将得到的各组CT值按公式2-ΔΔCT计算ColⅡ和蛋白聚糖(aggrecan,ACAN)的相对表达量。实验所用引物序列详见表1。
1.3.7 统计分析
所有实验数据均以平均数±标准误表示,统计分析采用Graphpad prism 5软件的Student-t检验处理,并采用双尾t检验进行分析,以P<0.05表示差异有统计学意义。

表1 目的基因和内参基因的引物序列Table 1Primer sequences of target and house-keeping genes used in this experiment
2 结果与分析
2.1 细胞形态观察
在倒置相差显微镜下观察可见:分离培养的原代软骨细胞接种约12h后开始贴壁;4d左右细胞数目明显增多,形态呈圆形或多角形;10d原代细胞融合成片,呈现典型“铺路石”状,可进行传代;传代约6 h后的细胞开始贴壁,生长速度加快,4d左右即可传代培养,且细胞周围可见具有折光性的细胞外基质(图2)。
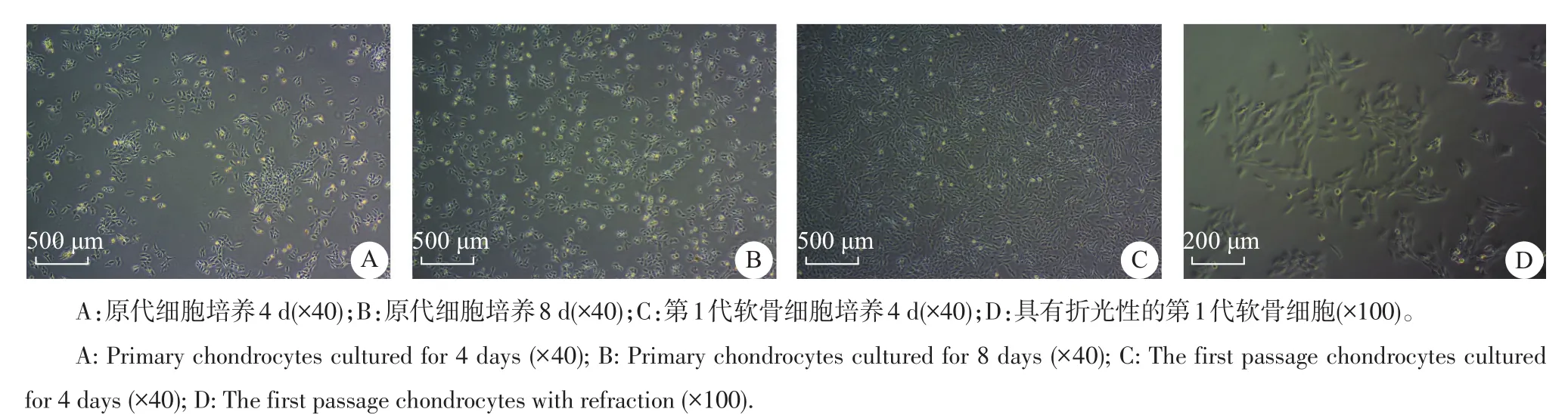
图2 在倒置相差显微镜下软骨细胞形态观察Fig.2Morphological observation of chondrocytes by inverted phase contrast microscope
2.2 细胞鉴定
软骨细胞的特征性分泌产物酸性蛋白聚糖与甲苯胺蓝碱性染液结合后呈异染性。在本实验中,甲苯胺蓝染色显示,培养细胞单层生长,呈多角形,细胞质为蓝紫色(图3A)。Ⅱ型胶原(ColⅡ)免疫荧光染色显示:细胞质较疏松,呈绿色;细胞核较大,呈圆形或椭圆形,位于细胞中央,呈蓝色(图3B)。这表明培养的细胞为软骨细胞。
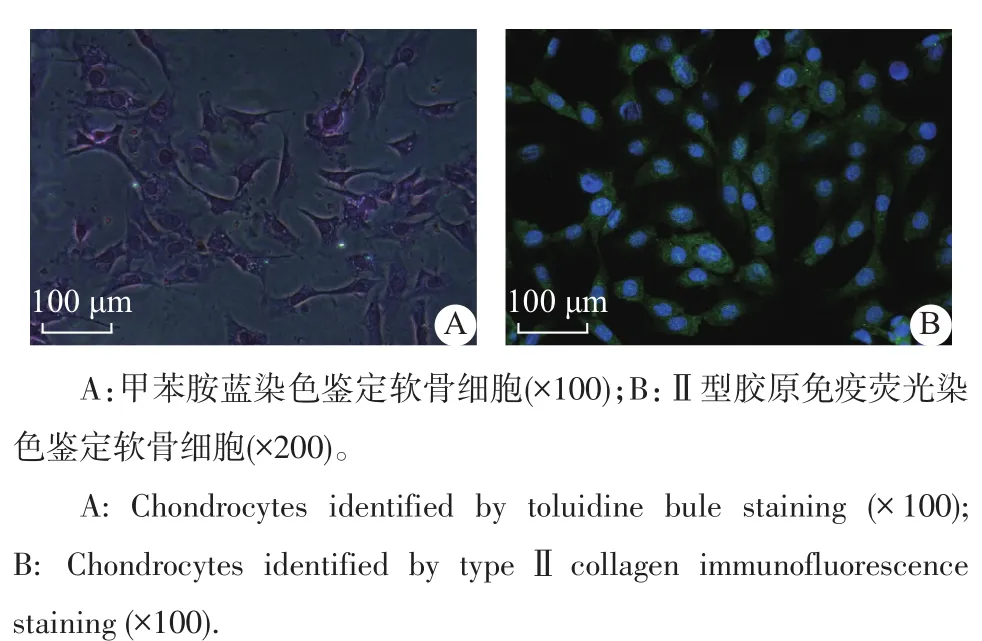
图3 在倒置荧光显微镜下软骨细胞鉴定观察Fig.3Identification of chondrocytes by inverted fluorescent microscope
2.3TFs对大鼠软骨细胞活性的影响
待第2代大鼠软骨细胞铺满至80%~90%时,用0~100 μg/mL TFs干预细胞24 h,测定TFs对软骨细胞活力的影响,筛选TFs的安全剂量阈值。结果(图4)表明:与对照组(TFs质量浓度为0 μg/mL)相比,25、50、75 μg/mL TFs干预组的细胞存活率间在统计学上无显著差异(P>0.05);100 μg/mL TFs干预组的细胞存活率下降,且与对照组相比差异有统计学意义(P<0.05)。表明0~75 μg/mL TFs是安全无毒的,不影响软骨细胞活力。因此,后续研究选用25、50、75 μg/mL这3个剂量的TFs,以保证细胞处于良好的状态。

图4TFs对大鼠软骨细胞活性的影响Fig.4Effect of TFs on cell viability of rat chondrocytes
2.4TFs对IL-1β诱导大鼠软骨细胞合成因子活性的影响
提取软骨细胞总RNA,通过qRT-PCR技术检测TFs对炎症软骨细胞中合成因子活性的影响。如图5所示:IL-1β处理细胞24 h后,ColⅡ和ACAN的表达量均极显著降低(P<0.01);经TFs(25、50、75 μg/mL)干预后,软骨细胞中ColⅡ和ACAN mRNA表达量明显高于模型组(P<0.05),并有效抑制了IL-1β引起的合成因子活性的降低,且随着TFs浓度的增加,其抑制效果呈浓度依赖性变化。说明TFs通过增强软骨细胞合成因子ColⅡ和ACAN活性来抑制软骨基质降解。
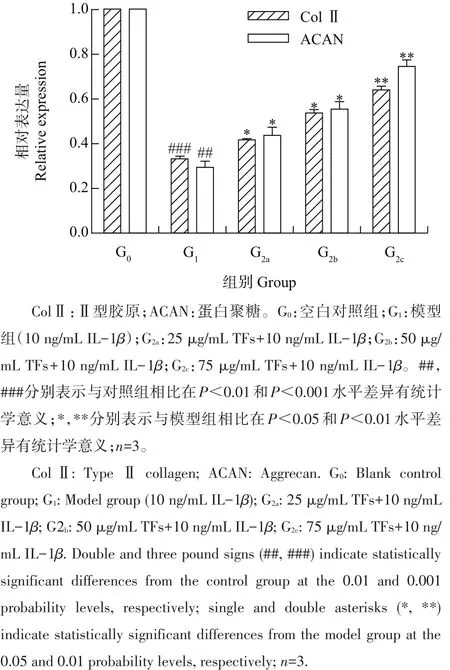
图5TFs对IL-1β诱导大鼠软骨细胞合成因子活性的影响Fig.5Effects of TFs on anabolic activity of IL-1β-induced rat chondrocytes
2.5TFs对IL-1β诱导大鼠软骨细胞分解因子活性的影响
MMP-13主要参与关节软骨分解代谢,是目前在破坏软骨基质稳态研究中受到关注较多的降解酶指标[15]。本实验测定了茶黄素复合物对该因子mRNA表达量的影响。如图6所示:与空白对照组相比,IL-1β处理大鼠软骨细胞24 h后,MMP-13 mRNA表达量极显著增加(P<0.001);与模型组相比,软骨细胞预孵不同质量浓度的TFs(25、50、75 μg/mL)2 h,再加入IL-1β(10 ng/mL)共培养24 h后,发现MMP-13的表达水平呈现出明显的浓度依赖性降低(P<0.05)。由此可见,TFs可减弱软骨细胞分解因子MMP-13活性,抑制软骨基质的降解,维持软骨基质稳态。
2.6TFs对IL-1β诱导大鼠软骨细胞COX-2 mRNA表达的影响
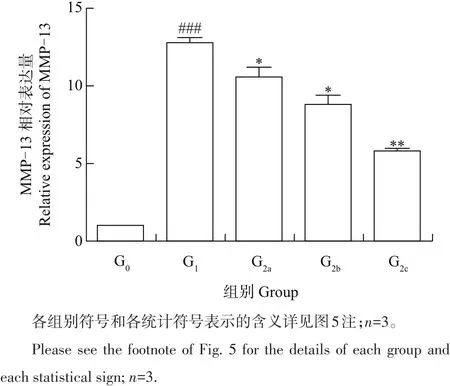
图6TFs对IL-1β诱导大鼠软骨细胞分解因子活性的影响Fig.6Effect of TFs on catabolic activity of IL-1β-induced rat chondrocytes
OA在病变过程中会释放出大量的炎症因子,其中前列腺素E2(prostaglandin E2,PGE2)是参与该病变的主要介质,因此,其合成所需的关键酶环氧化酶(cyclooxygenase-2,COX-2)对于骨关节炎的发生和发展具有重要作用和影响[16]。在本研究中IL-1β处理大鼠软骨细胞24 h后的COX-2 mRNA表达量呈极显著增加(P<0.001);与模型组相比,软骨细胞在不同质量浓度的TFs(25、50、75 μg/mL)中预孵2 h再加入IL-1β(10 ng/mL)共培养24 h后,COX-2的表达水平明显受到抑制(P<0.05),且抑制效果呈现浓度依赖性(图7)。
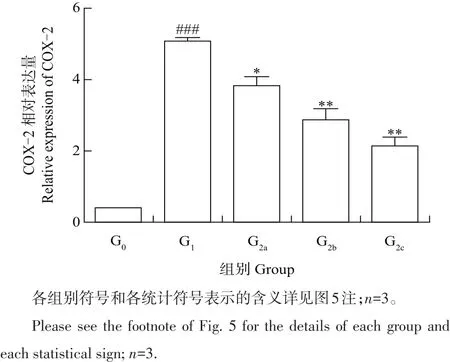
图7TFs对IL-1β诱导大鼠软骨细胞环氧化酶(COX-2)蛋白表达的影响Fig.7Effect of TFs on cyclooxygenase-2(COX-2)expression of IL-1β-induced rat chondrocytes
2.7TFs对IL-1β诱导的大鼠软骨细胞IL-1β mRNA表达的影响
如图8所示:正常大鼠软骨细胞经IL-1β处理24 h后,炎症因子IL-1β mRNA表达水平极显著升高(P<0.01);在TFs(25、50、75 μg/mL)中预孵2h后再加入IL-1β共培养24 h,发现IL-1β表达水平呈浓度依赖性降低,且差异具有统计学意义(P<0.05)。

图8TFs对IL-1β诱导大鼠软骨细胞IL-1β mRNA表达的影响Fig.8Effect of TFs on IL-1β mRNA expression of IL-1β-induced rat chondrocytes
3 讨论
骨关节炎的发病率正在迅速增加,可能在今后几十年内成为世界上第四大致畸原因[17]。关节软骨的破损与退化是OA的主要病理变化。关节软骨由软骨细胞及其分泌的细胞外基质构成,在成人的正常关节软骨中,软骨细胞仅占软骨总体积的2%,其余为细胞外基质,主要由胶原(Ⅱ型胶原占80%~90%[18])和蛋白聚糖组成,其中,Ⅱ型胶原和蛋白聚糖是软骨细胞的特异性分泌产物,常用于软骨细胞鉴定。本实验培养的细胞经甲苯胺蓝染色呈异染性,Ⅱ型胶原免疫荧光染色呈阳性,表明分离培养的细胞是软骨细胞。
茶黄素是红茶的有效活性成分之一,其分子结构包含多个酚羟基及没食子酰基,研究已证实其在肝、肺等人体器官炎症中表现出丰富的抗炎活性[9-12]。CCK-8细胞增殖实验结果显示,0~75 μg/mL的TFs是安全无毒的,不影响软骨细胞活力。因此,本研究采用质量浓度为25、50、75 μg/mL茶黄素来评估其对骨关节炎炎症的调节功效及分子机制。
Ⅱ型胶原(ColⅡ)和蛋白聚糖(ACAN)是关节软骨基质的主要组成成分,其主要功能是调节细胞外基质(ECM)的合成和分解,维持关节软骨基质稳态。本研究发现,大鼠软骨细胞经IL-1β诱导后,ColⅡ及ACAN含量明显降低,与ZHAO等[19]的研究结果一致。此外还发现,炎症软骨细胞经TFs预干预后,其ColⅡ和ACAN mRNA的表达明显上调,改善了软骨基质合成受阻现象。MMP-13在骨关节炎关节软骨退变中扮演了十分重要的角色,它可以通过降解关节软骨基质成分,破坏合成和分解代谢的动态平衡。CHEN等[20]发现,兔软骨细胞经IL-1β刺激24 h后,其MMP-13 mRNA的表达量极显著增加,本实验研究结果与此相符。在此基础上,添加TFs药物预干扰能够显著降低MMP-13降解酶的蛋白表达量,可有效抑制软骨基质的降解现象。
大量研究表明,IL-1β可以调节软骨细胞ECM的更新周转率,引起ECM合成和分解代谢失衡[19-22]。同时,处于基质稳态失衡环境下的软骨细胞又将促进包括其自身在内的炎性因子及炎症介质(如COX-2 mRNA)的大量合成和释放,进而对炎症反应产生自行性推进的影响,加大OA发展进程。因此,控制软骨细胞的炎症反应有利于控制或延缓OA进展,并可能成为治疗OA的关键。在本研究中,经IL-1β诱导的软骨细胞的IL-1β和COX-2 mRNA的表达量显著增加,与陈文超等[23]报道的结果相符。本研究还发现,TFs抑制IL-1β和COX-2 mRNA的表达呈浓度依赖性,其抗炎作用体现了多靶点性。以上结果表明,TFs对软骨细胞炎症因子IL-1β和炎症介质COX-2的表达具有抑制作用。
综上所述,茶黄素作为红茶的重要组成部分及营养物质,可通过上调软骨细胞合成因子ColⅡ和ACAN mRNA的表达,并下调分解因子MMP-13 mRNA的表达,来抑制IL-1β诱导的大鼠软骨基质的降解;同时,通过降低炎症因子IL-1β和炎症诱导酶COX-2 mRNA的表达水平,抑制IL-1β诱导的大鼠软骨细胞炎症反应。这些结果表明,TFs可以在一定程度上延缓大鼠软骨细胞炎性退变,正向调控OA病理进程。
[1]LEMETAYER J,TAYLOR S.Inflammatory joint disease in cats: Diagnostic approach and treatment.Journal of Feline Medicine and Surgery,2014,16(7):547-562.
[2]LOESER R F,GOLDRING S R,SCANZELLO C R,et al. Osteoarthritis:A disease of the joint as an organ.Arthritis and Rheumatism,2012,64(6):1697-1707.
[3]TROEBERG L,NAGASE H.Proteases involved in cartilage matrix degradation in osteoarthritis.Biochimica et Biophysica Acta,2012,1824(1):133-145.
[4]魏丽杰,王文雅.炎症引起的软骨细胞外基质的变化对骨关节
炎病理进展的作用.河北联合大学学报(医学版),2014,16(2): 170-171.
WEI L J,WANG W Y.Roles of changes of the extracellular matrix in cartilage caused by inflammation on osteoarthritis pathological progress.Journal of Hebei United University(Health Sciences),2014,16(2):170-171.(in Chinese)
[5]WANG D Y,QIAO J T,ZHAO X,et al.Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway.Inflammation, 2015,38(6):2235-2241.
[6]WOJDASIEWICZ P,PONIATOWSKI L A,SZUKIEWICZ D.The role of inflammatory and anti-inflammatory cytokines in the pathogenesis of osteoarthritis.Mediators of Inflammation,2014(2): 561459.
[7]AKHTAR N,MILLRE M J,HAQQI T M.Effect of a herbal-leucine mix on the IL-1β-induced cartilage degradation and inflammatory gene expression in human chondrocytes.BMC Complementary and Alternative Medicine,2011,11:66.
[8]ZHANG H F,YAN J P,ZHUANG Y S,et al.Anti-inflammatory effects of farrerol on IL-1β-stimulated human osteoarthritis chondrocytes.European Journal of Pharmacology,2015,764:443-447.
[9]WEERAWATANAKORN M,LEE Y L,TSAI C Y,et al. Protective effect of theaflavin-enriched black tea extracts against dimethylnitrosamine-induced liver fibrosis in rats.Food and Function,2015,6(6):1832-1840.
[10]OKA Y,IWAI S,AMANO H,et al.Tea polyphenols inhibit rat osteoclastformationanddifferentiation.Journalof Pharmacological Sciences,2012,118(1):55-64.
[11]WU Y T,JIN F J,WANG Y L,et al.In vitro and in vivoanti-inflammatory effects of theaflavin-3,3'-digallate on lipopolysaccharide-induced inflammation.European Journal of Pharmacology,2017,794(5):52-60.
[12]KO H J,LO C Y,WANG B J,et al.Theaflavin-3,3'-digallate,a
black tea polyphenol,attenuates adipocyte-activated inflammatory response of macrophage associated with the switch of M1/M2-like phenotype.Journal of Functional Foods,2014,11:36-48.
[13]冷薇,冯文周.骨性关节炎(OA)临床研究进展及药物治疗.中国实用医药,2010,22(5):246-249. LENG W,FENG W Z.Clinical progress research and drug treatment of osteoarthritis(OA).China Practical Medicine,2010, 22(5):246-249.(in Chinese)
[14]ZHOU J,LU P,REN H,et al.17β-estradiol protects human eyelidderived adipose stem cells against cytotoxicity and increases transplanted cell survival in spinal cord injury.Journal of Cellular and Molecular Medicine,2014,18(2):326-343.
[15]WU X C,YIN Q S,ZHENG C H,et al.Alendronate impact on ColⅡ, MMP-13,and β-catenin in osteoarthritis rats.International Journal of Clinical and Experimental Pathology,2016,9(3):3618-3623.
[16]HUANG C Y,HUANG L F,LIANG C C T,et al.COX-2 and iNOS are critical in advanced glycation end product-activated chondrocytes in vitro.European Journal of Clinical Investigation, 2009,39(5):417-428.
[17]URQUHART D M,SOUFAN C,TEICHTAHL A J,et al.Factors that may mediate the relationship between physical activity and the risk for developing knee osteoarthritis.Arthristis Research& Therapy,2008,10:203.
[18]SHINOMURAL T,ITO K,HÖÖK M,et al.A newly identified enhancer element responsible for typeⅡcollagen gene expression. The Journal of Biochemistry,2012,152(6):565-575.
[19]ZHAO H H,ZHANG T E,XIA C,et al.Berberine ameliorates cartilage degeneration in interleukin-1β-stimulated rat chondrocytes and in a rat model of osteoarthritis via Akt signaling.Journal of Cellular and Molecular Medicine,2014,18(2):283-292.
[20]CHEN W P,XIONG Y,HU P F,et al.Baicalein inhibits MMPs expression via a MAPK-dependment mechanism in chondrocytes. Cellular physiology and Biochemistry,2015,36(1):325-333.
[21]HUANG H J,LIU Q,LIU L,et al.Effect of epigallocatechin-3-gallate on proliferation and phenotype maintenance in rabbit articular chondrocytes in vitro.Experimental and Therapeutic Medicine,2015,9(1):213-218.
[22]NISHITANI K,ITO H,HIRAMITSU T,et al.PGE2 inhibits MMP expression by suppressing MKK4-JNK MAP kinase-c-JUN pathway via EP4 in human articular chondrocytes.Journal of Cellular Biochemistry,2010,109(2):425-433.
[23]陈文超,周然,王永辉,等.骨灵膏及其拆方对骨关节炎模型大鼠炎性细胞因子与聚蛋白多糖酶的影响.中医杂志,2016,57 (3):245-249. CHEN W C,ZHOU R,WANG Y H,et al.Effect of Gulinggao and its disassembled prescriptions on inflammatory cytokines and aggrecanase of osteoarthritis model rats.Journal of Traditional Chinese Medicine,2016,57(3):245-249.(in Chinese with English abstract)
Effect of theaflavins on inflammatory degeneration of rat chondrocytes induced by interleukin-1β.
Journal of Zhejiang University(Agric.&Life Sci.),2017,43(4):511-518
ZHOU Ying1†,HUANG Qian2†,WANG Shuai2,CHEN Ping1*(1.Department of Tea Science,College of Agriculture and Biotechnology,Zhejiang University,Hangzhou 310058,China;2.School of Basic Medical Sciences,Zhejiang University, Hangzhou 310058,China)
theaflavins;osteoarthritis;chondrocyte;interleukin-1β;cyclooxygenase-2;inflammatory degeneration
S 571.1;R 684.3;R 392.12
A
10.3785/j.issn.1008-9209.2016.12.282
国家茶叶产业技术体系项目(CARS-23)。
*通信作者(Corresponding author):陈萍(http://orcid.org/0000-0001-7995-6168),E-mail:pingchen@zju.edu.cn
周盈(http://orcid.org/0000-0002-4231-3270),E-mail:vaelailai@foxmail.com。†共同
第一作者
2016-12-28;接受日期(Accepted):2017-02-16

