灵菌红素对断奶大鼠肠道发育以及抗氧化能力的影响
钱 静,杨培周*,操丽丽,操新民,郑 志,姜绍通
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工省级实验室,安徽 合肥 230009)
灵菌红素对断奶大鼠肠道发育以及抗氧化能力的影响
钱 静,杨培周*,操丽丽,操新民,郑 志,姜绍通
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工省级实验室,安徽 合肥 230009)
为研究灵菌红素对肠道发育以及抗氧化能力的影响,以断奶应激诱导的肠道损伤大鼠为实验动物模型,将30 只断奶SD雄性大鼠随机平均分成对照组、低剂量组和高剂量组,对照组大鼠每天灌胃生理盐水,低剂量组和高 剂量组大鼠每天分别灌胃剂量为100、200 μg/kg的灵菌红素溶液(以体质量计);喂养实验持续14 d后处死实验大鼠并取样;记录大鼠每天的体质量和采食量;称取各组织器官质量,测量小肠和结肠的长度,计算器官指数;采用苏木精-伊红染色方法观察回肠和结肠的形态结构,测量回肠绒毛高度和隐窝深度以及结肠黏膜厚度和杯状细胞数量;检测回肠和结肠组织中总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione-peroxidase,GHS-Px)、超氧化物歧化酶(superoxide dismutase,SOD)活力和丙二醛的水平。结果表明:高剂量灵菌红素能够显著提高大鼠的体质量、平均日采食量(P<0.05),显著增加肝脏、脾脏和胸腺指数(P<0.05),显著增加小肠和结肠指数,增加回肠绒毛高度、绒腺比和结肠黏膜厚度(P<0.05);显著增加回肠组织中T-AOC、GHS-Px和SOD活力(P<0.05),并降低回肠组织中丙二醛含量;显著增加结肠组织中SOD活力(P<0.05),降低结肠组织中丙二醛含量。结论:灵菌红素有利于提高断奶大鼠的生长性能,提高回肠和结肠的抗氧化能力,具有缓解断奶应激诱导的大鼠肠道损伤的作用。
灵菌红素;断奶大鼠;肠道发育;免疫功能;抗氧化能力
钱静, 杨培周, 操丽丽, 等. 灵菌红素对断奶大鼠肠道发育以及抗氧化能力的影响[J]. 食品科学, 2017, 38(17): 244-250. DOI:10.7506/spkx1002-6630-201717040. http://www.spkx.net.cn
QIAN Jing, YANG Peizhou, CAO Lili, et al. Effect of prodigiosin on intestinal development and antioxidant capability in weaned rats[J]. Food Science, 2017, 38(17): 244-250. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717040. http://www.spkx.net.cn
肠道是人体最大的器官系统之一,当肠道功能受损时,容易引起持续性腹泻、脱水、肌肉萎缩、生长缓慢、感染频繁、体质量减轻和疲劳等症状[1-2]。断奶容易导致肠道产生免疫应激反应,进而导致肠道功能失衡,引起腹泻、肠易激综合征和炎症性肠病等肠道疾病[3]。据世界卫生组织统计,世界上每年死于肠道疾病的人数都在1 000万以上。肠道疾病长期得不到有效治疗或久治不愈,会导致机体营养物质吸收减少,体内毒素堆积,免疫力下降,并造成严重的 并发症,如心脑血管疾病、肝胆疾病、贫血、糖尿病、性功能减退等多种疾病[4-6],因此,研究和开发有利于提高肠道修复能力的天然产物具有非常重要的意义。
灵菌红素(prodigiosin,PG)是一种含有3 个吡咯环的甲氧基吡咯骨架结构的脂溶性天然红色素,是沙雷氏菌等产生的次级代谢产物[7],具有抗菌、抗疟疾、抗肿瘤、抗癌以及免疫调节等多种生物活性[8-12],受到国内外研究学者的广泛关注。近年来,已经有研究表明PG具有抗氧化和抗炎的功能,例如,PG具有与VC相当的抗氧化活性[13],能够通过抑制细胞中一氧化氮产生以及p38丝裂原激活蛋白激酶活性,抑制脂多糖诱导的小鼠巨噬细胞的炎症反应[14],能够通过减少活性氧等减轻大脑中动脉闭塞再灌注诱导的小鼠脑损伤[15]。目前,针对PG对肠道损伤以及肠道抗氧化能力影响的相关研究鲜见报道,因此,本研究以断奶应激引起的肠道损伤为实验动物模型,研究PG对断奶大鼠肠道发育以及抗氧化能力的影响,为PG应用于食品行业(特别是婴幼儿食品)提供依据,并为肠道疾病的预防和治疗提供参考。
1 材料与方法
1.1 材料、动物与试剂
PG为课题组分离获得黏质沙雷氏菌表达的次生代谢产物,经乙醇浸提和色谱柱等分离纯化后获得[16]。
SPF级雄性的19 d龄断奶Sprague-Dawley(SD)大鼠,体质量39~57 g,购自常州卡文斯实验动物有限公司,许可证号:SCxk(苏)2014-0007。
总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
1.2 仪器与设备
SK-1快速混匀器 金坛市杰瑞尔公司;MiniSpin plus离心机 德国Eppendorf公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器公司;HC-3018R高速冷冻离心机 安徽中科中佳公司;RM2235 切片机德国Leica公司;CX22LED显微镜 日本Olympus公司;MSHOT数码成像装置 广州明美光电公司。
1.3 方法
1.3.1 实验设计及分组
本研究前期实验表明,剂量为200 μg/kg体质量的PG对断奶大鼠体质量增加的促进作用明显,而超过剂量800 μg/kg不利于断奶大鼠生长;喂养28 d,断奶大鼠体质量随试验延长逐渐增加,以此为依据设计灌胃剂量最高为800 μg/kg,以28 d为一个实验周期,具体实验设计和分组为:36 只断奶大鼠随机平均分成6 组:对照组(每天灌胃生理盐水)和5 个PG剂量组(灌胃剂量分别为50、100、200、400、800 μg/kg的PG溶液,以体质量计,下同),实验周期为28 d。
其他实验大鼠饲养与分组:30 只断奶大鼠分别放入不锈钢的代谢鼠笼中,每个笼子1 只,适应性喂养2 d后,随机分成对照组(每天灌胃生理盐水)、PG低剂量组(每天灌胃剂量为100 μg/kg的PG溶液)和PG高剂量组(每天灌胃剂量为200 μg/kg的PG溶液)。饲养条件同上。实验周期为14 d。实验期间所有的断奶大鼠给予普通饲料饲养,自由采食和饮水;饲养温度22~25 ℃,相对湿度50%~70%,12 h昼夜交替(8:00~20:00)。
1.3.2 实验样本收集
在最后一次灌胃之后,给断奶大鼠腹腔注射戊巴比妥钠(剂量为45 mg/kg)进行麻醉,在麻醉状态下经心脏取血,处死大鼠,迅速取出心脏、肝脏、脾脏、肺、肾脏和胸腺组织,称质量;取出小肠和结肠,测量长度并称质量,截取小肠组织中的回肠部分,用于回肠形态学观察及抗氧化指标检测,结肠组织用于结肠形态学观察以及抗氧化指标检测。
1.3.3 指标检测
1.3.3.1 断奶大鼠生长性能
从实验的第0天开始起,每天称取断奶大鼠的体质量,并记录每天每只断奶大鼠的采食量;计算全实验周期内平均日增体质量、平均日采食量和料肉比,料肉比按照公式(1)计算。

1.3.3.2 器官指数的测定
器官(心脏、肝脏、脾脏、肺、肾脏和胸腺)指数和肠道(小肠和结肠)指数分别按照公式(2)、(3)计算。

1.3.3.3 回肠和结肠组织形态学观察
回肠和结肠显微观察采用苏木精-伊红(hematoxylineosin,HE)染色技术[17]:取断奶大鼠回肠和结肠组织置于4%多聚甲醛中固定,水冲洗,梯度乙醇脱水,二甲苯透明,常规石蜡包埋,5 μm切片厚度,常规脱蜡、复水、HE染色、脱水、透明、封片等;MSHOT数码图像采集系统采图;Image-Pro Plus 6.0显微图像分析软件测量回肠的绒毛高度、隐窝深度、结肠的黏膜厚度和杯状细胞数量等形态学指标[18]。
1.3.3.4 回肠和结肠组织抗氧化指标的检测
回肠和结肠组织中T-AOC、GSH-Px、SOD活力及MDA含量检测均按照试剂盒说明书进行测定。
1.4 数据统计分析
使用SPSS 17.0统计学软件进行分析,One-way ANOVA和Duncan’s test分析差异显著性,以P<0.05为差异具有统计学意义,结果用±s表示。
2 结果与分析
2.1 PG灌胃剂量和时间的确定
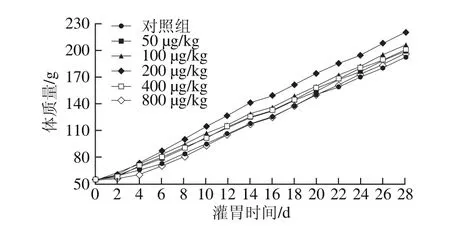
图 1 PG对断奶大鼠体质量的影响Fig. 1 Effect of prodigiosin on body weight of weaned rats
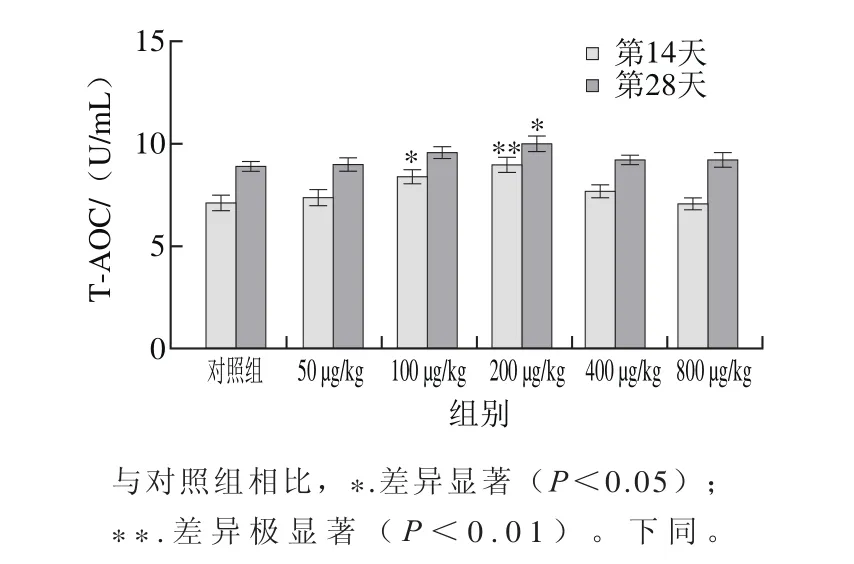
图 2 PG对断奶大鼠血清总抗氧化能力的影响Fig. 2 Effect of prodigiosin on serum total anti oxidant capacity in weaned rats
由图1可知,剂量为200 μg/kg体质量的PG对断奶大鼠体质量增加的促进作用最为明显,14 d内断奶大鼠体质量增加趋势明显,剂量为200 μg/kg的PG相对于其他剂量能够更明显地提高断奶大鼠体质量。用断尾取血的方法取第14天和第28天断奶大鼠的血液,并检测血清中总抗氧化能力的变化,由图2可知,在第14天,200 μg/kg剂量的PG极显著增加断奶大鼠血清中T-AOC(P<0.01),100 μg/kg剂量的PG显著增加了血清中T-AOC(P<0.05)。
过高剂量不利于断奶大鼠生长可能是因为大剂量PG(800 μg/kg)进入肠胃引起消化不良等负面效果。因此,在后续的实验中,将剂量为200、100 μg/kg的PG分别定为高剂量PG(H-PG)和低剂量PG(L-PG),研究PG对断奶大鼠肠道发育以及肠道抗氧化能力的影响。
2.2 PG对断奶大鼠生长性能的影响

表 1 PG对断奶大鼠生长性能的影响Table 1 Effect of PG on growth performance in weaned rats
与对照组相比,H-PG大鼠体质量极显著性增加(P<0.01),平均日增体质量、平均日采食量以及料肉比也显著性增加(P<0.05);L-PG大鼠体质量和料肉比有增加的趋势,但无显著性差异(表1)。本研究结果表明H-PG能够显著提高断奶大鼠的生长性能,促进营养物质的吸收,能够有效缓解断奶应激引起的大鼠采食量下降和生长迟缓等状况。
2.3 PG对断奶大鼠器官指数的影响
与对照组相比,H-PG大鼠的肝脏质量与指数、脾脏质量与指数、胸腺质量与指数都显著增加(P<0.05);L-PG大鼠呈增长趋势,但无显著性差异(表2)。脾脏和胸腺的质量和指数反映机体免疫器官发育状况以及机体免疫水平[19]。熊政委等[20]认为小鼠脾脏指数和胸腺指数的增加反映小鼠机体免疫力的提高。本研究表明,与对照组相比,灌胃高剂量PG增加断奶大鼠的脾脏和胸腺质量,提高脾脏和胸腺指数,说明高剂量PG能够促进断奶大鼠免疫器官的发育,具有提高机体免疫力的功能;心脏、肺和肾脏指数并无显著性差异,说明PG对其发育影响相对较小。
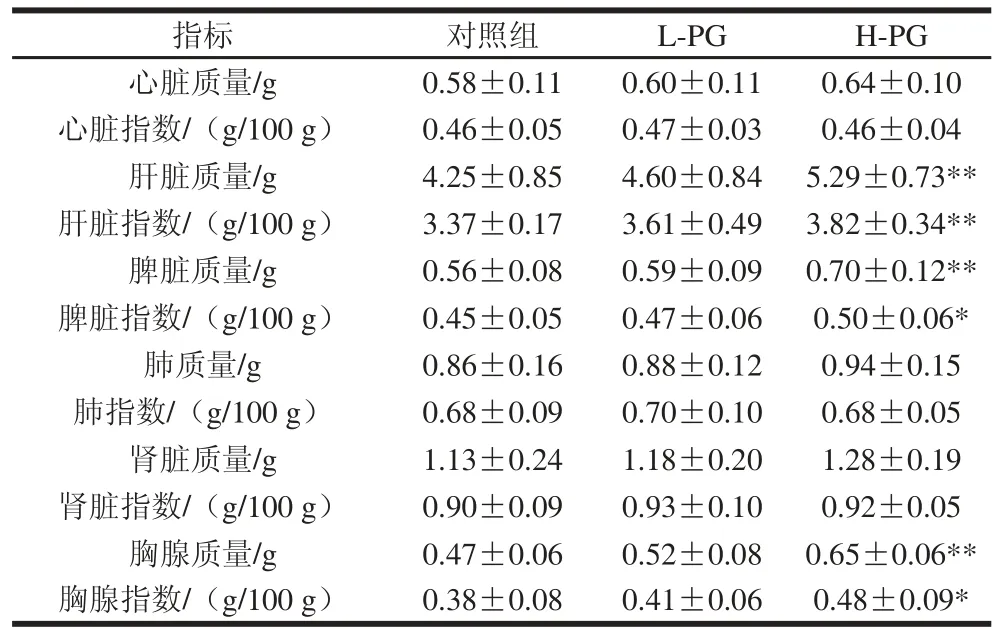
表 2 PG对断奶大鼠器官指数的影响Table 2 Effect of PG on organ indexes in weaned rats
2.4 PG对断奶大鼠肠道外观形态以及肠道指数的影响

图 3 PG对断奶大鼠小肠和结肠外观形态的影响Fig. 3 Effect of PG on the appearance of small intestine and colon in weaned rats
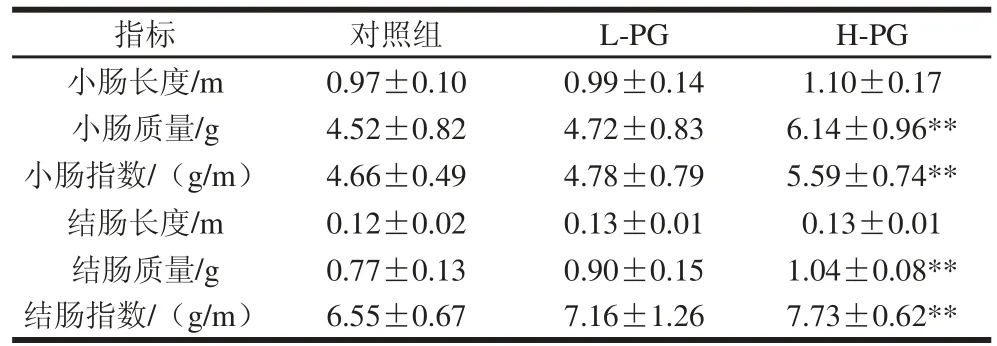
表 3 PG对断奶大鼠小肠和结肠指数的影响Table 3 Effect of PG on small intestine and colon indexes in weaned rats
由图3、表3可知,与对照组相比,H-PG大鼠小肠长度增加;对照组大鼠小肠的回肠区域外观颜色偏黄色,肠壁薄,且有轻微胀气症状(图3B);与对照组相比,H-PG大鼠小肠质量和小肠指数呈极显著性增加(P<0.01),H-PG大鼠结肠长度增加,结肠质量和结肠指数呈极显著性增加(P<0.01),L-PG大鼠结肠质量增加,而结肠的长度和结肠指数有增加趋势,但无差异。肠道长度、质量和指数能够直观地反映肠道的发育状况和消化吸收功能[21]。本研究结果表明,高剂量的PG能够促进断奶大鼠的肠道发育和营养物质消化吸收。
2.5 PG对断奶大鼠回肠形态学结构的影响
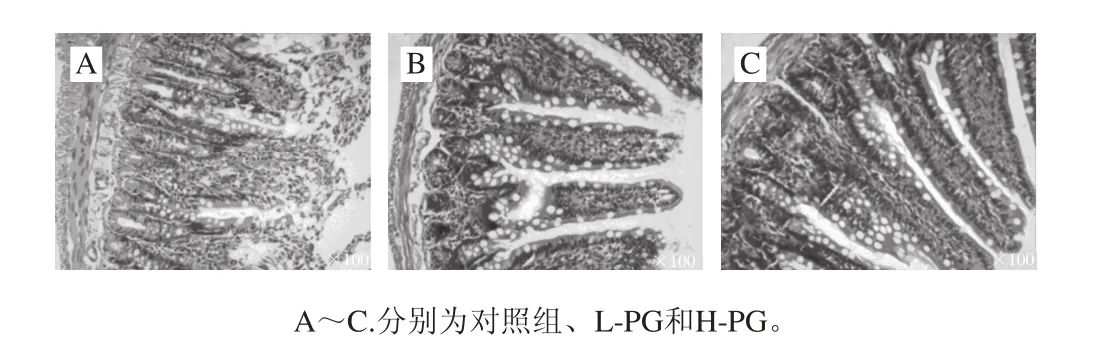
图 4 PG对断奶大鼠回肠形态学结构的影响Fig. 4 Effect of PG on the morphology of ileum in weaned rats
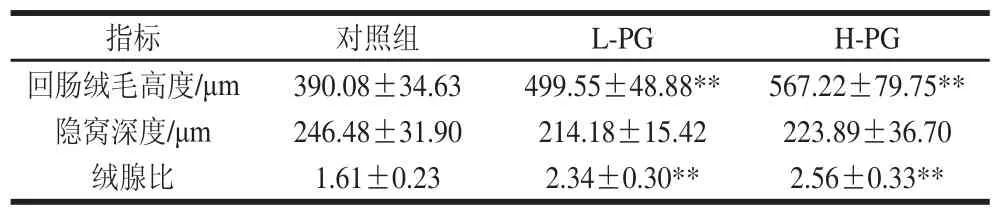
表 4 PG对断奶大鼠回肠绒毛高度、隐窝深度以及绒腺比的影响Table 4 Effect of PG on ileal villus height, crypt depth and ratio of villus height to crypt depth in weaned rats
切片显微观察表明,对照组的回肠细胞绒毛结构不规则,部分细胞破损严重,细胞排列不整齐,肠道黏膜萎缩,黏膜上皮水肿,肠绒毛脱落变短,杯状细胞破损严重(图4A);L-PG细胞间结构清晰,无损伤痕迹,肠道黏膜完整,无肠绒脱落现象,回肠肠黏膜绒毛结构完整,上皮细胞排列也较为整齐(图4B);H-PG断奶大鼠回肠肠黏膜绒毛结构较完整,上皮细胞排列较为整齐,杯状细胞能够较好保存完整,细胞外壁能够保存完整(图4C),H-PG和L-PG大鼠回肠绒毛高度和绒腺比都极显著增加(P<0.01)(表4)。早期断奶会引起肠道黏膜萎缩、黏膜上皮水肿、肠绒毛脱落变短、隐窝加深以及肠道通透性增加等[22-23]。小肠绒毛高度、隐窝深度以及绒腺比是判断小肠黏膜发育和吸收功能的重要指标[24]。小肠绒毛高度和绒腺比的增加,隐窝深度的降低可以间接地反映肠道对营养物质消化和吸收的增加[25-26]。本研究结果表明PG能够减轻断奶应激引起的大鼠小肠黏膜损伤,有利于促进断奶大鼠的小肠发育和营养物质的消化吸收。
2.6 PG对断奶大鼠结肠形态结构的影响
切片显微40 倍下观察对照组、L-PG和H-PG大鼠结肠肠腔黏膜的整体形态,各组大鼠结肠肌层和黏膜结构较完整(图5);100 倍下观察到各组大鼠结肠的肠腺排列较整齐;400 倍下观察到对照组大鼠结肠的肠道上皮不完整,边缘细胞部分断裂,出现较多破损形态,杯状细胞破损严重;L-PG和H-PG大鼠结肠肠道上皮细胞较完整,基本无断裂;结肠黏膜厚度较高,杯状细胞破损小,与对照组相比,L-PG大鼠的结肠黏膜厚度极显著性增加(P<0.01),而H-PG大鼠结肠的呈显著性增加(P<0.05);L-PG和H-PG组的杯状细胞数量与对照组无显著性差异(表5)。本研究结果表明PG能够减轻断奶应激引起的大鼠结肠黏膜损伤,有利于促进断奶大鼠的结肠发育和营养物质的消化和吸收。
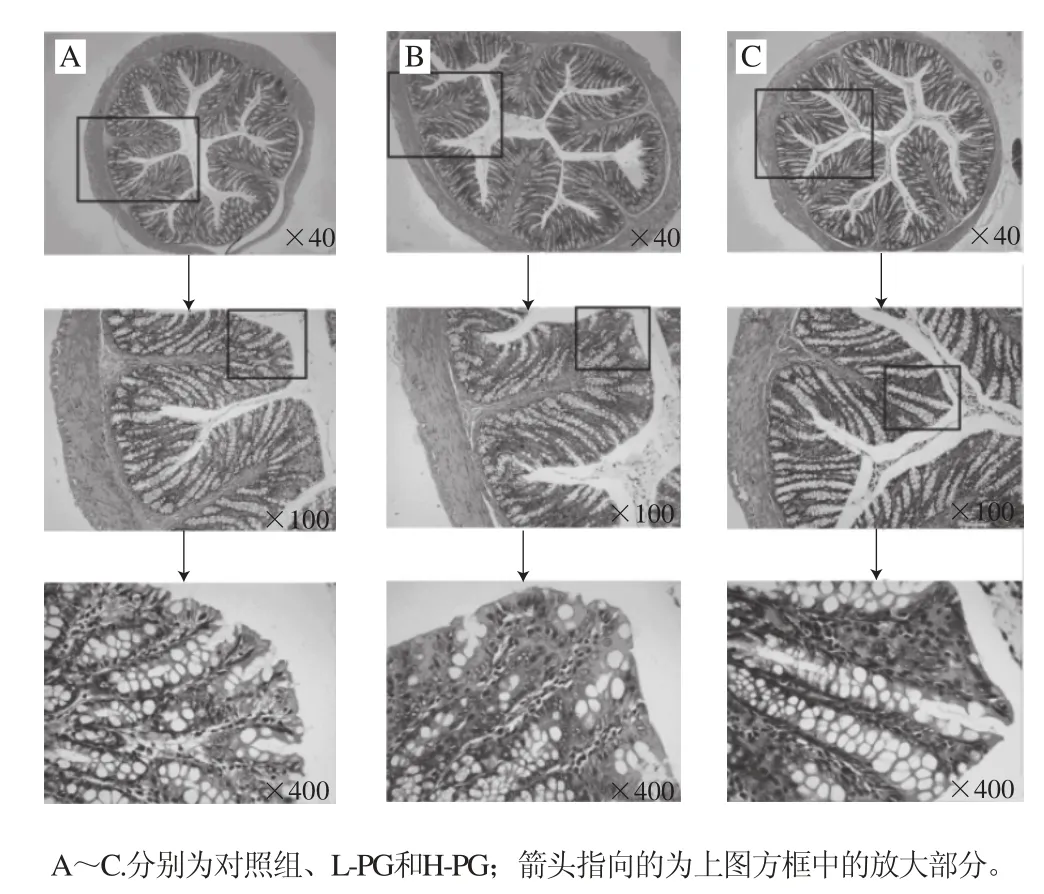
图 5 PG对断奶大鼠结肠形态结构的影响Fig. 5 Effect of PG on colonic morphology in weaned rats
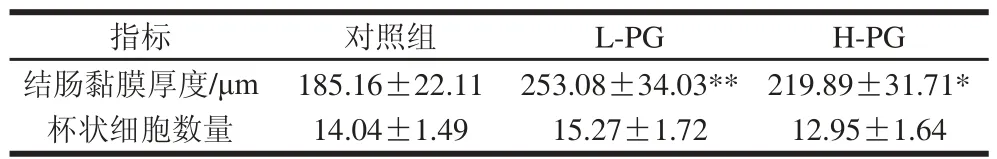
表 5 PG对断奶大鼠结肠黏膜厚度和杯状细胞数量的影响Table 5 Effect of PG on thickness of colonic mucosa and number of goblet cells in weaned rats
2.7 PG对断奶大鼠回肠和结肠抗氧化能力的影响

图 6 PG对断奶大鼠回肠和结肠组织中T-AOC的影响Fig. 6 Effect of PG on ileal and colonic T-AOC in weaned rats
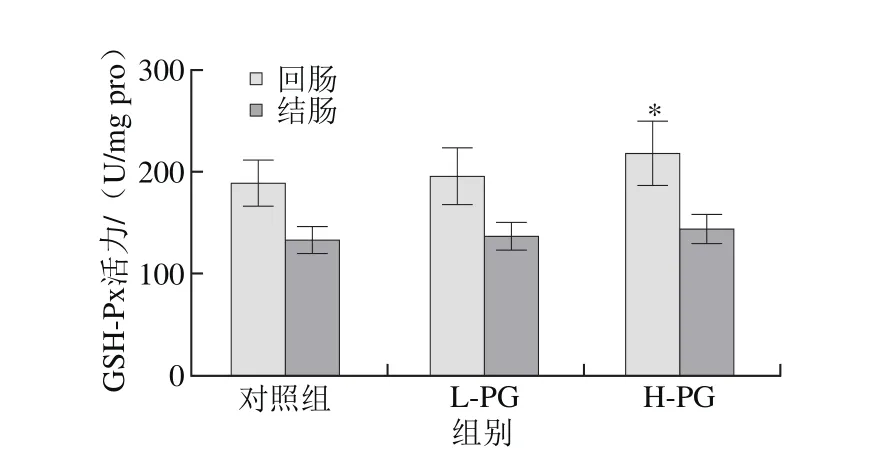
图 7 PG对断奶大鼠回肠和结肠组织中GSH-Px活力的影响Fig. 7 Effect of PG on ileal and colonic GSH-Px activity in weaned rats
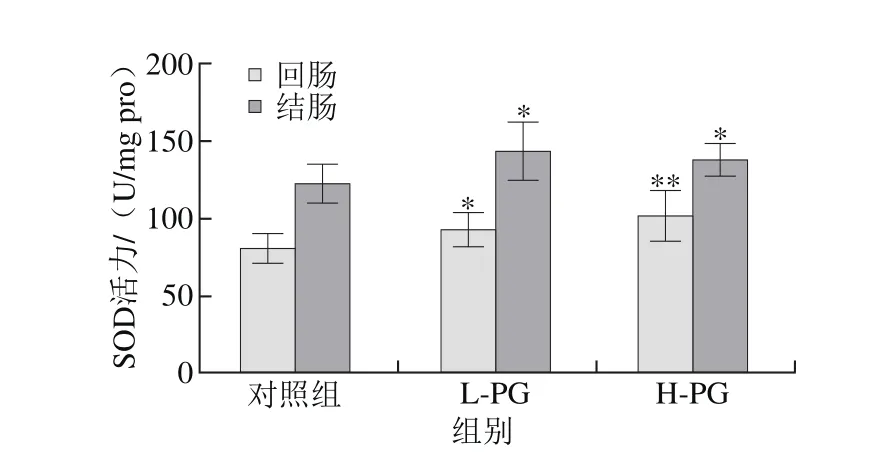
图 8 PG对断奶大鼠回肠和结肠组织中SOD活力的影响Fig. 8 Effect of PG on ileal and colonic SOD activity in weaned rats
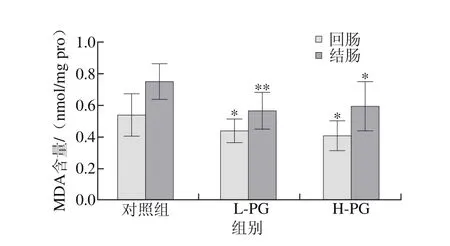
图 9 PG对断奶大鼠回肠和结肠组织中MDA含量的影响Fig. 9 Effect of PG on ileal and colonic MDA levels in weaned rats
与对照组相比,L-PG大鼠回肠组织中T-AOC和SOD活力显著增加(P<0.05)(图6、8),MDA含量显著降低(P<0.05)(图9);结肠组织中SOD活力显著增加(P<0.05),MDA含量极显著降低(P<0.01);与对照组相比,H-PG大鼠回肠组织中T-AOC、GSH-Px和SOD活力显著增加(P<0.05,P<0.01),MDA含量显著降低(P<0.05),结肠组织中SOD活力显著增加(P<0.05),MDA含量显著降低(P<0.05)(图7)。本研究结果表明PG能够抑制断奶大鼠肠道的脂质过氧化水平,清除自由基,减轻断奶应激引起的氧化损伤,从而提高肠道的抗氧化能力。
断奶应激会造成动物机体内氧化还原状态失衡,诱导氧化应激反应,自由基产生增加,抗氧化能力降低[27-28]。T-AOC能够反映机体总抗氧化能力强弱,抗氧化酶系统能够清除机体产生的自由基,从而保持机体氧化还原状态的平衡。MDA属于一种脂质过氧化产物,能够间接地反映细胞氧化损伤程度[29-30]。PG不仅具有体外抗氧化活性[13],抑制动脉闭塞再灌注诱导小鼠大脑中的活性氧自由基和一氧化氮的生成[15],提高断奶大鼠回肠和结肠内的抗氧化酶活力。根据形态观察以及抗氧化等研究结果,推测可能机制:PG通过抑制断奶大鼠肠道的脂质过氧化水平,清除自由基,减轻断奶应激引起的肠道氧化损伤,提高肠道抗氧化能力,保持肠道黏膜完整性,进而促进肠道的发育和提高机体免疫力,提高营养物质消化吸收,提高断奶大鼠生长性能的功能。但是PG在机体内如何代谢,代谢过程中对机体代谢的影响,以及对机体与免疫力相关的控制机制还有待于进一步研究和探讨。
3 结 论
通过分析PG对断奶大鼠生长性能、器官指数、肠道指数、肠道外观形态以及回肠和结肠形态结构的影响,考察断奶大鼠回肠和结肠抗氧化能力的指标,结果表明,高剂量的PG有利于提高断奶大鼠的终体质量、平均日增体质量和平均日采食量,降低料肉比,缓解断奶应激引起的大鼠采食量下降和生长迟缓;显著提高器官指数和肠道指数;PG有利于修复断奶造成回肠肠道黏膜萎缩、黏膜上皮水肿、肠绒毛脱落变短和隐窝加深等症状,增加结肠黏膜厚度;此外,PG还能够提高肠道中T-AOC、GSH-Px和SOD活力,降低MDA含量。总之,PG能够比较有效地提高断奶大鼠与生长性能相关的各项指标,降低断奶引起的肠道损伤,增强肠道的抗氧化能力。
[1] GAREAU M G, SHERMAN P M, WALKER W A. Probiotics and the gut microbiota in intestinal health and disease[J]. Nature Reviews Gastroenterology and Hepatology, 2010, 7(9): 503-514. DOI:10.1038/ nrgastro.2010.117.
[2] POWER S E, O’ TOOLE P W, STANTON C, et al. Intestinal microbiota, diet and health[J]. British Journal of Nutrition, 2014, 111(3): 387-402. DOI:10.1017/S0007114513002560.
[3] LUTGENDORFF F, AKKERMANS L M, SÖDERHOLM J D. The role of microbiota and probiotics in stress-induced gastro-intestinal damage[J]. Current Molecular Medicine, 2008, 8(4): 282-298. DOI:10.2174/156652408784533779.
[4] ZHOU X, HAN D W, XU R L, et al. Role of intestinal endotoxemia in development of metabolic syndrome-related diseases in rats[J]. Chinese Journal of Pathophysiology, 2012, 28(3): 492-498.
[5] SCHNABL B, BRENNER D A. Interactions between the intestinal microbiome and liver diseases[J]. Gastroenterology, 2014, 146(6): 1513-1524. DOI:10.1053/j.gastro.2014.01.020.
[6] JEDEL S, HOOD M M, KESHAVARZIAN A. Getting personal: a review of sexual functioning, body image, and their impact on quality of life in patients with inflammatory bowel disease[J]. Inflammatory Bowel Diseases, 2015, 21(4): 923-938. DOI:10.1097/ MIB.0000000000000257.
[7] CHANG C C, CHEN W C, HO T F, et al. Development of natural anti-tumor drugs by microorganisms[J]. Journal of Bioscience & Bioengineering, 2011, 111(5): 501-511. DOI:10.1016/ j.jbiosc.2010.12.026.
[8] PÉREZ-TOMÁS R, MONTANER B, LLAGOSTERA E, et al. The prodigiosins, proapoptotic drugs with anticancer properties[J]. Biochemical Pharmacology, 2003, 66(8): 1447-1452. DOI:10.1016/ S0006-2952(03)00496-9.
[9] ALIHOSSEINI F, JU K S, LANGO J, et al. Antibacterial colorants: characterization of prodiginines and their applications on textile materials[J]. Biotechnology Progress, 2008, 24(3): 742-747. DOI:10.1021/bp070481r.
[10] VAISHNAV P, DEMAIN A L. Unexpected applications of secondary metabolites[J]. Biotechnology Advances, 2011, 29(2): 223-229. DOI:10.1016/j.biotechadv.2010.11.006.
[11] HAN S B, LEE C W, YOON Y D, et al. Effective prevention of lethal acute graft-versus-host disease by combined immunosuppressive therapy with prodigiosin and cyclosporine A[J]. Biochemical Pharmacology, 2005, 70(10): 1518-1526. DOI:10.1016/ j.bcp.2005.08.017.
[12] WILLIAMSON N R, FINERAN P C, LEEPER F J, et al. The biosynthesis and regulation of bacterial prodiginines[J]. Nature Reviews Microbiology, 2006, 4(12): 887-899. DOI:10.1038/ nrmicro1531.
[13] GULANI C, BHATTACHARYA S, DAS A. Assessment of process parameters infi uencing the enhanced production of prodigiosin from Serratia marcescens and evaluation of its antimicrobial, antioxidant and dyeing potentials[J]. Malaysian Journal of Microbiology, 2012, 8(2): 116-122. DOI:10.21161/mjm.03612.
[14] HUH J E, YIM J H, LEE H K, et al. Prodigiosin isolated from Hahella chejuensis suppresses lipopolysaccharide-induced NO production by inhibiting p38 MAPK, JNK and NF-kappa B activation in murine peritoneal macrophages[J]. International Immunopharmacology, 2008, 7(13): 1825-1833. DOI:10.1016/j.intimp.2007.09.002.
[15] CHANG C C, WANG Y H, CHEM C M, et al. Prodigiosin inhibits gp91phox, and iNOS expression to protect mice against the oxidative/ nitrosative brain injury induced by hypoxia-ischemia[J]. Toxicology and Applied Pharmacology, 2011, 257(1): 137-147. DOI:10.1016/ j.taap.2011.08.027.
[16] 张丹峰, 杨培周, 操丽丽, 等. 黏质沙雷氏菌摇瓶发酵产灵菌红素的工艺优化[J]. 食品科学, 2015, 36(13): 119-124. DOI:10.7506/ spkx1002-6630-201513023.
[17] YANG X F, JIANG Z Y, GONG Y L, et al. Supplementation of pre-weaning diet with L-arginine has carry-over effect to improve intestinal development in young piglets[J]. Canadian Journal of Animal Science, 2016, 96(1): 52-59. DOI:10.1139/cjas-2015-0043.
[18] YAO K, GUAN S, LI T, et al. Dietary L-arginine supplementation enhances intestinal development and expression of vascular endothelial growth factor in weanling piglets[J]. British Journal of Nutrition, 2011, 105(5): 703-709. DOI:10.1017/S000711451000365X.
[19] 王元秀, 张桂香, 李峰, 等. 酵母多糖的提取及其对雏鸡免疫器官发育的影响[J]. 食品科学, 2011, 32(2): 256-259.
[20] 熊政委, 郑韵, 兰洋, 等. 菊糖酸奶对小鼠免疫器官指数和血清免疫球蛋白的影响[J]. 食品科学, 2014, 35(21): 216-218. DOI:10.7506/ spkx1002-6630-201421042.
[21] RUAN Z, YANG Y, WEN Y, et al. Metabolomic analysis of amino acid and fat metabolism in rats with L-tryptophan supplementation[J]. Amino Acids, 2014, 46(12): 2681-2691. DOI:10.1007/s00726-014-1823-y.
[22] TSUKAHARA T, INOUE R, NAKATANI M, et al. Influence of weaning age on the villous height and disaccharidase activities in the porcine small intestine[J]. Animal Science Journal, 2016, 87(1): 67-75. DOI:10.1111/asj.12399.
[23] 黄小流, 阮征, 张梅英, 等. 低聚乳果糖对断奶大鼠肠道发育的影响[J].食品科学, 2012, 33(9): 226-229.
[24] MONTAGNE L, PLUSKE J R, HAMPSON D J. A review of interactions between dietary fi bre and the intestinal mucosa, and their consequences on digestive health in young non-ruminant animals[J]. Animal Feed Science & Technology, 2003, 108: 95-117. DOI:10.1016/ S0377-8401(03)00163-9.
[25] 王文婷, 邬应龙. 氧化魔芋葡甘露聚糖对高脂饮食C57BL/6J小鼠十二指肠形态及肠道菌群的影响[J]. 食品科学, 2013, 34(19): 306-310. DOI:10.7506/spkx1002-6630-201319063.
[26] RUAN Z, LIU S, ZHOU Y, et al. Chlorogenic acid decreases intestinal permeability and increases expression of intestinal tight junction proteins in weaned rats challenged with LPS[J]. PLoS ONE, 2014, 9(6): e97815. DOI:10.1371/journal.pone.0097815.
[27] ZHU L H, ZHAO K L, CHEN X L, et al. Impact of weaning and an antioxidant blend on intestinal barrier function and antioxidant status in pigs[J]. Journal of Animal Science, 2012, 90(8): 2581-2589. DOI:10.2527/jas.2011-4444.
[28] YIN J, WU M M, XIAO H, et al. Development of an antioxidant system after early weaning in piglets[J]. Journal of Animal Science, 2014, 92(2): 612-619. DOI:10.2527/jas.2013-6986.
[29] 李超, 崔珏, 周小双, 等. 鼠曲草总黄酮改善糖尿病小鼠抗氧化功能的研究[J]. 食品科学, 2013, 34(21): 311-314. DOI:10.7506/spkx1002-6630-201321062.
[30] YANG Q M, PAN X H, KONG W B, et al. Antioxidant activities of malt extract from barley (Hordeum vulgare L.) toward various oxidative stress in vitro and in vivo[J]. Food Chemistry, 2010, 118(1): 84-89. DOI:10.1016/j.foodchem.2009.04.094.
Effect of Prodigiosin on Intestinal Development and Antioxidant Capability in Weaned Rats
QIAN Jing, YANG Peizhou*, CAO Lili, CAO Xinmin, ZHENG Zhi, JIANG Shaotong
(Anhui Key Laboratory of Intensive Processing of Agricultural Products, College of Food Science and Engineering, Hefei University of Technology, Hefei 230009, China)
To investigate the effect of prodigiosin on intestinal development and antioxidant function in weaned rats, thirty male SD weaned rats, which suffered from intestinal injury induced by weaning stress, were randomly equally divided into control, low-dose, and high-dose groups. The rats in the contr ol group were orally administered daily with sterile saline, while those in the low-dose, and high-dose groups were gavaged daily with 100 and 200 μg prodigiosin/kg body weight, respectively. The administration lasted for 14 days. All the rats were sacrifi ced after the last administration to collect tissue samples. Body weight and feed intake were recorded daily. Organ weights and the lengths of small intestine and colon were measured, and organ indexes were calculated. The morphological structures of ileum and colon were observed using hematoxylin and eosin (HE) staining. Ileal villus height and crypt depth, the thickness of colonic mucosa, and the number of goblet cells were measured. The total antioxidant capacity (T-AOC), glutathione-peroxidase (GHS-Px) and superoxide dismutase (SOD) activity, and malondialdehyde (MDA) content in ileum and colon were determined. The results showed that high-dose prodigiosin could signifi cantly increase body weight, daily feed intake, liver, spleen, thymus, small intestine and colon indexes, ileal villus height, the ratio of villus height and crypt depth, the thickness of colon mucosa, T-AOC, GHS-Px and SOD activities in ileum, and SOD in colon (P < 0.05), and decrease MDA contents in ileum and colon. In conclusion, prodigiosin is beneficial for improving the growth performance of weaned rats, and enhancing antioxidant capability in ileum and colon, as well as attenuating intestinal injury induced by weaning stress.
prodigiosin; weaned rats; intestinal development; immune function; antioxidant capability
10.7506/spkx1002-6630-201717040
TS235.1
A
1002-6630(2017)17-0244-07引文格式:
2016-07-30
安徽省科技攻关计划项目(1604a0702001);安徽省自然科学基金项目(1408085MC67)
钱静(1989—),女,硕士研究生,研究方向为食品质量与安全。E-mail:qianjing0311@126.com
*通信作者:杨培周(1976—),男,副教授,博士,研究方向为食品微生物与食品安全。E-mail:yangpeizhou@163.com

