日粮补充L-亮氨酸对超早期断奶宫内发育迟缓仔猪肠道免疫功能的影响
黄 强,徐 稳,何进田,白凯文,苏伟鹏,周 乐,张莉莉,王 恬*
(南京农业大学动物科技学院,江苏 南京 210095)
日粮补充L-亮氨酸对超早期断奶宫内发育迟缓仔猪肠道免疫功能的影响
黄 强,徐 稳,何进田,白凯文,苏伟鹏,周 乐,张莉莉,王 恬*
(南京农业大学动物科技学院,江苏 南京 210095)
目的:研究L-亮氨酸对超早期断奶宫内发育迟缓(intrauterine growth retardation,IUGR)仔猪肠道免疫功能的调节作用。方法:选取14 日龄断奶的正常初生体质量(normal birth weight,NBW)和IUGR新生仔猪各16 头,分别饲喂基础日粮或添加0.35% L-亮氨酸实验日粮,即4 个处理组,每组8 头猪。结果:与NBW仔猪相比,IUGR仔猪血清溶菌酶活力和补体3(complement-3,C3)水平显著降低(P<0.05),空肠和回肠中杯状细胞(goblet cells,GC)和淋巴细胞(intraepithelial lymphocytes,IEL)数量显著减少(P<0.05),回肠中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)含量显著升高(P<0.05),白细胞介素10(interleukin-10,IL-10)含量显著降低(P<0.05)。另外,IUGR仔猪回肠TNF-α mRNA表达量显著升高(P<0.05),IL-10 mRNA表达量显著降低(P<0.05)。日粮添加0.35% L-亮氨酸后,IUGR仔猪血清溶菌酶活力、C3和C4水平显著升高(P<0.05),回肠中GC数量及十二指肠和空肠中IEL数量显著增加(P<0.05),回肠中IL-10含量显著升高(P<0.05),并且IL-2和IL-10 mRNA表达量显著升高(P<0.05)。结论:IUGR会引起超早期断奶仔猪肠道黏膜发生炎症反应和肠道生长发育受限。L-亮氨酸可以有效缓解IUGR引起的肠道黏膜损伤,改善仔猪肠道的免疫功能。
L-亮氨酸;宫内发育迟缓;肠道;免疫功能;早期断奶仔猪
宫内发育迟缓(intrauterine growth retardation,IUGR)是指胚胎或胎儿器官在母体怀孕期间生长或发育不全[1]。世界卫生组织统计,全球每年约有15.5%的IUGR新生儿,且在人类医学上多胎儿的死亡率较高,迄今为止仍没有很好的治疗方法。同样,在集约化养殖模式下,IUGR发生率也很高,例如猪作为一种多胎动物有着较高的 IUGR自然发病 率和死亡率[2]。流行病学研究表明,IUGR婴儿和IUGR动物模型的器官发育及功能不同于正常的婴儿或者动物,且成年后易出现肥胖、Ⅱ型糖尿病、高血压等代谢综合征[3-5]。IUGR还会显著影响新生儿免疫系统的发育和功能。 Contreras等[6]研究表明IUGR可降低新生儿体内免疫细胞的数量,进而影响其细胞免疫功能。研究也发现,IUGR会损害小肠发育和破坏肠道结构,降低肠道免疫功能[7]。小肠是营养物质吸收和抗原入侵的重要场所,大量的细胞和生物活性物质构成了肠道黏膜的屏障,包括机械屏障、化学屏障、免疫屏障和微生物屏障,共同抵御抗原的入侵[8]。
亮氨酸是机体内的必需氨基酸,也是功能性氨基酸,近年来被广泛作为食品添加剂。针对小鼠的研究发现,亮氨酸能有效缓解高脂肪日粮诱导的线粒体功能紊乱、胰岛素抵抗和肥胖等代谢综合征[9]。日粮中补充亮氨酸能提高断奶仔猪的生长性能,促进肌肉蛋白质合成[10]。适当添加亮氨酸可以提高草鱼肠道的免疫状态、增强免疫力及相关基因的表达[11]。这些结果提示亮氨酸作为食品添加剂具有保护动物健康、保障食品安全和人类健康的研究潜力。猪是一种理想的人类医学模型,对IUGR猪的研究不仅有助于解决养猪生产上的问题,也有助于促进人类医学的研究。但目前有关亮氨酸对IUGR婴儿和动物的研究还较少。因此,本实验选择自然发生IUGR仔猪为研究模型,考察超早期断奶后补充L-亮氨酸对仔猪肠道免疫功能的影响,为IUGR仔猪的养殖和婴儿营养的临床应用提供思路,同时也为L-亮氨酸在食品科学领域的应用提供一定参考。
1 材料与方法
1.1 材料与试剂
L-亮氨酸(纯度≥98.0%) 美国Sigma-Aldrich公司;苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒 碧云天生物技术研究所;溶菌酶(lysozyme)、补体3(complement-3,C3)、C4试剂盒 南京建成生物工程研究所;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)试剂盒、白细胞介素2(interleukin-2,IL-2)试剂盒、IL-10试剂盒北京北方生物技术研究所;Trizol试剂 美国Invitrogen公司;mRNA反转录试剂盒、荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 日本TaKaRa生物科技股份有限公司。
1.2 仪器与设备
BX5光学显微镜 日本奥林巴斯公司;Model PRO 200 Double Insulated匀浆机 美国ProScience公司;T-6紫外-可见分光光度计 南京菲勒仪器有限公司;Nano Drop 2000超微量可见光分光光度计 美国Thermo公司;StepOnePlus实时荧光定量PCR仪 美国应用生物系统公司。
1.3 方法
1.3.1 动物实验设计
选取品种相同(长白×大白)、胎次和预产期相近的妊娠母猪16 头,在其分娩后,选择16 窝新生仔猪(杜洛克×长白×大白),每窝选择1 头正常初生体质量(normal birth weight,NBW)仔猪((1.52±0.06)kg)和1 头同性别IUGR仔猪((0.87±0.04)kg)[7],即16 头NBW仔猪和16 头IUGR仔猪。采用2×2因子设计,所有新生仔L-猪随母猪哺乳至14 日龄断奶,然后分别饲喂基础日粮或L-亮氨酸日粮(基础日粮+0.35% L-亮氨酸)并随机分为4 组,即NC(NBW+基础日粮)组、NL(NBW+L-亮氨酸日粮)组、IC(IUGR+基础日粮)组、IL(IUGR+L-亮氨酸日粮)组,每组8 个重复,每个重复1 头猪。当仔猪饲养至35 日龄时,每组屠宰8 头仔猪,公母各半。宰前空腹12 h,颈部肌肉注射戊巴比妥钠(50 mg/kg,以体质量计)麻醉致死,立即采集血样,并迅速剖开腹腔,取出十二指肠、空肠和回肠,用生理盐水将食糜冲净后于4%多聚甲醛缓冲液(0.1 mol/L,pH 7.4)中固定,待做组织切片。另外,截取相同部位的回肠一段,刮取肠黏膜,立即放入液氮速冻,-80 ℃保存供后期实验分析。基础日粮配制参照美国国家研究委员会(National Research Council,NRC)(2012)修订的猪饲养标准[12],其组成及营养水平见表1。L-亮氨酸添加量参照本课题组和前人的研究结果[10,13]。
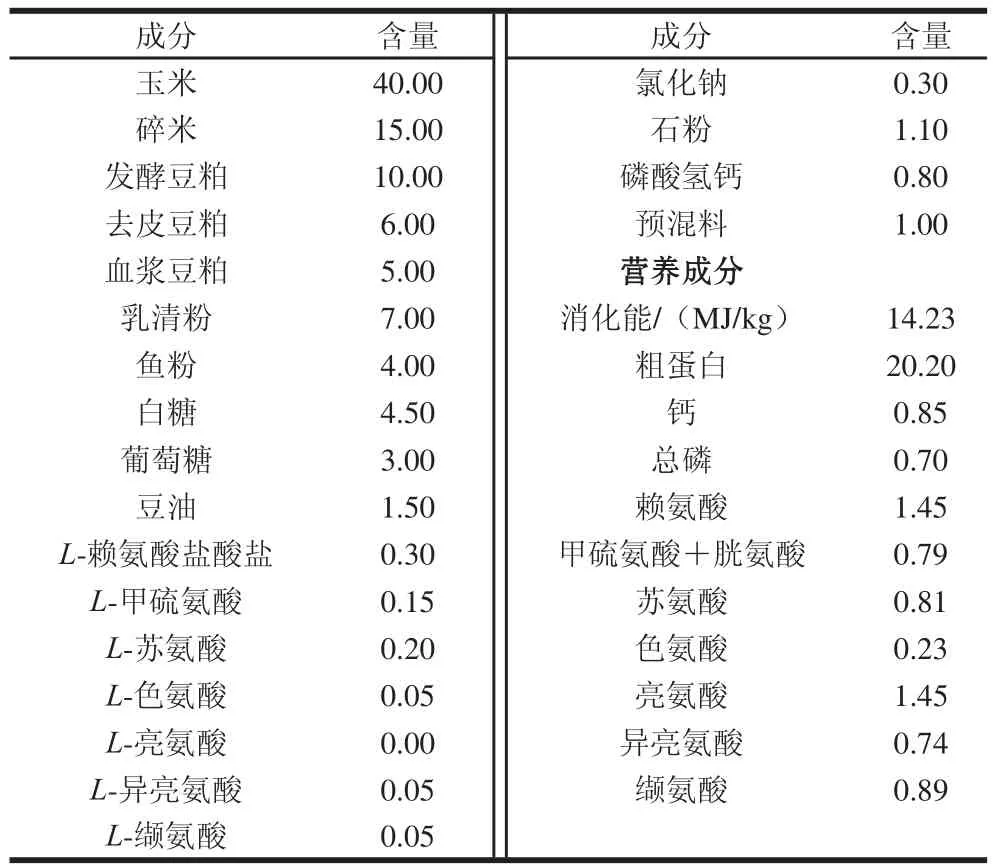
表 1 基础日粮组成及营养成分(风干)Table 1 Ingredients and nutrient contents of diets (on an air-dry basis) %
1.3.2 动物饲养管理
实验期内仔猪每重复饲养于一栏,每头猪平均占有圈舍1 m×0.6 m,自由采食和饮水,每天清扫和消毒猪舍,猪舍温度和相对湿度分别控制在25~28 ℃和50%~ 70%之间。实验期间断牙、断尾、去势、常规补铁与免疫等均按照猪场相关规程操作,饲养管理严格执行卫生防疫制度。
1.3.3 血清免疫指标的测定
仔猪屠宰时采集血样,4 ℃、3 000 r/min离心15 min,制备血清于-20 ℃冰箱中保存待用。血清中溶菌酶活力、C3和C4水平均严格按照试剂盒说明书的方法和步骤进行测定。
1.3.4 小肠黏膜上皮间杯状细胞和淋巴细胞数量的检测
多聚甲醛固定液中的十二指肠、空肠和回肠标本经水洗、透明、浸蜡、包埋等处理后,在室温条件下切成8 μm的切片,HE染色,封片。在显微镜下分别详细观察和检测各组肠黏膜上皮柱 状细胞间杯状细胞(goblet cells,GC)和淋巴细胞(intraepithelial lymphocytes,IEL)的数量。具体检测方法是:取每根肠管横断面,统计观察5 根最长且排列整齐的绒毛,计数每100 个肠黏膜柱状上皮细胞 间GC和IEL的数量[14]。
1.3.5 回肠黏膜细胞因子含量的测定
取200 mg回肠黏膜样品制备20%组织匀浆液,匀浆液于4 ℃、4 000 r/min离心15 min,分离上清液待测。采用放射免疫试剂盒检测回肠黏膜中细胞因子TNF-α、IL-2、IL-10的含量。
1.3.6 TNF-α、IL-2、IL-10 mRNA相对表达量的测定
采用Trizol试剂提取回肠黏膜中总RNA,1%琼脂糖凝胶电泳检查总RNA的完整性。使用Nano Drop 2000超微量可见光分光光度计测定总RNA的质量浓度和纯度,并用0.1%焦碳酸二乙酯(diethylpyrocarbonate,DEPC)水稀释到相同质量浓度500 ng/μL。稀释后的RNA采用20 μL反转录反应体系,按照反转录试剂盒说明书的方法和步骤进行测定,反应条件为37 ℃,15 min;85 ℃,5 s。反转录产物(cDNA)保存于-20 ℃备用。
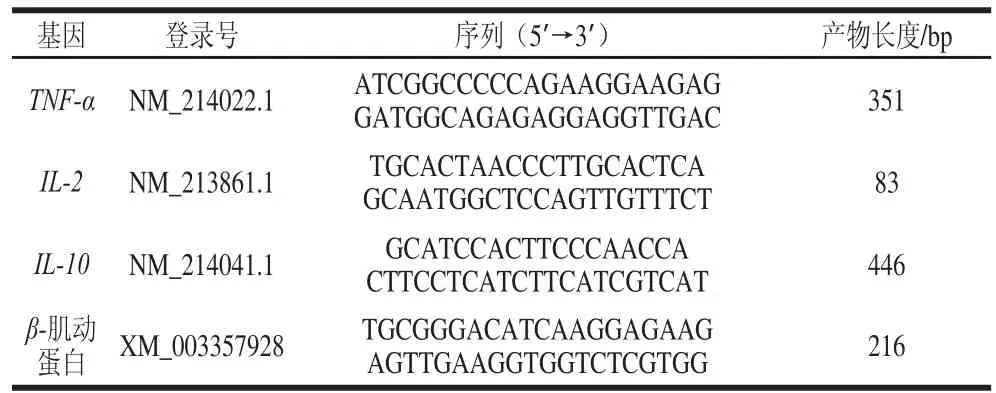
表 2 实时荧光定量PCR引物序列Table 2 Primer sequences used for quantitative real-time PCR
基因引物序列见表2,由Invitrogen(上海)公司设计并合成。采用20 μL反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)体系:SYBR 10 μL、Rox Reference Dye(50×)0.4 μL、上下游引物各0.4 μL、DEPC水6.8 μL和cDNA模板2 μL。RT-PCR程序为:预变性,95 ℃,30 s,1 个循环;变性,95 ℃,5 s,退火温度60 ℃,31 s,40 个循环。每个样品各做3 个平行。目的基因的相对表达含量以β-肌动蛋白作为内参基因,以NC组回肠黏膜目的基因的表达为基准,使用ABI(applied biosystems)软件检测相关基因表达,用2-ΔΔCt方法计算各目的基因的相对表达量。
1.4 数据统计分 析
使用SPSS 20.0软件中的一般线性模型程序,采用双因素方差分析(Two-way ANOVA)法确定主因素(仔猪类型(piglet)和日粮类型(diet))及其互作效应的影响。当互作效应P<0.05时,采用单因素方差分析(Oneway ANOVA)、邓肯氏(Duncan)法检测组间差异,结果用平均值表示,P<0.05为差异显著,0.05<P<0.10为有提高或降低的趋势。
2 结果与分析
2.1 L亮氨酸对IUGR仔猪血清溶菌酶活力、C3和C4水平的影响由表3可知,与NBW仔猪相比,IUGR仔猪血清溶菌酶活力(仔猪类型P<0.05)和C3水平(互作效应

表 3 L-亮氨酸对IUGR仔猪血清溶菌酶活力、C3和C4水平的影响Table 3 Effect of L-leucine on lysozyme activity and C3 and C4 levels in the serum of IUGR piglets
P<0.05)显著降低,而C4水平变化不显著(互作效应
P<0.05)。在日粮中添加L-亮氨酸后,可使IUGR仔猪血清溶菌酶活力(日粮类型P<0.05)、C3和C4水平(互作效应P<0.05)均显著升高。另外,IUGR与L-亮氨酸对仔猪血清C3和C4水平的影响存在交互作用。
2.2 L-亮氨酸对IUGR仔猪小肠上皮间GC和IEL数量的影响
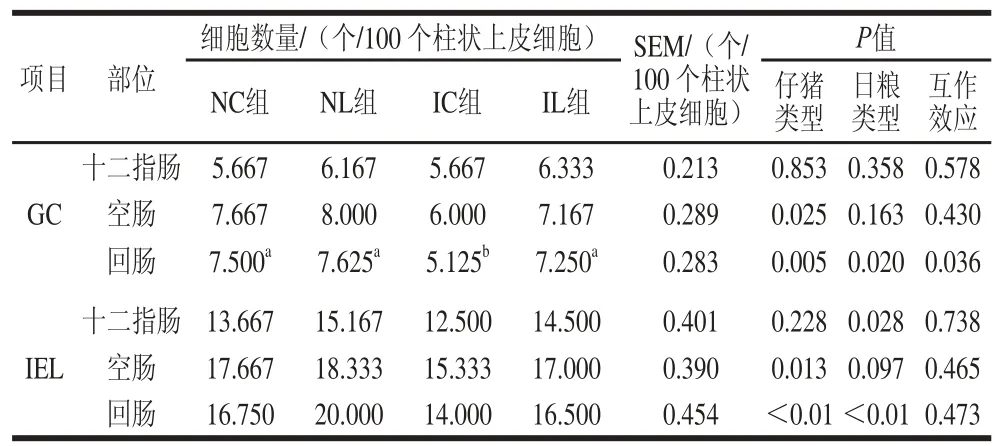
表 4 L-亮氨酸对IUGR仔猪小肠上皮间GC和IEL数量的影响Table 4 Effect of L-leucine on the number of GC and IEL in the small intestine of IUGR piglets
由表4可知,与NBW仔猪相比,IUGR仔猪空肠(仔猪类型P<0.05)和回肠(互作效应P<0.05)中GC数量显著减少,而十二指肠中GC数量变化不显著(仔猪类型P>0.05);在日粮中添加L-亮氨酸后,可使IUGR仔猪回肠中GC数量显著增加(互作效应P<0.05),而十二指肠和空肠中GC数量无显著变化(日粮类型P>0.05)。与NBW仔猪相比,IUGR仔猪空肠和回肠中IEL数量显著减少(仔猪类型P<0.05),但十二指肠中IEL数量变化不显著(仔猪类型P>0.05);在日粮中添加L-亮氨酸后,IUGR仔猪十二指肠和回肠中IEL数量显著增加(日粮类型P<0.05),且有增加空肠中IEL数量的趋势(日粮类型P=0.097)。另外,IUGR与L-亮氨酸对仔猪回肠中GC数量的影响存在交互作用。
2.3 L-亮氨酸对仔猪回肠黏膜中细胞因子含量的影响
由表5可知,与NBW仔猪相比,IUGR仔猪回肠中TNF-α含量显著升高(仔猪类型P<0.05),IL-2含量无显著变化(仔猪类型P>0.05),IL-10含量显著降低(仔猪类型P<0.05)。日粮添加L-亮氨酸后,IUGR仔猪回肠中TNF-α含量与未添加时有降低趋势(日粮类型P=0.051),IL-2含量无显著变化(日粮类型P>0.05),IL-10含量显著升高(日粮类型P<0.05)。另外,IUGR与L-亮氨酸对仔猪回肠黏膜中细胞因子含量的影响不存在交互作用。
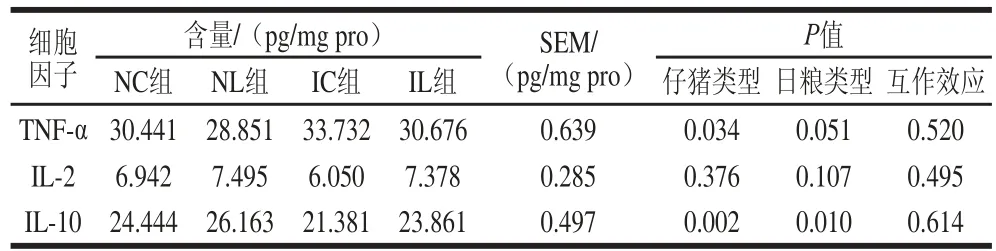
表 5 L-亮氨酸对IUGR仔猪回肠黏膜中细胞因子含量的影响Table 5 Effect of L-leucine on the contents of cytokines in the ileal mucosa of IUGR piglets
2.4 L-亮氨酸对IUGR仔猪回肠基因TNF-α、IL-2、IL-10 mRNA相对表达量的影响
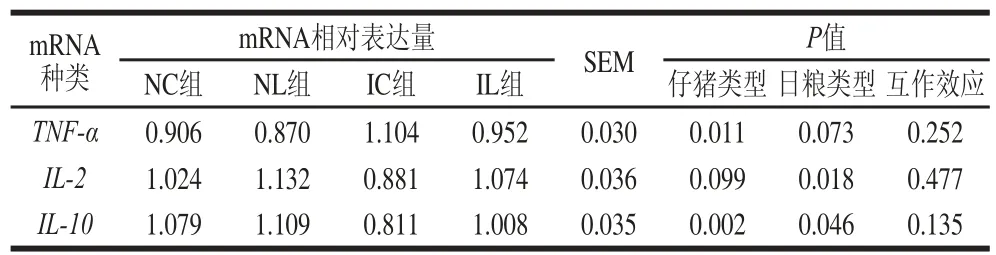
表 6 L-亮氨酸对IUGR仔猪回肠TNF-α、IL-2、IL-10 mRNA相对表达量的影响Table 6 Effect of L-leucine on the mRNA expression of TNF-α,IL-2 andIL-10 in the ileum of IUGR piglets
由表6可知,与NBW仔猪相比,IUGR仔猪回肠TNF-α mRNA相对表达量显著升高(仔猪类型P<0.05),IL-2 mRNA相对表达量有降低的趋势(仔猪类型P=0.099),IL-10 mRNA相对表达量显著降低(仔猪类型P<0.05)。在日粮中添加L-亮氨酸后,与IC组相比,IUGR仔猪回肠TNF-α mRNA相对表达量有下降的趋势(日粮类型P=0.073),IL-2和IL-10 mRNA相对表达量显著升高(日粮类型P<0.05)。另外,IUGR与L-亮氨酸对仔猪回肠免疫相关基因mRNA表达量的影响均不存在交互作用。
3 讨 论
IUGR可导致新生儿肠道发育和屏障功能受损,并影响整个机体的免疫状态和长期健康,许多研究者认为这种不利影响还会持续到生后甚至成年,并造成重大经济损失。目前对于IUGR的研究主要集中在IUGR的危害及预防措施上,通过开发有效的添加剂来提高食物中营养水平也是改善IUGR个体存活和健康的一条潜在途径。机体在出生后早期,细胞生长迅速并大量增殖[15],同时拥有较强的发育可塑性[16],亮氨酸作为机体的必需氨基酸,其在体内的代谢与蛋白质合成、能量代谢和免疫调节等过程密切相关[17-18],但目前有关亮氨酸作为食品添加剂对IUGR引起的肠道黏膜损伤和免疫功能影响的研究报道仍较少。
溶菌酶是正常机体的一种非特异性抗菌物质,能有效地水解细菌细胞壁的肽聚糖。C3和C4是体内补体系统的重要组成部分,参与机体的保护性免疫应答和自身稳定功能,协助抗体吞噬细胞或杀灭病原微生物,担负机体非特异性抗感染作用。本实验发现,受IUGR影响,35日龄仔猪血清溶菌酶活力和C3水平显著降低,这提示IUGR可能抑制了血液中的一些非特异性杀菌物质,减弱了清除病原微生物的能力。吴佳捷等[19]研究也发现IUGR患者血清C3、C4水平显著降低,这与本实验结果一致。由此可见,IUGR能抑制机体非特异性免疫应答,降低机体免疫能力。本实验发现在日粮补充L-亮氨酸后,IUGR仔猪血清溶菌酶活力、C3和C4水平均显著升高,说明L-亮氨酸作为食品添加剂可以改善IUGR仔猪的非特异性免疫功能。谷氨酰胺是亮氨酸的转氨基产物,刘婷婷等[20]研究表明,日粮中添加1%谷氨酰胺能显著提高断奶仔猪血清溶菌酶活力及免疫球蛋白、C3和C4水平,提示亮氨酸的代谢产物可能参与了免疫球蛋白的合成,并激活非特异性免疫系统,改善肠道内的微生态环境,减少体内有害物质的积累,从而增强机体免疫功能。包国强等[21]发现给术后胃肠道肿瘤患者注射支链氨基酸及谷氨酰胺,患者血清C3和C4水平显著提高,机体免疫功能也显著改善。
肠道黏膜免疫系统是肠道屏障的重要组成部分,与肠道黏膜上皮细胞相互作用,共同抵抗细菌、病毒等微生物的入侵,保护肠道健康[14]。分布在肠道黏膜上皮间的杯状细胞能合成和分泌糖蛋白,并在黏膜表面形成一层保护膜。肠道黏膜上皮淋巴细胞是病原微生物最先遇到的免疫细胞,其数量多少与肠道吞噬或杀灭病原微生物的能力有关[22-24]。本实验结果显示,IUGR仔猪空肠和回肠中GC和IEL数量均显著减少,这说明IUGR可导致肠道黏膜上皮免疫细胞凋亡增多,造成肠道黏膜的免疫屏障受损,Dong Li等[7]的研究也得出了类似的结果。在日粮中补充L-亮氨酸后,IUGR仔猪回肠中GC数量及十二指肠和空肠中IEL数量显著增加,提示亮氨酸能抑制肠道黏膜上皮中杯状细胞和淋巴细胞的凋亡,促进细胞的增殖,提高IUGR仔猪肠道的免疫功能。Calder[25]报道,支链氨基酸可以促进淋巴细胞内蛋白质、RNA和DNA的合成,并对维持其他免疫细胞的功能也起到重要作用。此外,激活的磷酸肌醇3-激酶(phosphoinositide 3-kinase,PI3K)信号可促进肠道黏膜细胞的增殖和修复[26],本实验中L-亮氨酸对肠道黏膜上皮免疫细胞的改善作用可能与其激活PI3K信号有关,但具体机制还有待研究。
在黏膜免疫系统中,细胞因子对体液免疫和细胞免疫都有重要的免疫学功能,其中TNF-α、IL-2、IL-10具有广泛的生物学活性。TNF-α是一种有效的促炎症细胞因子,在免疫系统中主要发挥诱导细胞凋亡的作用。IL-2可作用于T、B淋巴细胞、NK细胞和巨噬细胞等多种免疫细胞,对免疫应答具有广泛的上调作用。IL-10是典型的抗炎症与免疫抑制性细胞因子,主要生理功能是抑制巨噬细胞的抗原递呈功能和抑制多种促炎症细胞因子的产生。IUGR可以导致新生仔猪免疫缺陷,降低仔猪T、B淋巴细胞数量,阻碍T、B淋巴细胞的增殖及细胞因子的分泌[27]。Lindner等[28]研究发现早产胎儿体内细胞因子分泌会出现异常,且多数细胞因子在其转录水平会受到严格调控。本实验结果表明IUGR导致仔猪回肠中TNF-α含量显著升高,IL-10含量显著减少,并且mRNA的表达量发生相似的变化,这与Amu[29]、Raghupathy[30]等的研究结果相似。在日粮中添加L-亮氨酸后对IUGR引起的仔猪肠道免疫缺陷起到了一定的缓解作用,回肠中TNF-α含量降低,IL-10含量得到显著提高,并且mRNA的表达量也发生相似的变化。Simone等[31]在体外实验中发现,高浓度支链氨基酸处理的胶质细胞IL-10表达量增多,细胞吞噬能力提高。Jiang Weidan等[11]的研究表明亮氨酸主要通过抑制NF-κB,降低肠道TNF-α等促炎症细胞因子的基因表达,促进IL-10等抗炎症细胞因子的基因表达,从而缓解肠道炎症反应,这与本实验结果较符合。这些结果提示IUGR可能会从转录水平调控仔猪肠道黏膜细胞因子的分泌,而亮氨酸对IUGR仔猪肠道的免疫功能可能有一定的改善作用,具体作用机理有待进一步研究。
4 结 论
IUGR显著降低了仔猪血清中溶菌酶活力和C3水平,同时减少了肠道黏膜上皮内的免疫细胞数量,引起回肠中TNF-α含量显著升高,IL-10含量显著降低,而且细胞因子的mRNA表达量也发生相似的变化,对肠道免疫功能造成了一定的损伤。而日粮中添加0.35% L-亮氨酸后,IUGR仔猪上述指标均能得到一定程度的改善,与正常组仔猪相比无显著差异。结果表明:L-亮氨酸作为食品添加剂可能具有缓解IUGR引起的肠道黏膜损伤、改善超早期断奶仔猪肠道免疫功能的重要作用。
[1] WU G, BAZER F W, WALLACE J M, et al. Board-invited review: intrauterine growth retardation: implications for the animal sciences[J]. Journal of Animal Science, 2006, 84(9): 2316-2337. DOI:10.2527/ jas.2006-156.
[2] MICHEL C L, BONNET X. Influence of body condition on reproductive output in the guinea pig[J]. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 2012, 317(1): 24-31. DOI:10.1002/jez.714.
[3] GODFREY K M, BARKER D J. Fetal nutrition and adult disease[J]. American Journal of Clinical Nutrition, 2000, 71(Suppl 5): 224-225.
[4] ROSENBERG A. The IUGR newborn[J]. Seminars in Perinatology, 2008, 32(3): 219-224. DOI:10.1053/j.semperi.2007.11.003.
[5] LONGO S, BORGHESI A, TZIALLA C, et al. IUGR and infections[J]. Early Human Development, 2014, 90(Suppl 1): 42-44. DOI:10.1016/S0378-3782(14)70014-3.
[6] CONTRERAS Y M, XING Y, HALE M A, et al. Intrauterine growth restriction alters T-lymphocyte cell number and dual specificity phosphatase 1 levels in the thymus of newborn and juvenile rats[J]. Pediatric Research, 2011, 70(2): 123-129. DOI:10.1203/ PDR.0b013e31821f6e75.
[7] DONG Li, ZHONG Xiang, AHMAD H, et al. Intrauterine growth restriction impairs small intestinal mucosal immunity in neonatal piglets[J]. Journal of Histochemistry & Cytochemistry, 2014, 62(7): 510-518. DOI:10.1369/0022155414532655.
[8] PITMAN R S, BLUMBERG R S. First line of defense: the role of the intestinal epithelium as an active component of the mucosal immune system[J]. Journal of Gastroenterology, 2000, 35(11): 805-814. DOI:10.1007/s005350070017.
[9] LI H, XU M, LEE J, et al. Leucine supplementation increases SIRT1 expression and prevents mitochondrial dysfunction and metabolic disorders in high-fat diet-induced obese mice[J]. American Journal of Physiology Endocrinology and Metabolism, 2012, 303(10): 11-19. DOI:10.1152/ajpendo.00198.2012.
[10] XU Wen, BAI Kaiwen, HE Jintian, et al. Leucine improves growth performance of intrauterine growth retardation piglets by modifying gene and protein expression related to protein synthesis[J]. Nutrition, 2016, 32(1): 114-121. DOI:10.1016/j.nut.2015.07.003.
[11] JIANG Weidan, DENG Yuping, LIU Yang, et al. Dietary leucine regulates the intestinal immune status, immune-related signalling molecules and tight junction transcript abundance in grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2015, 444: 134-142. DOI:10.1016/j.aquaculture.2015.04.005.
[12] National Research Council. Nutrient requirement of swine[C]. 11th revised ed. Washington (DC): National Academy Press, 2012: 210-211.
[13] YIN Yulong, YAO Kang, LIU Zhaojin, et al. Supplementing L-leucine to a low-protein diet increases tissue protein synthesis in weanling pigs[J]. Amino Acids, 2010, 39(5): 1477-1486. DOI:10.1007/s00726-010-0612-5.
[14] 石玉祥, 闫金坤, 王雪敏. 枸杞多糖对小鼠肠道上皮内淋巴细胞和杯状细胞数量、分布及对IL-2水平影响[J]. 食品科学, 2011, 32(13): 318-320.
[15] WHITTEMORE C T, TULLIS J B, EMMANS G C. Protein growth in pigs[J]. Animal Production, 1988, 46(3): 462-462. DOI:10.1017/ S0003356100019048.
[16] GODFREY K M, GLUCKMAN P D, HANSON M A. Developmental origins of metabolic disease: life course and intergenerational perspectives[J]. Trends in Endocrinology & Metabolism, 2010, 21(4): 199-205. DOI:10.1016/j.tem.2009.12.008.
[17] PEDROSO J A B, NISHIMURA L S, MATOS-NETO E M D, et al. Leucine improves protein nutritional status and regulates hepatic lipid metabolism in calorie-restricted rats[J]. Cell Biochemistry and Function, 2014, 32(4): 326-332. DOI:10.1002/cbf.3017.
[18] KONASHI S, TAKAHASHI K, AKIBA Y. Effects of dietary essential amino acid defi ciencies on immunologic variables in broiler chickens[J]. British Journal of Nutrition, 2000, 83(4): 449-456.
[19] 吴佳捷, 曾文洁, 陈朝晖, 等. 抗心磷脂抗体与原因不明胎儿宫内生长迟缓的关系[J]. 湖南医科大学学报, 1999, 24(1): 65-67. DOI:10.3321/j.issn:1672-7347.1999.01.020.
[20] 刘婷婷, 张帅, 邓斐月, 等. 谷氨酰胺与丁酸梭菌对断奶仔猪生长性能、免疫功能、小肠形态和肠道菌群的影响[J]. 动物营养学报, 2011, 23(6): 998-1005. DOI:10.3969/j.issn.1006-267X.2011.06.017.
[21] 包国强, 李红梅, 何显力, 等. 富含支链氨基酸和谷氨酰胺的营养配方对贲门癌术后早期机体免疫功能的影响[J]. 现代肿瘤医学, 2007, 15(8): 1158-1161. DOI:10.3969/j.issn.1672-4992.2007.08.044.
[22] 顾宪红, 佘锐萍, 张宏福, 等. 断奶对仔猪肠上皮间淋巴细胞、杯状细胞数量的影响[J]. 畜牧兽医学报, 2003, 34(3): 232-238. DOI:10.3321/j.issn:0366-6964.2003.03.006.
[23] 杨玉荣, 佘锐萍, 张日俊, 等. 大豆生物活性肽对肉鸡肠道黏膜上皮内淋巴细胞和IgA+生成细胞的影响[J]. 中国预防兽医学报, 2006, 28(4): 412-415. DOI:10.3969/j.issn.1008-0589.2006.04.011.
[24] 张玉仙, 王文利, 陈耀星, 等. 不同浓度的大蒜溶液对小鼠小肠黏膜上皮内淋巴细胞和杯状细胞数量的影响[J]. 黑龙江畜牧兽医, 2009(11): 106-107. DOI:10.13881/j.cnki.hljxmsy.2009.11.053.
[25] CALDER P C. Branched-chain amino acids and immunity[J]. Journal of Nutrition, 2006, 136(Suppl 1): 288-293.
[26] SHENG H, SHAO J, TOWNSEND C M, et al. Phosphatidylinositol 3-kinase mediates proliferative signals in intestinal epithelial cells[J]. Gut, 2003, 52(10): 1472-1478. DOI:10.1136/gut.52.10.1472.
[27] 钟翔. Hsp70介导IUGR仔猪早期免疫功能损伤的机理及谷氨酰胺的营养调控研究[D]. 南京: 南京农业大学, 2010: 59-61.
[28] LINDNER U, TUTDIBI E, BINOT S, et al. Levels of cytokines in umbilical cord blood in small for gestational age preterm infants[J]. Klinische Pädiatrie, 2013, 225(2): 70-74. DOI:10.1055/s-0033-1334879.
[29] AMU S, HAHN-ZORIC M, MALIK A, et al. Cytokines in the placenta of Pakistani newborns with and without intrauterine growth retardation[J]. Pediatric Research, 2006, 59(2): 254-258. DOI:10.1203/01.pdr.0000196332.37565.7d.
[30] RAGHUPATHY R, AL-AZEMI M, AZIZIEH F. Intrauterine growth restriction: cytokine profiles of trophoblast antigen-stimulated maternal lymphocytes[J]. Clinical and Developmental Immunology, 2012, 2012(1): 579-590. DOI:10.1155/2012/734865.
[31] SIMONE R D, VISSICCHIO F, MINGARELLI C, et al. Branchedchain amino acids infi uence the immune properties of microglial cells and their responsiveness to pro-infi ammatory signals[J]. Biochimica et Biophysica Acta, 2013, 1832(5): 650-659. DOI:10.1016/ j.bbadis.2013.02.001.
Effect of Dietary L-Leucine Supplementation on Intestinal Immune Function in Ultra-Early Weaned Piglets with Intrauterine Growth Retardation
HUANG Qiang, XU Wen, HE Jintian, BAI Kaiwen, SU Weipeng, ZHOU Le, ZHANG Lili, WANG Tian*
(College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Objective: To ascertain the effect of dietary leucine supplementation on intestinal immune function in ultra-early weaned piglets suffering from intrauteri ne growth retardation (IUGR). Methods: Sixteen normal birth weight (NBW) piglets weaned at 14 days of age and sixteen IUGR newborn piglets were selected according to their birth weight. All the piglets were randomly divided into four groups with 8 replicates in each group, and fed control diet alone or supplemented with 0.35% L-leucine for 21 days, respectively. Results: Compared with NBW piglets, IUGR piglets showed signifi cantly lower lysozyme activity and complement-3 (C3) level in the serum (P < 0.05), a signifi cant reduction in the number of goblet cells (GC) and intraepithelial lymphocytes (IEL) in the jejunum and ileum (P < 0.05) and interleukin-10 (IL-10) content in the ileum, and a sign ifi cant increase intumor necrosis factor-α (TNF-α) c ontent in the ileum (P < 0.05). In addition, IUGR piglets had signifi cantly increased TNF-α mRNA expression but signifi cantly decreased IL-10 mRNA expression (P < 0.05). Dietary supplementation with 0.35% L-leucine signifi cantly increased lysozyme activity and the levels of C3 and C4 in the serum, the numbers of GC in the ileum and IEL in the duodenum and jejunum, IL-10 content in the ileum, and the mRNA expression of IL-2 and IL-10 in the ileum of IUGR piglets (P < 0.05). Conclusion: IUGR could induce intestinal mucosal infi ammatory response and hinder intestinal growth and development in early weaned piglets. L-Leucine could effectively alleviate intestinal mucosal injury caused by IUGR, and improve intestinal immune function in piglets.
L-leu cine; intrauterine growth retardation (IUGR); intestine; immune function; early weaned piglets
10.7506/spkx1002-6630-201717030
TS202.3
A
1002-6630(2017)17-0184-06
黄强, 徐稳, 何进田, 等. 日粮补充L-亮氨酸对超早期断奶宫内发育迟缓仔猪肠道免疫功能的影响[J]. 食品科学, 2017, 38(17): 184-189. DOI:10.7506/spkx1002-6630-201717030. http://www.spkx.net.cn
HUANG Qiang, XU Wen, HE Jintian, et al. Effect of dietary L-leucine su pplementation on intestinal immune function in ultra-early weaned piglets with intrauterine growth retardation[J]. Food Science, 2017, 38(17): 184-189. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717030. http://www.spkx.net.cn
2016-06-20
国家重点基础研究发展计划(973计划)项目(2012CB124703)
黄强(1991—),男,硕士研究生,研究方向为动物营养与饲料科学。E-mail:2014105070@njau.edu.cn *通信作者:王恬(1958—),男,教授,博士,研究方向为动物营养与饲料科学。E-mail:twang18@163.com

