吉西他滨联合替吉奥治疗晚期胰腺癌的疗效分析
程月鹃,孟长婷,邵亚娟,李宁宁,周 娜,阎小妍,高 鑫,周建凤,白春梅
1中国医学科学院 北京协和医学院 北京协和医院肿瘤内科,北京 1007302北京大学 临床研究所生物统计部,北京 1001913中国医学科学院 北京协和医学院 北京协和医院放射科,北京 100730
吉西他滨联合替吉奥治疗晚期胰腺癌的疗效分析
程月鹃1,孟长婷1,邵亚娟1,李宁宁1,周 娜1,阎小妍2,高 鑫3,周建凤1,白春梅1
1中国医学科学院 北京协和医学院 北京协和医院肿瘤内科,北京 1007302北京大学 临床研究所生物统计部,北京 1001913中国医学科学院 北京协和医学院 北京协和医院放射科,北京 100730
目的 探讨吉西他滨联合替吉奥治疗局部晚期和转移性胰腺导管腺癌的疗效和不良反应,以及可能影响患者生存的因素。方法 回顾性分析北京协和医院肿瘤内科2014年1月至2017年1月病理确诊并接受吉西他滨联合替吉奥方案(第1、8天吉西他滨1000 mg/m2静脉滴注30 min;第1~14天口服替吉奥40~60 mg/次,每日2次,每21天为1个周期)一线治疗的胰腺导管腺癌患者的临床资料,所有患者至少接受2周期化疗、有疗效评估和随访资料。结果 60例晚期胰腺癌患者纳入分析,疾病部分缓解13例(22%),稳定37例(61%),进展10例(17%),总体中位无进展生存期7个月(95%CI=6- 10),中位总生存期12个月(95%CI=9- 20)。单因素分析和多因素分析均显示原发灶切除对无进展生存期、肺转移对总生存期有显著影响。最常见3~4度不良反应为中性粒细胞减少(27%)、白细胞减少(18%)。结论 吉西他滨联合替吉奥方案一线治疗晚期胰腺癌有效率较高,不良反应易于管理。
晚期;胰腺癌;吉西他滨;替吉奥;疗效
胰腺导管腺癌是一种致死率高的恶性肿瘤。2012年全球肿瘤流行病统计数据显示,胰腺癌的发病率与死亡率接近[1]。吉西他滨在1997年成为治疗晚期胰腺癌的首选一线治疗药物[2],近年的临床研究显示,三药联合方案(FOLFIRINOX)[3]、两药联合方案(吉西他滨联合白蛋白结合型紫杉醇)与吉西他滨单药相比,可以提高治疗有效率,显著延长患者生存期,但不良反应发生率也明显增加,且治疗费用高昂,影响了上述方案在临床实践中的使用[4]。替吉奥胶囊是口服氟脲嘧啶类药物,临床应用方便,不良反应发生率低[5- 6]。对比替吉奥单药,吉西他滨单药和吉西他滨联合替吉奥治疗局部晚期和转移性胰腺癌的随机对照Ⅲ期临床研究(gemcitabine and S- 1 Trial,GEST)结果显示,吉西他滨联合替吉奥(gemcitabine and S- 1,GS)与吉西他滨单药相比,治疗晚期胰腺癌有效率与无进展生存期显著改善,但患者总生存期差异无统计学意义[7- 8]。此后数项Meta分析和汇总分析结果显示GS方案与单药吉西他滨相比,可以显著延长晚期胰腺癌患者总生存期,因此可以作为一线治疗的选择[9- 11]。本研究回顾性分析近3年在北京协和医院肿瘤内科一线接受GS方案治疗的患者的疗效与生存。
对象和方法
对象 2014年1月至2017年1月在北京协和医院肿瘤内科接受GS方案一线治疗的局部晚期、转移性胰腺癌患者。患者需经组织学或细胞学病理确诊为胰腺导管腺癌,无法手术治疗,既往未接受过系统治疗、放疗,或既往根治性手术后复发,辅助治疗结束至少6个月,有可测量病灶,美国东部肿瘤合作组(Eastern Cooperative Oncology Group,ECOG)[12]体力状况评分0~1分,接受至少2周期吉西他滨联合替吉奥方案治疗,具备疗效评估及随访资料。
治疗方案 第1、8天吉西他滨1000 mg/m2静脉滴注30 min;第1~14天替吉奥胶囊口服,每日2次,剂量根据体表面积确定:体表面积<1.25 m2,40 mg/次;1.25 m2≤体表面积<1.5 m2,50 mg/次;体表面积≥1.5 m2,60 mg/次。每21天为1个周期。每2个周期复查CT/核磁共振评价疗效。当出现病情进展时停止用药。联合治疗6~8周期后疾病稳定或缓解的患者可考虑吉西他滨或替吉奥单药维持治疗,局部晚期患者可根据病灶缓解情况接受手术或放疗。
客观有效率与生存期评价 治疗疗效根据RECIST 1.1版实体瘤疗效评价标准[13]分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、病情稳定(stable disease,SD)。影像学资料由放射科医生协助测量靶病灶,并评估疗效。无进展生存期(progression-free survival,PFS)为治疗开始至疾病进展时间,总生存期(overall survival,OS)为治疗开始至患者死亡时间。
不良反应 根据美国卫生及公共服务部国立卫生研究院与国家癌症研究所公布的常见不良反应事件评价标准(NCI CTCAE 4.0版)判定。
统计学处理 采用SAS 9.4统计分析软件处理数据。采用Kaplan-Meier 法绘制生存曲线。影响患者预后的因素可能包括:年龄、性别、肿瘤分期、原发灶部位、是否切除原发灶、是否发生肝转移、肺转移、腹膜转移、癌胚抗原和糖类抗原199水平以及ECOG体力状况评分,单因素分析通过log-rank检验进行生存期比较,多因素分析采用COX回归法,探索上述因素对于OS和PFS的影响。其中癌胚抗原按照是否在正常范围内分组,糖类抗原199按照是否大于1000 U/ml进行分组。初次回归将全部变量纳入回归模型,设置变量筛选方法为STEPWISE,引入和剔除变量的检验水准为0.1。
结 果
患者特征 共60例符合入选标准的患者纳入分析,其中男性36例(60%)、女性24例(40%),中位年龄61岁(34~76岁),ECOG体力状况评分0分24例(40%)、1分36例(60%),原发灶切除患者14例(23%)、未切除者46例(77%),原发灶在胰头颈部和体尾部分别为30例(50%),局部晚期19例(32%),转移性疾病41例(68%),转移部位包括肝(28例)、淋巴结(8例)、肺(7例)、腹膜(6例)、骨(4例)。
治疗情况 60例患者共接受325周期GS方案化疗,中位周期数为6(2~21)。5例患者接受吉西他滨维持治疗,13例患者接受替吉奥胶囊维持治疗,11例患者接受放疗,29例患者在病情进展后接受二线化疗,均为奥沙利铂为基础的方案。
疗效与生存分析 无CR病例,PR 13例(22%),SD 37例(61%),PD 10例(17%),客观有效率(CR+PR)22%,疾病控制率(CR+PR+SD)83%,靶病灶变化瀑布图显示超过半数(79%)患者靶病灶变小(图1)。至2017年2月,患者中位随访时间为10个月,其中38例死亡,49例出现疾病进展,总体中位PFS 7个月(95%CI=6- 10),中位OS 12个月(95%CI=9- 20),Kaplan-Meier生存曲线显示,局部晚期患者中位PFS 12个月(95%CI=6- 15),中位OS 13个月(95%CI=12- 27);转移性疾病患者中位PFS 6个月(95%CI=5- 10),中位OS 10个月(95%CI=8- 15)(图2、3)。单因素分析结果显示,原发灶切除对PFS、肺转移对OS有显著影响(表1)。多因素分析结果与单因素分析结果一致,原发灶切除患者PFS更短(HR=2.216,95%CI=1.076- 4.566,P=0.0309),肺转移患者OS更短(HR=2.922,95%CI=1.183- 7.218,P=0.0201)(表2)。
不良反应 最常见1~2度不良反应为中性粒细胞减少(40%),其次为白细胞减少(37%)、恶心/呕吐(33%),3~4度不良反应为中性粒细胞减少(27%)、白细胞减少(18%)、贫血(8%)、血小板下降(7%)、皮疹(2%)(表3)。

图 1 治疗后患者最佳疗效的靶病灶变化瀑布图
Fig 1 Waterfall plot illustrating patients’ best radiographic response of target lesions

OS:总生存期
OS:overall survival
图 2 患者总体OS
Fig 2 OS of all patients

PFS:无进展生存期
PFS:progression-free survival
图 3 患者总体PFS
Fig 3 PFS of all patients
讨 论
尽管手术是可能治愈胰腺癌的唯一手段,但只有15%~20%患者在诊断时可以接受手术治疗[14],目前局部晚期和转移性胰腺癌的治疗仍以化疗为主[15- 16]。
2007年在日本和台湾地区开展的GEST研究纳入834例局部晚期(24.3%)和转移性胰腺癌(75.7%)患者,接受吉西他滨、替吉奥胶囊或GS方案治疗。患者的客观有效率分别为13.3%、21%和29.3%,中位OS分别为8.8、9.7和9.9个月,中位PFS分别为4.1、3.8和5.7个月,尽管GS组与单药吉西他滨相比总生存差异无统计学意义(HR=0.88,97.5%CI=0.71- 1.08,P=0.15),但有效率和PFS与吉西他滨组相比有显著改善[7- 8]。
本研究GS方案有效率为22%,略低于GEST研究相同方案的有效率,原因之一可能为胰腺病灶通常形状不规则,与正常胰腺组织分界不清,测量困难,存在不同测量者评估结果的差异,导致有效率数值的差异。但本研究疾病控制率83%与GEST研究的84.7%[7]接近,且靶病灶变化瀑布图显示多数患者病灶有减小,表明多数患者可从治疗中获益。本研究的中位PFS(7个月)与OS(12个月)结果优于GEST研究,可能与局部晚期患者比例略高(32%)有关,通常认为局部晚期患者生存优于转移性疾病患者,且GEST研究亚组分析结果显示局部晚期患者可能从联合治疗方案获益更多[7]。尽管本研究局部晚期患者的PFS和OS较转移性疾病患者有延长,但差异无统计学意义,可能与样本量少有关。
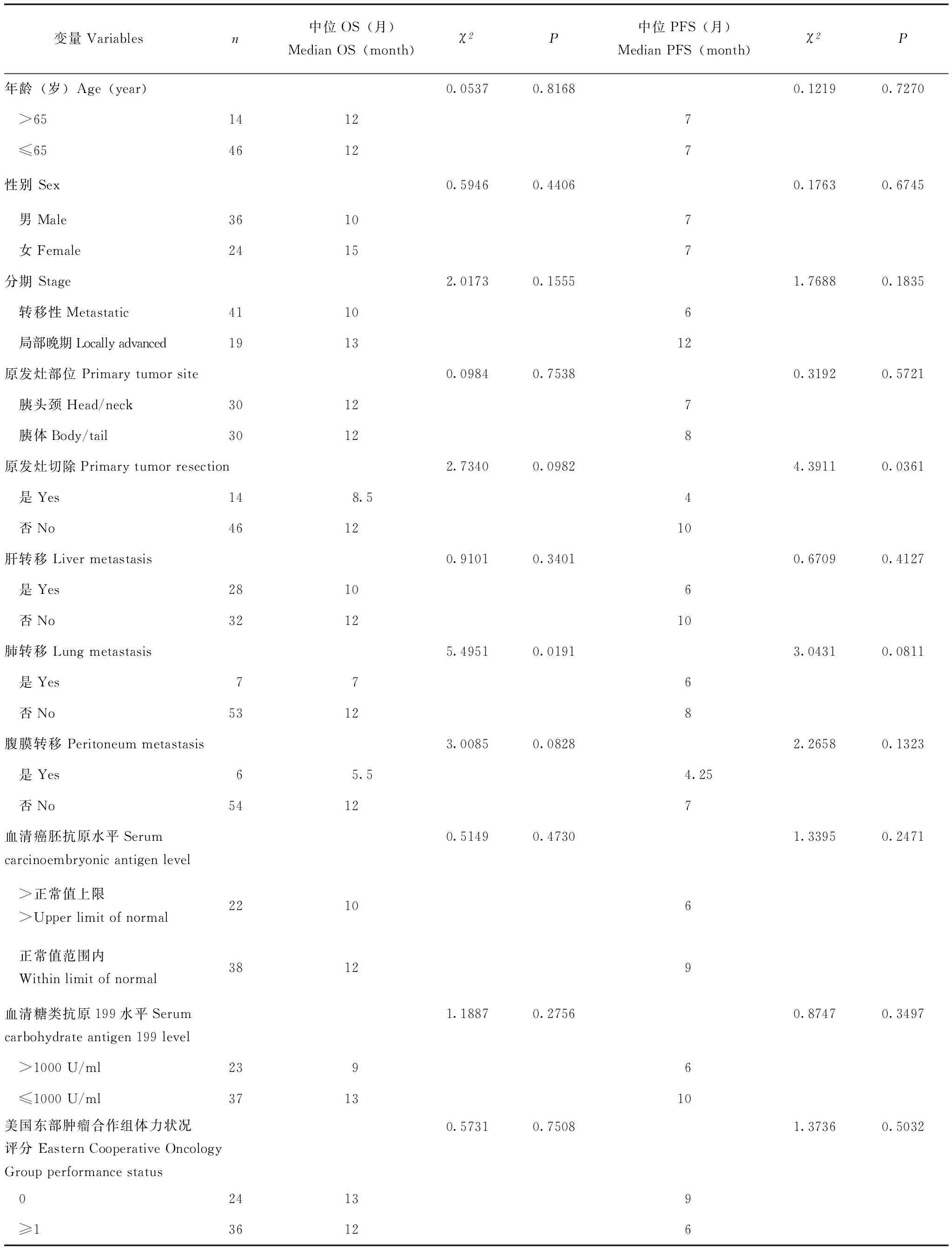
表 1 预后因素的单因素分析Table 1 Univariate analysis of prognostic factors

表 2 预后因素的多因素分析Table 2 Multivariate analysis of prognostic factors

表 3 吉西他滨联合替吉奥方案的不良反应[n(%)]Table 3 Adverse events of gemcitabine and S- 1 [n(%)]
晚期胰腺癌患者通常一般情况较弱,存在疼痛、进食减少与体重减轻等症状,选择方案时除考虑疗效外,还需兼顾患者对化疗方案的耐受与安全性。在欧美进行的两项临床研究中,FOLFIRINOX方案[3]及吉西他滨联合白蛋白结合型紫杉醇方案[4]与吉西他滨单药相比,均显著提高有效率和生存期。其中FOLFIRINOX方案治疗转移性胰腺癌有效率31.6%,PFS与OS分别为6.4和11.1个月,是目前疗效最佳的化疗方案,但该项研究3~4度中性粒细胞减少发生率为45.7%,中性粒细胞减少伴发热发生率为5.4%[3],影响了该方案在临床实践中的广泛使用。本研究转移性疾病患者的PFS与OS分别为6和10个月,尽管略逊于FOLFIRINOX方案[3]的生存结果,但3~4度不良反应发生率相对较低,3~4度中性粒细胞减少发生率为27%,无中性粒细胞减少伴发热出现,2例1~2度发热患者出现发热的原因均考虑与吉西他滨有关。
本研究进行的预后因素分析结果显示原发灶切除对PFS有不利影响,推测原因可能为原发灶切除的14例患者中,超过半数(8例)在术后8周内即出现病情进展,出现远处转移,提示该组患者疾病恶性程度高、进展迅速、预后差。胰腺癌最常见转移部位为肝脏,肺转移相对少见,本研究7例出现肺转移的患者中6例伴有其他部位如肝、腹膜后淋巴结、骨等转移,孤立肺转移者仅1例,转移广泛,可能造成该组患者OS较短。当然本研究样本量较小,也会影响对预后因素的分析。
本研究是目前国内报道的病例数较多的吉西他滨联合替吉奥一线治疗晚期胰腺癌的研究,结果显示吉西他滨联合替吉奥方案治疗晚期胰腺癌有效率高,不良反应可以耐受,安全性佳,与Ⅲ期临床研究结果一致,同时GS方案使用方便,可在临床实践中选择用于治疗晚期胰腺癌的一线治疗。
[1]Ferlay J,Soerjomataram I,Ervik M,et al. Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359- E386.
[2]Burris HA,Moore MJ,Andersen J,et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer:a randomized trial[J].J Clin Oncol,1997,15(6):2403- 2413.
[3]Conroy T,Desseigne F,Ychou M,et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer[J].N Engl J Med,2011,364(19):1817- 1825.
[4]Von Hoff DD,Ervin T,Arena FP,et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine[J].N Engl J Med,2013,369(18):1691- 1703.
[5]Shirasaka T,Shimamato Y,Ohshimo H,et al. Development of a novel form of an oral 5-Xuorouracil derivative(S- 1) directed to the potentiation of the tumor selective cytotoxicity of 5-Xuorouracil by two biochemical modulators[J].Anticancer Drugs,1996,7(5):548- 557.
[6]Takechi T,Nakano K,Uchida J,et al. Antitumor activity and low intestinal toxicity of S- 1,a new formulation of oral tegafur,in experimental tumor models in rats[J].Cancer Chemother Pharmacol,1997,39(3):205- 211.
[7]Ueno H,Ioka T,Ikeda M,et al. Randomized phase Ⅲ study of gemcitabine plus S- 1,S- 1 alone,or gemcitabine alone in patients with locally advanced and metastatic pancreatic cancer in Japan and Taiwan:GEST study[J].J Clin Oncol,2013,31(13):1640- 1648.
[8]Okusaka T,Miyakawa H,Fujii H,et al. Updated results from GEST study:a randomized,three-arm phase Ⅲ study for advanced pancreatic cancer[J].J Cancer Res Clin Oncol,2017,143(6):1053- 1059.
[9]Cao C,Kuang M,Xu W,et al. Gemcitabine plus S- 1:a hopeful frontline treatment for Asian patients with unresectable advanced pancreatic cancer[J].Jpn J Clin Oncol,2015,45(12):1122- 1130.
[10]Li D,Chen C,Zhou Y,et al. Gemcitabine compared with gemcitabine and S- 1 combination therapy in advanced pancreatic cancer:a systematic review and meta-analysis[J].Medicine(Baltimore),2015,94(35):e1345.
[11]Yanagimoto H,Ishii H,Nakai Y,et al. Improved survival with combined gemcitabine and S- 1 for locally advanced pancreatic cancer:pooled analysis of three randomized studies[J].J Hepatobiliary Pancreat Sci,2014,21(10):761- 766.
[12]Oken MM,Creech RH,Tormey DC,et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group[J].Am J Clin Oncol,1982,5(6):649- 655.
[13]Eisenhauer EA,Therasse P,Bogaerts J,et al. New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1) [J].Eur J Cancer,2009,45(2):228- 247.
[14]Mancuso A,Calabrò F,Sternberg CN.Current therapies and advances in the treatment of pancreatic cancer[J].Crit Rev Oncol Hematol,2006,58(3):231- 241.
[15]Moore MJ,Goldstein D,Hamm J,et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer:a phase Ⅲ trial of the National Cancer Institute of Canada Clinical Trials Group[J].J Clin Oncol,2007,25(15):1960- 1966.
[16]Miksad RA,Schnipper L,Goldstein M.Does a statistically significant survival benefit of erlotinib plus gemcitabine for advanced pancreatic cancer translate into clinical significance and value? [J].J Clin Oncol,2007,25(28):4506- 4507(author reply 4508).
Efficacy of Gemcitabine and S- 1 for Patients with Advanced Pancreatic Cancer
CHENG Yuejuan1,MENG Changting1,SHAO Yajuan1,LI Ningning1,ZHOU Na1,YAN Xiaoyan2,GAO Xin3,ZHOU Jianfeng1,BAI Chunmei1
1Department of Medical Oncology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China2Department of Biostatistics,Peking University Clinical Research Institute,Beijing 100191,China3Department of Radiology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
ZHOU Jianfeng Tel:010- 88068720,E-mail:ZhouJF@pumch.cn
Objective To explore the efficacy and toxicities of gemcitabine combined with S- 1 in treating locally advanced and metastatic pancreatic ductal adenocarcinoma and prognostic factors.Methods We retrospectively analyzed the clinical data of patients with locally advanced and metastatic pancreatic cancer receiving gemcitabine and S- 1 as first-line therapy in the Department of Medical Oncology,Peking Union Medical College Hospital from January 2014 to January 2017.Gemcitabine was administered at a dose of 1000 mg/m2over 30 min-utes on days 1 and 8,and oral S- 1 at a dose of 40- 60 mg twice daily from days 1 to 14,repeated every 3 weeks.All patients received at least two cycles of chemotherapy.Results A total of 60 patients were included,13(22%) achieved partial remission,37(61%) had stable disease,and 10(17%) experienced progressive disease.The median progression- free survival was 7 months(95%CI=6- 10 months) and the median overall survival was 12 months(95%CI=9- 20 months).Both univariate and multivariate analyses of prognostic factors showed primary resection was significant in predicting shorter progression- free survival and lung metastasis was significant for shorter overall survival.The most common grade 3- 4 toxicities were neutropenia(27%) and leukopenia(18%).Conclusion Gemcitabine combined with S- 1 is an effective regimen with manageable toxicities in the treatment of advanced pancreatic cancer and can be used as first-line therapy.
advanced;pancreatic cancer;gemcitabine;S- 1;efficacy
562-567
周建凤 电话:010- 88068720,电子邮件:ZhouJF@pumch.cn
R735.9
A
1000- 503X(2017)04- 0562- 06
10.3881/j.issn.1000- 503X.2017.04.016
2017- 04- 05)
——中国居民收入分配中的逆向调节机制

