灵芝制剂治疗APP/PS- 1阿尔茨海默病转基因小鼠模型的病理学改变
秦 川,吴善球,陈保生,吴小闲,屈焜耀,刘军民,张桂芳,徐艳峰,舒顺利,孙丽华,李彦红,朱 华,黃 澜,马春梅,徐玉环,韩云林,卢耀增
1中国医学科学院医学实验动物研究所 北京协和医学院比较医学中心,北京 1000212美善堂生物科技(深圳)有限公司,深圳 5180003中国医学科学院 北京协和医学院 基础医学研究所生物化学与分子生物学系,北京 1000054广州中医药大学中药学院,广州 510006
灵芝制剂治疗APP/PS- 1阿尔茨海默病转基因小鼠模型的病理学改变
秦 川1,吴善球2,陈保生3,吴小闲1,屈焜耀2,刘军民4,张桂芳4,徐艳峰1,舒顺利2,孙丽华1,李彦红1,朱 华1,黃 澜1,马春梅1,徐玉环1,韩云林1,卢耀增1
1中国医学科学院医学实验动物研究所 北京协和医学院比较医学中心,北京 1000212美善堂生物科技(深圳)有限公司,深圳 5180003中国医学科学院 北京协和医学院 基础医学研究所生物化学与分子生物学系,北京 1000054广州中医药大学中药学院,广州 510006
目的 探讨灵芝制剂对APP/PS- 1转基因阿尔茨海默病(AD)小鼠的病理学改变。方法 选用4月龄APP/PS- 1转基因小鼠,分为AD模型组、灵芝高剂量[2250 mg/(kg·d)]组和灵芝中剂量[750 mg/(kg·d)]组,阳性对照组用盐酸多奈哌齐药物[2 mg/(kg·d)],正常组选用C57BL/6J野生鼠。动物给药4个月后解剖观察组织病理,应用苏木素-伊红(HE)染色、免疫组织化学、特殊染色及电子显微镜超微结构观察并比较各组组织病理形态及结构差异。结果 病理形态学改变:灵芝制剂组小鼠脑内老年斑降解、减少或消失;神经元纤维缠结减少或消失;淀粉样蛋白血管病明显减少;海马和齿状核的幼稚神经细胞数量比AD模型组显著增多(海马:F=1.738,P=0.016;齿状核:F=1.924,P=0.026);灵芝制剂高、中剂量组小鼠小脑浦肯野细胞较模型组丢失少(F=9.46,P=0.007;F=9.46,P=0.010);灵芝制剂组DCX免疫组织化学染色阳性显示小脑神经干细胞出现早而且数量多。电镜观察灵芝制剂组小鼠海马神经细胞较AD模型小鼠完整,核膜完好,胞质内的线粒体、内质网、高尔基体、微管结构、突触完整。小胶质细胞无异常。灵芝制剂治疗组小鼠在整个实验中未见到细胞和组织学的毒性表现。结论 灵芝制剂可使AD小鼠脑内老年斑和神经元纤维缠结降解、减少或消失及淀粉样蛋白血管病变减少。
灵芝制剂;阿尔茨海默病;老年斑;神经元纤维缠结;神经干细胞
阿尔茨海默病(Alzheimer’s disease,AD)是1906年德国病理学家Alois Alzheimer通过尸检发现死者大脑皮层小血管布满脂肪沉积物,脑内亦可见坏死的脑细胞及异常沉积物,1910年将该病命名为阿尔茨海默病。随着时代的进展,世界各国老年人不断增加,AD的发病率也不断上升,仅美国2005年就有450万AD患者[1]。2010年我国AD患病人数已超过568万,跃居世界第1位[1]。AD的致残率和致死率居肿瘤和心脑血管病之后列第3位。有研究显示,灵芝制剂具有保护神经细胞并提高机体免疫功能的作用[2]。本研究主要观察灵芝制剂对AD转基因小鼠(APP/PS- 1)病理学改变的影响。
材料和方法
实验动物及分组 APP/Ps1delta E 9(APP/PS- 1)双转基因阿尔茨海默病小鼠模型,由中国医学科学院医学实验动物研究所遗传中心提供[3]。动物分组情况:正常组为C57BL/6J野生鼠10只(雌4只、雄6只);APP/PS- 1双转基因小鼠44只,分为AD模型组11只(雌4只、雄7只);灵芝高剂量组11只(雌3只、雄8只),灵芝孢子粉和灵芝孢子油每日各2250 mg/kg;灵芝中剂量组11只(雌4只、雄7只),灵芝孢子粉和灵芝孢子油每日各750 mg/kg,其中灵芝孢子油软胶囊和灵芝孢子粉胶囊由美善堂生物科技(深圳)有限公司提供;阳性对照盐酸多奈哌齐组11只(雌4只、雄7只),每日2 mg/kg盐酸多奈哌齐[安理申,卫材(中国)药业有限公司制造]。给药途径为将药物加入饲料给药,给药4个月。各组动物为4月龄小鼠,体重平均30 g,清洁级动物房饲养[设施合格证SYXK(京)2011- 0022],饲料购自军事医学科学院实验动物中心[合格证SCXK- (军) 2007- 005],动物自由进食。
病理检测 小鼠断颈处死后取脑组织,10%中性福尔马林溶液固定,常规脱水,透明、石蜡包埋,切片染色。(1)常规HE染色[4];(2)脑特殊染色:Bielschowsky神经纤维染色[4]、Masson 三色染色[4];(3)免疫组织化学染色[5]:神经干细胞DCX(MD5089- 050,MDL)、老年斑4G8(SIG- 39220,Covance)(选择小鼠大脑具有代表性且含神经核团较多的3个冠状切面进行老年斑的统计分析)。冠状切面根据Paxinos和Franklin[6]合著《小鼠脑立体坐标》中第27、47和52页切面图进行计算。大脑冠状切面:(1)前脑,切面含扣带回、纹状体、伏隔核、苍白球、皮层视区、梨状核等;(2)在海马上端的最大面切面,含顶叶皮层、丘脑、海马、齿状核、下丘脑、梨形核、杏仁核等;(3)在脑室最后,也是大脑皮层最后,切面含后顶叶皮层、梨形核、杏仁核、顶蓋核、丘脑、黒质、乳头核等。
电子显微镜标本制作 动物处死后,快速取出脑组织,在解剖镜下取海马CA1~CA2区组织,在2.5%戊二醛磷酸缓冲液中固定,2%锇酸后固定,环氧树脂包埋,超薄切片机切出超薄切片,枸橼酸铅和醋酸双氧铀双重染色,透射电子显微镜(HITACHI- 7650,北京交通大学协助)观察。
统计学处理 图像采用Image-pro plus软件进行图像结果分析,数据经Microsoft Excel处理,数据用均数±标准差表示,统计处理软件用SPSS 19.0,多组数据间的比较在符合正态分布时采用单因素方差分析(One-way ANOVA),不符合正态分布时采用非参数检验(Kruskal-Wallis)和(Mann-Whitney U)法,正态分布检验根据偏度系数和峰度系数,P<0.05为差异有统计学意义。
结 果
病理形态表现
老年斑:形态学显示老年斑色泽较浅,斑体积小,有些则浓缩成斑点状。AD模型组小鼠老年斑在大脑内的分布基本上在大脑边缘系统和基底神经节,服灵芝制剂后小鼠的老年斑在大脑、小脑内的分布和数量上(数量单位:斑)有所改变(图1)。大脑冠状第1切面灵芝高剂量组(8.00±0.96)、灵芝中剂量组组(8.50±0.87)和盐酸多奈哌齐治疗组(14.00±2.17)小鼠老年斑数量均显著低于AD模型组(31.38±3.57)(Chi-Square=12.985,P=0.000,P=0.000,P=0.015),大脑冠状第2切面灵芝高剂量组(23.55±2.89)和灵芝中剂量组(18.25±1.56)小鼠老年斑数量均显著低于AD模型组(40.65±4.13)(Z=-2.021,P=0.043;Z=-2.309,P=0.021),AD模型组与盐酸多奈哌齐治疗组(29.25±4.23)相比差异无统计学意义。大脑冠状第3切面灵芝高剂量组(19.00±2.16)和灵芝中剂量组(9.25±1.05)小鼠老年斑数量显著低于AD模型组(39.50±5.12)(Z=-2.021,P=0.043;Z=-2.323,P=0.020)。AD模型组与盐酸多奈哌齐治疗组(24.75±4.21)相比,差异无统计学意义(图2)。正常组小鼠到一定年龄后(8个月龄)脑内也会出现老年斑。
神经元纤维缠结:Bielschowsky银染显示一般神经元纤维缠结最初形成少量前纤维缠结,后转变成大量的神经元纤维缠结,最后有些发展成鬼样神经元纤维缠结。AD模型组小鼠神经细胞内有大量的神经元纤维缠结和部分鬼样神经元纤维缠结,灵芝高剂量和灵芝中剂量组则多处于前纤维缠结和少量神经元纤维缠结,盐酸多奈哌齐治疗组小鼠多为神经元纤维缠结和鬼样缠结(图3)。在小鼠脑的3个冠状切面统计(数据近似正态分布)显示,灵芝高剂量组(1.071±0.30)、灵芝中剂量组(0.917±0.07)小鼠纤维缠结显著少于AD模型组(2.286±0.40)(F=4.12,P=0.013,P=0.011)。盐酸多奈哌齐治疗组纤维缠结(1.500±0.37)与AD模型组小鼠比较差别无统计学意义(图4)。
类淀粉蛋白血管病:在AD模型组小鼠Bielschowsky银染切片中可见到银染的微血管壁收缩、血流受阻、内皮和外皮细胞肿大或固缩,而灵芝高剂量和灵芝中剂量组小鼠切片只偶见个别类淀粉蛋白血管病变(图5)。
海马和齿状核幼稚神经细胞的数量和分化成神经细胞的比较:灵芝高剂量和灵芝中剂量组小鼠的海马端侧、齿状核的基底层出现一些幼稚神经细胞、胞核和胞质尚未分化,其中也有一些分化成为神经细胞。灵芝中剂量组幼稚神经细胞数量(个)(数据近似正态分布)(海马:2.2±0.34;齿状核:1.5±0.13)明显多于AD模型组(海马:1.2±0.25;齿状核:0.7±0.11)(海马:F=1.738,P=0.016;齿状核:F=1.924,P=0.026)(图6)。5组的海马和齿状核幼稚神经细胞胞质和核质的分化不同,AD模型组小鼠的幼稚神经细胞核质少,大小不等的碎片或细丝网状,部分核质逸出细胞外,细胞趋向溶解、消失。而灵芝高剂量和灵芝中剂量组小鼠幼稚神经细胞核质形成网状,核膜、染色质、核仁逐渐分化形成神经细胞。盐酸多奈哌齐治疗组小鼠幼稚神经细胞与AD模型组相似。
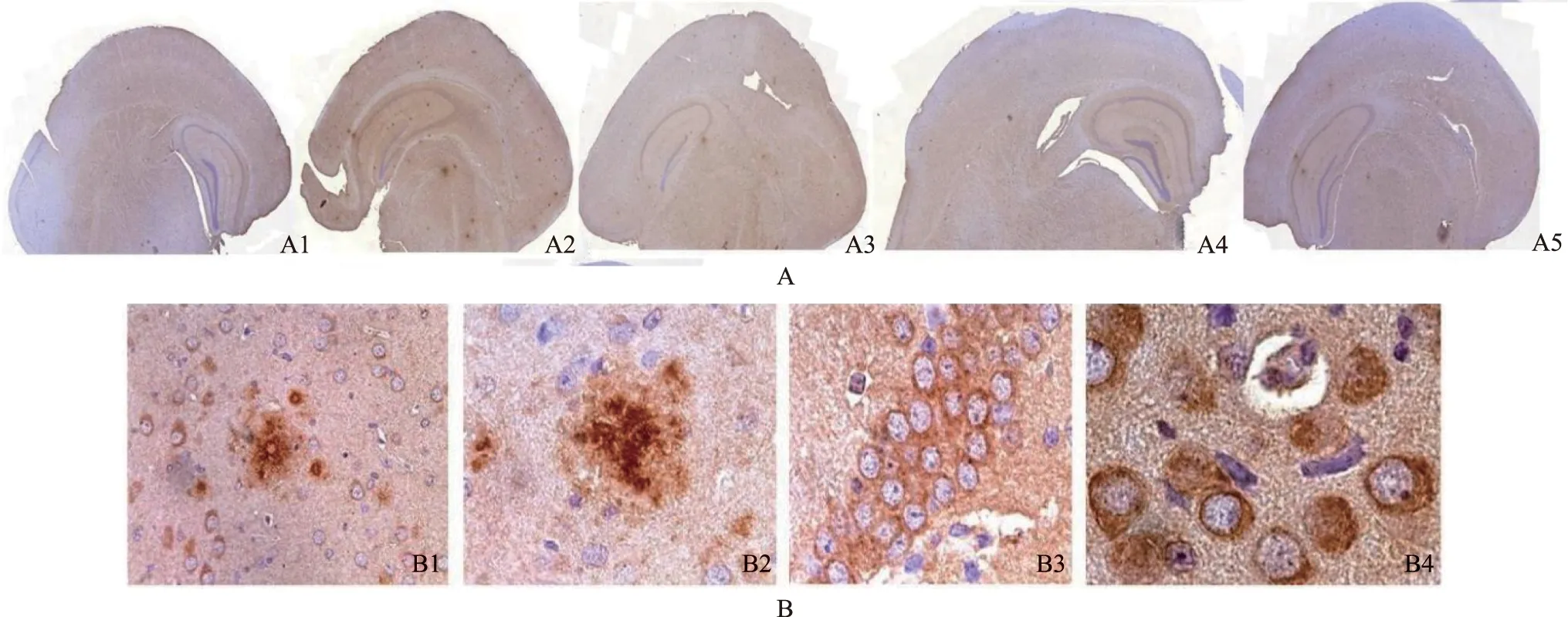
AD:阿尔茨海默病;LZ-H:灵芝高剂量;LZ-M:灵芝中剂量
AD:Alzheimer’s disease;LZ-H:high dose of Lingzhi;LZ-M:middle dose of Lingzhi
A.脑老年斑(冠状第2切面)4G8染色(×20):A1.正常组小鼠脑内未见老年斑;A2.AD模型组小鼠在海马、齿状核及丘脑可见大小形态不等的黄色老年斑;A3.LZ-H组小鼠仅在海马C4、丘脑、顶叶皮层散在小的老年斑;A4.LZ-M组小鼠仅在齿状核旁有少量老年斑;A5.盐酸多奈哌齐组在顶叶皮层、海马、齿状核和丘脑处可见老年斑;B.老年斑的各种形态4G8染色(×1000):B1.单纯老年斑,由核心向周围扩大,如水滴;B2.复合老年斑,由中心向周围扩大,内有呈放射状的纤维条索状物;B3.淀粉样蛋白沉积于神经细胞周围;B4.淀粉样蛋白沉积于细胞胞质和神经细胞核内,神经细胞濒临死亡
A.senile plaques in brain,the second coronal section of brain 4G8 stain(×20):A1.the normal mouse showed no senile plaques in brain;A2.the hippocampus,dentate nucleus and thalamus of AD model group showed yellow senile plaques of different sizes and shapes;A3.the small senile plaques were observed in hippocampus C4,thalamus,and parietal cortex in LZ-H group;A4.only a few senile plaques appeared around the dentate nucleus in LZ-M group;A5.senile plaques deposition was seen in the parietal cortex,hippocampus,dentate nucleus and thalamus of mice in donepezil hydrochloride group;B.morphological appearance of senile plaques 4G8 stain(×1000):B1.single senile plague,which looks like a drop of water spreading to the periphery;B2.a complicated senile plaque,in which a center radiated to the periphery and consisted of broken fibers;B3.amyloid infiltrated and encapsulated the neurons;B4.amyloid appeared in the cytoplasma and intranucleus,and the neurons were going to death
图 1 小鼠脑内老年斑(4G8免疫组织化学染色)
Fig 1 Senile plaques in the brains of mice(4G8 immunohistochemical staining)
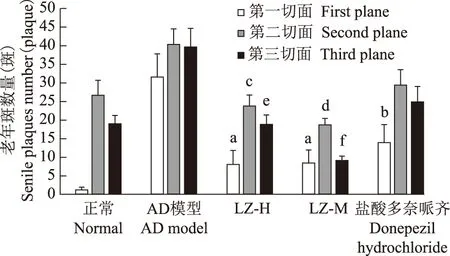
与AD模型组比较,aP=0.000,bP=0.015,cP=0.043,dP=0.021,eP=0.043,fP=0.020
aP=0.000,bP=0.015,cP=0.043,dP=0.021,eP=0.043,fP=0.020 compared with AD model group
图 2 脑切面老年斑数量
Fig 2 The number of senile plaques in brain sections

A.正常组小鼠海马区的神经细胞,未见神经元纤维缠结;B.AD模型组小鼠海马神经细胞核内多量神经元纤维缠结,部分靠近核膜;C.LZ-H组神经细胞胞质内可见少量神经纤维;D.LZ-M组小鼠海马区神经细胞核仅见点状神经纤维;E.盐酸多奈哌齐治疗组小鼠海马区神经细胞内可见神经元纤维缠结,呈圈状及鬼样缠结
A.there was no neurofibrillary tangles in hippocampus of normal mouse;B.many neurofibrillary tangles existed in hippocampal nucleus of AD model group mouse;C.there were a few nervous fibers in the cytoplasm of neurones of LZ-H group mouse;D.only a few neural fibers appeared in hippocampal nucleus of LZ-M group mouse;E.the hippocampal neurones of donepezil hydrochloride group mouse showed a ring-shaped and ghost neurofibrillary tangles
图 3 海马区神经元纤维缠结Bielschowsky染色(×1000)
Fig 3 Neurofibrillar tangles in hippocampal area(Bielschowsky staining,×1000)

与AD模型组比较,aP=0.013,bP=0.011
aP=0.013,bP=0.011 compared with AD model group
图 4 脑切面海马神经元纤维缠结数量的比较
Fig 4 Comparison of the numbers of neurofibrillary tangles in hippocampus of brain sections
小脑浦肯野细胞的丢失和神经干细胞的新生:AD模型小鼠(42.0±3.6)小脑浦肯野神经细胞的缺失比灵芝高剂量组(27.4±5.84)(F=9.46,P=0.007)、灵芝中剂量组(28.6±7.28)(F=9.46,P=0.010)和盐酸多奈哌齐治疗组(32.4±4.24)(F=9.46,P=0.044) 明显增多(图7)。在灵芝高剂量和灵芝中剂量组小鼠小脑切片上出现不同时相的浦肯野神经细胞,其中成长的神经细胞多,胞体积大核团大。小脑DCX组化染色显示在灵芝中剂量和灵芝高剂量组可见成排的新兴的浦肯野细胞和密集黄棕色的棘突,表明存在神经干细胞的出现(图8)。
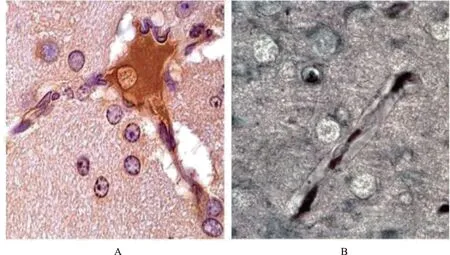
A.毛细血管紧闭,内皮细胞和外皮细胞固缩,管内血液储留;B.毛细血管内皮细胞变性、固缩,血管内膜闭合,外膜有少量液体淤积
A.capillary closure,pyknosis of endothelial cells and periocytes,and retention of blood in intra vessel space;B.degeneration and pyknosis of capillary endothelial cells and the adhesion of intima,the outer membrane of capillary infiltrated with a few of liquid
图 5 类蛋白血管病(免疫组织化学和嗜银染色,×1000)
Fig 5 Amyloid angiopathy(immunohistochemical and Bielschowsky staining,×1000)

与AD模型组比较,aP=0.012,bP=0.016,cP=0.031,dP=0.026
aP=0.012,bP=0.016,cP=0.031,dP=0.026 compared with AD model group
图 6 海马(A)和齿状核(B)幼稚神经细胞核质分化数量的比较
Fig 6 Comparison of karyoplasma differentiation appeared in immature neurons in hippocampus(A) and dentate nucleus(B)
电镜检查海马组织超微结构的变化 电镜观察各组小鼠超微结构显示正常对照组小鼠海马神经元细胞无异常。AD模型组小鼠海马组织内可见萎缩的神经元,细胞体积缩小,细胞核轮廓不清,染色质边集,核仁消失,胞浆浓缩。部分神经元变性,细胞表面呈现复杂的质膜内褶,胞浆内可见大量脂滴和脂褐素沉积,细胞核边缘皱褶,染色质均匀化。核周隙增宽,核膜局部断裂崩解,染色质边集。胞浆内线粒体病变明显,部分线粒体体积增大、变形、局部崩解、基质肿胀、嵴肿胀溶解。可见线粒体内包涵物。内质网扩张,高尔基体变形。神经纤维内微管解聚。线粒体肿胀,轮廓模糊,嵴溶解。断裂突触肿胀,突触小泡减少,突触内线粒体变形,线粒体肿胀及溶解。可见大量变性的神经突,早期可见浓缩的轴浆、变性的线粒体、自噬空泡和电子密度不等的膜包颗粒。小胶质细胞内可见吞噬的淀粉样物质,部分胶质细胞固缩。灵芝中剂量和灵芝高剂量组小鼠海马组织内大部分神经元结构完整,形态清晰。细胞核内可见少量异染色质,核仁清楚,核膜完整。胞浆内线粒体形态改善,轮廓清楚,线粒体嵴结构清晰,无明显肿胀。高尔基体、内质网等细胞器结构较完整,脂褐素沉积减少。神经纤维内微管结构较清晰。突触结构较完整,可见多量突触小泡。未见变性的神经突。灵芝高剂量组小胶质细胞形态基本正常,未见吞噬淀粉样物质。灵芝中剂量组少数小胶质细胞固缩。盐酸多奈哌齐治疗组海马组织内仍可见萎缩及变性的神经元,细胞表面可见明显的质膜内褶,细胞核轮廓不清,染色质均质化。核膜局部崩解,轮廓不清。部分线粒体肿胀、变形、嵴溶解。胞浆内可见较多脂褐素沉积。神经纤维内微管结构较清晰。突触结构较完整,可见多量突触小泡。小胶质细胞内可见大量脂褐素沉积,大部分小胶质细胞固缩(图9)。

与AD模型组比较,aP=0.002,bP=0.007,cP=0.010,dP=0.044
aP=0.002,bP=0.007,cP=0.010,dP=0.044 compared with AD model group
图 7 小脑浦肯野神经细胞丢失比较
Fig 7 Comparison of Purkinje cell loss in cerebellum of mice

A.正常组:多量的浦肯野细胞和树突着棕黄色;B.AD模型组:浦肯野细胞和树突比较少;C.LZ-H组:多量的幼龄浦肯野细胞和树突;D.LZ-M组:多量的幼龄浦肯野细胞和树突;E.盐酸多奈哌齐组:少量的浦肯野细胞和树突
A.normal group had a large number of Purkinje’s cells and apical dendrites brown-yellow in color;B.AD model group had a large number of Purkinje’s cells and apical dendrites brown-yellow in color;C.LZ-H group had a large number of Purkinje’s cells and apical dendrites brown-yellow in color;D.LZ-M group had a large number of Purkinje’s cells and apical dendrites brown-yellow in color;E.donepezil hydrochloride group had a few of Purkinje’s cells and apical dendrites brown-yellow in color
图 8 小脑神经干细胞分化(微管相关蛋白免疫组织化学染色,×400)
Fig 8 Differentiation of cerebellum neural stem cells(microtubule-associated protein immunohistochemical staining,×400)

A.正常组小鼠海马神经细胞;B.正常组小鼠神经细胞的核膜和细胞器;C.正常组小鼠的神经纤维;D.正常组小鼠的突触;E.正常组小鼠小神经胶质细胞;F.AD模型组小鼠海马神经细胞萎缩;G.AD模型组小鼠神经细胞核膜和细胞器;H.AD模型组小鼠神经纤维;I.AD模型组小鼠突触;J.AD模型组小鼠小神经胶质细胞;K.LZ-M组小鼠海马神经细胞;L.LZ-M组小鼠神经细胞的核膜和细胞器;M.LZ-M组小鼠神经纤维;N.LZ-M组小鼠突触;O.LZ-M组小鼠小神经胶质细胞;P.LZ-H组小鼠海马神经细胞;Q.LZ-H组小鼠神经细胞的核膜和细胞器;R.LZ-H组小鼠神经纤维;S.LZ-H组小鼠突触;T.LZ-H组小鼠小神经胶质细胞;U.盐酸多奈哌齐组小鼠海马神经细胞萎缩;V.盐酸多奈哌齐组小鼠神经细胞核膜和细胞器;W.盐酸多奈哌齐组小鼠神经纤维;X.盐酸多奈哌齐组小鼠突触;Y.盐酸多奈哌齐组小鼠小神经胶质细胞轻度萎缩
A.hippocampus neurons in normal group mouse;B.the nuclear membranes and organelles of neurons in the normal group mouse;C.the nerve fibers in normal group mouse;D.the synapses in normal group mouse;E.the microglia in normal group mouse;F.the atrophic neurons in the hippocampus of AD model group mouse;G.the nuclear membranes and organelles of neurons in the AD model group mouse;H.the nerve fibers in AD model group mouse;I.the synapses in AD model group mouse;J.the microglia in AD model group mouse;K.hippocampus neurons in LZ-M group mouse;L.the nuclear membranes and organelles of neurons in LZ-M group mouse;M.the nerve fibers in LZ-M group mouse;N.the synapses in LZ-M group mouse;O.the microglia in LZ-M group showed mild pyknosis;P.the hippocampus neurons in LZ-H group mouse;Q.the nuclear membranes and organelles of neurons in LZ-H group mouse;R.the nerve fibers in LZ-H group mouse;S.the synapses in LZ-H group mouse;T.the microglia in LZ-H group mouse;U.the atrophic neurons in the hippocampus of the donepezil hydrochloride group mouse;V.the nuclear membranes and organelles of neurons in the donepezil hydrochloride group mouse;W.the nerve fibers in donepezil hydrochloride group mouse;X.the synapses in donepezil hydrochloride group mouse;Y.the microglia in donepezil hydrochloride group mouse showed mild pyknosis
图 9 灵芝制剂和盐酸多奈哌齐对海马的超微结构的作用
Fig 9 The effect of ganoderma lucidum preparation and donepezil hydrochloride on hippocampal ultrastructure
讨 论
老年斑(αβ类淀粉蛋白)和神经元纤维缠结是AD发病的特征性病变[7]。AD模型组小鼠老年斑在大脑内的分布基本上在大脑边缘系统和基底神经节,少数在神经细胞上,与文献[8]报道基本一致。在海马和齿状核αβ类淀粉蛋白则包裹着神经细胞,影响神经细胞的信息交流和细胞代谢功能,而神经元纤维缠结有所不同,神经细胞内的Tau蛋白的过度磷酸化形成神经元纤维缠结,甚至可见鬼样神经元纤维缠结[9],此时神经细胞死亡破裂,神经元纤维缠结散布,感染邻周的神经细胞、胶质细胞和神经纤维。由此可见,老年斑、αβ类淀粉蛋白在脑基质内的广泛沉积和神经元纤维缠结对中枢神经系统有广泛的严重损害。导致临床上AD患者认知能力和学习降低以及行动障碍、生活不能自理等后果。在灵芝治疗组可以看到小鼠的老年斑、弥漫的类淀粉沉积以及神经元纤维缠结病变程度均有所减轻或消失。
2004年Csatellani等[10]报道类淀粉蛋白血管病,并通报1938年Dirry描述在老年斑中血管有类淀粉蛋白的沉着与AD的发病机制有关。这是AD患者和部分老年人大脑出现大脑皮层变薄、脑回变窄、脑沟增宽、脑室扩大的病变原因。大脑皮质小血管受到类淀粉蛋白的侵袭,在微血管内膜沉积,内皮细胞和外皮细胞退变、固缩导致微血管闭合,血脑屏障功能受损,脑皮质缺血致大脑皮层萎缩。本研究AD模型组的微小血管受αβ类淀粉蛋白损害的多见,而在灵芝制剂组少见,这和血内和脑内αβ类淀粉蛋白的浓度高低有一定的关系。
2004年Jin等[11]提出AD患者的海马和齿状核中出现一些“神经干细胞”。为证明其属性,取用小鼠神经干细胞免疫组织化学DCX和TUC4染色[12]进行鉴别,结果表明这些细胞DCX和TUC4均呈阴性。2016年Dhaliwal等[13]的DCX试验否定成年小鼠齿状回和海马出现神经干细胞。而在灵芝治疗小鼠小脑浦肯野细胞染色阳性,表明促进了小脑浦肯野细胞的再生。
电镜观察显示,AD小鼠模型的海马组织神经元损害最为严重,其损害程度与相关文献[14- 15]报道的结果相似,而灵芝治疗组病变则相对减轻,进一步表明灵芝的神经细胞保护作用。
小脑浦肯野神经细胞的丢失这一类病变已有报道。2011年Louis等[16]认为小脑浦肯野细胞的丢失是特征性震颤症。小脑浦肯野神经细胞丢失致小脑震颤、硬化症、共济失调。研究表明AD模型组小鼠的小脑浦肯野神经细胞的丢失量超过灵芝高剂量和灵芝中剂量组小鼠(P<0.05)。AD患者早期出现的认知和学习功能降低和手指协调运动障碍也可能与小脑浦肯野神经细胞的丢失有关[8]。由于过去对AD病变的注意力比较集中于海马,因而临床上主要考虑是海马受创原因,没有或较少考虑小脑浦肯野细胞丢失的参与,但本研究表明AD病变中小脑浦肯野神经细胞丢失最早。因此如果对AD早期症状的认识考虑到小脑的参与,也许对早期诊断和防治有所帮助。
综上,灵芝制剂对于APP/PS- 1转基因AD小鼠脑内老年斑和神经元纤维缠结具有一定的降解作用,使其减少或消失及淀粉样蛋白血管病变减轻,并且灵芝兼具神经元细胞保护作用,促进幼稚神经细胞生长。本研究为其在临床治疗AD疾病提供一定的理论基础。
(志谢:感谢中国医学科学院基础医学研究所薛全福教授在本文构思和撰写中予以热情的帮助)
[1]赵斌,蔡志友.阿尔茨海默病[M].北京:科学出版社,2015:1- 5.
[2]卢耀增,吴小闲,陈颂,等.灵芝制剂治疗猴获得性免疫缺陷综合征的疗效观察[J].中国医学科学院学报,2011,33(3):318- 324.
[3]张连峰,秦川.基因工程小鼠资源和比较医学信息[M].北京:卫生部人类疾病比较医学重点实验室,2008:18- 21.
[4]王伯沄,李玉松,黄高昇,等.病理学技术[M].北京:人民卫生出版社,2000:142- 182.
[5]Kingsbury BF,Johannsen OK.Histological technique- a guide for use in a laboratory course in histology[M].Boston:F.H.Glison Co.,2007:1- 6.
[6]Paxinos G,Franklin KBJ.The mouse brain in skereotaxic coordinates [M].second edition.San Diego:Academic Press,2001:27;47;52.
[7]Castellan RJ,Rolston RK,Smith MA.Alzheimer disease [J].Dis Mon,2010,56(9):484- 596.
[8]Lundy-Ekman L.Neuroscience fundamental for rehabilitation [M].3rd Edition.Philadelphca:Sauders Elsevier,2007:244- 247;444- 445;200- 261.
[9]里德U-N,维尔纳-M,舍费尔H-E.里德病理学[M].武忠弼,译.5版,上海:科学技术出版社,2007:974- 975.
[10]Csatellani RJ,Smith MA,Perry G,et al. Cerebral amyloid angiopathy:major contributor or decorative response to Alzheimer’s disease pathogenesis[J].Neurobiol Aging,2004,25(5):599- 602.
[11]Jin K,Peel AL,Mao XO,et al. In increased hippocampal neurogenesis in Alzheimer’s disease[J].Proc Natl Acad Sci USA,2004,101(1):343- 347.
[12]武菲,张秋玲.神经干细胞增殖分化研究中的常用标记物[J].中华行为医学与脑科学杂志,2013,22(3):283- 285.
[13]Dhaliwal J,Xi Y,Bruel-Jungerman E,et al. Doublecortin(DCX) is not essential for survival and differentiation of newborn neurons in the adult mouse dentate gyrus[J].Front Neurosci,2016,9(71):494.
[14]Dikranian K,Kim J,Stewart FR,et al. Ultrastructuralstudies in APP/PS- 1 mice expressing human ApoE isoforms:implications for Alzheimer’ s disease [J].Int J Clin Exp Pathol,2012,5(6):482- 495.
[15]Zhang L,Ma Q,Yang W,et al. Recombinant DNA vaccine against neurite out growth inhibitors attenuates behavioral deficits and decreases abeta in an Alzheimer’s disease mouse model[J].Neuropharmacology,2013,70:200- 210.
[16]Louis ED,Faust PL,Vonsattel JP.Purkinje cell loss is a characteristic of essential tremor [J].Parkinsonism Relat Disord,2011,17(6):406- 409.
Pathological Changes in APP/PS- 1 Transgenic Mouse Models of Alzheimer’s Disease Treated with Ganoderma Lucidum Preparation
QIN Chuan1,WU Shanqiu2,CHEN Baosheng3,WU Xiaoxian1,QU Kunyao2,LIU Junmin4,ZHANG Guifang4,XU Yanfeng1,SHU Shunli2,SUN Lihua1,LI Yanhong1,ZHU Hua1,HUANG Lan1,MA Chunmei1,XU Yuhuan1,HAN Yunlin1,LU Yaozeng1
1Institute of Medical Laboratory Animal Science,Chinese Academy of Medical Sciences,Center of Comparative Medicine,Peking Union Medical College,Beijing 100021,China2Mei Shan Tang Biotechnology(Shenzhen) Ltd,Shenzhen,Guangdong 518000,China3Department of Biochemistry and Molecular Biology,Institute of Basic Medical Sciences, CAMS and PUMC,Beijing 100005,China4Institute of Chinese Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510006,China
LU Yaozeng Tel:010- 63010060,E-mail:lyz_wxx@163.com;
Objective To explore the efficacy of ganoderma lucidum preparation(Ling Zhi) in treating APP/PS- 1 transgenic mouse models of Alzheimer’s disease(AD).Methods APP/PS-1 transgenic mice of 4 months were randomly divided into model group,ganoderma lucidum treatment groups,including high [2250 mg/(kg·d)] and middle [750 mg/(kg·d)] dose groups,i.e.LZ-H and LZ-M groups,and the positive control group(treated with donepezil hydrochloride [2 mg/(kg·d)]).In addition,C57BL/6J wild mice were selected as normal group.The animals were administered for 4 months.Histopathological examinations including hematoxylin-eosin(HE) staining,immunohistochemistry,special staining,and electron microscopy were applied,and then the pathological morphology and structures in different groups were compared.Results The senile plaques and neurofibrillar tangles in the cerebrum and cerebellum were dissolved or disappeared in LZ-H and LZ-M groups.Decrease of amyloid angiopathy was found in LZ-H and LZ-M groups.The immature neurons appeared more in hippocampus and dentate nucleus of LZ-H and LZ-M groups than those in AD model and donepezil hydrochloride groups(hippcampus:F=1.738,P=0.016;dentate nucleus:F=1.924,P=0.026),and these immature neurons differentiated to be neurons.More Purkinje cells loss occurred in AD model mice than that in LZ-H and LZ-M groups(F=9.46,P=0.007;F=9.46,P=0.010).The LZ-H and LZ-M groups had more new neuron stem cells grown up in cerebellum.Electromicroscopic examination showed the hippocampal neurons in LZ-H and LZ-M group were integrated,the nuclear membrane was intact,and the mitochondria in the cytoplasm,endoplasmic reticulum,Golgi bodies,microtubules,and synapses were also complete.The microglial cell showed no abnormality.No toxicity appeared in the pathological specimens of mice treated with ganoderma lucidum preparation.Conclusion The ganoderma lucidum preparation can dissolve and decline or dismiss the senile plaques and neurofibrillar tangles in the brain of AD mice and also reduce the amyloid angiopathy.
ganoderma lucidum preparation;Alzheimer’s disease;senile plaque;neurofibrillary tangle;neural stem cell
552-561
卢耀增 电话:010- 63010060,电子邮件:lyz_wxx@163.com;
陈保生 电话:010- 63010060,电子邮件:capogene@126.com
R364.7
A
1000- 503X(2017)04- 0552- 10
10.3881/j.issn.1000- 503X.2017.04.015
CHEN Baosheng Tel:010- 63010060,E-mail:capogene@126.com
2016- 07- 01)

