术前氢质子磁共振波谱主要代谢物水平与术中胶质母细胞瘤荧光强度的比较
田海龙,祖玉良,王超超,林 涛,郭振涛,姜 彬,殷 鑫,郭文强,王志刚
山东大学 齐鲁医院神经外科,山东青岛 266000
术前氢质子磁共振波谱主要代谢物水平与术中胶质母细胞瘤荧光强度的比较
田海龙,祖玉良,王超超,林 涛,郭振涛,姜 彬,殷 鑫,郭文强,王志刚
山东大学 齐鲁医院神经外科,山东青岛 266000
目的 对比分析术前氢质子磁共振波谱成像(1H-MRS)主要代谢物水平和术中荧光素钠(FLs)标记胶质母细胞瘤(GBM)的荧光强度,探讨不同荧光强度GBM组织代谢水平的变化,为GBM荧光手术治疗提供客观依据。方法 对2014年4月1日至2015年12月31日磁共振扫描成像平扫+增强序列新诊断的GBM,完成1H-MRS检查和FLs标记下手术治疗,术后病理确诊为GBM的病例行肿瘤边界Ki67免疫组织化学检测。对1H-MRS主要代谢物水平与肿瘤荧光强度进行对比分析。结果 33例纳入研究,术前1H-MRS诊断结果:25例提示为高级别胶质瘤,N-乙酰门冬氨酸(NAA)峰明显降低,胆碱(Cho)峰明显增高;Cho/NAA、NAA/肌酸(Cr)和Cho/Cr在不同肿瘤区域差异有统计学意义(P=0.02,P=0.01,P=0.00)。FLs标记手术结果:术中清晰看见组织荧光;29例全切、4例次全切;术后无急性脑膨出,癫痫发生2例。术后常规病理结果:28例确诊为GBM(22例与1H-MRS诊断一致)。GBM肿瘤荧光显影结果:肿瘤实质区域荧光强度高于肿瘤边界和瘤周水肿(P=0.01)。1H-MRS代谢物分析结果:不同荧光强度的GBM实质,NAA和Cho峰高度不同(P=0.01,P=0.02),Cho/NAA不同(P=0.01);不同荧光强度的GBM边界,NAA峰高度差异无统计学意义,Cho峰高度不同,Cho/NAA不同(P=0.02,P=0.00);不同荧光强度GBM瘤周水肿中,NAA和Cho峰高度、Cho/NAA差异无统计学意义(P=0.23,P=0.09,P=0.14)。GBM肿瘤边界免疫组织化学结果:不同荧光显影边界,Ki67表达程度不同(P=0.03)。结论 GBM肿瘤实质荧光强度高于其他区域,不同荧光强度的GBM,代谢水平不同;FLs标记下实施GBM手术治疗,需重视术前1H-MRS提供的代谢信息,并就两者的相关性做进一步探讨。
胶质母细胞瘤;氢质子磁共振波谱;荧光素标记
作为重要的非侵袭性肿瘤生物化学定量检测方法,氢质子磁共振波谱成像(proton magnetic resonance spectroscopy,1H-MRS)能够反映胶质瘤生物化学代谢异常的信息,弥补常规核磁共振检查的不足,对于胶质瘤术前诊断与定位肿瘤有着潜在价值。本研究将1H-MRS与术中荧光素(fluorescein sodium,FLs)标记技术优势联合,针对临床诊断的胶质瘤母细胞瘤(glioblastoma,GBM)患者行磁共振扫描成像(magnetic resonance imaging,MRI)常规+磁共振波谱分析(magnetic resonance spectroscopy,MRS)检查,利用荧光实时导航切除肿瘤,并在肿瘤不同区域取材,行光镜和免疫组织化学检测,针对肿瘤代谢、荧光显影强度和分子病理对比分析,探讨不同荧光强度GBM组织代谢水平的变化,为GBM荧光手术治疗提供客观依据。
资料和方法
临床资料 2014年4月1日至2015年12月31日山东大学齐鲁医院(青岛)神经外科经MRI平扫+增强序列新诊断的GBM,全部病例完成1H-MRS检查,开颅行显微外科手术治疗,术中使用FLs标记肿瘤,术后常规病理检查确定诊断。纳入标准:(1)MRI平扫+增强扫描新诊断GBM;(2)行1H-MRS检查;(3)首次颅内肿瘤切除术;(4)行FLs标记下显微外科手术治疗。排除标准:(1)病理检查排除GBM;(2)拒绝行1H-MRS检查;(3)GBM复发;(4)FLs过敏;(5)拒绝FLs标记显微手术治疗;(6)接受过放射或化学治疗;(7)合并严重肝、肾、心血管、血液系统疾病无法耐受手术;(8)年龄≥80岁和≤3岁。患者家属签署知情同意书。
MRI和1H-MRS检查 由本院MRI室2名副主任医师采用双盲法阅片,分别进行并取平均值。
MRI检查:所有病例均采用荷兰PHILIPS Ingenia 3.0T超导磁共振扫描机,使用全数字15通道并行采集相控阵头线圈进行扫描。常规MRI扫描包括横轴位扰相自旋回波T1加权成像(重复时间:2000 ms,回波时间/反转时间:20 ms/800 ms)、扰相自旋回波T2加权成像(重复时间/回波时间2365 ms/107 ms)、T2加权液体衰减反转回复序列(重复时间11 000 ms,反转时间2800 ms,回波时间125 ms)、弥散加权成像(b=1000),层厚/层间距:6 mm/1 mm,视野=210 mm×210 mm,重建矩阵=384×384。增强扫描行矢状位、横断面及冠状面 T1加权增强扫描,经肘前静脉注射造影剂钆贲替酸葡甲胺,剂量为0.2 mmol/kg体质量。
1H-MRS检查:所有病灶均在术前行多体素1H-MRS检查,采用二维点分辨波谱分析法技术,重复时间2000 ms,回波时间144 ms,翻转角90°,选择性水激发水抑制技术(水抑制带宽140 Hz,水抑制率>96%,二次激发角300,半高全宽32 Hz)。视野120 mm×120 mm~140 mm×140 mm,采集次数=1,重建矩阵512×512,成像时间286 s。数据后处理采用本机或原装工作站软件Spetro View进行数据处理。以健侧的正常脑组织作为对照,在增强后横断面T1加权图像上定位感兴趣区(region of interest,ROI)层面位于肿瘤的实质(尽可能包括目的肿瘤强化区)、强化边缘区(肿瘤边界)和周围水肿组织。扫描结束后,测定N-乙酰门冬氨酸(N-acetylaspartate,NAA)、肌酸(creatine,Cr)、胆碱(choline,Cho)的峰下面积,采用LCModel软件对磁共振频谱Pfile文件数据进行基线校正等后处理,应用内参考标准(脑白质水的浓度)进行绝对定量分析;并计算 Cho/Cr、Cho/NAA、NAA/Cr的比值。
手术方法和FLs标记 完善术前常规检查,行锁骨下或颈内静脉穿刺置管。FLs皮试:将0.5 ml的20%FLs注射液(3 ml∶600 mg,广州白云山明兴制药生产,国药准字:H44023400)稀释至3%,由深静脉推注5 ml,监测患者生命体征及有无皮疹发生;无异常者将20%FLs稀释至1%~1.5%,以3 mg/kg静脉推注。均采用气管插管及静脉复合全麻,气管插管后不再使用肌松药,常规开颅,掀起骨瓣后暴露肿瘤(推注后60~75 min)。在激发状态下,通过安装YELLOW 560 nm 滤光片的Pentero 900手术显微镜(Carl Zeiss Meditec,Oberkochen,Germany)观察到肿瘤及瘤周水肿组织可呈现强荧光显影区(明黄色)、弱荧光显影区(浅黄色)或无荧光显影。根据荧光染色强度,结合MRI强化边界及MRS定位的感兴趣区等影像学信息,分辨和切除肿瘤。肿瘤切除过程中,脑叶塌陷造成的脑移位可能导致影像与肿瘤空间位置的差异,手术切除程度仍以荧光染色强度为主,并以肿瘤与正常脑组织质地的差异为参考。荧光可保持3~4 h,然后自行消退。
组织学检查方法 新鲜切除肿瘤标本,常规固定、包埋、切片,HE染色后镜下观察。肿瘤边界免疫组织化学检测Ki67表达:取石蜡切片,贴附于载玻片上备用。采用SP法,单克隆抗体选用Ki67,抗体购自福州迈新公司。判断标准及评价:阳性以胞浆染色呈棕黄色为判定标准,评估染色百分率并分级:无阳性细胞或阳性细胞<10%为阴性;阳性细胞比率在10%~50%阳性(+);阳性细胞比率>50%强阳性(++)。
统计学处理 采用SPSS 15.0统计软件,计量资料以均数±标准差表示;GBM定位ROI层面与荧光强度的比较采用多个构成比比较的χ2检验;GBM中不同肿瘤区域1H-MRS主要代谢物比较,1H-MRS 中NAA、Cho峰度及 Cho/NAA与GBM中荧光强度的比较,均采用单因素方差分析,双向P值,P<0.05为差异有统计学意义。
结 果
常规MRI平扫+增强检查结果 33例常规MRI平扫+增强诊断为GBM的病例符合本研究纳入标准,其中男19例、女14例,年龄29~74岁,平均(39.5±0.45)岁。MRI表现为病灶信号不均,并伴出血、钙化、坏死或囊变,瘤周水肿及占位效应明显,T2加权液体衰减反转回复序列像病灶呈高或混杂高信号;注射钆喷替酸葡甲胺增强扫描后,3例未见明显强化,1例轻度强化,余29例呈环形、花环形或不均匀强化(图1)。
1H-MRS分析结果 25例考虑为高级别胶质瘤,表现为病变区域NAA峰明显降低,Cho明显增高;肿瘤实质、边界和瘤周水肿Cho/NAA 和 Cho/Cr 比值较对照区显著升高(图1D);肿瘤实质区域NAA峰明显低于肿瘤边界和瘤周水肿(F=7.33,P=0.00),肿瘤实质区域Cho峰明显高于肿瘤边界和瘤周水肿(F=5.79,P=0.02),不同肿瘤区域Cr峰度差异无统计学意义(F=1.25,P=0.11);肿瘤实质区域Cho/NAA和Cho/Cr明显高于边界和瘤周水肿(F=5.98,F=6.84,P=0.02,P=0.01)、NAA/Cr明显低于边界和瘤周水肿(F=6.32,P=0.00)(表1)。
FLs标记手术和病理学检查结果 所有病例在注射FLs 60~70 min后均能清晰看见组织荧光(图1C),平均手术时间(192 ±7.5)min(91~ 235 min)。术中YELLOW 560 nm滤光器可以通过显微镜手柄上的按钮顺利打开和关闭。33例中29例全切、4例次全切。术后无急性脑膨出,癫痫发生2例。术后病理证实33例术前诊断的GBM,其中28例获得病理确诊(22例与1H-MRS诊断一致),余5例分别为间变性星形细胞瘤2例(与1H-MRS诊断一致)、转移瘤2例(与1H-MRS诊断一致)、淋巴瘤1例(1H-MRS代谢表现为高级别胶质瘤)。
GBM定位不同ROI层面中荧光强度的比较结果 肿瘤实质区域荧光强度高于肿瘤边界和瘤周水肿(χ2=10.28,P=0.01)(表2);1H-MRS 中NAA、Cho峰度及 Cho/NAA与GBM中荧光强度的比较显示,强荧光肿瘤实质中,NAA峰度最低,Cho峰度最高(F=7.24,F=4.91,P=0.01,P=0.02),Cho/NAA高于弱荧光和无荧光肿瘤实质(F=5.33,P=0.01);不同荧光强度肿瘤边界中,NAA峰度差异无统计学意义(F=1.17,P=0.46),Cho峰度不同,Cho/NAA不同(F=5.00,F=7.08,P=0.02,P=0.00);不同荧光强度瘤周水肿中,NAA和Cho峰度、Cho/NAA差异无统计学意义(F=2.95,F=1.83,F=2.46,P=0.23,P=0.09,P=0.14)(表3)。不同荧光强度GBM肿瘤边界的Ki67表达程度比较显示,GBM肿瘤边界不同的荧光强度组织,其Ki67表达程度不同,强荧光肿瘤边界,Ki67表达高于弱荧光肿瘤边界组织(χ2=9.01,P=0.03)。
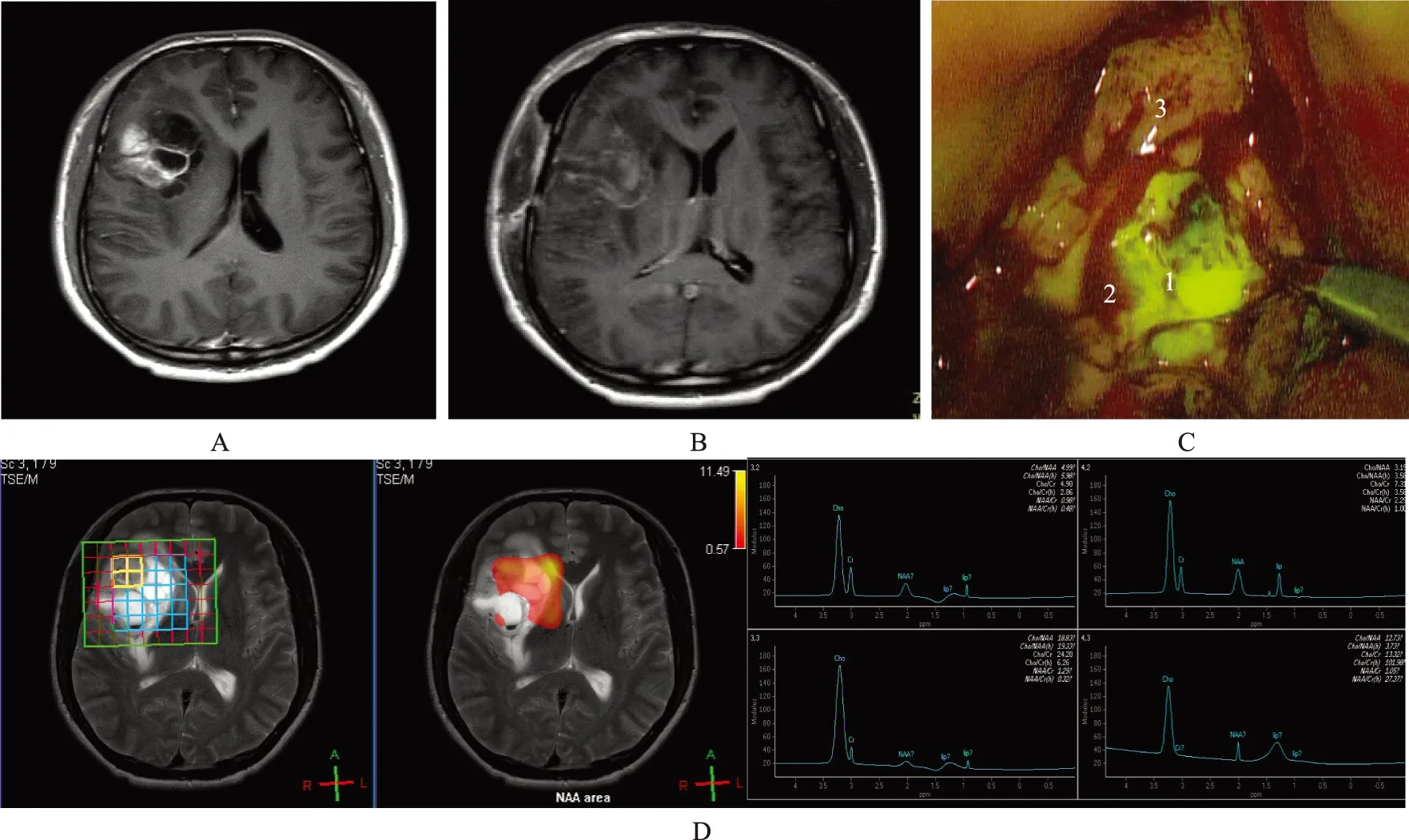
GBM:胶质母细胞瘤;MRI:磁共振扫描成像;1H-MRS:氢质子磁共振波谱成像;NAA:N-乙酰门冬氨酸;Cr:肌酸;Cho:胆碱GBM:glioblastoma;MRI:magnetic resonance imaging;1H-MRS:proton magnetic resonance spectroscopy;NAA:N-acetylaspartate;Cr:creatine;Cho:choline
A.术前MRI平扫及增强影像显示右侧额叶不规则环形强化病变;B.术后MRI增强影像显示右侧额叶无异常强化;C.肿瘤组织不同区域荧光显影程度不同(1:肿瘤实质;2:肿瘤边界;3:瘤周水肿);D.1H-MRS显示肿瘤区域NAA峰明显减低,Cr峰稍减低,Cho峰明显升高,Cho/Cr、Cho/NAA 值增高
A.preoperative MRI plain scan and enhanced image displayed a irregular ring enhanced lesion in right frontal lobe;B.postoperative MRI images showed no abnormal enhancement in right frontal lobe;C.different fluorescence imaging in different tumor regions(1:tumor parenchyma;2:tumor boundary;3:peritumoral edema);D.1H-MRS showed significantly decreased NAA peak,slightly decreased Cr peak,significantly increased Cho,and increased values of Cho/Cr and Cho/NAA in tumor region
图 1 男,39 岁,右侧额叶GBM
Fig 1 A 39-year-old male patient with GBM in right frontal lobe

表 1 28例GBM中不同肿瘤区域1H-MRS 主要代谢物比较(-±s)Table 1 Comparisons of major metabolites of 1H-MRS of different tumor regions in 28 GBM(-±s)
F、P:肿瘤实质区域与肿瘤边界和瘤周水肿区域比较
F,P:tumor parenchymavs.tumor boundary and peritumoral edema

表 2 28例GBM不同定位感兴趣区层面中荧光强度的比较(n)Table 2 Comparison of fluorescence intensity in different regions of interest in 28 GBM(n)
χ2、P:肿瘤实质区域与肿瘤边界和瘤周水肿区域比较
χ2,P:tumor parenchymavs.tumor boundary and peritumoral edema

表 3 GBM中荧光强度与1H-MRS 中NAA、Cho峰度及 Cho/NAA比值的比较(-±s)Table 3 Comparison of the fluorescence intensity GBM and 1H-MRS in the kurtosis of NAA and Cho and the ratio of Cho/NAA(-±s)
F、P:强荧光与弱荧光和无荧光区域比较
F,P:strong fluorescence intensityvs.weak and none fluorescence intensity
讨 论
2001年,Croteau等[1]提出MRS有望成为精准引导脑肿瘤手术切除的重要手段,Son等[2]认为MRS 判定的肿瘤代谢信息与病理组织学所见一致。Hall等[3]肯定多体素1H-MRS确定胶质瘤活检部位的积极作用,指出定位于Cho 最大和NAA最小(肿瘤细胞增生最活跃)的活检区域可提高活检的确诊率。Laprie等[4]认为异常波谱显示的病变进展较常规影像及临床表现早2~5个月。目前,MRS与FLs的对比或相关性研究报道较少见。有学者指出,FLs能够很好地分辨和定位胶质瘤,血脑屏障的破坏是荧光素钠进入组织的前提。作为一种荧光染料,FLs通过被破坏的血脑屏障进入肿瘤细胞内,使肿瘤组织及肿瘤浸润的部分在荧光显微镜下呈现特定的荧光影像,从而定位肿瘤并区分边界[5- 6]。但是荧光边界和肿瘤代谢之间的联系,尚不明确。
本研究显示,不同1H-MRS感兴趣区,即肿瘤不同区域的荧光强度不同(P<0.05)。分析原因可能为:(1)肿瘤实质、边界和瘤周水肿等不同区域,血脑屏障受破坏的程度不同,所以FLs在GBM不同区域的分布有差异[7- 10];(2)FLs剂量、FLs给药时间亦影响荧光显影效果。注射FLs后30~45 min,白光下瘤体已开始呈现浅黄色并逐渐加深,60~70 min后能清晰看见组织荧光,90~120 min达到高峰,3~4 h后开始消退;本研究平均手术时间(192±7.5)min(91~ 235 min),其中切除肿瘤的操作时间与FLs达峰时间基本一致,目的是减少药物血管内衰减对荧光显影效果的影响。此外,虽然FLs应用于眼科诊断的安全性已获肯定,但是应用FLs标记肿瘤的剂量并不统一:欧洲和北美学者报道的剂量普遍较大(5~12 mg/kg),甚至曾报道20 mg/kg用量[10- 13];国内多报道5 mg/kg左右剂量,日本学者应用5~10 mg/kg剂量,除了进行胶质瘤切除手术,还进行颅内动脉瘤和动静脉畸形术中的血管显影[14]。本研究剂量在3 mg/kg,除发生2例皮疹过敏反应外,未发生术中血压、心率突变情况,荧光显影的持续时间较理想。后续研究拟分析FLs浓度梯度与显影程度的关系,进一步优化给药剂量。
不同肿瘤区域NAA和Cho峰度不同,Cho/NAA、NAA/Cr和Cho/Cr在不同肿瘤区域有差异(P<0.05),是GBM等高级别胶质瘤在1H-MRS的特征性表现,提示GBM这种高度恶性的肿瘤细胞分裂失控,细胞膜转换增强,肿瘤细胞对正常神经元的破坏也明显增强[1,4];因此,本研究结果提示GBM的血脑屏障破坏与NAA、Cho等主要代谢物的代谢水平之间,可能存在一致性关系,需要从相关性、敏感性和特异性等方面进一步验证。但是,不同荧光强度的肿瘤边界中,Cho峰度不同,Cho/NAA不同,而NAA峰度无差异,似乎与上述推论有悖。分析与以下因素有关:(1)GBM的异质性表现为不同的GBM肿瘤个体,或者同一GBM肿瘤个体的不同区域,其肿瘤分子病理和生物学行为特点可能具有较大差异[15- 17]。本研究不同荧光强度的肿瘤边界免疫组织化学检测提示,GBM肿瘤边界的强荧光显影组织和弱/无荧光显影组织,其Ki67表达程度不同。受样本量限制,只能按Ki67的两个表达程度范围进行比较(Ki67≤10%和Ki67>10%),今后将扩大样本量,进一步分析GBM肿瘤实质、边界、瘤周水肿等区域主要代谢物与Ki67等分子病理标志物的相关性;(2)脑漂移是实时荧光导航难以避免的局限性。由于肿瘤切除过程中脑叶不断塌陷,相对于术前增强MRI和1H-MRS的定位结果,术中实时观察到的肿瘤边界将发生有限的位移,手术病理取材和成像位置无法完全对应,造成GBM代谢边界和荧光边界的偏倚[8- 9,11- 12];(3)目前荧光定量仍以荧光显微镜下的显影效果为主,缺乏客观的绝对定量,在一定程度掩盖了主要代谢物在不同荧光强度肿瘤组织间变化的实际差异,肿瘤组织荧光光度分析方法有望减少误差的出现[18]。
综上,GBM肿瘤实质荧光强度高于其他区域,不同荧光强度的GBM代谢水平不同;FLs标记下实施GBM手术治疗,需重视术前1H-MRS提供的代谢信息,并扩大样本量和分子病理标志物检测范围,进一步完善两者相关性的验证。
[1]Croteau D,Searpaee L,Hearshen D,et al.Correlation between magnetic resonance spectroscopy imaging and image-guided biopsies:semiquantitative and qualitative histopathological analysis of patients with untreated gliomas [J].Neurosurgery,2001,49(4):823- 829.
[2]Son BC,Kim MC,Choi BG,et al.Proton magnetie resonancechemical slight imaging(1H-MRS)-directed stereotactics biopsy[J].Aeta Neuroehir(Wein),2001,143(1):45- 50.
[3]Hall WA,Liu HY,Truwit CL,et al.Magnetic resonance spectroscopy-guided biopsy of intracranial tumor[J].Techniques Neurosurg,2002,7(4):291- 298.
[4]Laprie A,Pirzkall A,Haas-Kogan DA,et al.Longitudinal multivoxel MR spectroscopy study of pediatric diffuse brainstem gliomas treated with radiotherapy[J].Int J Radiat Oncol Biol Phys,2005,62(1):20- 31.
[5]Gulati S,Jakola AS,Nerland US,et al.The risk of getting worse:surgically acquired deficits,perioperative complications,and functional outcomes after primary resection of glioblasto ma[J].World Neurosurg,2011,76(6):572- 579.
[6]Feigl GC,Ritz R,Moraes M,et al.Resection of malignant brain tumors in eloquent cortical al’efs:a new muhimodal apprnach combining 5-aminolevulinic acid and intranperative monitoring[J].J Neurosurg,2010,113(2):352- 357.
[7]Schebesch KM,Proescholdt M,Höhne J,et al.Sodium fluorescein-guided resection under the YELLOW 560 nm surgical microscope filter in malignant brain tumor[J].Acta Neurochir(Wien),2013,155(4):693- 699.
[8]陈大伟,顾卫红,葛鹏飞,等.荧光引导脑胶质瘤切除的临床应用[J].中华神经外科杂志,2012,8(28):829- 831.
[9]Chen B,Wang H,Ge P,et al.Gross and total resection of glioma with the intraoperative fluorescence-guidance of fluorescein sodium [J].Int J Med Sci,2012,9(8):708- 714.
[10]Koc K,Anik L,Cabuk B,et al.Fluorescence sodium-guided surgery in glioblastoma multiforme:a prospective evaluation[J].Br J Neumsugery,2008,22(1):99- 103.
[11]Frnncesco A,Morgan B,Eoli M,et al.Fluorescein-guided surgery for grade Ⅳ gliomas with a dedicated filter on the surgical micro scope:preliminary results in 12 cases[J].Acta Ncuro chir(Wien),2013,155(7):1277- 1286.
[12]Shinoda J,Yano H,Yoshimura S,et al.Fluorescence-guided resection of glioblastoma multif orme by using high-dose fluorcsccin sodium.Tcclmical note[J].J Neurosurg,2003,99(3):597- 603.
[13]Acerbi F,Cavallo C,Broggi M,et al.Fluorescein-guided surgery for malignant gliomas:a review [J].Neurosurg Rev,2014,37(4):547- 557.
[14]Kuroda K,Kinouchi H,Kanemaru K,et al.Intra-arterial injection fluorescein video angiography in aneurysm surgery[J].Neurosurgery,2013,72(2):141- 150.
[15]缪亦锋,王冉,金义超,等.脑中线部位胶质瘤的手术治疗及分子生物学分析[J].上海交通大学学报(医学版),2015,35(12):1911- 1914.
[16]Dey M,Lin Y,Melkonian S,et al.Prognostic factors and survival,in primary adult high grade brainstem astrocytoma:a population based study from 1973- 2008[J].J Clin Neurosci,2014,21(8):1298- 1303.
[17]di Russo P,Perrini P,Pasqualetti F,et al.Management and outcome of high-grade multicentric gliomas:a contemporary single-institution series and review of the literature[J].Acta Neurochir(Wien),2013,155(12):2245- 2251.
[18]董宇,张东智,汪立刚,等.在恶性胶质瘤中与荧光强度相关性的研究[J].齐齐哈尔医学院学报,2011,32(24):3945- 3947.
Major Metabolite Levels of Preoperative Proton Magnetic Resonance Sectroscopy and Intraoperative Fluorescence Intensity in Glioblastoma
TIAN Hailong,ZU Yuliang,WANG Chaochao,LIN Tao,GUO Zhentao,JIANG Bin,YIN Xin,GUO Wenqiang,WANG Zhigang
Department of Neurosurgery,Qilu Hospital,Shandong University,Qingdao,Shandong 266000,China
WANG Zhigang Tel/Fax:0532- 66850752,E-mail:wzg1110@126.com
Objective To compare the intraoperative major metabolite level of preoperative proton magnetic resonance spectroscopy(1H-MRS)and fluorescence intensity marked with fluorescein sodium(FLs)in glioblastoma(GBM)and thus provide an objective basis for fluorescence surgical treatment of GBM.Methods All newly diagnosed patients by plain and enhanced magnetic resonance imaging from the April 1,2014 to December 31,2015 were enrolled in this study.All of them received1H-MRS and marked with FLs.The expression of Ki67 in tumor boundary were confirmed by postoperative pathology and determined by immunostaining assay.The relationship between1H-MRS metabolite levels and tumor fluorescence intensity was analyzed.Results Totally 33 patients were included in the study.Preoperative1H-MRS revealed high-grade gliomas in 25 cases.The N-acetylaspartate(NAA)decreased significantly and choline(Cho)increased significantly in high-grade gliomas.The ratios of Cho/NAA,NAA/creatine(Cr),and Cho/Cr significantly differed in different tumor regions(P=0.02,P=0.01,andP=0.00,respectively).Surgical results were marked with FLs intraoperatively.Tissue fluorescence were clearly seen.There were 29 patients undergoing total resection and 4 cases undergoing subtotal resection.No acute encephalocele occured after operation,while 2 patients suffered from epilepsy.Postoperative pathology results included:28 cases were diagnosed as GBM(22 cases consistent with1H-MRS diagnosis).The results of GBM fluorescence imaging included:the level of fluorescence intensity in tumor parenchyma was significantly higher than that in tumor boundary and peritumoral edema(P=0.01).The result of1H-MRS metabolite analysis included:The kurtosis of NAA and of Cho and the ratio of Cho/NAA were significantly different according the fluorescence intensity in tumor parenchyma(P=0.01,P=0.02,andP=0.01).While there was no difference in the kurtosis of NAA,the kurtosis of Cho and the ratio of Cho/NAA were significantly different according the fluorescence intensity in tumor boundary(P=0.02,P=0.00).In peritumoral edema,there was no significant different in kurtosis of NAA and of Cho and in the ratio of Cho/NAA(P=0.23,P=0.09,P=0.14).Immunohistochemistry in GBM tumor boundary showed different Ki67 expressions according to different fluorescence imaging(P=0.03).Conclusions The fluorescence intensity in GBM parenchyma is higher than that in other tumor regions,and there are different metabolic levels in different fluorescence intensity.The metabolic information marked by FLs and provided by1H-MRS before operationis are important,and the correlation between them should be further investigated.
glioblastoma;proton magnetic resonance spectroscopy;fluorescence labeling
511-517
山东大学齐鲁医院(青岛)科研启动基金(QDKY2015LH01)Supported by the Initiating Research Foundation of Qilu Hospital(Qingdao)in Shandong University(QDKY2015LH01)
王志刚 电话/传真:0532- 66850752,电子邮件:wzg1110@126.com
R616.2
A
1000- 503X(2017)04- 0511- 07
10.3881/j.issn.1000- 503X.2017.04.009
2016- 03- 22)

