CellSearch系统检测胃癌患者循环肿瘤细胞及临床意义
贾海明,米泰宇,杨 雯,贾彬彬,张克玲,蒲 竞
(兰州市第二人民医院,甘肃 兰州 730046)
CellSearch系统检测胃癌患者循环肿瘤细胞及临床意义
贾海明,米泰宇*,杨 雯,贾彬彬,张克玲,蒲 竞
(兰州市第二人民医院,甘肃 兰州 730046)
CellSearch系统;胃癌;循环肿瘤细胞
循环肿瘤细胞(Circulating Tumor Cells,CTC)是指在肿瘤患者外周血中检测到来源于实体肿瘤、逃离宿主免疫杀伤后存活的异质性肿瘤细胞。19世纪许多学者发现,肿瘤细胞能通过血流传播到远处器官[1]。1869年,Cristofanilli等[2]在恶性肿瘤患者外周血中发现了与原发灶肿瘤性质相似的细胞,首次提出循环肿瘤细胞的概念。1889年,Chafer等[3]提出了“种子和土壤”假说,解释了肿瘤原发灶与转移灶之间的关系。肿瘤的原发病灶往往并不致死,因肿瘤转移和复发所引起的死亡约占实体瘤的90%[4]。循环肿瘤细胞可能代表原发肿瘤的表型和遗传组成,被称为潜在的转移性肿瘤的“液体活检”。
CellSearch系统是目前自动化程度最高的循环肿瘤细胞检测技术,受人为因素影响较小,该系统集免疫磁珠富集技术和免疫荧光技术于一体,具有较高的特异性、敏感性及可重复性[5]。该系统是目前唯一被美国食品与药品监督管理局批准用于转移性乳腺癌、结直肠癌或前列腺癌循环肿瘤细胞检测的新技术[6~8]。近年来,应用该系统检测肺癌及其他实体瘤循环肿瘤细胞的研究也越来越受重视,而且通过该系统分析循环肿瘤细胞分子标记的研究也渐有尝试。我们采用CellSearch系统检测47例胃癌患者的循环肿瘤细胞,现报告如下。
1 对象与方法
1.1 对象
搜集2014年4月至2016年5月就诊于兰州市第二人民医院,并经病理证实为胃癌的患者共47例,其中女19例,男28例;年龄≤60岁者29例,>60岁者18例;I期患者3例,Ⅱ期患者8例,Ⅲ期患者27例,Ⅳ期患者9例。慢性胃炎患者40例,其中女24例,男26例,平均年龄(54.42±8.76)岁。健康志愿者40例,其中女26例,男14例,平均年龄(47.60±10.37)岁。将以上人群作为研究对象。
1.2 仪器与设备
9541循环上皮细胞自动样本处理系统(上海宝腾生物医药科技有限公司);9555循环上皮细胞结果分析系统(上海宝腾生物医药科技有限公司),包括CellSave储存管、CellSearch试剂盒、CellTracks自动处理系统、磁槽、CellTracks自动分析仪。
1.3 纳入标准和排除标准
纳入标准:(1)经病理学检查确诊的患者;(2)入组前未接受任何形式的抗肿瘤治疗;(3)既往无其他恶性肿瘤病史;(4)自愿参与此次研究。排除标准:(1)合并终末期肝病或者肾病的患者;(2)合并全身其他恶性肿瘤的患者。
2 方法
2.1 样本处理
空腹抽取肘静脉血7.5m l,标记锥形管,将每支CellSave储存管中的7.5m l血液注入带有标记的CellTracks AutoPrep锥形管内进行混合,加入6.5ml稀释缓冲液,盖好装有血液的Cell-Tracks AutoPrep锥形管,并颠倒混匀5次,以2 000 r/min离心10分钟,样本准备完成1小时内,在CellTracks AutoPrep系统上对试管进行处理。
2.2 CTC无创性标准化检测
系统自动处理样本,磁珠富集EpCAM阳性细胞,细胞固定后依次加入藻红蛋白(PE)标记的CK81/81/9抗体、藻蓝蛋白(APC)标记的CD45抗体,使用4,6-二脒基-2-苯基吲哚(4,6-diamin-odino-2-phenylindole,DAPI)对细胞核进行染色。处理后的样品自动转入MagNest,避光孵育20分钟后放入Analyzer系统进行荧光扫描分析并还原成图像,系统分选符合肿瘤细胞形态、CK的细胞供人工判读,CK+DAPI+CD45的细胞被定义为循环肿瘤细胞。
2.3 统计学方法
对所获得的实验数据应用SPSS 17.0软件进行统计学分析,计数资料采用χ2检验,P<0.05为差异有显著性。
3 结果
3.1 胃癌组、慢性胃炎组、健康对照组循环肿瘤细胞阳性人数比例比较
胃癌组循环肿瘤细胞阳性比例在术前、术后、化疗前及化疗后均明显高于慢性胃炎组以及健康对照组(P<0.05),具体见表1。
3.2 循环肿瘤细胞与性别、年龄的关系
调查发现,胃癌患者循环肿瘤细胞与性别、年龄之间无显著相关性(P>0.05)。
3.3 循环肿瘤细胞与肿瘤标记物的相关性

表1 胃癌组、慢性胃炎组、健康对照组循环肿瘤细胞阳性人数比例比较[n(%)]
研究显示,胃癌患者循环肿瘤细胞与肿瘤标记物CEA、CA125、CA153、CA199、CA724之间无显著相关性(P>0.05)。
3.4 循环肿瘤细胞与肿瘤分期的关系
I~Ⅱ期胃癌患者11例,其中4例循环肿瘤细胞阳性(36.4%);Ⅲ~Ⅳ期胃癌患者36例,其中24例循环肿瘤细胞阳性(66.7%),两组间循环肿瘤细胞阳性率比较,差异有显著性(P<0.05)。T1~T2和T3~T 4期胃癌患者循环肿瘤细胞阳性率分别为46.4%和57.9%,两组间循环肿瘤细胞阳性率比较,差异无显著性(P>0.05)。淋巴结分期为N0~N1、N2~N3胃癌患者循环肿瘤细胞阳性率分别为46.2%、76.2%,两组间循环肿瘤细胞阳性率比较,差异有显著性(P<0.05)。无远处转移(M0)的胃癌患者循环肿瘤细胞阳性率为55.3%,有远处转移(M1)的胃癌患者循环肿瘤细胞阳性率为77.8%,两组循环肿瘤细胞阳性率比较,差异有显著性(P<0.05),具体见表2。
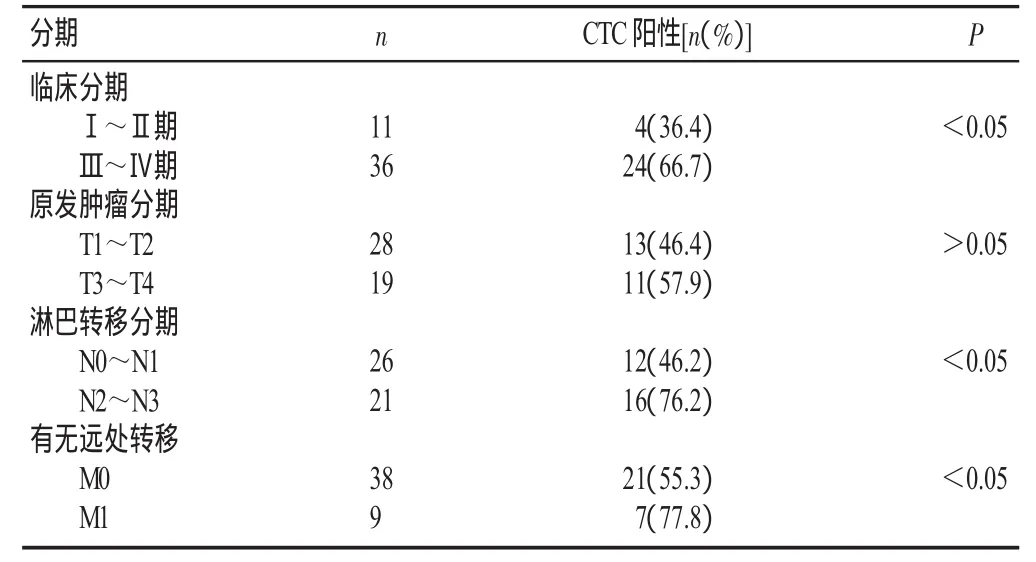
表2 循环肿瘤细胞与肿瘤分期的关系
4 讨论
4.1 胃癌患者循环肿瘤细胞阳性率分析
血液转移是肿瘤转移的重要途径之一,是否存在远处转移是恶性肿瘤临床分期的判断标准之一。虽然血液中检测到肿瘤细胞并不意味着一定存在转移灶,但是研究表明,循环肿瘤细胞的存在与肿瘤分期具有明显的相关性(P<0.05)[9],而目前的临床分期基于影像学或病理学检查结果,难以精确反映转移灶对患者治疗和预后的影响。刘志东等[10]研究发现,外周血循环存在肿瘤细胞可被视为肿瘤TNM分期的TX状态,作为精确临床分期的必要补充,有利于对患者的预后做出更准确的预测。Sastre等[11]使用CellSearch系统检测大肠癌患者的循环肿瘤细胞,结果显示,循环肿瘤细胞阳性率与原发肿瘤部位、癌胚抗原、乳酸脱氢酶升高水平及肿瘤分化程度无关(P>0.05),但与结肠癌的临床分期有关(P<0.05),且循环肿瘤细胞在结肠癌的早期即可检测到,表明循环肿瘤细胞检测有助于早期发现结肠癌及可能出现的微转移。Tanaka等[12]通过CellSearch系统检测125例原发性肺癌患者及25例非恶性肿瘤患者的循环肿瘤细胞,结果发现,在38例肺癌患者外周血中检测到循环肿瘤细胞,3例非恶性肿瘤患者外周血中检测到循环肿瘤细胞,且肺癌患者循环肿瘤细胞计数显著高于非恶性肿瘤患者(P<0.05),对于肺癌患者,小细胞肺癌患者循环肿瘤细胞计数显著高于非小细胞肺癌患者(P<0.05),且循环肿瘤细胞计数随着疾病严重程度(分期)的增加而显著增加(P<0.05),Ⅳ期患者循环肿瘤细胞计数显著高于Ⅰ期患者(P<0.05),有远处转移患者的循环肿瘤细胞计数显著高于无转移的患者(P<0.05),这表明循环肿瘤细胞计数是诊断远处转移的一个标志,但Tanaka等[12]提示,循环肿瘤细胞检测的临床应用价值有待进一步验证。但是,Hofman等[13]应用 CellSearch系统检测非小细胞肺癌患者循环肿瘤细胞,结果发现,循环肿瘤细胞的存在与肿瘤分期及其组织学类型无关(P>0.05)。可见,对于循环肿瘤细胞与肿瘤临床分期的相关性众说纷纭,为明确其确切意义,尚需进一步开展大规模、高质量的临床研究来验证。
4.2 循环肿瘤细胞检测的应用前景
循环肿瘤细胞标准化检测已经成为美国乳腺癌、前列腺癌和结肠癌等肿瘤转移性诊断、疗效检测和预后判断的重要依据。但是,对我国高发肿瘤——胃癌的研究却很少。因此,本研究采用目前国际上先进的循环肿瘤细胞无创性标准化检测技术,针对我国常见的胃癌早期诊断标志物进行系列研究,获取国人常见肿瘤发生、发展与转移过程中循环肿瘤细胞的基本数据,并与血清标志物数据进行比对。结果表明,胃癌患者血循环肿瘤细胞阳性率显著高于慢性胃炎患者和健康人群(P<0.05),而与胃癌患者的年龄、性别无明显关系(P>0.05),这提示循环肿瘤细胞也许可以成为诊断胃癌的血液学指标,以提高胃癌的早期诊断率;淋巴结转移及其他远处转移患者的循环肿瘤细胞阳性率高于无转移的胃癌患者(P<0.05),这提示血液中循环肿瘤细胞的出现与胃癌转移密切相关。另外,部分早期胃癌患者外周血中可查到循环肿瘤细胞,这表明早期胃癌在未出现明显影像学转移灶时已发生微转移,这将对胃癌的诊断及制订治疗方案方面起到至关重要的作用。肿瘤临床分期越高,循环肿瘤细胞的阳性率越高。
4.3 循环肿瘤细胞检测的临床应用价值
大量研究证实,循环肿瘤细胞与肿瘤复发和转移密切相关(P<0.05),检测循环肿瘤细胞有助于肿瘤转移的早期诊断、临床分期、疗效监测及预后判断,并为肿瘤患者个体化治疗提供临床指导。作为一种标准化的检测体系,CellSearch系统的出现,使得在临床常规开展循环肿瘤细胞检测成为可能。此外,CellSearch系统以及其他的循环肿瘤细胞检测技术也在不断改进和发展,这有助于我们更深入地了解肿瘤转移的生物学特性,动态实时地分析患者的肿瘤分子特征,为真正的个体化治疗提供依据。
[1]Zong C,Lu S,Chapman A R,et a1.Genome-wide detec tion of singlenucleotide and copy-number variations of a single human cell[J].Science,2012,338(14):1622-1626.
[2]Cristofanilli M,Budd G T,Ellis M J,et al.Circulating tumor cells,disease progression,and survival inmetastatic breast cancer[J].N Engl JMed,2004,351(8):781-791.
[3]Chafer C L,Weinberg R A.A perspective on cancer cellm etastasis[J]. Science,20l1,331(24):1559-1564.
[4]乔媛媛.循环肿瘤细胞及其与肿瘤转移复发的相关性研究[J].现代肿瘤医学,2011,19(9):1877-1880.
[5]Pantel K,Alix-Panabieres C.Circulating tumour cells in cancer patients:challengesand perspectives[J].Trends in Molecular Medicine,2010,16(9):398-406.
[6]Paterlini Brechot P,Benali N L.Circulating tumor cells(CTC)detection:Clinical impactand future directions[J].Cancer Letters,2007,253(2):180-204.
[7]Alunni Fabbroni M,Sandri M T.Circulating tumour cells inclinical practice:Methods of detection and possible characterization[J].Methods,2010,50(4):289-297.
[8]Allard W J,Jeri Matera,Miller M C,et a1.Tumor cells circulate in the peripheral blood of all major carcinom as but not in healthy subjects or patients with nonmalignant diseases[J].Clin Cancer Res,2004,10(20):6897-6904.
[9]Hayes D F,Cristofanilli M,Budd G T,et al.Circulating tumor cells at each follow-up time point during therapy ofmeta static breast cancer patients predict progression-free and overall survival[J].Clin Cancer Res,2006,12(14):4218-4224.
[10]刘志东,许绍发,李云松,等.非小细胞肺癌循环肿瘤细胞的定量检测意义[J].中华胸心外科杂志,2009,25(3):184-186.
[11]Sastre J,Maestro M L,Puente J,et a1.Circulatin g tumor cells in colorectal cancer:correlation with clinical and path ological variables[J].Ann Oncol,2008,19(5):935-938.
[12]Tanaka F,Yoneda K,Kondo N,et a1.Circulating tumor cell as a diagnostic marker in primary tung cancer[J].Clin Cancer Res,2009,15(22):6980-6986.
[13]Hofman V,Ilie M I,Hofman P,et al.Detection of circulating tumor cells as a prognostic factor in patients undergoing radical surgery for nonsmall cell lung carcinoma:Comparison of the effieaey of the CellSearch Assay and the isolation by size of epithelial tumor cell method[J].Int J Cancer,2011,129(7):165l-1660.
(*通讯作者:米泰宇)
R735.2
:A
1671-1246(2017)17-0149-03
注:本文系甘肃省自然科学基金(145RJZA057)

