对二甲苯光氯化反应动力学研究
陈寿林,马定娜,王 赛
(青岛科技大学 化工学院,山东 青岛 206642)
对二甲苯光氯化反应动力学研究
陈寿林,马定娜,王 赛
(青岛科技大学 化工学院,山东 青岛 206642)
研究了对二甲苯光氯化反应的宏观动力学,通过气相色谱仪采用内标法测定并计算反应过程中反应体系内各组分的浓度。建立动力学方程,对各组分的浓度进行拟合,得到在不同温度下各步反应的速率常数。通过阿累尼乌斯方程计算得到各步反应的指前因子A和活化能Ea,对后期的工艺优化提供了有力的理论依据。
对二甲苯;光氯化反应;动力学
1,4-双(三氯甲基)苯既是一种抗血吸虫病药物[1]又是一种高效氯化剂[2],它对肝吸虫病、阿米巴原虫病、疟疾以及肠道线虫有一定疗效,但对神经系统的不良反应较多见,且延迟反应持续较久。作为氯化剂尤其是在氯化对苯二甲酸合成对苯二甲酰氯方面效果显著[3-4],相比于氯化亚砜法、三氯化磷法、五氯化磷法以及光气法,使用1,4-双(三氯甲基)苯作为氯化剂具有高效,节能、环保无污染等优点[5-7]。
1 实验部分
对二甲苯光氯化反应步骤见图1。
1.1 实验装置及流程叙述
光化学反应装置见图2。
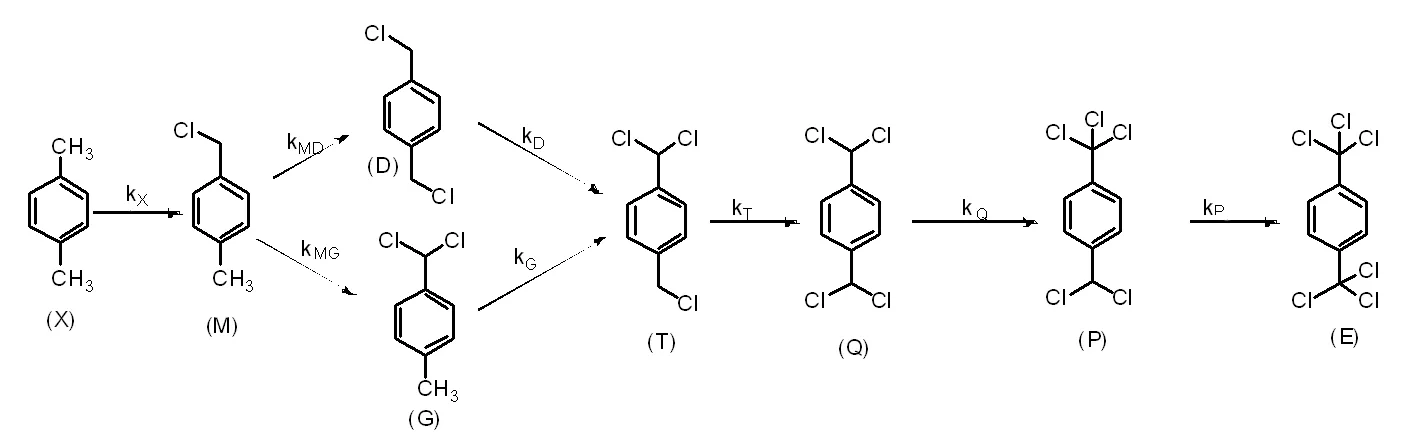
图1 对二甲苯光氯化反应步骤
Fig.1 The reaction step of photochlorination of p-xylene
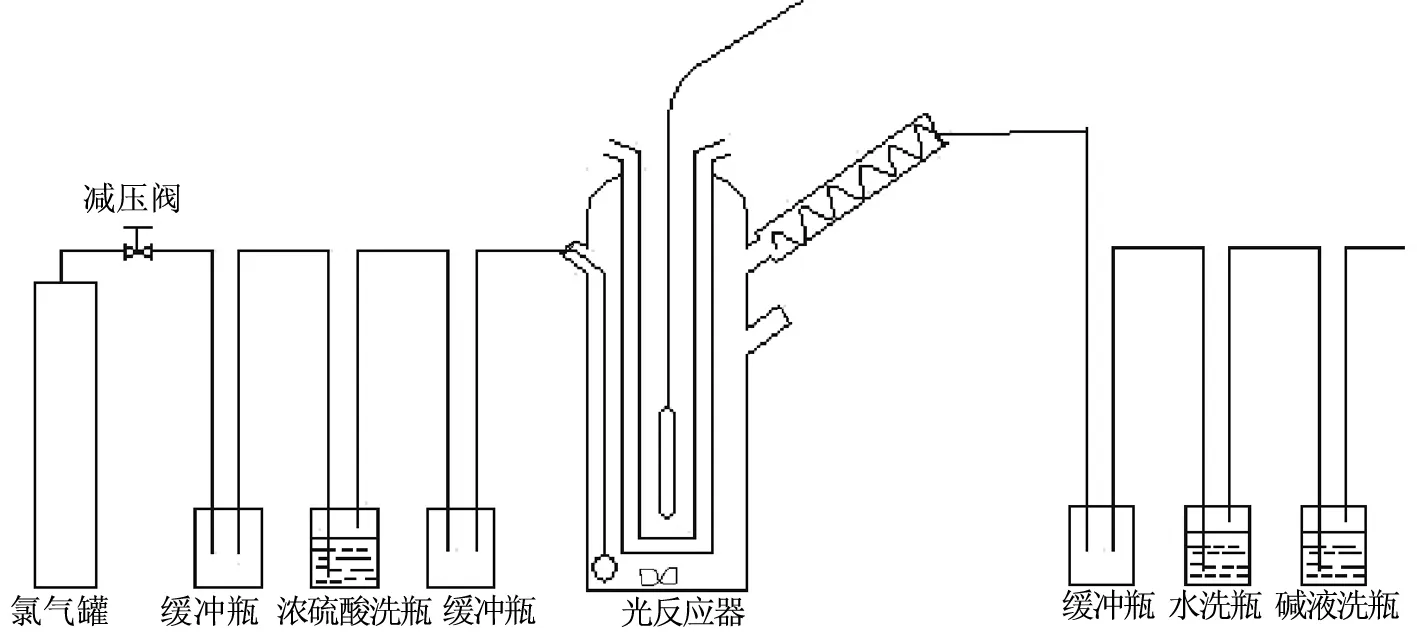
图2 光化学反应装置
测定对二甲苯光氯化合成1,4双(三氯甲基)苯工艺和公理学数据的实验流程图如图2所示。来自氯气钢瓶的氯气,经浓硫酸洗气后再经转子流量计计量由进料口经导管从外间隙底部流出,氯气分布器将氯气均匀的分散在反应体系中,在加热以及紫外光照射作用下氯气与对二甲苯发生发应,尾气则由冷凝管回收其中的科宁省原料和产物,不凝性的尾气(主要是氯气和氯化氢)进入碱液吸收系统。
1.2 分析方法
本实验使用气相色谱分析,定量分析方法采用面积归一法。
气相色谱仪采用岛津GC-2014;色谱柱,ENX5型弱极性毛细管柱;数据处理系统采用N2000色谱工作站;分析条件:载气压力为0.05MPa;氢气压力为0.05MPa;柱温70~250℃;检测室温260℃;汽化室温240℃;进样量0.2μL。
2 动力学方程的建立与参数的计算
查阅以往文献,芳香烃光氯化反应动力学的研究并不算多,甲苯侧链光氯化反应动力学的研究结果[8]表明,在反应温度一定时,甲苯光氯化反应速率与氯气浓度(或分压)、反应物浓度、光照强度有关。在光照强度固定及反应区域中氯气过量存在时,甲苯侧链光氯化反应可以简化成拟一级连串反应。与甲苯光氯化类似,本实验对二甲苯光氯化也在光照强度固定,氯气过量的情况下反应,也可以尝试简化为拟一级反应。因为反应产物4-甲基氯化苄继续氯化时,会同时产生4-甲基-1-二氯甲基苯和1,4-双(一氯甲基)苯两种产物,然后该两种产物继续氯化生成1-二氯甲基-4-一氯甲基苯,所以本实验可简化为拟一级连串竞争反应。
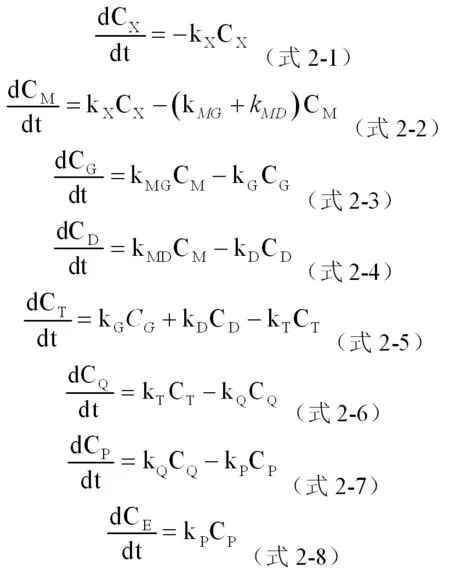
2.1 反应速率常数的计算
反应过程中对二甲苯的浓度随时间的增长而逐渐减小直至完全消失,1,4-双(三氯甲基)苯的浓度随着反应时间的增长而逐渐增大,其余各组分的浓度均是随着反应的进行先增大后减小,每个组分的浓度都存在一个最大值。
当组分中对甲基氯化苄(M)的浓度CM达到最大时,
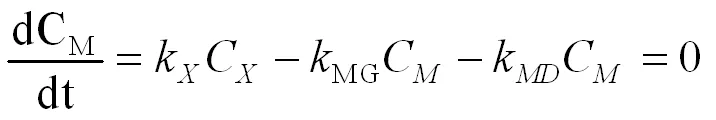
(式2-9)
由上式得,
(式2-10)
当组分中对甲基二氯甲基苯(G)的浓度CG达到最大时,
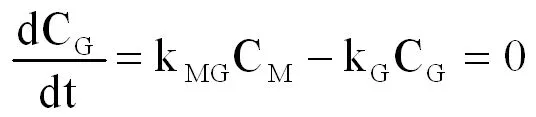
(式2-11)
由上式得,
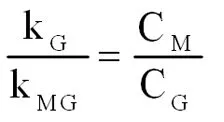
(式2-12)
当组分中对二氯苄(D)的浓度CD达到最大时,

(式2-13)
由上式得,

(式2-14)
当组分中1-二氯甲基-4-一氯甲基苯(T)的浓度CT达到最大时,
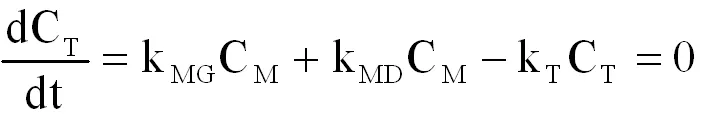
(式2-15)
由上式得,
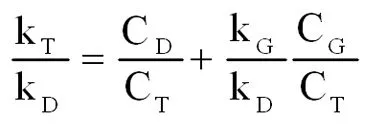
(式2-16)
当组分中1,4-双(二氯甲基)苯(Q)的浓度CQ达到最大时,

(式2-17)
由上式得,
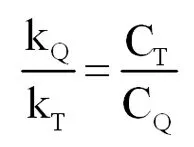
(式2-18)
当组分中1-三氯甲基-4-二氯甲基苯(P)的浓度CP达到最大时,
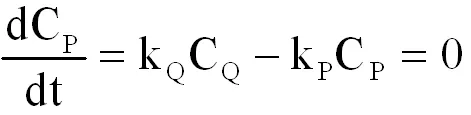
(式2-19)
由上式得,

(式2-20)
合并(式2-3)和(式2-4)两式得,

(式2-21)
在反应初始时,对甲基二氯甲基苯的浓度CG和对二氯苄的浓度CD都是零(CG=0,CD=0),
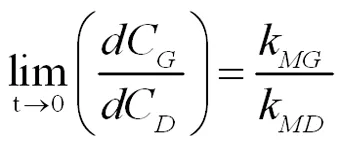
(式2-22)
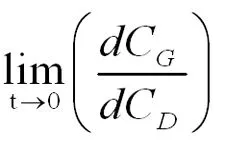

的值。
分别做CM随时间t变化、CG随随时间t变化、CD随随时间t变化、CT随随时间t变化、 随随时间t变化、CQ随随时间t变化和CP随随时间t变化的曲线,可根据曲线获得当各组分浓度达到最大值时响应的浓度比(CX/CM)、(CM/CG)、(CM/CD)、(CG/CT)、(CD/CT)、(CT/CQ)和(CQ/CP) 的对应值。
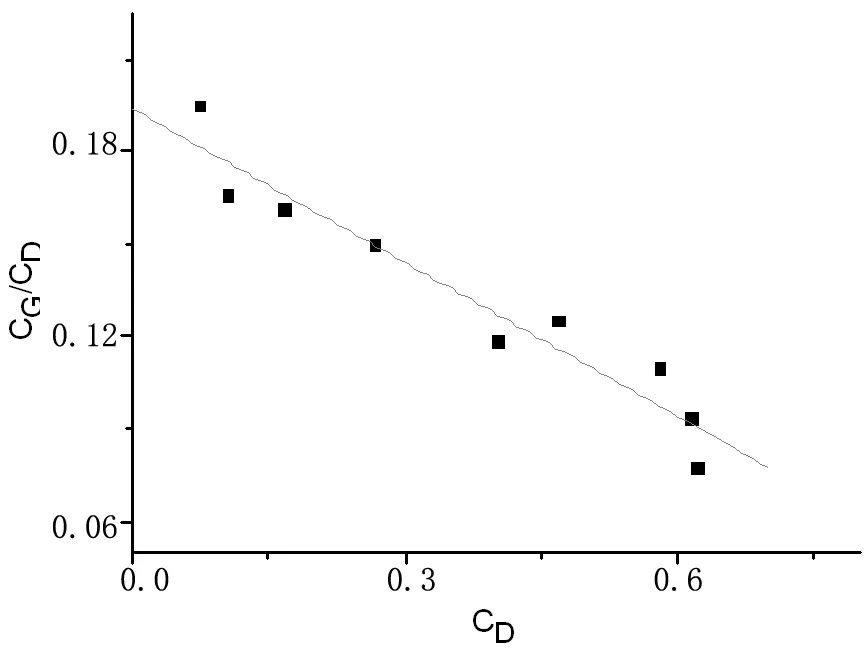
图3 (CG/CD)随CD变化的曲线
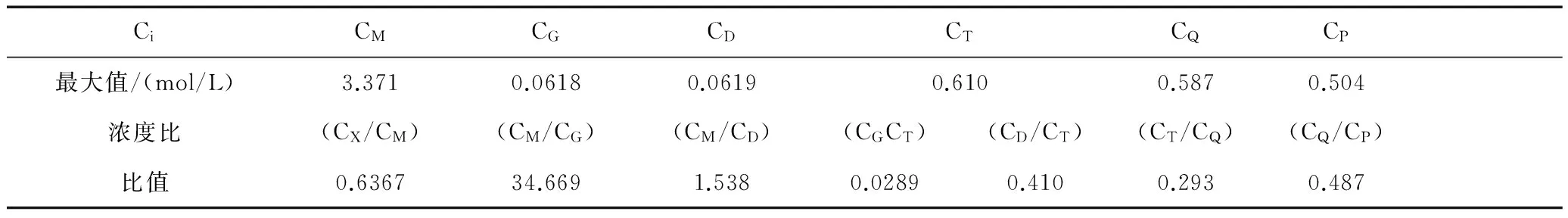
CiCMCGCDCTCQCP最大值/(mol/L)3.3710.06180.06190.6100.5870.504浓度比(CX/CM)(CM/CG)(CM/CD)(CGCT)(CD/CT)(CT/CQ)(CQ/CP)比值0.636734.6691.5380.02890.4100.2930.487
结合(式2-10)、(式2-12)、(式2-14)、(式2-16)、(式2-18)和(式2-20)可计算得相对速率常数,见表2。
表2 60℃时相对速率常数

Table 2 The relative rate constant at 60℃
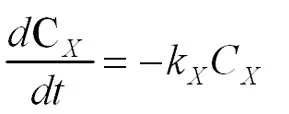
当t=0时,CX=8.112,绘制lnCX随时间t变化的曲线得图4:

图4 lnCX随时间变化t的曲线
进而得到 ,结合表2得到各步反应速率常数,见表3。

表3 60℃时各步反应速率常数
将速率常数带入反应动力学方程利用MATLAB软件解方程,并利用Origin绘图软件绘制曲线与实验值比较。
从图5、6看出,实验值与计算值基本吻合,说明之前动力学方程级数为一级的假设成立。
2.2 指前因子与活化能的计算
分别测定并计算得反应在40,80,100,120℃和140℃下各步反应速率常数,见表4。
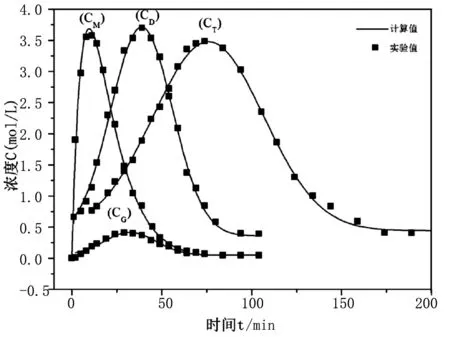
图5 实验值与计算值的比较(1)
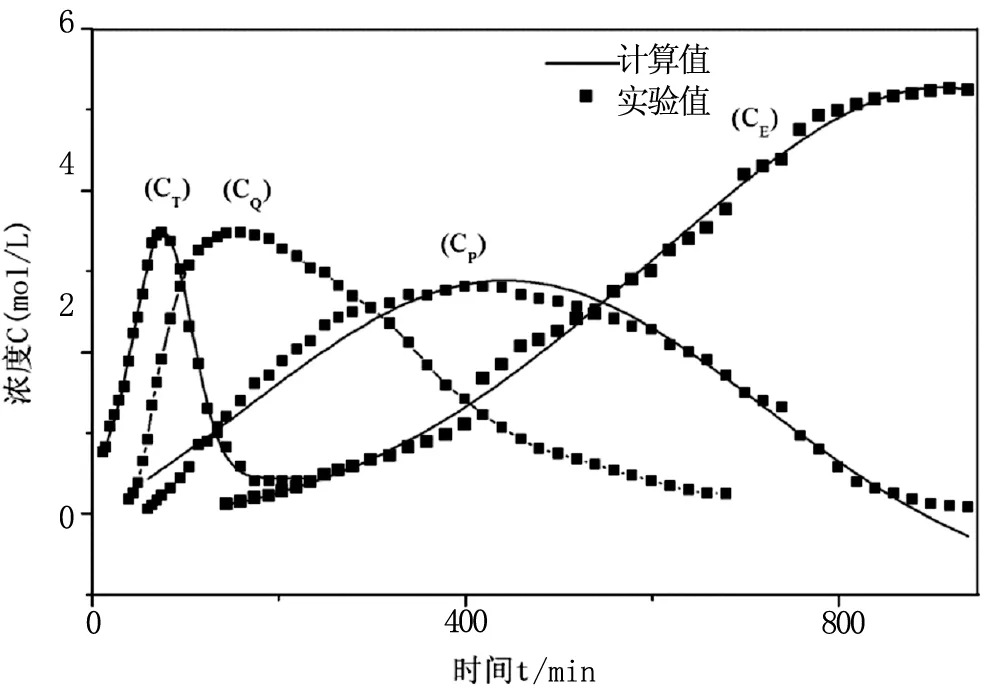
图6 实验值与计算值的比较(2)
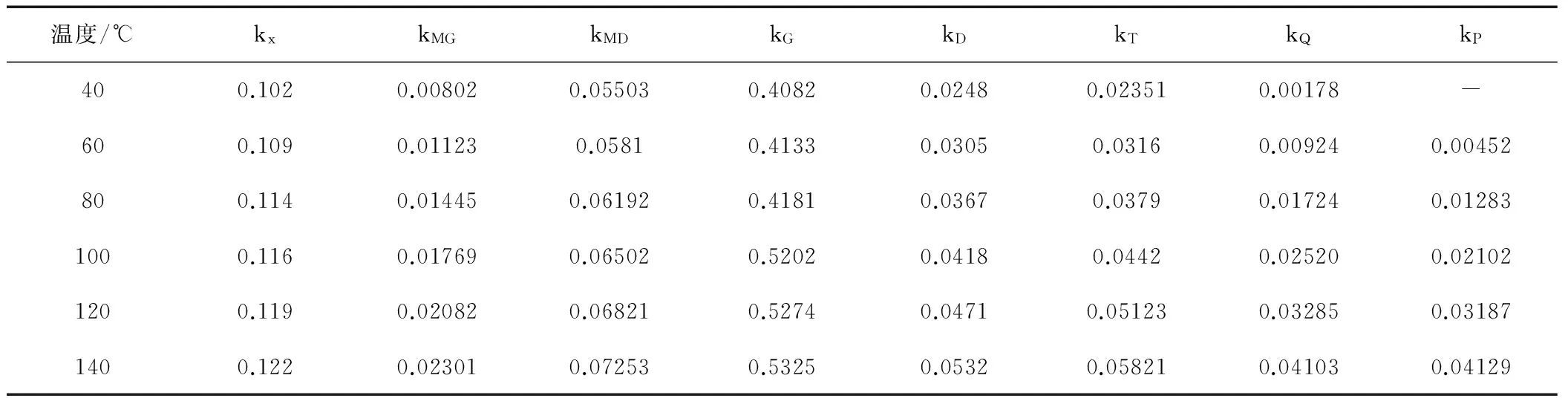
温度/℃kxkMGkMDkGkDkTkQkP400.1020.008020.055030.40820.02480.023510.00178-600.1090.011230.05810.41330.03050.03160.009240.00452800.1140.014450.061920.41810.03670.03790.017240.012831000.1160.017690.065020.52020.04180.04420.025200.021021200.1190.020820.068210.52740.04710.051230.032850.031871400.1220.023010.072530.53250.05320.058210.041030.04129
由阿伦尼乌斯方程可以计算出八步竞争连串反应中每一步反应的指前因子和活化能。阿伦尼乌斯方程形式如下:
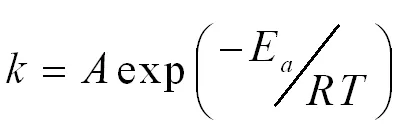
(式2-24)
由上式可以得到:
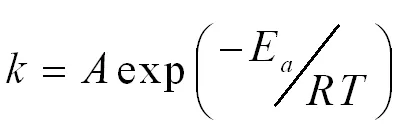
(式2-25)
将各温度下的反应速率常数KX、KMG、KMD、KG、KD、KT、KQ和KP的值带入动力学方程进行拟合,结果见表5。

表5 参数拟合结果表
[1] 李 龙.抗血吸虫病药物的研究现状[J].兽医导刊,2009 (8):43-45.
[2] 刘红云,牟银慧. 重整氯化剂的应用及其对健康和环境的影响[J].炼油技术与工程.2003,33(5):56-58.
[3] 金 栋.对苯二甲酰氯的生产和应用前景[J].精细化工原料及中间体,2012 (8):17-20.
[4] 游安基,陆道惠,宝净生,等.苯二甲酰氯纯度分析[J]. 合成纤维工业, 1982 (1): 32-35.
[5] 刘柏松,刘国栋,孟庆荣,等. 一种快速制备对苯二甲酰氯的方法[J]. 化学试剂, 2006,28(7):446-450.
[6] 程永浩,邹小毛,任雪玲,等. 对苯二甲酰氯合成[J]. 化学试剂,2003,25(2):118-121.
[7] 盛庆全,肖鉴谋,栾伟丽,等.对苯二甲酰氯合成研究进展[J].江西化工,2007(4):15-18.
[8] Haring H G , Knol H W . Photochemical side-chain chlorination of toluene[J]. Chemical and Process Engineering, 1964, 45(10): 560-567.
(本文文献格式:陈寿林,马定娜,王 赛.对二甲苯光氯化反应动力学研究[J].山东化工,2017,46(08):40-43.)
Study on the Reaction Kinetics of the Photo-Chlorintion of P-xylene
ChenShoulin,MaDingna,WangSai
(Qingdao University of Science and Technology,Qingdao 266042, China)
In this paper, the macroscopic kinetics of chlorination reaction of p-xylene was studied. The concentration of each component in the reaction system was determined by internal standard method through gas chromatography. The kinetic equation is established, and the concentration of each component is fitted. The rate constants of the reaction at different temperatures were obtained. The pre - exponential factor A and the activation energy Ea of each step reaction were calculated by the Arrhenius equation which provides a strong theoretical basis for the later process optimization.
p-xylene;chlorination reaction;kinetics
2017-03-03
陈寿林(1990—),山东临清人,硕士,研究方向精细有机合成。
O643.1;O621.25
A
1008-021X(2017)08-0040-04

