人乳头瘤病毒在宫颈鳞癌宫旁组织中的表达及意义
杨 卓, 陈英汉, 顾佳晖, 刘岿然, 李馨慧, 王丹波
(1.中国医科大学附属盛京医院 妇产科,辽宁 沈阳 110004;2.中国医科大学肿瘤医院 妇产科,辽宁 沈阳 110000)
人乳头瘤病毒在宫颈鳞癌宫旁组织中的表达及意义
杨 卓1, 陈英汉1, 顾佳晖1, 刘岿然1, 李馨慧1, 王丹波2
(1.中国医科大学附属盛京医院 妇产科,辽宁 沈阳 110004;2.中国医科大学肿瘤医院 妇产科,辽宁 沈阳 110000)
为研究高危型人乳头瘤病毒(high-risk human papillomavirus,hr-HPV)在宫颈鳞癌宫旁组织中的表达及意义,采用免疫组织化学技术对51例宫颈鳞癌患者术后宫旁组织不同位点的hr-HPV表达情况进行检测,应用重复测量设计的方差分析及单因素分析方法进行统计。hr-HPV在宫旁组织中的表达随着距宫颈距离的增加呈明显的梯度下降趋势(P<0.05),在不同临床分期、宫颈浸润深度、淋巴结转移组内表达存在差异(P<0.05),当临床分期ⅠB1期、宫颈浸润深度≤1/2以及无淋巴结转移时,hr-HPV在距离宫颈2 cm处主韧带、骶韧带及距离宫颈3 cm处阴道中表达开始与正常对照组无差异(P>0.05)。结果表明,部分早期宫颈鳞癌患者可选择Ⅱ型改良式根治性子宫切除术,但阴道切除仍推荐>3 cm。
人乳头瘤病毒;宫颈鳞癌;宫旁组织
我国宫颈浸润癌(invasive cervical cancer,ICC)以每年约13.15万新发病例的速度在增长,年轻患者及早期诊断患者比例逐年上升[1]。目前对于全部IA2-ⅠB1期患者均采用根治性子宫切除术,由此给患者带来的膀胱、直肠等功能障碍及性功能障碍等至今仍是临床面临的最大问题。妇科肿瘤医生已尝试探讨对部分ⅠB1期患者适当缩小宫旁组织切除范围,进一步保护周围脏器功能、性功能,降低术后并发症几率,提高生活质量,目前观察总生存率及预后未见影响,但如何筛选出部分早期患者及宫旁组织切除的安全范围仍无基础理论依据支持。高危型人乳头瘤病毒(high-risk human papillomavirus,hr-HPV)的感染是宫颈浸润癌发病的核心因素[2],其持续活性是发生和进展到高级别宫颈病变及宫颈癌的必要条件,也是宫颈癌疾病进展过程中的预示性标记物[3]。因此,本研究应用免疫组织化学技术检测51例宫颈鳞癌患者术后宫旁组织不同离心位点的hr-HPV表达情况,分析其与临床分期、病理浸润深度、淋巴结转移、病理分化的相关性,以期为进一步探讨宫颈癌个体化手术范围提供客观依据。
1 材料与方法
1.1 材料
1.1.1 研究对象与分组 选取2014年1月至2016年1月间在中国医科大学附属盛京医院诊治的早期宫颈浸润癌患者为实验组,共计51例,中位年龄48.28岁(36岁~52岁),根据临床分期分为两组:ⅠB1期组23例;>ⅠB1期组28例。对照组选择因其他良性疾病选择全子宫切除及hr-HPV16、18阳性的手术患者,共计20例。全部病例均经盛京医院伦理委员会审批,术前患者签署知情同意书,术后均经病理再次确认诊断,同时证明宫旁无癌浸润。
1.1.2 实验组入选标准及排除标准 ①入选标准:原发宫颈鳞癌,未进行术前化疗或放疗,无其他肿瘤病史;行III型根治性子宫切除术,即主韧带、骶韧带及阴道切除范围>3 cm;hr-HPV16、18阳性;术后病理确定无宫旁组织受累。 ②排除标准:合并其他恶性肿瘤;其他型HPV病毒感染或无HPV感染;术前接受新辅助化疗等其他治疗;行II型根治性子宫切除术,宫旁组织手术切除范围<3 cm;病理诊断为其他病理类型或者宫旁组织受累。
1.2 方法
1.2.1 宫旁组织获取 实验组:宫颈癌根治性子宫切除术后立即取主、骶韧带及阴道的不同位点新鲜组织,各组距宫颈1、2 及3 cm处分别标记为主韧带1、主韧带2、主韧带3,骶韧带1、骶韧带2、骶韧带3及阴道1、阴道2、阴道3,见图1。对照组:全子宫切除术中于切除断端获取正常主韧带、骶韧带及阴道组织。
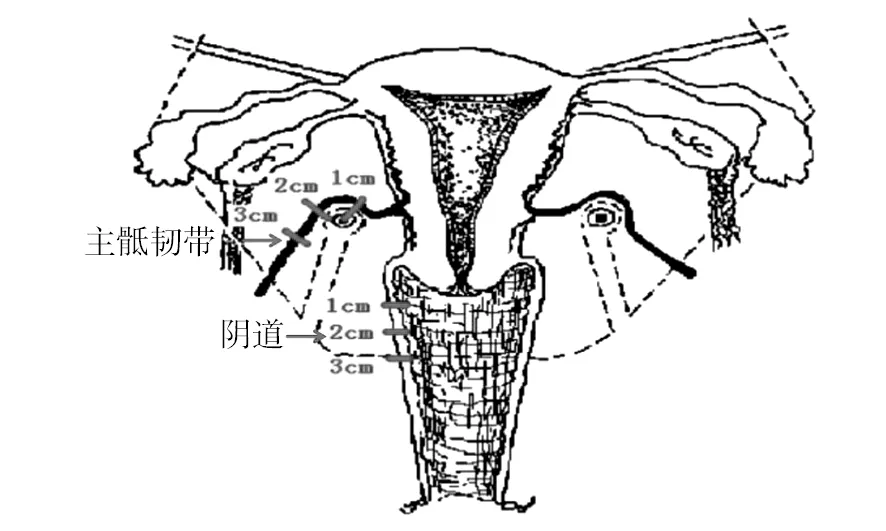
图1 骶韧带及阴道的靶位点选取示意图Fig.1 Target site selection of cardinal ligament, sacral ligament and vagina
实验组新鲜标本分成两份,一份浸泡于福尔马林、石蜡包埋,随机多点抽取石蜡切片进行常规HE染色,确定病理无转移;另一份液氮迅速冻存后移至-80 ℃冰箱保存。
1.2.2 免疫组织化学检测hr-HPV16、18的表达 利用过氧化物酶标记的链霉卵白素染色试剂盒进行ABC免疫组化法检测hr-HPV16、18的表达。蜡块连续切片,厚度4~6 μm,每个位点连续切片10张;一抗为生物素标记山羊抗兔大鼠小鼠豚鼠IgG,调节浓度为1∶100;最后应用DAB显色。
1.2.3 结果读取及评分标准 结果由双人双盲进行光学显微镜观察,按阳性细胞百分比及阳性细胞染色强度评分,HIS=X×Y,使用免去一抗的空白对照作为阴性对照。 X代表阳性细胞的百分比对应的评分:阳性细胞显色数≤25%,X=1;阳性细胞显色数26%~50%,X=2;阳性细胞显色数51%~75%,X=3; 阳性细胞显色数>75%,X=4。 Y代表阳性细胞染色强度:不显色,Y=1;浅黄色,Y=2;棕黄色,Y=3;深黄,Y=4。
1.2.4 统计学处理 使用SPSS21.0统计软件进行数据分析,检测结果以均值±标准差表示,应用重复测量设计的方差分析、单因素方差分析进行各靶组织及不同分组间hr-HPV16、18的表达差异比较,P<0.05为有统计学意义。
2 结果与分析
2.1 各靶组织中hr-HPV16、18的表达情况
由图2、图3可以看出,随着距宫颈的距离增加(1、2、3 cm)hr-HPV16、18在主韧带、骶韧带、阴道中呈明显的梯度下降趋势(P<0.05)。
2.2 hr-HPV16、18表达与临床分期、病理浸润深度、淋巴结转移、病理分化的相关性
hr-HPV16、18表达在不同临床分期、宫颈浸润深度、淋巴结转移组间表达存在差异(P<0.05);而在不同病理分化组间表达均无差异,见表1。进一步的研究将筛选同时满足ⅠB1期、宫颈浸润深度≤1/2及无淋巴结转移低危因素的设为“早期组”,其他设为“晚期组”,分别进行各位点再比较。

图2 hr-HPV16、18在宫旁组织中的阳性表达Fig.2 The positive expression of hr-HPV16、18 in the parametriuma:主韧带;b:骶韧带;c:阴道;图3同a: cardinal ligament;b: sacral ligament;c: vagina;Figure 3 is the same

图3 hr-HPV16、18在距宫颈1、2、3 cm宫旁组织中的表达Fig.3 The expression of HPV in parametrium with the increasing distance from the cervix (1 cm,2 cm,3 cm)
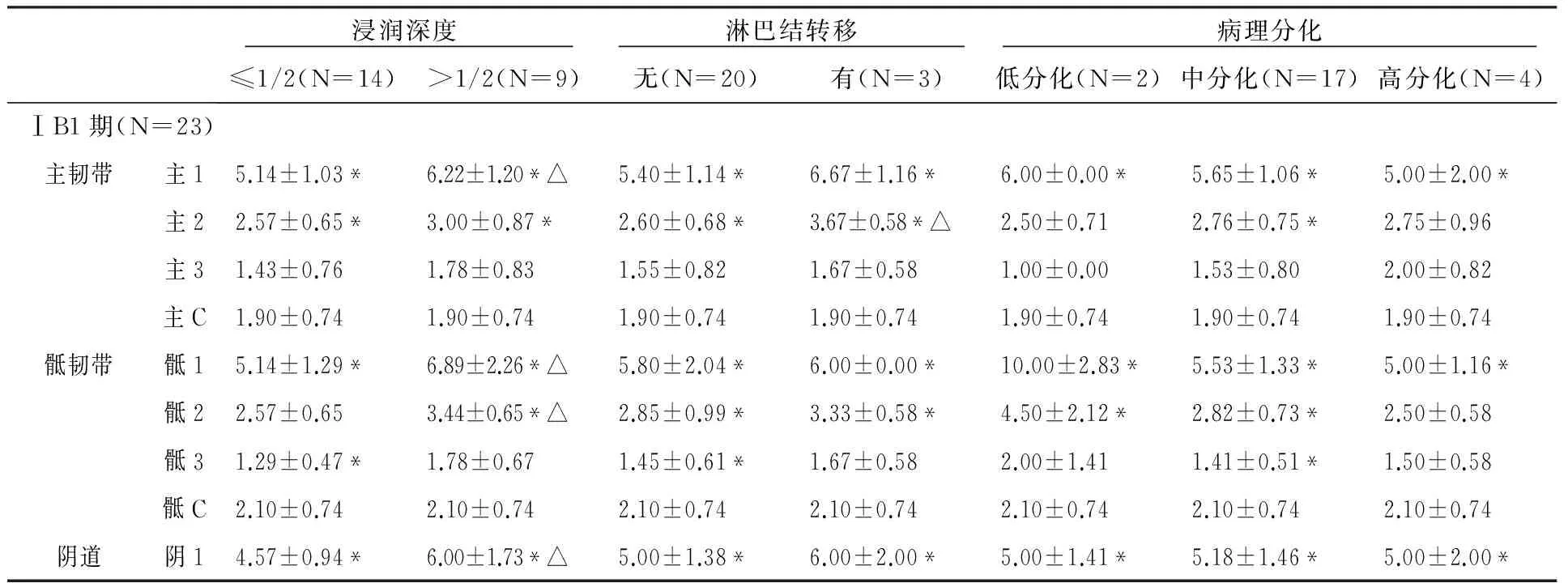
浸润深度 淋巴结转移 病理分化 ≤1/2(N=14)>1/2(N=9)无(N=20)有(N=3)低分化(N=2)中分化(N=17)高分化(N=4)ⅠB1期(N=23)主韧带主15.14±1.03*6.22±1.20*△5.40±1.14*6.67±1.16*6.00±0.00*5.65±1.06*5.00±2.00*主22.57±0.65*3.00±0.87*2.60±0.68*3.67±0.58*△2.50±0.712.76±0.75*2.75±0.96主31.43±0.761.78±0.831.55±0.821.67±0.581.00±0.001.53±0.802.00±0.82主C1.90±0.741.90±0.741.90±0.741.90±0.741.90±0.741.90±0.741.90±0.74骶韧带骶15.14±1.29*6.89±2.26*△5.80±2.04*6.00±0.00*10.00±2.83*5.53±1.33*5.00±1.16*骶22.57±0.653.44±0.65*△2.85±0.99*3.33±0.58*4.50±2.12*2.82±0.73*2.50±0.58骶31.29±0.47*1.78±0.671.45±0.61*1.67±0.582.00±1.411.41±0.51*1.50±0.58骶C2.10±0.742.10±0.742.10±0.742.10±0.742.10±0.742.10±0.742.10±0.74阴道阴14.57±0.94*6.00±1.73*△5.00±1.38*6.00±2.00*5.00±1.41*5.18±1.46*5.00±2.00*
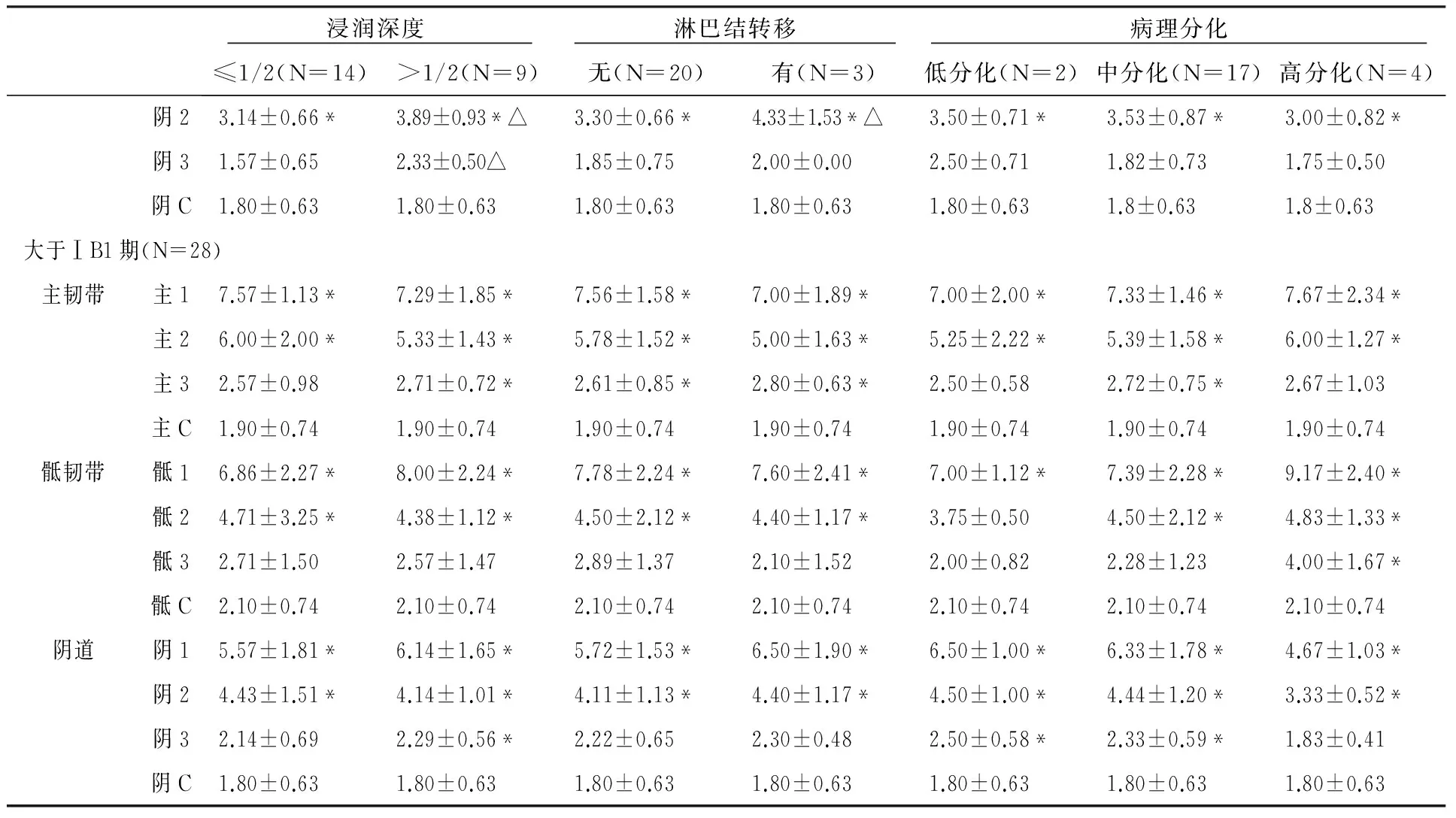
续表1
注:主C、骶C、阴C为正常对照组;*表示与正常对照相比较P<0.05;△表示病理因素组内比较P<0.05
2.3 “早期组”及“晚期组”各靶位点hr-HPV16、18的表达
hr-HPV16、18表达在“早期组”主、骶韧带2 cm处与对正常照组无差异,在阴道3 cm处与正常对照组无差异,而hr-HPV16、18表达在“晚期组”于主、骶韧带3 cm处与正常对照组无差异,在阴道3 cm处仍与对照组有显著差异(P<0.05),见图4。
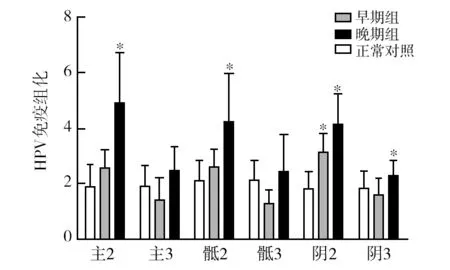
图4 hr-HPV16、18在“早期组”及“晚期组”各靶位点的表达情况Fig.4 The expressions of hr-HPV16、18 in different loci in "the early group" and "the advanced group" *表示与正常对照组相比表达有差异,P<0.05* means compareing with the normal control group, P<0.05
3 讨 论
现代医学对肿瘤治疗越来越追求个体化治疗方案的制定,当前的趋势是将之前统一在同一临床分期的肿瘤根据临床特点等细化分类,更有个体化、人性化的选择治疗方案。Ⅱ型改良式根治性子宫切除术,与Ⅲ型根治性子宫切除术最大的区别在于在宫旁约1.5~2.0 cm的子宫动脉与输尿管交叉处切断结扎子宫动脉,部分切除主韧带和子宫骶韧带,既保证了肿瘤“A”级根治手术切缘距离癌灶至少1 cm的根治范围[7-8],同时很好地保留了营养膀胱、远端输尿管及直肠的神经和血管,降低了并发症的发病率,从而提高患者的生存质量。当前基于对宫颈癌基础和临床的深入认识以及多元化治疗方式的配合与进展,宫颈癌的手术范围与几十年前的手术方式相比,总体上趋向于缩小。那么对于相对早期、无高危因素的患者是否可以缩小手术范围,如行Ⅱ型改良式根治性子宫切除术,而不影响治愈率及生存率呢?目前,Kodama 等[9]、Gemer等[10]、Kodama等[11]进行的多项临床研究已经对这一焦点问题进行了探讨,但目前少有基础实验对此进行验证。
宫颈癌宫旁组织受累是肿瘤转移的复杂过程,致病基因hr-HPV16、18的整合、表达起着关键的作用。本研究结果表明,hr-HPV16、18表达在实验组宫旁组织中随着距宫颈的距离增加(1、2、3 cm)呈明显的梯度下降趋势(P<0.05),不同临床分期、宫颈浸润深度及淋巴结转移情况下hr-HPV16、18的表达有差异(P<0.05),这与其他临床研究的结果基本符合。Lee等的临床研究表明,通过对宫颈癌术后患者病理情况统计,仅约有4%~11%的患者存在宫旁累及[12],当肿瘤直径≤2 cm,无宫颈深肌层浸润,无淋巴血管间隙浸润,无淋巴结转移等情况时,宫旁受累的风险明显下降[11,13]。本研究结果也表明当同时满足临床分期ⅠB1期、宫颈浸润深度≤1/2以及无淋巴结转移的低危因素,即“早期组”时,hr-HPV16、18在距离宫颈2 cm处主韧带、骶韧带中表达开始与正常对照组无差异,在距离宫颈3 cm处阴道中表达与正常对照组无差异;而“晚期组”hr-HPV16、18在距离宫颈3 cm处的各组宫旁组织中表达仍有差异,提示可考虑缩小此类患者宫旁主、骶韧带的手术切除范围,采用Ⅱ型改良式根治性子宫切除术,保留营养膀胱、远端输尿管及直肠的神经和血管,减少手术创伤,降低并发症风险,在保证治疗肿瘤、延长肿瘤患者生存的同时提高生存质量[14-16]。
本研究结果显示,阴道3 cm切缘处在晚期组hr-HPV16、18表达仍显现出与正常对照组有差异,而早期组在3 cm处方显现出与对照组无差异,是因为HPV感染弥漫性导致,还是说明无论早期还是晚期,阴道切除范围仍然保证>3 cm才更安全,有待进一步完善研究论证。同时本研究仅检测了hr-HPV16、18一种指标在宫旁组织的表达情况,具有一定局限性,应进一步检测与宫颈癌侵袭、转移相关的其他因子在宫旁组织中的表达情况,以验证研究结果。
总之,hr-HPV16、18在宫颈鳞癌宫旁组织中的表达随着距宫颈的距离增加呈明显的梯度下降趋势,并且与临床分期、宫颈浸润深度及淋巴结转移病理因素相关,当同时满足临床分期ⅠB1期、宫颈浸润深度≤1/2以及无淋巴结转移的低危因素,hr-HPV16、18在距离宫颈2 cm处主韧带、骶韧带中表达与正常对照组无差异,在距离宫颈3 cm处阴道中表达与正常对照组无差异,提示可考虑缩小此类患者宫旁主、骶韧带的手术切除范围,采用Ⅱ型改良式根治性子宫切除术,但阴道切除范围仍推荐>3 cm。
[1] 朗景和.中华妇产科杂志临床指南荟萃[M]. 北京:人民卫生出版社,2015:361.
[2] Walboomers JM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J]. Journal of Pathology, 1999, 189(1): 12-19.
[3] Joseph A.Jordan, Albert Singer. The cervix (second edition)[M]. USA: Blackwell Publishing Ltd,2009.
[4] Koh WJ,Greer BE,Abu-Rustum NR,et al. Cervical,Version 2. 2015[J].J Natl Compr Canc Netw,2015,13(4):359-404.
[5] 徐光炜.肿瘤外科历史回顾及未来憧憬[J].国外医学肿瘤学分册, 2000, 27(1):1-5.
[6] Greenlee RT, Hill-Harmon MB, Murray T, et a1. Cancer statistics[J]. CA Cancer J Clin,2001, 51(1):15-36.
[7] Michalas S, Rodolakis A, Voulgaris Z, et al. Management of early-stage cervical carcinoma by modified (type II) radical hysterectomy[J]. Gynecol Oncol, 2002, 85:415-22.
[8] Girardi F, Pickel H, Winter R. Pelvic and parametrial lymph nodes in the quality control of the surgical treatment of cervical cancer[J]. Gynecol Oncol,1993, 50: 330-333.
[9] Kodama J, Kusumoto T, Nakamura K, et al. Factors associated with parametrial involvement in stage IB1 cervical cancer and identification of patients suitable for less radical surgery[J]. Gynecol Oncol, 2011, 122(3):491-494.
[10]Gemer O, Eitan R, Gdalevich M, et al. Can parametrectomy be avoided in early cervical cancer? An algorithm for the identification of patients at low risk for parametrial involvement[J]. Eur J Surg Oncol, 2013, 39(1):76-80.
[11]Kodama J, Fukushima C, Kusumoto T, et al. Stage IB1 cervical cancer patients with an MRI-measured tumor size < or = 2 cm might be candidates for less-radical surgery[J]. Eur J Gynaecol Oncol, 2013, 34(1):39-41.
[12]Lee Yoo-Young, Choi Chel Hun, Sung Chang Ohk, et al. Prognostic value of pre-treatment circulating monocyte count in patients with cervical cancer: comparison with SCC-Ag level[J]. Gynecol Oncol, 2012, 124(1):92-97.
[13] Schmeler KM, Frumovitz M, Ramirez PT. Conservative management of early stage cervical cancer: is there a role for less radical surgery?[J]. Gynecol Oncol, 2011, 120:321-325.
[14]Carrillo CE, Marin OVA, Sole RM, et al. Role of 18F-FDG-PET/CT in the management of Burkitt lymphoma[J]. Eur J Haematol. 2015, 94(1):23-30.
[15]Kraljevic Z, Viskovic K, Ledinsky M, et al. Primary uterine cervical cancer: correlation of preoperative magnetic resonance imaging and clinical staging (FIGO) with histopathology findings[J]. Coll Antropol, 2013, 37(2):561-568.
[16] Ryu SY, Kim MH, Nam BH, et al. Intermediate-risk grouping of cervical cancer patients treated with radical hysterectomy: a Korean Gynecologic Oncology Group study[J]. Br J Cancer, 2014, 110(2):278-285.
Human Papillomavirus Expressions in Parametrium of Cervical Squamous Carcinoma and Its Clinical Significance
YANG Zhuo1, CHEN Ying-han1, GU Jia-hui1, LIU Kui-ran1, LI Xin-hui1, WANG Dan-bo2
(1.Dept.ofObstet&Gynecol,Affil.Hosp.Shengjing,ChinaMed.Uni.,Shenyang110004; 2.Dept.ofObstet&Gynecol,CancerHosp.,ChinaMed.Uni.,Shenyang110000)
Expression of high-risk human papillomavirus (hr-HPV) in parametrium of cervical squamous carcinoma and its significance was studied adopting immunohistochemistry in parametrium of 51 patients with cervical squamous carcinoma after operation, from the cancer tissue adjacent to different sites of parametrium foci to carry out tests and detection, and applied repeated measurement design to carry out statistics for analyses of variance as well as analyses of single factor. In the parametrium with increasing distance from the cervix, the expressions of hr-HPV showed a trend of obvious gradient descent (P<0.05). The expression of hr-HPV existed differences between groups in different clinical stage, cervical infiltration depth, within tissue in lymph node metastasis expression (P<0.05). When clinical stage at ⅠB1, the infiltration depth of cervical ≤1/2 as well as no lymph node metastasis, the expression of hr-HPV has no difference with the normal control group in the cardinal ligaments at 2 cm, sacral ligaments at 2 cm, and in vaginal at 3 cm (P>0.05). The results showed that part of early stage cervical cancer patients could choose individualized typeⅡ modified radical hysterectomy, but vaginal removal by >3 cm is still recommended.
human papillomavirus; cervical squamous carcinoma; parametrium
辽宁省自然科学基金项目(2014021029);中国医科大学附属盛京医院科研基金项目(ME66)
杨卓 女,讲师,主治医师。主要从事宫颈病变及宫颈癌的临床及基础研究。
Tel:024-23892617,E-mail:yangz@sj-hospital.org
2017-03-14;
2017-03-23
Q939.47;R711.74
A
1005-7021(2017)03-0043-05
10.3969/j.issn.1005-7021.2017.03.008

