基于离子液体的基质固相分散萃取结合高效液相色谱法测定肌肉组织中的氟喹诺酮类抗生素
徐尉力,聂 稳,张凯丽,郭海南,朱守明,马国祥,王志兵*
基于离子液体的基质固相分散萃取结合高效液相色谱法测定肌肉组织中的氟喹诺酮类抗生素
徐尉力,聂 稳,张凯丽,郭海南,朱守明,马国祥,王志兵*
(长春工业大学化学与生命科学学院,吉林 长春 130012)
将基质固相分散、离子液体均相液-液微萃取和高效液相色谱法相结合,建立一种用于肌肉组织中依诺沙星、培氟沙星、诺氟沙星和恩诺沙星4 种氟喹诺酮类药物的分析方法。首先以硅胶为分散剂,以200 μL 1-己基-3-甲基咪唑四氟硼酸盐([C6mim]BF4)离子液体为萃取剂,pH 1.0水溶液为洗脱剂,采用基质固相分散法处理样品,目标分析物被转移至洗脱液中后,再以六氟磷酸铵为离子对试剂,采用均相液-液微萃取法分离、富集目标分析物于离子液体相中,最后通过高效液相色谱-二极管阵列检测器对目标物进行定量分析。结果表明,各化合物在线性范围内具有较好的线性关系(r>0.997 4),检出限为2.9~8.6 µg/kg,加标回收率在87.9%~105.3%之间,其相对标准偏差为2.2%~8.6%。本法操作简单,不使用有机溶剂,可广泛应用于动物肌肉组织中氟喹诺酮类抗生素的萃取与检测。
基质固相分散;离子液体均相液-液微萃取;氟喹诺酮类药物;肌肉样品;高效液相色谱
氟喹诺酮类抗菌剂属于吡酮酸类抗生素的衍生物,是20世纪70年代初发展起来的第3代喹诺酮类药物,具有广谱、高效、低毒、吸收好等特点[1-5]。它对革兰阳性菌、革兰阴性菌、细胞内病原菌、支原体、衣原体及某些耐药菌株均有很好的抗菌活性,是兽医临床上治疗各种感染性疾病的常用药物[1,5-6]。但其在食品中残留可能会产生蓄积毒性和细菌耐药性,并引发一系列不良反应如神经中毒、肾功能损伤、过敏反应等[7-9]。因此,食品中兽药残留检测与监控对保证消费者饮食安全和身体健康至关重要。但由于各种食品组成十分复杂、干扰物质多,而且样品中兽药残留水平很低,不易进行待测组分的分离富集,这使样品前处理方法成为兽药残留分析检测技术中的关键环节。
基质固相分散是近些年国外新兴的一种在固相萃取基础上发展起来的新型样品提取分离方法[10-11],它集样品均匀化、组织细胞裂解、提取、过滤、净化于一体,避免了试样均化、转溶、乳化、浓缩等造成的待测物损失[12],使样品处理变得简单,尤其适合于固体、半固体和高黏稠的生物样品的分离分析[12-17]。但此法常以乙腈、甲醇、乙醚等有机溶剂作为萃取剂,不仅污染环境,还会危害实验操作人员的健康,而且有机溶剂缺乏对目标分析物的萃取选择性。由有机阳离子和有机或无机阴离子组成的离子液体[18-19],具有热稳定性好、密度大、不易燃、不挥发、环境友好、阴阳离子可设计性强等特点[20-21],且对各种无机和有机化合物有良好的溶解能力[21-24],是一种理想的代替传统有机溶剂用于萃取分离过程的绿色溶剂[25-26]。
本研究以硅胶为分散剂,离子液体水溶液为洗脱剂,将基质固相分散提取和离子液体均相液-液微萃取相结合,用于肌肉组织中氟喹诺酮类抗生素的提取、分离与富集,并且结合高效液相色谱法对多种食品进行了定量分析与检测。
1 材料与方法
1.1 材料与试剂
不同品牌的肌肉组织样品,包括牛肉(样品1、2)、猪肉(样品3、4)、羊肉(样品5、6)和鸡肉(样品7、8),均购自于长春市湖西路农贸市场。
标准品依诺沙星(enoxacin,ENO)、培氟沙星(pefloxacin,PEF)、诺氟沙星(norfloxacin,NOR)和恩诺沙星(enrofloxacin,ENR)(纯度均大于99%)美国Sigma公司;六氟磷酸铵(NH4PF6)、1-丁基-3-甲基咪唑四氟硼酸盐([C4mim]BF4)、1-己基-3-甲基咪唑四氟硼酸盐([C6mim]BF4)和1-辛基-3-甲基咪唑四氟硼酸盐([C8mim]BF4) 上海成捷化学有限公司;硅胶、硅藻土、弗罗里硅土、酸性氧化铝、中性氧化铝和碱性氧化铝 上海阿拉丁生化科技股份有限公司;乙腈、甲醇(色谱级) 美国费舍尔公司;其他试剂均为分析纯。1.2 仪器与设备
1100型高效液相色谱仪(配有二极管阵列检测器)、Zorbax SB-C18色谱柱(4.6 mm×150 mm,3.5 μm)、C18预柱(7.5 mm×2.1 mm,5 μm) 美国Agilent公司;Allegra 64R高速离心机 美国贝克曼公司;KQ-100DE超声波清洗器 江苏昆山市超声仪器有限公司。
1.3 方法
1.3.1 标准溶液的配制
分别准确称取ENO、PEF、NOR和ENR标准品各5 mg于10 mL容量瓶中,用含有冰醋酸浓度为4.72 mmol/L的乙腈溶液溶解,并定容至10 mL,配制成质量浓度为500 μg/mL的标准储备液,于4 ℃冰箱中保存,备用。工作溶液是由各标准储备液经乙腈稀释得到的。
1.3.2 样品的制备
将所有样品去骨、去皮后,用组织捣碎机绞碎,形成肉泥,然后装入保鲜袋中,于-20 ℃冰箱中保存,备用。含有氟喹诺酮类药物的加标样品是通过向样品中添加混合标准溶液得到的。在本研究中,除实际样品分析外,其余实验结果均通过样品1获得的。
1.3.3 基质固相分散-均相离子液体微萃取
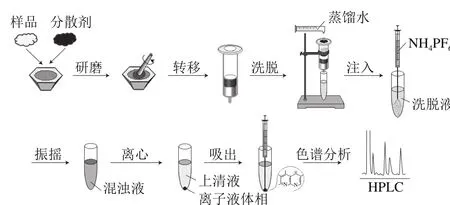
图1 基质固相分散-均相离子液体微萃取操作流程图Fig. 1 Schematic flow chart of the IL-based MSPD-HLLME procedure
基质固相分散-均相离子液体微萃取操作流程如图1所示。准确称取0.20 g加标样品、1.0 g 分散剂硅胶和200 μL水溶性离子液体[C6mim]BF4于玛瑙研钵中,充分研磨5 min。当研磨均匀后,将此混合物转移至底部有一层脱脂棉的萃取柱中,在柱口上方用一层脱脂棉塞紧,并用玻璃棒轻轻压实,避免萃取柱中出现空隙。采用pH 1.0的蒸馏水作为洗脱剂在重力作用下淋洗萃取柱,离子液体和目标分析物则被从萃取柱中洗脱出来,收集6 mL洗脱液于10 mL离心管中,随后用一次性注射器将1.0 mL 2.0 mol/L的NH4PF6溶液快速注入到洗脱液中,此时NH4PF6与离子液体发生原位反应,使原来的亲水性离子液体转变为疏水性离子液体,并形成均匀的乳浊液,然后用10 000 r/min冷冻离心5 min,溶液分成两相,疏水性离子液体结合目标分析物沉积在离心管底部。吸除上层水相,将离子液体部分用乙腈稀释至300 μL,过0.22 μm滤膜,将得到的样品溶液进行色谱分析。
1.3.4 色谱条件
流动相:0.1%甲酸溶液(A)和乙腈(B),流动相梯度洗脱条件如表1所示;流动相流速:0.5 mL/min;进样体积:20 μL;柱温:35 ℃;检测波长:280 nm。

表1 流动相梯度洗脱条件Table 1 Mobile phase composition for gradient elution
2 结果与分析
2.1 萃取条件优化
2.1.1 离子液体的种类和体积
离子液体的组成、结构和物理化学性质对目标分析物的提取效率有显著影响。在本研究中,考察了[C4mim]BF4、[C6mim]BF4和[C8mim]BF43 种离子液体对氟喹诺酮类药物回收率的影响。结果表明,[C4mim]BF4获得的目标分析物的回收率显著低于[C6mim]BF4和[C8mim]BF4,其原因可能是萃取过程中产生的疏水性离子液体[C4mim]PF6在水中的溶解度比[C6mim]PF6和[C8mim]PF6要高,从而导致目标分析物在离心后更多的残留于水相中,使回收率降低。此外,离子液体烷基链越长,目标物回收率越高,但使用[C8mim]BF4作为提取剂时,在色谱图的中间部分出现一些干扰峰,影响PEF和NOR的准确测定。因此,选择[C6mim]BF4为萃取剂。
本研究又考察[C6mim]BF4体积(120~240 μL)对目标分析物回收率的影响。如图2所示,当离子液体体积200 μL时,目标分析物的回收率达到较大值。当离子液体体积从200 μL增加到240 μL时,回收率基本保持不变。因此,选择离子液体[C6mim]BF4的最佳用量为200 μL。
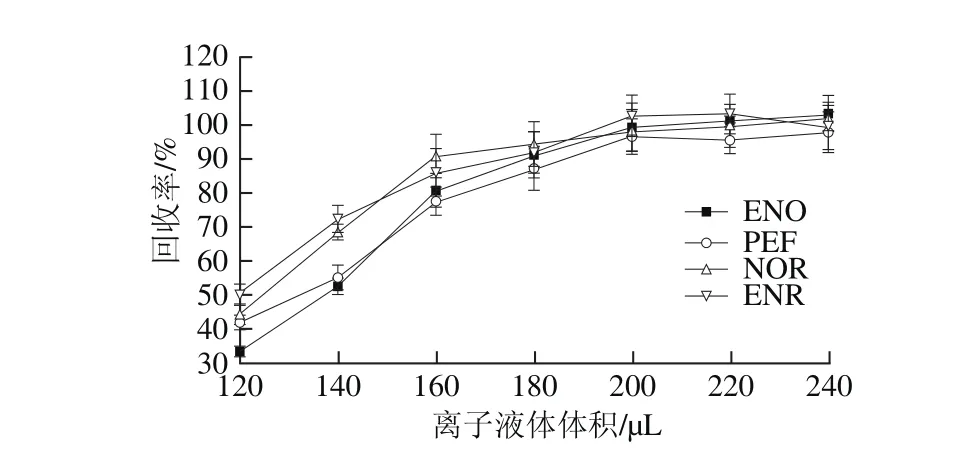
图2 离子液体体积对回收率的影响Fig. 2 Effect of ionic liquid volume on recovery
2.1.2 分散剂的种类和用量
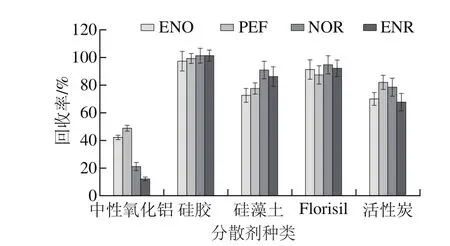
图3 分散剂对回收率的影响Fig. 3 Effect of dispersants on recovery
分散剂不仅可以破坏样品的组织结构,还能增加萃取剂与目标物分子的接触面积。如图3所示,当硅胶为分散剂时,各分析物回收率最高。当硅藻土、Florisil和活性炭为分散剂时,可能由于分散剂对离子液体的吸附作用减弱了洗脱剂对离子液体和目标物的洗脱效果,从而使回收率降低。当中性氧化铝为分散剂时,所获得的回收率最低,色谱图很干净,这说明氧化铝不仅能吸附杂质,同时也吸附了大量目标分析物。因此,本实验选择硅胶作为分散剂。
本实验还考察了当样品用量为0.20 g时,样品与硅胶质量比(1∶1、1∶2、1∶3、1∶4、1∶5、1∶6和1∶7)对目标分析物回收率的影响。实验结果表明,当质量比为1∶3时,目标分析物的回收率最高。因此,选择样品与分散剂的质量比为1∶3。
2.1.3 洗脱剂的种类和体积
在本研究中,洗脱剂应具备两个重要功能:1)应具有一定的极性,能将目标分析物和水溶性离子液体从萃取柱中洗脱出来;2)当离子对试剂NH4PF6加入到洗脱液中后,新形成的疏水性离子液体[C6mim]PF6应不溶于原洗脱剂中,以便形成均相体系。显然,常用的有机溶剂并不适合作为本实验的洗脱剂,因为[C6mim]PF6在有机溶剂中有较高的溶解性。因此,本实验选择蒸馏水为洗脱剂。
本实验还考察了洗脱剂体积(3、4、5、6、7、8 mL和9 mL)对目标分析物回收率的影响。结果表明,当体积从3~6 mL时,回收率逐渐增加;从6~9 mL时,回收率略有下降。因此,选择洗脱剂体积为6 mL。
2.1.4 洗脱剂的pH值

图4 洗脱剂pH值对回收率的影响Fig. 4 Effect of pH value of elution solvent on recovery
本实验考察洗脱溶剂pH值在1.0~11.0范围内各化合物的回收率,结果见图4。目标物的回收率随着pH值的升高而显著降低,当pH值为1.0时,回收率达到最大值,这与文献报道的结果一致[27]。其原因可能是氟喹诺酮类化合物的等电点接近于7,使其在中性水溶液中的溶解度大大降低,因此,化合物更容易被酸性或碱性水溶液洗脱。然而,当pH值过高时,离心后产生的疏水性离子液体体积显著减少,从而导致目标分析物回收率明显降低。因此,本研究选择洗脱剂pH值为1.0。
2.1.5 NH4PF6的浓度
为了研究离子对试剂对目标物回收率的影响,将1 mL不同浓度(0.4、0.8、1.2、1.6、2.0、2.4 mol/L和2.8 mol/L)的NH4PF6溶液加入到洗脱液中,随之发生原位生成反应,萃取剂[C6mim]BF4中的BF4-被阴离子PF6-所取代,从而产生疏水性离子液体[C6mim]PF6,该离子液体生成量的多少,将直接决定目标分析物的提取效率,结果见图5。
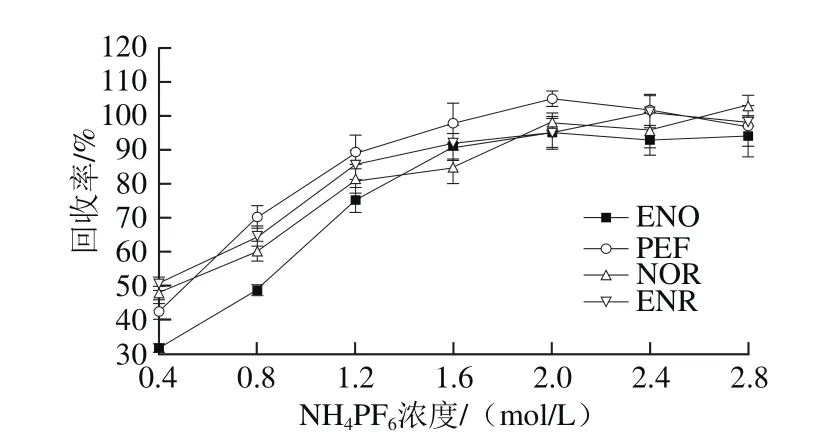
图5 NH4PF6溶液浓度对回收率的影响Fig. 5 Effect of NH4PF6 concentration on recovery
结果表明,随着NH4PF6的浓度从0.4 mol/L增加至2.0 mol/L时,目标分析物的回收率不断增加;但从2.0 mol/L增加至2.8 mol/L时,目标物的回收率没有明显变化。一方面,PF6-有利于[C6mim]PF6的形成和离子液体沉淀相的增加。另一方面,盐的增加可以促进相分离。因此,本研究选择NH4PF6溶液浓度为2.0 mol/L。
2.2 方法评价结果
2.2.1 线性关系、检出限和定量限
配制含有4 种氟喹诺酮药物的一系列不同浓度的加标样品(样品1),按1.3.2节和1.3.3节所述方法,在最佳条件下提取和分析样品。以分析物含量(c)为横坐标,峰面积(A)为纵坐标,制作工作曲线,得到线性回归方程。检出限和定量限是信噪比分别为3和10时实验方法所能检出和定量的目标化合物的最低含量。结果表明,各化合物在线性范围内具有较好的线性关系(r>0.997 4),检出限和定量限分别为2.9~8.6 µg/kg和9.5~28.5 µg/kg,结果见表2。
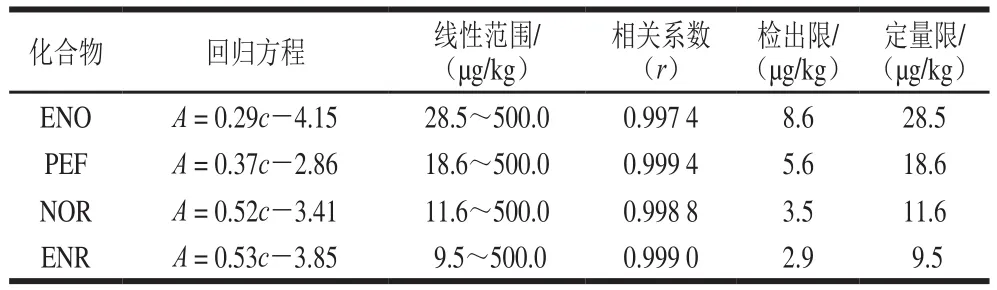
表2 目标化合物的工作曲线、检出限及定量限Table 2 Linear regressions, limits of detection and limits of quantitation for the analytes
2.2.2 精密度实验结果
本研究对测定加标牛肉样品(样品1)中目标分析物的重复性进行了评价。通过对日内和日间相对标准偏差的测定评估其精密度。日内精密度是通过1 d之内平行分析5 次加标样品所得到回收率的相对标准偏差。日间精密度是通过每天分析1 次加标样品,连续分析5 d所得到回收率的相对标准偏差。如表3所示,日内和日间精密度分别为1.9%~7.5%和2.4%~8.6%之间,说明该方法的重复性结果令人满意。

表3 分析物的日内精密度和日间精密度Table 3 Intra- and inter- day precision for the analytes
2.2.3 回收率实验结果
为了考察本法的准确度,本研究分析了8 种肌肉组织样品的加标回收率(表4)。结果表明,各样品加标回收率为87.9%~105.3%,相对标准偏差在2.2%~8.6%之间,说明本法可提供令人满意的回收率和精密度,可用于动物肌肉样品中氟喹诺酮类抗生素的提取分析。

表4 牛肉、羊肉、猪肉和鸡肉样品分析Table 4 Analytical results of beef, mutton, pork and chicken samples
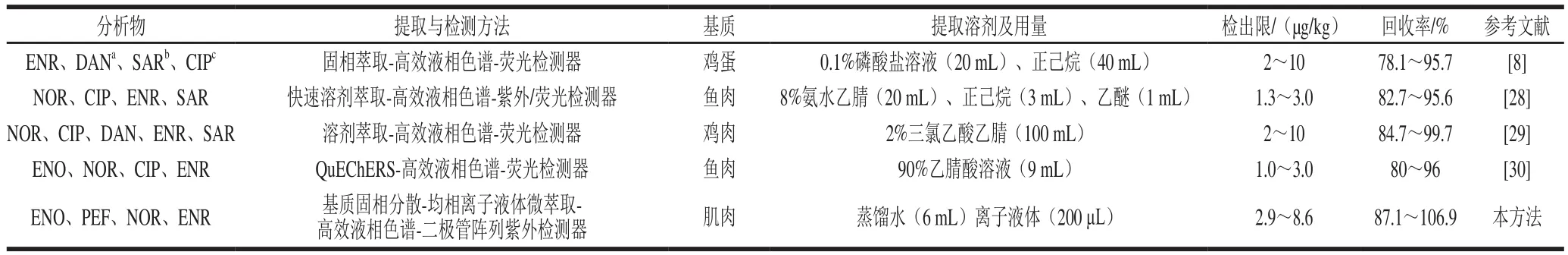
表5 方法比较Table 5 Comparison between the proposed method and other methods
2.2.4 实际样品分析结果
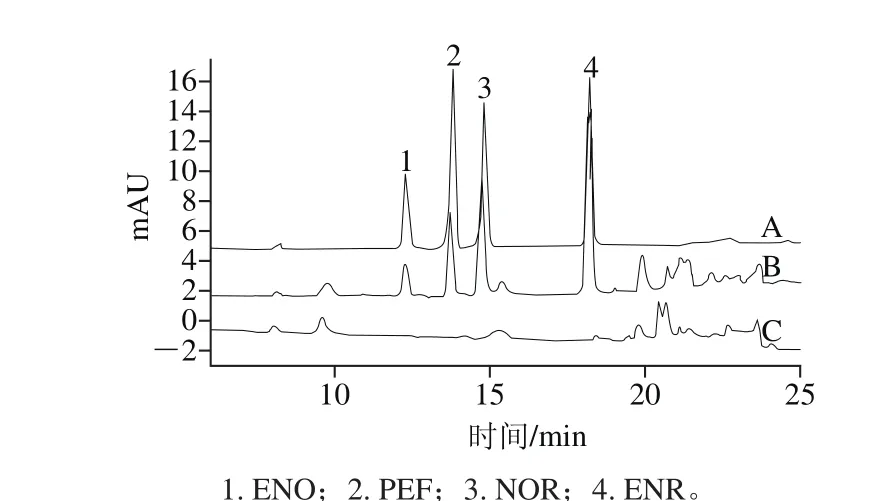
图6 标准溶液(A)、加标样品1(B)和空白样品(C)色谱图Fig. 6 Chromatograms of standard solution (A), spiked sample 1 (B) and blank sample (C)
为考察本法的适用性,本研究分析了牛肉、猪肉、羊肉和鸡肉等8 种肌肉组织样品(表4)。结果表明,实际样品中并未检出氟喹诺酮类抗生素,且在各化合物保留时间内也无干扰峰出现。空白样品和加标样品的色谱图见图6。
2.2.5 方法比较结果
与参考方法相比,本法使用离子液体代替传统有机溶剂作为萃取剂,大大减少了萃取溶剂的用量,提高了样品回收率,有效地保护了环境和实验操作人员的健康(表5)。基质固相分散和离子液体均相液-液微萃取技术相结合,使样品的制备、提取和净化于一体,从而使整个提取过程变得简单、快速,大大缩短了提取时间。因此,与其他方法相比,本法在萃取溶剂用量、保护环境、实验成本和简化实验操作等方面有一定优势。
3 结 论
本研究将基质固相分散、均相离子液体微萃取和高效液相色谱相结合,建立了一种简单、快速、绿色的分析方法用于检测肌肉组织中的氟喹诺酮类抗生素。该方法以离子液体作为萃取溶剂,避免了大量有机溶剂的使用,无需蒸发有机溶剂和回溶的操作步骤,不仅提高了目标物的回收率,而且使样品前处理技术更加简单、高效和环保。与其他方法相比,本法具有提取效率高、萃取溶剂用量少、环境污染小和操作简单快速等特点,可用于动物源性食品中氟喹诺酮类抗生素的提取分析。
[1] 黄优生, 刘波平, 朱筱玲, 等. 高效液相色谱-串联质谱法快速测定鱼肉中4 种氟喹诺酮类药物残留[J]. 食品科学, 2010, 31(2): 127-130.
[2] 李丹, 张玉洁, 孙志文, 等. 高效液相色谱法测定羊奶中五种氟喹诺酮类药物残留量的研究[J]. 中国兽药杂志, 2016, 50(1): 31-35.
[3] HO C, SIN D, TANG H, et al. Determination and on-line clean-up of (fluoro) quinolones in bovine milk using column-switching liquid chromatography fluorescence detection[J]. Journal of Chroatography A, 2004, 1061(2): 123-131. DOI:10.1016/j.chroma.2004.11.003.
[4] CHO H, yI H, CHO S, et al. Single-step extraction followed by LC determination of (fluoro) quinolone drug residues in muscle, eggs, and milk[J]. Journal of Separation Science, 2010, 33(8): 1034-1043. DOI:10.1002/jssc.200900772.
[5] TANG Q, yANG T, TAN X, et al. Simultaneous determination of fluoroquinolone antibiotic residues in milk sample by solid-phase extraction-liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2009, 57(11): 4535-4539. DOI:10.1021/jf900513b.
[6] ZHAO S, JIANG H, LI X, et al. Simultaneous determination of trace levels of 10 quinolones in swine, chicken, and shrimp muscle tissues using HPLC with programmable fluorescence detection[J]. Journal of Agricultural and Food Chemistry, 2007, 55(10): 3829-3834. DOI:10.1021/jf0635309.
[7] 池永红, 云雅光. SPE-HPLC检测动物源性食品中3 种氟喹诺酮类药物残留[J]. 食品研究与开发, 2015, 36(20): 152-155. DOI:10.3969/ j.issn.1005-6521.2015.20.041.
[8] 刘媛, 谢孟峡, 丁岚, 等. 高效液相色谱同时测定鸡蛋中4 种氟喹诺酮类药物残留[J]. 分析化学, 2004, 32(3): 352-355.
[9] POSYNIAK A, ZMUDZKI J, SEMENIUK S. Effects of the matrix and sample preparation on the determination of fluoroquinolone residues in animal tissues[J]. Journal of Chromatography A, 2001, 914(1/2): 89-94. DOI:10.1016/S0021-9673(00)01088-8.
[10] 王重洋, 王远鹏, 王宁, 等. 基质固相分散-超快速液相色谱法测定牛肉中磺胺类兽药[J]. 分析化学, 2013, 41(1): 83-87. DOI:10.3724/ SP.J.1096.2013.20535.
[11] 薛平, 史惠娟, 杜利君, 等. 5 种基质中19 种有机磷农药残留的基质固相分散-气相色谱法测定[J]. 食品科学, 2010, 31(18): 227-231.
[12] LI J, LI y, XU D, et al. Determination of metrafenone in vegetables by matrix solid-phase dispersion and HPLC-UV method[J]. Food Chemistry, 2017, 214: 77-81. DOI:10.1016/j.foodchem.2016.07.061.
[13] HUANG Z, PAN X, HUANG B, et al. Determination of 15 β-lactam antibiotics in pork muscle by matrix solid-phase dispersion extraction (MSPD) and ultra-high pressure liquid chromatography tandem mass spectrometry[J]. Food Control, 2016, 66: 145-150. DOI:10.1016/ j.foodcont.2016.01.037.
[14] SILVA M C, ORLANDO R M, FARIA A F. Electrical field assisted matrix solid phase dispersion as a powerful tool to improve the extraction efficiency and clean-up of fluoroquinolones in bovine milk[J]. Journal of Chromatography A, 2016, 1461: 27-34. DOI:10.1016/j.chroma.2016.07.063.
[15] PÉREZ-PARADA A, COLAZZO M, BESIL N, et al. Determination of coumaphos, chlorpyrifos and ethion residues in propolis tinctures by matrix solid-phase dispersion and gas chromatography coupled to flame photometric and mass spectrometric detection[J]. Journal of Chromatography A, 2011, 1218: 5852-5857. DOI:10.1016/ j.chroma.2011.06.097.
[16] MICHEL R, CyBELLE O, TAMIRES G, et al. Validation of a matrix solid phase dispersion (MSPD) technique for determination of pesticides in lyophilized eggs of the chicken Gallus gallus domesticus[J]. Microchemical Journal, 2013, 110: 395-401. DOI:10.1016/j.microc.2013.05.001.
[17] GAÑAN J, SILVA M, MORANTE-ZARCERO S, et al. Application of hybrid mesoporous silica for extraction of hormones in milk by matrix solid phase dispersion[J]. Materials Letters, 2014, 119: 56-59. DOI:10.1016/j.matlet.2013.12.107.
[18] 张琰, 张耀海, 焦必宁. 离子液体-分散液液微萃取在食品及环境污染物检测中的应用[J]. 食品科学, 2015, 36(5): 250-259. DOI:10.7506/spkx1002-6630-201505046.
[19] GAO S, yANG X, yU W, et al. Ultrasound-assisted ionic liquid/ionic liquid-dispersive liquid-liquid microextraction for the determination of sulfonamides in infant formula milk powder using high-performance liquid chromatography[J]. Talanta, 2012, 99: 875-882. DOI:10.1016/ j.talanta.2012.07.050.
[20] WANG Z, HU J, DU H, et al. Microwave-assisted ionic liquid homogeneous liquid-liquid microextraction coupled with high performance liquid chromatography for the determination of anthraquinones in Rheum palmatum L.[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 125: 178-185. DOI:10.1016/ j.jpba.2016.03.046.
[21] HU H, LIU B, yANG J, et al. Sensitive determination of trace urinary 3-hydroxybenzo[a]pyrene using ionic liquids-based dispersive liquidliquid microextraction followed by chemical derivatization and high performance liquid chromatography-high resolution tandem mass spectrometry[J]. Journal of Chromatography B, 2016, 1027: 200-206. DOI:10.1016/j.jchromb.2016.05.041.
[22] GAO J, WANG H, QU J, et al. Development and optimization of a naphthoic acid-based ionic liquid as a “non-organic solvent microextraction” for the determination of tetracycline antibiotics in milk and chicken eggs[J]. Food Chemistry, 2017, 215: 138-148. DOI:10.1016/j.foodchem.2016.07.138.
[23] FARAJZADEH M, BAMOROWAT M, MOGADDAM M. Ringer tablet-based ionic liquid phase microextraction: application in extraction and preconcentration of neonicotinoid insecticides from fruit juice and vegetable samples[J]. Talanta, 2016, 160: 211-216. DOI:10.1016/j.talanta.2016.03.097.
[24] WANG Z, ZHANG L, LI N, et al. Ionic liquid-based matrix solid-phase dispersion coupled with homogeneous liquid-liquid microextraction of synthetic dyes in condiments[J]. Journal of Chromatography A, 2014, 1348: 52-62. DOI:10.1016/j.chroma.2014.04.086.
[25] XU X, SU R, ZHAO X, et al. Ionic liquid-based microwaveassisted dispersive liquid-liquid microextraction and derivatization of sulfonamides in river water, honey, milk, and animal plasma[J]. Analytica Chimica Acta, 2011, 707: 92-99. DOI:10.1016/ j.aca.2011.09.018.
[26] WANG Z, CAO B, yU A, et al. Ultrasound-assisted ionic liquidbased homogeneous liquid-liquid microextraction high-performance liquid chromatography for determination of tanshinones in Salvia miltiorrhiza Bge. root[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 104: 97-104. DOI:10.1016/j.jpba.2014.11.034.
[27] GAO S, JIN H, yOU J, et al. Ionic liquid-based homogeneous liquid-liquid microextraction for the determination of antibiotics in milk by high-performance liquid chromatography[J]. Journal of Chromatography A, 2011, 1218: 7254-7263. DOI:10.1016/ j.chroma.2011.08.063.
[28] 于辉, 赵萍. 快速溶剂萃取-高效液相色谱-紫外串联荧光检测法测定太平湖白鱼中4 种氟喹诺酮类药物残留[J]. 中国食品卫生杂志, 2011, 23(4): 322-325. DOI:10.13590/j.cjfh.2011.04.024.
[29] 李维铖, 姬长云, 张静洁, 等. 高效液相色谱法检测鸡肉中氟喹诺酮类药物残留量前处理方法的优化[J]. 华南农业大学学报, 2014, 35(5): 14-18. DOI:10.7671/j.issn.1001-411X.2014.05.003.
[30] 李慧芳, 殷军港, 刘永明. 鱼肉中喹诺酮类药物残留检测前处理方法的研究[J]. 中国渔业质量与标准, 2012, 2(1): 62-66.
Determination of Fluroquinolones in Muscle Samples by Ionic Liquid-Based Matrix Solid Phase Dispersion Extraction Coupled with High Performance Liquid Chromatography
XU Weili, NIE Wen, ZHANG Kaili, GUO Hainan, ZHU Shouming, MA Guoxiang, WANG Zhibing*
(College of Chemistry and Life Science, Changchun University of Technology, Changchun 130012, China)
A new method based on matrix solid phase dispersion, ionic liquid-based homogeneous liquid-liquid microextraction and high performance liquid chromatography was developed for the determination of fluroquinolones (FQs), including enoxacin (ENO), pefloxacin (PEF), norfloxacin (NOR) and enrofloxacin (ENR) in muscle samples. Muscle samples were directly treated by matrix solid phase dispersion using silica gel as dispersant, 200 μL of 1-hexyl-3-methylimidazolium hexafluorophosphate ([C6mim]BF4) was used as extraction solvent, and aqueous solution of pH 1.0 was used as elution solvent. After the target analytes were transferred into eluate, ammonium hexafluorophosphate was added. The eluate obtained was treated by ionic liquid-based homogeneous liquid-liquid microextraction and the analytes were enriched into the ionic liquid phase. High performance liquid chromatography with diode array detection was applied to separate and determine the target analytes. The experimental results showed that the calibration curve exhibited a good linear relationship (r > 0.997 4). The limits of detection (LODs) of the method were in the range of 2.9 to 8.6 µg/kg. The recoveries were between 87.9% and 105.3% with relative standard deviations (RSDs) of 2.2%–8.6%. The proposed method has the advantages of simple operation and no need for organic solvent and can be extensively applied for determination of fluroquinolones in animal tissue samples.
matrix solid phase dispersion; ionic liquid-based homogeneous liquid-liquid microextraction; fluroquinolones;
10.7506/spkx1002-6630-201716033
TS207.3
A
1002-6630(2017)16-0210-06
徐尉力, 聂稳, 张凯丽, 等. 基于离子液体的基质固相分散萃取结合高效液相色谱法测定肌肉组织中的氟喹诺酮类抗生素[J]. 食品科学, 2017, 38(16): 210-215. DOI:10.7506/spkx1002-6630-201716033. http://www.spkx.net.cn
2016-09-21
国家自然科学基金青年科学基金项目(21401011);吉林省教育厅“十二五”科学技术研究项目(2015105)
徐尉力(1995—),男,学士,研究方向为食品分析。E-mail:1441842257@qq.com
*通信作者:王志兵(1982—),男,讲师,博士,研究方向为食品分析。E-mail:wangzhibing1012@163.com
XU Weili, NIE Wen, ZHANG Kaili, et al. Determination of fluroquinolones in muscle samples by ionic liquid-based matrix solid phase dispersion extraction coupled with high performance liquid chromatography[J]. Food Science, 2017, 38(16): 210-215. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716033. http://www.spkx.net.cn
muscle samples; high performance liquid chromatography (HPLC)

