慢性阻塞性肺疾病患者FeNO值测定的临床意义
王珍 屠春林 王文韬 姚文飞 孙锦贤 朱丽萍
慢性阻塞性肺疾病患者FeNO值测定的临床意义
王珍 屠春林 王文韬 姚文飞 孙锦贤 朱丽萍
目的 探讨慢阻肺患者FeNO值的临床意义。方法 分别测定健康对照组,稳定期慢阻肺组,AECOPD组各50人的FeNO值,比较各组差异,评估慢阻肺组的FeNO值与肺功能,吸烟等的关系。结果 正常对照组的FeNO值、稳定期慢阻肺组的FeNO值和AECOPD组的FeNO值逐步升高,有显著性差异(P<0.05)。稳定期慢阻肺组与AECOPD组无显著性差异(P>0.05)。吸烟组FeNO值低于不吸烟者组,有显著性差异(P<0.05)。在AECOPD组中不同GOLD分级的组间,随着肺功能的下降,FeNO值随之下降,有显著性差异(P<0.05)。结论 FeNO值可用于检测慢阻肺患者中的气道炎症。在急性加重期可评估病情严重程度。吸烟导致FeNO值降低。
呼出气一氧化氮;慢性阻塞性肺疾病;慢性气道炎症;肺功能(FEV1%pred)
呼出气一氧化氮(fraction of exhaled nitric oxide,FeNO)作为气道嗜酸性粒细胞炎症的指标,目前被广泛应用于哮喘的诊断,预测和评估激素对其治疗的效果[1]。慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)病情的特征在于逐渐加重的不完全可逆的气流受限,除感染外亦与有害气体颗粒的慢性炎症反应的增加有关,有研究提出[2]其发病过程可能存在NO的参与。一些研究表明[3-4]慢阻肺在细胞水平上存在不同的表型,可分成“嗜酸性粒细胞”型表型和“细菌”型表型,“嗜酸性粒细胞”表型可进行糖皮质激素的定向目标治疗。Marini 等人的研究[5]指出,吸烟会使正常人的FeNO值降低。而吸烟是慢阻肺的重要的发病因素。本研究通过检测健康对照组,稳定期慢阻肺组,AECOPD组的FeNO浓度,探讨慢阻肺中的FeNO值与肺功能,吸烟等因素之间的关系,以指导对本病的防治。
资料与方法
一、对象
选取2015年1月至2016年6月在上海市嘉定中心医院就诊的慢阻肺患者,入选患者在年龄,性别上均无显著性差异(P﹥0.05),符合2016年GOLD(Global Initiative for Chronic Obstructive Lung Disease)[6]的诊断标准:即吸入支气管舒张剂后第一秒用力呼气容积( FEV1) /用力肺活量( FVC)<70%,能配合肺功能及FeNO检测,2周内无使用激素史,排除影响FeNO值的其他疾病如哮喘,过敏性鼻炎,特异性变态反应、嗜酸粒细胞性支气管炎等。本研究包括:稳定期慢阻肺组50人,男性40人,女性10人,年龄(66.66±11.65)岁,患者近8周内咳嗽,咳痰和气症状稳定或症状轻微,病情恢复到急性加重期前的状态。AECOPD组50人,男性45人,女性5人,年龄(71.00±8.88)岁,患者呼吸系统症状出现急性加重(典型表现为呼吸困难、咳嗽、痰量增多和/或痰液呈脓性),超出日常的变异,并且需要改变药物治疗[5]。以及选取同期门诊健康体检者50人,男性36人,女性14人,年龄(67.96±10.77)岁,作为对照组,均无吸烟史,肺功能正常,无肺部疾病。
二、研究方法
1 FeNO检测方法:采用瑞典NIOX VERO一氧化氮(NO)测定仪,根据美国胸科学会(ATS)/欧洲呼吸学会(ERS)推荐测定方法,患者需要停止吸烟12小时以上,停止吸氧半小时之后,采用NO测试仪,嘱患者先尽量深呼气排空肺内气体,用嘴紧含测定仪滤器,深吸气后以流速为50mL/s的恒定气流呼气,呼出时间为10 s,随后读取检测数值。
2 GOLD分级标准[7]:按照慢阻肺患者气流受限分级(吸入支气管扩张剂后的FEV1%pred):FEV1%pred≥80% GOLD1(轻度);50%≤FEV1%pred<80% 为GOLD2(中度);30%≤FEV1%pred<50%为 GOLD3(重度); FEV1%pred<30%为GOLD4(非常重度)。
三、统计学处理应用
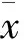
结 果
一、正常对照组、稳定期慢阻肺组和AECOPD组之间的FeNO值及肺功能指标比较分析
三组相比,FeNO值是正常对照组最低,AECOPD组最高。FEV1% pred及FEV1/FVC是正常对照组最高,AECOPD组最低。正常对照组与其它两组的FeNO值,FEV1% pred有显著性差异(P<0.01)。稳定期慢阻肺组与AECOPD组的FeNO值,FEV1% pred无显著性差异(P﹥0.05)。各组间的FEV1/FVC均有显著性差异,P<0.01。(见表1)。
二、稳定期慢阻肺组和AECOPD组吸烟者与不吸烟者的FeNO值比较分析
稳定期慢阻肺组和AECOPD组中吸烟者的FeNO值均低于不吸烟者,有显著性差异,P<0.05。(见表2)。
三、稳定期慢阻肺组不同GOLD分级的组间比较分析
稳定期慢阻肺组不同GOLD分级的各组间FeNO值无显著性差异,P>0.05。(见表3)。
四、AECOPD组不同GOLD分级的组间吸烟患者的比例及FeNO值比较分析
各组间随着肺功能(FEV1% pred)的下降,FeNO值随之下降,呈正相关,FeNO值有显著性差异(r=0.738,P<0.001)。(见表4)。
五、在AECOPD组中,由单因素分析可知,吸烟史和GOLD分级均可影响患者的FeNO值。因此以FeNO值为因变量,以吸烟史(吸烟=1,不吸烟=2)、GOLD分级为自变量拟合多重线性回归模型。研究结果显示:GOLD分级对FeNO值的影响更大。(见表5)。
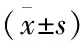
表1 不同组患者FeNO值、FEV1% pred、FEV1/FVC的比较
注:*与正常组比P<0.01;△与稳定期慢阻肺组比较:P<0.05
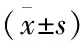
表2 稳定期慢阻肺组及AECOPD组吸烟者与不吸烟者的FeNO值比较

表3 稳定期慢阻肺组不同GOLD分级的组间FeNO值比较±s)
注:稳定期慢阻肺组各组间比较P>0.05
讨 论
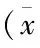
表4 AECOPD组不同GOLD分级的组间吸烟患者的比例及FeNO值比较±s)
注:*与GOLD1级组比较P<0.05,与GOLD2级比较:△P<0.05,与GOLD3级组比较:□P<0.05

表5 AECOPD患者FeNO值的多重线性回归分析
内源性一氧化氮(NO)与气道嗜酸性粒细胞炎症及气道高反应(AHR)密切相关[8],起着在调节呼吸道和血管功能的重要作用, NO的形成由一氧化氮合酶(NOS)介导,NOS分为三种亚型:神经元型(nNOS),内皮型(eNOS)和诱导型(iNOS)。 Brindicci等的研究[2,9],慢阻肺患者的气道和肺泡中可出现nNOS和iNOS的表达,引起组织损伤及气道炎症。其中nNOS 主要存在于肺血管内皮细胞及上皮细胞, iNOS 的形成需要包括内毒素在内的多种炎症因子刺激。也有研究指出[9-11],NO参与的发病机制是硝化应激和氧化应激,在此过程中,neNOS的表达增加,iNOS的表达减少。
在本研究结果中,稳定期慢阻肺组和AECOPD组的FeNO值高于正常对照组,提示NO参与慢阻肺的发病过程。AECOPD组的FeNO值比稳定期慢阻肺组高,但无显著性差异。其中稳定期慢阻肺组的FeNO值为(15.60±5.78)ppb,最高值为28 ppb,AECOPD患者的FeNO值为(16.96±7.97)ppb,最高值为38ppb。根据Shaw 等[12]报道,有临床意义的FeNO 临界点为26 ppb, 以FeNO=33 ppb 为界点能很好地预测对激素治疗的有效性。慢阻肺患者的急性发作过程中,除了痰中性粒细胞增多,部分患者还有嗜酸粒细胞的增多,也就是之前所说的的“嗜酸性粒细胞”型表型和“细菌”型表型。而在本研究的结果中,部分AECOPD患者的FeNO值高于33 ppb,考虑为“嗜酸性粒细胞”型表型。对于FeNO值高于33 ppb的AECOPD患者,可进行查血液和气道炎症,如血液嗜酸性粒细胞,痰、粘液、支气管肺泡灌洗液(BAL)嗜酸性粒细胞、血清IgE等相关检测,进一步判断这些患者是否存在气道嗜酸性粒细胞升高,为在治疗过程中使用激素提供更明确的依据。
从本次的研究中可以看出,无论是稳定期慢阻肺组还是AECOPD组,吸烟者的FeNO值均比不吸烟者低,提示吸烟可导致慢阻肺患者的FeNO值降低,这与相关的文献报道[13]一致。因此临床医生在评估过程中,要考虑到吸烟人群的FeNO值会比实际值偏低。
在AECOPD患者中,根据GOLD 的分级,随着肺功能(FEV1%pred)的下降,FeNO值随之下降,可能有以下几个原因:① 在氧化应激产生超氧阴离子和NO结合的过程中,形成过氧亚硝酸盐,从而放大硝化应激。在这种硝化应激的周期中,nNOS和iNOS产生失衡,随着疾病的严重程度增加,iNOS的表达在早期增加(GOLD1级和2级),在晚期减少(GOLD3级和4级)。② 慢性阻塞性肺病是反复发作的气道炎症导致气流受限,随着肺功能严重程度升高,代表气道狭窄严重程度增加,气道细胞功能减退,NO释放减少。但是FeNO值与肺功能的相关性一直是有争议的,也有研究表明[14],肺功能(FEV1%pred)和GOLD严重度分级无明显相关性。造成结论不一致的原因,主要可能有以下因素:各研究样本量都比较小,入组的病人标准不一致,慢阻肺患者的FeNO值受到各方面的因素干扰,如感染,吸烟等情况,包括一部分 “嗜酸性粒细胞”型表型的慢阻肺患者也会影响实验结果。
综上所述, FeNO值作为检测气道嗜酸性粒细胞炎症的指标,可以应用于慢阻肺患者中,尤其是在AECOPD患者中。在急性加重期的FeNO值与肺功能(FEV1%pred)下降一致,可作为评估AECOPD患病情严重程度的指标之一。很多慢阻肺患者是吸烟者,而吸烟可导致他们的FeNO值降低,因此这些患者的FeNO值检测受到了一定的干扰。临床医生在工作中,应结合慢阻肺患者的临床症状,肺功能,吸烟状况等综合考虑,选择个体化治疗方案。
[1] Pijnenburg MW,Hofhuis W,Hop WC,et al.Exhaled nitric oxide predicts asthma relapse in children with clinical asthma remission[J].Thorax,2005,60(3):215-218.
[2] Brindicci C,Kharitonov SA,Ito M,et al.Nitric oxide synthase isoenzyme expression and activity in peripheral lung tissue of patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2010,181(1):21-30.
[3] Brightling CE.Biomarkers that predict and guide therapy for exacerbations of chronic obstructive pulmonary disease[J].Ann Am Thorac Soc,2013,10 Suppl:S214-S219.
[4] Bafadhel M,McKenna S,Terry S,et al.Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers[J].Am J Respir Crit Care Med,2011,184(6):662-671.
[5] Marini S,Buonanno G,Stabile L,et al.Short-term effects of electronic and tobacco cigarettes on exhaled nitric oxide[J].Toxicol Appl Pharmacol,2014,278(1):9-15.
[6] GOLD Executive Committee.Global strategy for diagnosis, management, and prevention of COPD-2016[EB/OL].http://goldcopd.org/.
[7] Vestbo J,Hurd SS,Agustí AG,et al.Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary[J].Am J Respir Crit Care Med,2013,187(4):347-365.
[8] Dweik RA,Boggs PB,Erzurum SC,et al.An official ATS clinical practice guideline:interpretation of exhaled nitric oxide levels(FENO)for clinical application[J].Am J Respir Crit Care Med,2011,184(5):602-615.
[9] Ricciardolo FL,Caramori G,Ito K,et al.Nitrosative stress in the bronchial mucosa of severe chronic obstructive pulmonary disease[J].J Allergy Clin Immunol,2005,116(5):1028-1035.
[10] Sevenoaks MJ,Stockley RA.Chronic Obstructive Pulmonary Disease, inflammation and co-morbidity-a common inflammatory phenotype?[J].Respir Res,2006,7:70.
[11] Gelb AF,Barnes PJ,George SC,et al.Review of exhaled nitric oxide in chronic obstructive pulmonary disease[J].J Breath Res,2012,6(4):47101-47107.
[12] Shaw DE,Berry MA,Thomas M,et al.The use of exhaled nitric oxide to guide asthma management:a randomized controlled trial[J].Am J Respir Crit Care Med,2007,176(3):231-237.
[13] Malerba M,Radaeli A,Olivini A,et al.Exhaled nitric oxide as a biomarker in COPD and related comorbidities[J].Biomed Res Int,2014,271918.
[14] Lehouck A,Carremans C,De Bent K,et al.Alveolar and bronchial exhaled nitric oxide in chronic obstructive pulmonary disease[J].Respir Med,2010,104(7):1020-1026.
Clinical significance of FeNO detection in COPD patients
WANGZhen,TUChun-lin,WANGWen-tao,YAOWen-fei,SUNJin-xian,ZHULi-ping
JiadingDistrictCentralHospital,Shanghai201800,China
Objective To investigate the clinical significance of FeNO value in COPD patients. Methods The study selected 50 healthy people as the control group, 50 stable COPD patients as the group A and 50 AECOPD patients as the group B. Their FeNO value was compared among the three groups. Relationship between FeNO value and lung function, smoking history was investigated. Results FeNO value was significantly higher in the AECOPD group than in the healthy control group and the stable COPD group (P<0.05), but it showed no significant difference between the stable COPD group and the AECOPD group (P>0.05). FeNO value was significantly lower in patients with a history of smoking than those without (P<0.05). FeNO value was positively correlated with lung function (P<0.05). Conclusion FeNO value reflects the airway inflammation in COPD patients. It can be used to evaluate the severity during acute exacerbation period. Smoking can cause FeNO value decrease.
exhaled nitric oxide; chronic obstructive pulmonary disease; chronic airway inflammation; lung function (FEV1% pred)
10.3969/j.issn.1009-6663.2017.09.028
201800 上海,上海市嘉定区中心医院呼吸内科
屠春林,E-mail:tuchunlin@out100k.com
2017-02-08]

