不同体积分数氧气对山羊颞下颌关节盘细胞骨架改建的影响
何晓兰包广洁,2孙凌璐张雪保善英康宏
1.兰州大学口腔医学研究所,兰州 730000;
2.西北民族大学甘肃省口腔疾病研究重点实验室,西北民族大学口腔医学国家民委重点实验室,兰州 730030
·基础研究·
不同体积分数氧气对山羊颞下颌关节盘细胞骨架改建的影响
何晓兰1包广洁1,2孙凌璐1张雪1保善英1康宏1
1.兰州大学口腔医学研究所,兰州 730000;
2.西北民族大学甘肃省口腔疾病研究重点实验室,西北民族大学口腔医学国家民委重点实验室,兰州 730030
目的探讨不同体积分数的氧气对山羊颞下颌关节盘细胞3种细胞骨架蛋白改建的影响。方法体外分离、培养山羊颞下颌关节盘细胞,传代至第2代,分别于常氧21%O2及低氧8%O2、4%O2、2%O2下培养。甲苯胺蓝、天狼星红及Ⅰ型胶原免疫细胞化学染色观察不同氧体积分数下细胞显型的变化。细胞免疫荧光染色和实时定量逆转录聚合酶链反应检测细胞骨架蛋白,包括肌动蛋白、微管蛋白和波形蛋白的表达情况。。结果不同氧体积分数下关节盘细胞仍然具有成纤维特性,3种细胞骨架蛋白有规律地排列。4%O2时,肌动蛋白和波形蛋白荧光强度最低(P<0.05);2%O2时,微管蛋白荧光强度最高(P<0.05),其他各组间差异无统计学意义(P>0.05)。检测肌动蛋白mRNA表达,21%O2组最高,而2%O2组和4%O2组最低(P<0.05);微管蛋白mRNA表达在2%O2组最高,8%O2组最低(P<0.05);波形蛋白mRNA表达,在4%O2组最低,21%O2组最高,差异有统计学意义(P<0.05)。结论在不同氧体积分数条件下,细胞骨架蛋白有不同程度的改建,2%O2可能是适合颞下颌关节盘细胞扩增的最佳氧体积分数。
颞下颌关节盘; 低氧; 细胞骨架; 肌动蛋白; 微管蛋白; 波形蛋白
颞下颌关节(temporomandibular joint,TMJ)的关节盘是位于下颌骨髁突和颞骨关节窝之间椭圆形的,质地致密且无血管的纤维软骨组织[1-3],其正常代谢所需的营养物质,如氧和葡萄糖等,主要依靠关节滑液和连接到双板区血管的扩散完成[4],因此关节盘被认为是处于生理性低氧环境中的组织[5]。
颞下颌关节紊乱病(temporomandibular joint disorders,TMD)具有患病率高、慢性迁延、影响面广的特征[6]。无支架的自组装技术在修复TMD导致的关节盘缺损或替换受损的关节盘等方面有较好的应用前景[7],但是选择合适的种子细胞仍是当前亟待解决的问题[8]。细胞骨架是位于细胞膜下面的网状结构,反映着细胞的结构和功能[9]。Lee等[10]在对自组装机制的研究中指出,肌动蛋白细胞骨架的主动收缩是自组装过程中必不可少的因素,有效的软骨细胞自组装需要完整的细胞骨架。本研究假设:控制TMJ关节盘细胞生长的氧环境可以改变细胞骨架及其骨架的反应性,从而为TMJ关节盘组织工程种子细胞优化选择提供依据。
1 材料和方法
1.1 主要试剂
Ⅰ型胶原、微管蛋白、波形蛋白单克隆抗体(Abcam公司,英国);Ⅰ型胶原酶、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-鬼笔环肽(Sigma公司,美国);FITC-抗鼠IgG和罗丹明-抗兔IgG(北京中杉金桥生物技术有限公司)。
1.2 关节盘细胞分离与培养
自屠宰厂购买宰杀2 h内的1月龄山羊头,清洗干净,75%乙醇浸泡30 min。无菌条件下取出双侧TMJ关节盘,修剪净周围组织,PBS充分冲洗后将其剪碎至约1 mm3大小,置于0.2%Ⅰ型胶原酶溶液中,于37 ℃、90 r·min-1恒温水浴摇床上消化过夜,约16 h。次日,DMEM/F-12洗3次,收集细胞。用含10%胎牛血清、25 μg·mL-1维生素C和1%青霉素-链霉素的DMEM/F-12培养液,在37 ℃、5%CO2及21%O2饱和湿度二氧化碳培养箱内培养细胞,传代,取第二代细胞(P2)用于实验。
1.3 实验分组及不同体积分数氧干预
实验分4组:常氧21%O2组,低氧8%O2组、4%O2组、2%O2组。生长状态良好的P2代关节盘细胞以每毫升1×104个细胞的密度接种于细胞培养皿和预先放置盖玻片的12孔板中,分别置于二氧化碳培养箱(21%O2)及氧体积分数为2%O2、4%O2、8%O2的三气培养箱中培养,三气培养箱中充入N2,以获得需要的氧体积分数。4~5 d后,细胞融合至85%左右,收集细胞进行实时定量逆转录聚合酶链反应(realtime reverse transcription-polymerase chain reaction,RT-qPCR),检测细胞骨架蛋白肌动蛋白、微管蛋白、波形蛋白mRNA的表达;同时固定细胞爬片,分别行甲苯胺蓝、天狼星红和Ⅰ型胶原免疫细胞化学染色以鉴定不同体积分数氧含量下的关节盘细胞,然后行细胞免疫荧光染色,观察3种细胞骨架蛋白(肌动蛋白、微管蛋白、波形蛋白)的表达情况。
1.4 颞下颌关节盘细胞的鉴定
甲苯胺蓝染色:滴加甲苯胺蓝染液于细胞爬片上,染色30 min。天狼星红染色:滴加天狼星红染液于细胞爬片上染色1 h,PBS洗,苏木素复染1 min。Ⅰ型胶原免疫组织化学染色:按免疫组织化学试剂盒SP法进行。染色完成后,经蒸馏水洗,梯度乙醇脱水,二甲苯透明,中性树胶封片,镜下观察。
1.5 细胞骨架蛋白免疫荧光染色及荧光强度分析
经过固定的细胞爬片,用含0.1% Triton X-100 的PBS通透5 min,PBS洗,含2%BSA、0.1% Tween 20的PBS封闭1 h。肌动蛋白染色:滴加1∶60稀释的FITC-鬼笔环肽室温避光孵育60 min。微管蛋白和波形蛋白染色:分别滴加1∶200稀释的微管蛋白和波形蛋白一抗,4 ℃过夜孵育,次日分别滴加1∶200稀释二抗罗丹明-抗兔IgG和FITC-抗鼠IgG抗体。4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI,质量浓度为1 μg·mL-1)染核2 min,PBS洗,抗荧光淬灭剂封片,倒置荧光显微镜观察,采集荧光图像。Image-Pro Plus 6.0软件分析骨架蛋白的荧光强度,每张图像随机选取10个细胞,每个骨架蛋白共分析40个细胞。
1.6 RT-qPCR
RT-qPCR检测肌动蛋白、微管蛋白、波形蛋白mRNA相对表达量。按照UNIQ-10柱式Trizol总RNA抽提试剂盒说明步骤提取细胞总RNA,第一链cDNA合成试剂盒进行逆转录,在荧光定量PCR仪中进行反应。细胞相关基因引物由上海生物工程股份有限公司设计,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参基因,相关基因序列见表1。采用2-(∆∆Ct)法对基因相对表达量进行分析比较。

表 1 RT-qPCR引物Tab 1 Primers for RT-qPCR
1.7 统计学分析
实验重复3次,SPSS 19.0软件进行统计分析,组间差异采用单因素方差分析,两两比较采用LSD检验,检验水准为双侧α=0.05。
2 结果
2.1 颞下颌关节盘细胞的鉴定
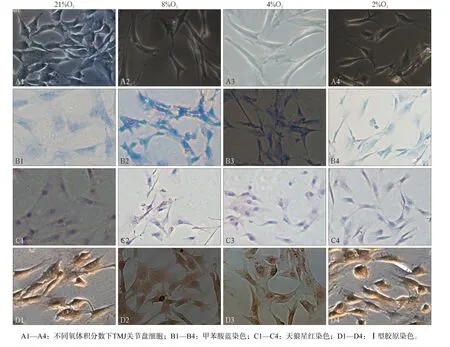
图 1 TMJ关节盘细胞形态学观察 光镜 × 400Fig 1 Morphology of TMJ disc cells optical microscope × 400
光镜下,常氧21%O2组细胞多呈多边形,低氧8%O2、4%O2、2%O2组细胞以长梭形为主(图1A1—A4)。各种不同氧体积分数下,甲苯胺蓝染色细胞质呈蓝色(图1B1—B4),表明关节盘细胞有糖胺多糖产生;天狼星红染色可见,细胞质呈紫红色(图1C1—C4),表明关节盘细胞有胶原产生;Ⅰ型胶原免疫细胞化学染色可见细胞质内有棕黄色颗粒(图1D1—D4),表明Ⅰ型胶原染色阳性。细胞鉴定结果表明,不同氧体积分数下关节盘细胞仍具有成纤维特性。
2.2 细胞骨架蛋白免疫荧光染色及荧光强度值分析
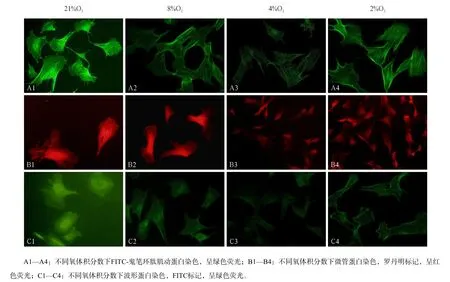
图 2 TMJ关节盘细胞骨架蛋白的变化 免疫荧光染色 × 400Fig 2 Cytoskeleton of TMJ disc cells immunofuorescence staining × 400
不同氧体积分数下3种细胞骨架蛋白有规律地排列,但是各组间的荧光强度有差异。关节盘细胞肌动蛋白微丝沿细胞膜外围均匀排列,与细胞长轴方向一致(图2A1—A4);荧光强度分析可见,4%O2组肌动蛋白荧光强度最低(P<0.05),其他3组差异均无统计学意义(P>0.05,图3左)。微管蛋白从细胞核伸展到细胞膜边缘,逐渐松散成网状(图2B1—B4);荧光强度分析显示,2%O2组微管蛋白荧光强度最高(P<0.05)(图3中)。波形蛋白细胞核周荧光强度最强,向细胞膜周围逐渐减弱(图2C1—C4);荧光强度分析显示,4%O2组波形蛋白荧光强度最低(P<0.05),其他3组的差异均无统计学意义(P>0.05,图3右)。
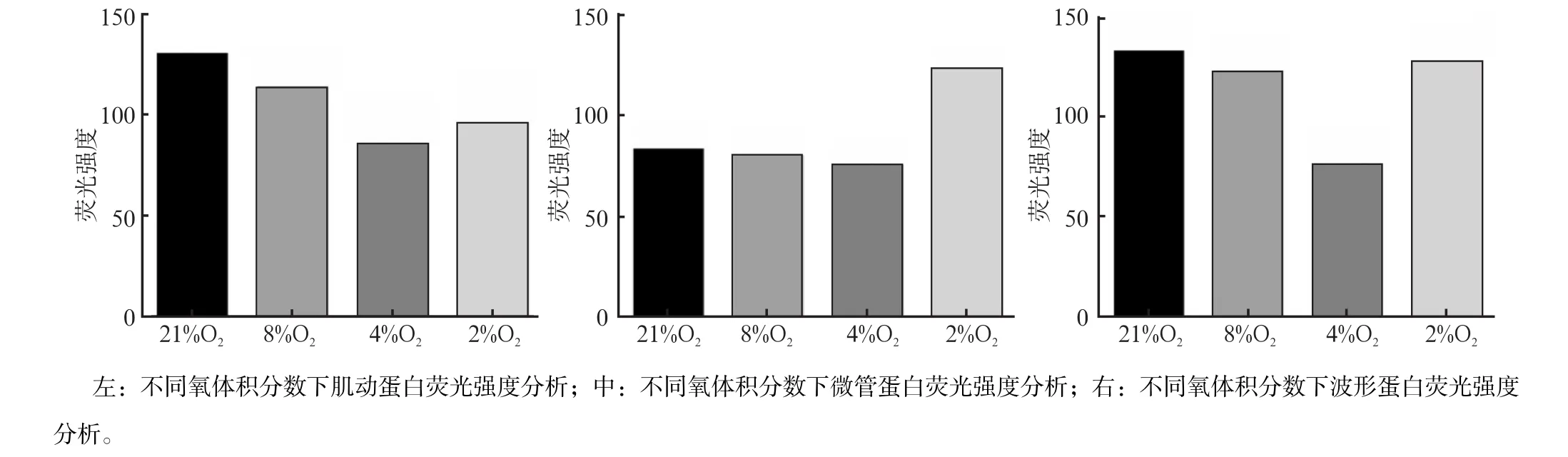
图 3 TMJ关节盘细胞骨架蛋白免疫荧光染色的荧光强度分析Fig 3 Immunofuorescence staining intensity analysis of TMJ disc cells cytoskeleton
2.3 细胞骨架蛋白mRNA表达的变化
不同氧体积分数下3种细胞骨架蛋白mRNA表达变化见表2。肌动蛋白mRNA相对表达量,在2%O2和4%O2组最低,21%O2组最高,差异有统计学意义(P<0.05)。微管蛋白mRNA相对表达量,在2%O2组最高,8%O2组最低(P<0.05)。波形蛋白mRNA相对表达量,在4%O2组最低,21%O2组最高,差异有统计学意义(P<0.05)。

表 2 TMJ关节盘细胞3种骨架蛋白mRNA的相对表达量Tab 2 Cytoskeleton mRNA relative expression levels of TMJ disc cells
3 讨论
TMJ关节盘是无血管的组织,Kuo等[11]通过对猪TMJ关节盘不同分区细胞密度和基础耗氧率的研究,指出关节盘可能存在一个比关节软骨更高的氧梯度,Cisewski等[12]对关节盘细胞代谢的研究也提出这一观点。研究[13]证实,关节软骨从表层到深层有一个6%至1%的氧体积分数梯度,在病理情况下这一氧体积分数更低。考虑TMJ关节盘细胞处于低氧的生理环境中,本研究尝试通过细胞形态学、免疫荧光染色和RT-qPCR等方法,探讨不同的氧体积分数下TMJ关节盘细胞细胞骨架蛋白,包括肌动蛋白、微管蛋白及波形蛋白的组织结构以及mRNA的表达。
细胞骨架是存在于真核细胞细胞质中的三维网络结构,主要由微丝、微管及中间丝组成,在维持细胞生物力学功能上发挥重要作用[14-16]。微丝由肌动蛋白单体聚合合成,F-肌动蛋白细胞骨架被视为调控细胞形态和产生细胞生物力的关键因素,在细胞生理和病理行为中起重要作用[17]。研究[18]表明,TMJ关节盘中肌动蛋白表达上调是退行性变的迹象,细胞表现为收缩的表型,可能参与关节盘组织的收缩和修复。微管是高度动态的细胞骨架成分,主要负责细胞质内物质运输和细胞分裂[19]。微管的主要成分微管蛋白对软骨细胞的稳态有重要影响,微管蛋白破坏可致软骨细胞早期凋亡[20]。波形蛋白是中间纤维的一种蛋白,在所有TMJ关节盘细胞中均有表达[18]。研究[21]显示,波形蛋白可能是TMJ内紊乱和滑膜病理性肥大的重要标志。
过去关于细胞骨架的研究[22-25]多与生物力学有关,低氧条件下细胞骨架的重构或改建很少被研究。本研究结果显示,不同氧体积分数下3种细胞骨架蛋白有规律排列,但荧光强度和相关基因表达有差异。2%O2及4%O2下,肌动蛋白mRNA表达下调,可能由于低氧环境部分逆转了细胞的表型,向着正常的关节盘细胞分化;微管蛋白mRNA在2%O2下表达最高,可能与细胞的分裂活动有关,在2%O2下细胞表现为更高的活性和分裂能力;4%O2下,波形蛋白mRNA表达降低,而其他3组间的差异无统计学意义(P>0.05)。
本课题组前期的研究[26]结果提示,TMJ关节盘自组装基体在培养过程中出现收缩变小的现象可能与肌动蛋白的过表达有关,且TMJ细胞随传代次数的增加肌动蛋白表达呈上升趋势。结合本次研究,笔者推测,体积分数2%O2可能最适合关节盘细胞扩增。低氧可能会导致细胞骨架的改建,具体表现在2%O2时,肌动蛋白荧光强度减弱,微管蛋白荧光强度增强,肌动蛋白mRNA表达下调,微管蛋白mRNA表达上调。这一改变是否与细胞活性和细胞表型改变相关还需后续实验更进一步的研究。
[1] Stanković S, Vlajković S, Bošković M, et al. Morphological and biomechanical features of the temporomandibular joint disc: an overview of recent fndings[J]. Arch Oral Biol, 2013, 58(10):1475-1482.
[2] Piette E. Anatomy of the human temporomandibular joint. An updated comprehensive review[J]. Acta Stomatol Belg, 1993, 90(2):103-127.
[3] Benjamin M, Ralphs JR. Biology of fbrocartilage cells[J]. Int Rev Cytol, 2004, 233:1-45.
[4] Alonso LG, Smith RL, Junior JAF, et al. Ultrastructural evidence of vascularization of the central zone of the temporomandibular joint disc in human fetus[J]. Eur J Anat, 2016, 10(2):45-48.
[5] Yamaguchi A, Tojyo I, Yoshida H, et al. Role of hypoxia and interleukin-1beta in gene expressions of matrix metalloproteinases in temporomandibular joint disc cells[J]. Arch Oral Biol, 2005, 50(1):81-87.
[6] Chisnoiu AM, Picos AM, Popa S, et al. Factors involved in the etiology of temporomandibular disorders—a literature review[J]. Clujul Med, 2015, 88(4):473-478.
[7] DuRaine GD, Brown WE, Hu JC, et al. Emergence of scaffoldfree approaches for tissue engineering musculoskeletal cartilages[J]. Ann Biomed Eng, 2015, 43(3):543-554.
[8] Shu W, Liu L, Bao G, et al. Tissue engineering of the temporomandibular joint disc: current status and future trends [J]. Int J Artif Organs, 2015, 38(2):55-68.
[9] Hsieh CH, Lin YH, Lin S, et al. Surface ultrastructure and mechanical property of human chondrocyte revealed by atomic force microscopy[J]. Osteoarthr Cartil, 2008, 16(4): 480-488.
[10] Lee JK, Hu JC, Yamada S, et al. Initiation of chondrocyte self-assembly requires an intact cytoskeletal network[J]. Tissue Eng Part A, 2016, 22(3/4):318-325.
[11] Kuo J, Shi C, Cisewski S, et al. Regional cell density distribution and oxygen consumption rates in porcine TMJ discs: an explant study[J]. Osteoarthr Cartil, 2011, 19(7):911-918.
[12] Cisewski SE, Zhang L, Kuo J, et al. The effects of oxygen level and glucose concentration on the metabolism of porcine TMJ disc cells[J]. Osteoarthr Cartil, 2015, 23(10):1790-1796.
[13] Cernanec J, Guilak F, Weinberg JB, et al. Infuence of hypoxia and reoxygenation on cytokine-induced production of proinfammatory mediators in articular cartilage[J]. Arthritis Rheum, 2002, 46(4):968-975.
[14] Blain EJ. Involvement of the cytoskeletal elements in articular cartilage homeostasis and pathology[J]. Int J Exp Pathol, 2009, 90(1):1-15.
[15] Benjamin M, Archer CW, Ralphs JR. Cytoskeleton of cartilage cells[J]. Microsc Res Tech, 1994, 28(5):372-377.
[16] Chen C, Yin L, Song X, et al. Effects of vimentin disruption on the mechanoresponses of articular chondrocyte[J]. Biochem Biophys Res Commun, 2016, 469(1):132-137.
[17] Jin H, Liang Q, Chen T, et al. Resveratrol protects chondrocytes from apoptosis via altering the ultrastructural and biomechanical properties: an AFM study[J]. PLoS ONE, 2014, 9(3):e91611.
[18] Leonardi R, Villari L, Piacentini C, et al. Immunolocalization of vimentin and alpha-smooth muscle actin in dysfunctional human temporomandibular joint disc samples[J]. J Oral Rehabil, 2002, 29(3):282-286.
[19] Thyberg J, Moskalewski S. Role of microtubules in the organization of the Golgi complex[J]. Exp Cell Res, 1999, 246 (2):263-279.
[20] 郭恒, 段王平, 李琦, 等. 微管蛋白破坏对软骨细胞代谢功能的影响[J]. 中华医学杂志, 2011, 91(15):1036-1040.
Guo H, Duan WP, Li Q, et al. Disassembly of the tubulin cytoskeleton disrupts articular cartilage chondrocyte homeostasis[J]. Natl Med J China, 2011, 91(15):1036-1040.
[21] Yoshida H, Fukumura Y, Nishida M, et al. The immunohistochemical distribution of vimentin in human temporomandibular joint samples[J]. J Oral Rehabil, 2004, 31(1):47-51.
[22] Trickey WR, Vail TP, Guilak F. The role of the cytoskeleton in the viscoelastic properties of human articular chondrocytes [J]. J Orthop Res, 2004, 22(1):131-139.
[23] Noriega S, Hasanova G, Subramanian A. The effect of ultrasound stimulation on the cytoskeletal organization of chondrocytes seeded in three-dimensional matrices[J]. Cells Tissues Organs, 2013, 197(1):14-26.
[24] Pascarelli NA, Collodel G, Moretti E, et al. Changes in ultrastructure and cytoskeletal aspects of human normal and osteoarthritic chondrocytes exposed to interleukin-1β and cyclical hydrostatic pressure[J]. Int J Mol Sci, 2015, 16(11): 26019-26034.
[25] Magara J, Nozawa-Inoue K, Suzuki A, et al. Alterations in intermediate flaments expression in disc cells from the rat temporomandibular joint following exposure to continuous compressive force[J]. J Anat, 2012, 220(6):612-621.
[26] 孔楠楠, 张文霞, 康宏, 等. 山羊颞下颌关节盘细胞肌动蛋白骨架的研究[J]. 口腔医学研究, 2015, 31(10):953-956.
Kong NN, Zhang WX, Kang H, et al. Study on the cytoskeleton of cultured goat temporomandibular joint disc cells[J]. J Oral Sci Res, 2015, 31(10):953-956.
(本文编辑 吴爱华)
Effect of different oxygen tension on the cytoskeleton remodeling of goat temporomandibular joint disc cells
He Xiao-lan1, Bao Guangjie1,2, Sun Linglu1, Zhang Xue1, Bao Shanying1, Kang Hong1.
(1. Institute of Stomatology, Lanzhou University, Lanzhou 730000, China; 2. Key Laboratory of Oral Diseases of Gansu Provincial, Key Laboratory of Stomatology of State Ethnic Affairs Commission, Northwest Minzu University, Lanzhou 730030, China)
ObjectiveThe effect of different oxygen tensions on the cytoskeleton remodeling of goat temporomandibular joint (TMJ) disc cells were investigated.MethodsGoat TMJ disc cells were cultured under normoxia (21% O2) and hypoxia (2%, 4%, and 8% O2). Toluidine blue, picrosirius red, and type Ⅰ collagen immunocytochemical staining were performed to observe the changes in cell phenotype under different oxygen levels. Immunofuorescent staining and real-time reverse transcription-polymerase chain reaction analysis were then performed to identify actin, tubulin, and vimentin in the cultured disc cells.ResultsTMJ disc cells still displayed fbroblast characteristics under different oxygen levels and their cytoskeletons had regular arrangement. The fuorescence intensities of actin and vimentin were lowest at 4% O2(P<0.05), whereas that of tubulin was highest at 2% O2(P<0.05). No signifcant difference among the other groups was observed (P>0.05). Actin mRNA levels were considerably decreased at 2% O2and 4% O2in hypoxic conditions, while actin mRNA expression was highest in 21% O2. Tubulin mRNA levels considerably increased at 2% O2, while tubulin mRNA expression was lowest in 8% O2(P<0.05). Vimentin mRNA expression was lowest at 4% O2and highest at 21% O2, and signifcant differences were observed between vimentin mRNA expression levels among these oxygen levels (P<0.05).ConclusionCytoskeletons were recon-structed in different oxygen tensions, and 2% O2may be the optimal oxygen level required to proliferate TMJ disc cells.
temporomandibular joint disc; hypoxia; cytoskeleton; actin; tubulin; vimentin
R 78
A
10.7518/hxkq.2017.04.004
Supported by: Natural Nation Science Foundation of China (81160139, 81660189). Correspondence: Kang Hong, E-mail: kanghong@lzu.edu.cn.
2017-01-11;
2017-04-01
国家自然科学基金(81160139,81660189)
何晓兰,硕士,E-mail:hexl2014@lzu.edu.cn
康宏,教授,博士,E-mail:kanghong@lzu.edu.cn

