孕期健康和环境暴露对牙发育的影响
万冕 周学东 郑黎薇
口腔疾病研究国家重点实验室,国家口腔疾病临床研究中心,四川大学华西口腔医院,成都 610041
孕期健康和环境暴露对牙发育的影响
万冕 周学东 郑黎薇
口腔疾病研究国家重点实验室,国家口腔疾病临床研究中心,四川大学华西口腔医院,成都 610041
牙发育是复杂信号网络调控的牙源性上皮和神经嵴来源牙源性间充质之间交互作用的结果,遗传因素及环境因素在此过程中均发挥重要作用。母体是胎儿生长发育的主要载体,孕期母体健康和环境暴露对胎儿和儿童牙发育具有较大影响。本文根据不同类型的孕期母体环境因素,重点从环境内分泌干扰物、多种化学物质的联合作用及母体健康等三个方面对胎儿和儿童牙发育的关键问题进行综述,探讨了孕期环境因素在釉质发育缺陷、磨牙切牙矿化不全、氟牙症、多生牙及先天性缺牙等牙发育异常中的作用,为从生命早期预防牙发育异常、评估牙发育异常风险、进行牙发育相关咨询、促进儿童口腔健康管理提供理论依据。
牙发育; 孕期健康; 环境因素; 环境内分泌干扰物
母体是胎儿生长发育的主要载体,母体环境时刻影响胎儿生长发育。随着母源性疾病(maternal disease)、健康与疾病的发育起源(developmental origins of health and disease,DOHaD)等理论的提出和发展[1],孕期母体健康与环境暴露对儿童发育和健康的影响越来越受到各方关注。
牙发育异常(developmental defects of teeth)是由于牙发育信号紊乱所致的牙形态结构异常,包括牙数目、大小、形态及牙体结构的异常。牙发育异常可致错畸形及颌面部发育异常,并且是儿童最常见口腔疾病—龋病发生的高风险因素[2]。众所周知,牙发育是由复杂信号网络调控的牙源性上皮和神经嵴来源的牙源性间充质之间交互作用的结果,遗传因素及环境因素在此过程中均发挥重要作用。牙结构异常中的釉质发育缺陷病例中,遗传性因素占5%,环境因素影响高达95%[3]。
国内外研究发现孕期母体健康状态、有害化学物质暴露、不良生活方式等与胎儿甚至儿童牙发育密切相关。这提示孕期环境因素在牙发育过程中所发挥的作用不容忽视。本文综述了孕期母体健康状态及环境暴露对儿童牙齿生长发育的影响,为从生命早期预防牙发育异常、评估牙发育异常风险、提供牙发育相关咨询、促进儿童口腔健康管理提供理论依据。
1 牙发育
牙发育是胚胎发育的一部分,与口腔颌面部发育密切相关。人胚胎发育过程可分为三个阶段:第一阶段是自受精卵形成至第2周的增殖期(Preembryonic Period)。该阶段包括受精、着床及三胚层胚盘的形成。一些先天性的发育缺陷来源于该阶段,严重时可致早期流产。第二阶段为胚胎期(Embryonic Period),即第3~8周,涉及形态发生并分化出不同类型的组织形成器官、系统和胚胎。口腔颌面部发育主要来源于第1鳃弓(衍化出的下颌突和上颌突)和额鼻突(衍化出的中鼻突和侧鼻突)。这些面突在胚胎第6~7周时进行联合或融合。颜面各部分于第7~8周时初具人形。乳牙从该阶段开始发生:在胚胎第24天时,部分口腔被覆上皮开始增厚,并展现成牙潜能信号。该上皮在第5周由深层间充质诱导形成原发性上皮。在胚胎第7周,原发性上皮向深层生长,形成牙板,牙发育正式启动。胚胎期结束后,胚胎发育进入胎儿期(Fetal Period)直至出生。期间,胚胎进一步发育成熟。在胚胎第8周,牙板继续向深处的间充质组织生长,伴随其下方及周围间充质细胞增生,形成牙胚。牙胚由成釉器、牙乳头和牙囊组成。成釉器和牙乳头分化形成的成釉细胞和成牙本质细胞交替分泌釉质及牙本质基质并形成牙冠。牙冠基本形成后,成釉器的内釉上皮和外釉上皮向根尖方向生长形成上皮根鞘,并与牙囊相互作用最终形成牙根。随着牙根的发育,牙齿萌出并向平面移动直至建完成(图1)。
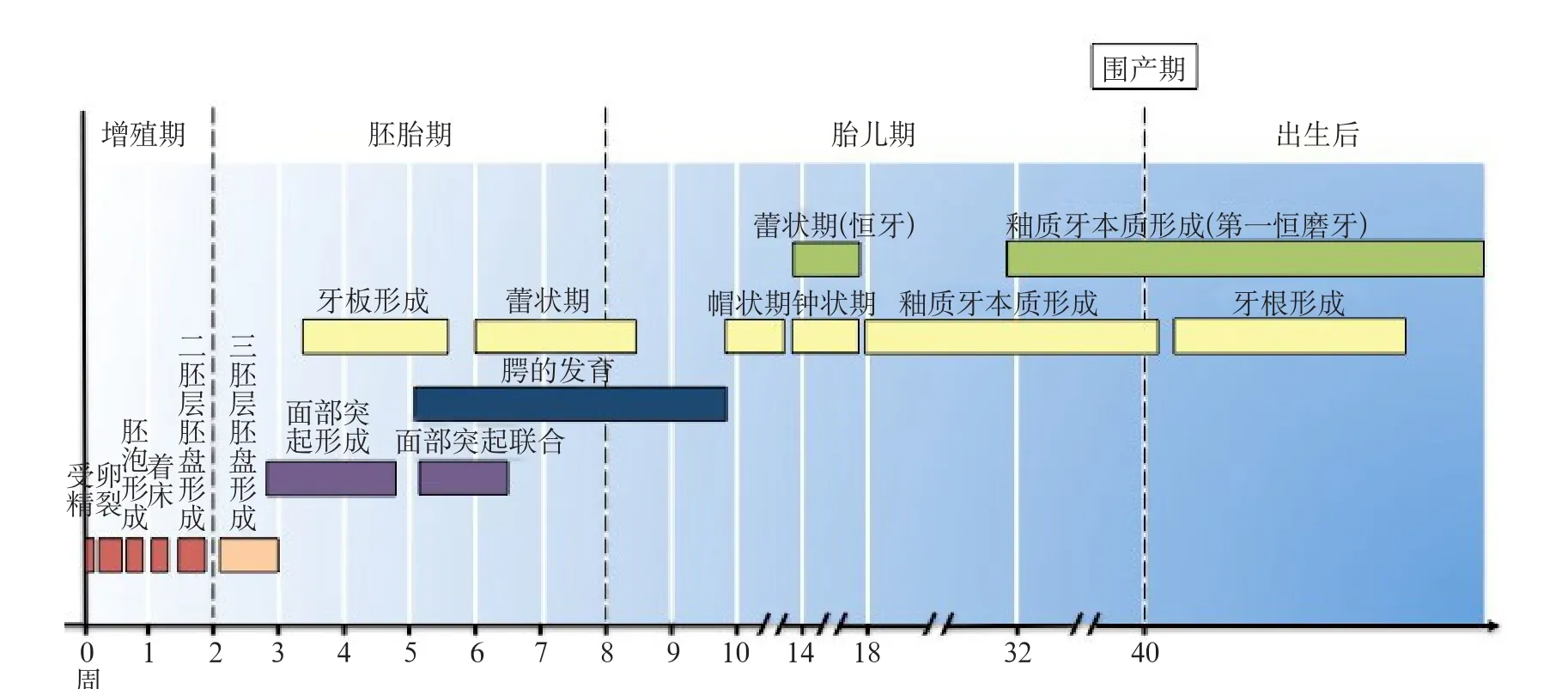
图 1 牙发育时间轴Fig 1 Timeline of tooth development
恒牙发育与乳牙相似,但发育时间点不同。乳牙胚从胚胎第6~8周开始形成,这一过程约10周。继承恒牙(切牙、尖牙、前磨牙)牙胚在第20周至出生后10个月间形成。恒磨牙牙胚的形成从胚胎第20周(第一恒磨牙)持续至5岁(第三恒磨牙)。此过程发生紊乱可导致多种牙发育异常。但牙根的发育主要发生在出生后,因此母体环境因素对其影响甚微[4]。
2 孕期环境因素
孕期母体环境因素可影响胎儿牙发育。妊娠早期病毒、药物、环境污染、X线照射等因素均可影响牙齿发育,尤其是牙的数目、大小及形态。母体缺乏蛋白质,维生素A、D或矿物质钙、磷、铁等,可直接影响牙发育,导致釉质或牙本质结构异常。同时越来越多的学者关注到,生命早期母体的环境暴露与胎儿及儿童的牙发育异常密切相关。这种暴露往往是多因素的,在研究环境暴露时必须考虑其与其他环境暴露的联合作用。
2.1 环境内分泌干扰物(environmental endocrine disruptors,EEDs)
近年,母体孕期EEDs的暴露对胎儿甚至儿童生长发育的不良影响受到广泛关注。EEDs又称环境类激素,是指一些可干扰体内正常内分泌物质的合成、分泌、转运、结合、作用或消除的外源性化学物质。它们可激活或抑制内分泌系统功能,最终影响机体正常生长发育及稳态维持。目前已发现具有内分泌干扰作用的化学物质至少有70余种,具有不易降解及易挥发等特点,并且可通过生物富集和食物链的放大作用造成体内蓄积。这些化合物对胎儿的生长发育、出生缺陷、代谢紊乱等都具有明显的干扰效应。
双酚A(bisphenol A,BPA)是EEDs中最具代表性的一种,广泛应用于工业制造。在美国,孕妇的血清、羊水及胎儿出生时的脐带血中均存在BPA,这表明产前期是BPA暴露的关键窗口[5-6]。血清和尿液中BPA浓度已证实与甲状腺功能减退、不孕症、心血管疾病和糖尿病风险增加有关[7]。BPA进入母体,并通过胎盘传递给胎儿,对胎儿器官功能、中枢神经系统发育、心理行为等方面产生影响。
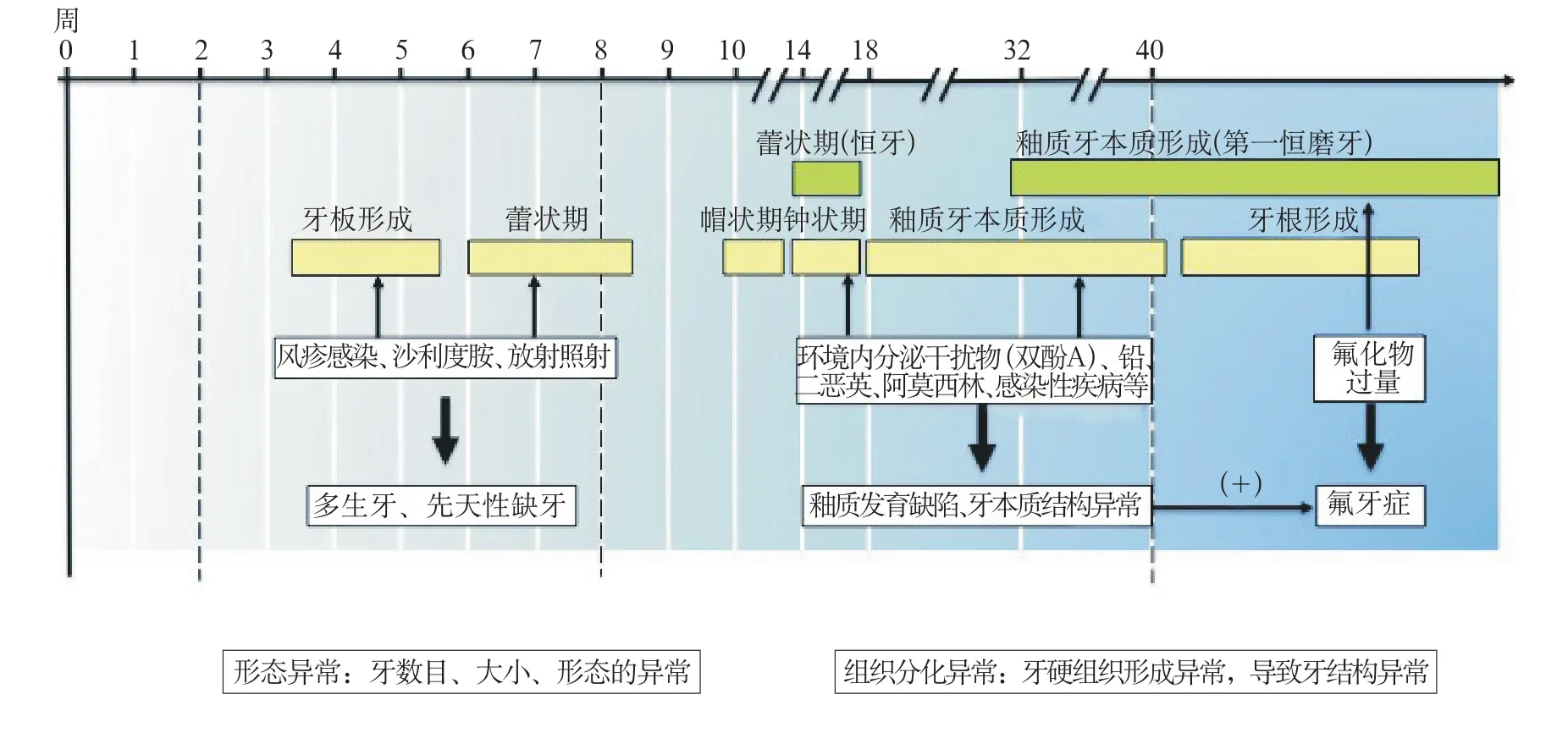
图 2 母体环境因素与牙发育的相关性Fig 2 Correlations of odontogenesis and maternal environmental factors
围产期是BPA暴露最敏感的时期,同时也是人釉质形成的关键时期[8-10](图2)。近期的研究[11-12]表明,大鼠从胚胎期至出生后30 d暴露于少量BPA中,釉质形成不均匀不透明的斑点状病损,成功构建釉质发育缺陷模型。该模型中的釉质发育缺陷与人磨牙切牙矿化不全(molar incisor hypomineralization,MIH)的临床表现及生化特性相近。MIH是全身因素引起的一个或一个以上第一恒磨牙釉质矿化不全,常伴切牙受累。患牙常呈现界限清晰、范围局限的不透明斑块,颜色为白色、黄色甚至棕色。患牙釉质易发生破损并快速发展为龋。其病因尚不明确,多认为与患儿3岁以前全身情况或环境因素有关[13-14]。目前,实验性研究表明,大鼠釉质发育缺陷与母体暴露于EEDs密切相关,提示孕期母体EEDs暴露极有可能是MIH的病因之一。
2.2 多种化学物的联合作用
2.2.1 环境内分泌干扰素与氟化物的联合作用 氟化物存在于世界各个地区,被广泛应用于牙科以预防龋病。但在牙发育阶段摄入过多的氟可导致氟牙症(dental fuorosis,DF)。近年,水中氟化物浓度已经得到精确调控。尽管如此,流行病学研究[15-16]结果显示,DF患病率仍呈逐年上升趋势。美国12~15岁青少年的流行病学调查指出,1999—2004年DF的发病率较1986—1987年明显提高[17]。人群不明原因地对氟敏感度提高可能与多种化学物质的联合作用密切相关[18]。最新研究[19]发现,较单纯环境暴露,大鼠孕期同时暴露于氟化物及BPA可形成更严重的牙釉质矿化不全。该研究结果提示BPA可能提高人体对氟的敏感度并导致牙发育异常,如儿童MIH及青少年DF等,并且最终导致儿童及成年患者的龋病发生率升高。
2.2.2 其他毒物与氟化物的联合作用 当孕鼠单纯暴露于铅时并不会影响子代牙釉质发育,然而同时暴露于铅和氟化物导致的釉质发育缺陷较单独暴露于氟化物更为严重[20]。此外,孕期二恶英或阿莫西林的暴露也可加重氟化物引起的牙釉质发育不全[20-22]。以上研究结果提示,孕期的二恶英、阿莫西林及铅等药物或毒素的暴露可加重儿童及成年患者因氟牙症形成的牙体缺损。尽管已经证实多种化学物联合作用可增加人群对毒物的敏感度及加重牙发育异常的严重程度,但其导致釉质发育缺陷的潜在机制仍有待进一步研究。
2.3 母体健康因素
孕期母体全身系统性改变同样能够导致牙发育异常。孕期母体感染已证实与牙发育相关,如釉质发育不全。学者们通过流行病学调查及实验研究对釉质发育缺陷(developmental defects of enamel,DDE)进行研究发现,感染性疾病的病原体,如细菌、病毒等可以引起釉质发育不全,并且多同时影响乳牙列和恒牙列。母体梅毒螺旋体感染所造成“哈钦森牙”主要表现为牙体形态及牙体结构(釉质结构上属于釉质发育不全)发育异常。母体全身疾病同样影响胎儿牙齿发育。目前已有研究[23-24]结果指出母体的糖尿病可能与幼儿乳牙发育异常相关。此外,母体身体健康状态与牙发育密切相关。妊娠期母体营养不良常导致低出生体重儿童,并与儿童釉质发育不全密切相关。低出生体重儿童乳牙釉质发育不全患病率明显高于出生体重正常的儿童[25]。更有学者提出,低出生体重患儿在出生后易出现钙元素代谢紊乱,从而影响釉质矿化并导致釉质浑浊症。
牙发育过程中遗传因素与环境因素的影响在不同牙发育异常中所占比重各有不同。遗传因素被证实是牙数目异常、牙本质形成缺陷及结构不良等发育异常的主要因素。多生牙是由于牙板过长或恒牙胚异常分裂所致,已被证实具有一定的遗传性和家族性[26]。临床研究[27]提示先天性缺牙病例同样呈现家族聚集现象,先天性缺牙患者的一级亲属患有先天性缺牙的概率明显高于普通人群。也有研究指出许多潜在的环境因素均可导致以上牙发育异常的发生,如外伤、放射线照射、化学药物、病理代谢产物、微生物、细菌和梅毒螺旋体感染等。另外,大量研究[28]指出先天性缺牙的病因模式是多基因多因素的,环境因素可干扰先天性缺牙特定基因表型的表达。
目前,母体孕期环境因素对牙发育的负面效应已经得到证实。本文根据环境因素的不同类型,重点从环境内分泌干扰物、多种化学物质的联合作用及母体健康状态等三个方面对胎儿及儿童牙发育的关键问题进行综述,探讨了孕期环境因素在釉质矿化不全、磨牙切牙矿化不全、氟牙症、多生牙及先天性缺牙等牙发育异常中的作用。
综上所述,任何能够通过母体途径影响胎儿发育的环境暴露都可视为孕期环境暴露。孕期环境暴露可影响胎儿牙发育甚至可作用于儿童期或成年期。未来需要更多的流行病学和实验研究来解释母体健康及孕期环境暴露与胎儿牙发育异常的病因关联,并致力于母体环境暴露对胎儿牙发育负面影响的发生机制研究,为从生命早期预防牙发育异常,评估牙发育异常风险,提供牙发育相关咨询及促进儿童口腔健康管理提供理论依据。
[1] Heindel JJ, Balbus J, Birnbaum L, et al. developmental origins of health and disease: integrating environmental infuences [J]. Endocrinology, 2015, 156(10):3416-3421.
[2] Zhou Y, Lin HC, Lo EC, et al. Risk indicators for early childhood caries in 2-year-old children in southern China[J]. Aust Dent J, 2011, 56(1):33-39.
[3] Zhong C, Ma KN, Wong YS, et al. Oral health knowledge of pregnant women on pregnancy gingivitis and children’s oral health[J]. J Clin Pediatr Dent, 2015, 39(2):105-108.
[4] Nanci A. Ten Cate’s oral histology[M]. 8th ed. St. Louis. Elsevier, 2013:70-94.
[5] Silva MJ, Scurrah KJ, Craig JM, et al. Etiology of molar incisor hypomineralization-a systematic review[J]. Community Dent Oral Epidemiol, 2016, 44(4):342-353.
[6] Pirard C, Sagot C, Deville M, et al. Urinary levels of bisphenol A, triclosan and 4-nonylphenol in a general Belgian population[J]. Environ Int, 2012, 48:78-83.
[7] Zoeller RT. Endocrine disruptors: do family lines carry an epigenetic record of previous generations’ exposures[J]. Endocrinology, 2006, 147(12):5513-5514.
[8] Poimenova A, Markaki E, Rahiotis C, et al. Corticosteroneregulated actions in the rat brain are affected by perinatal exposure to low dose of bisphenol A[J]. Neuroscience, 2010, 167(3):741-749.
[9] Varayoud J, Ramos JG, Muñoz-de-Toro M, et al. Long-lasting effects of neonatal bisphenol A exposure on the implantation process[J]. Vitam Horm, 2014, 94:253-275.
[10] AlQahtani SJ, Hector MP, Liversidge HM. Brief communication: the London atlas of human tooth development and eruption[J]. Am J Phys Anthropol, 2010, 142(3):481-490.
[11] Jedeon K, De la Dure-Molla M, Brookes SJ, et al. Enamel defects refect perinatal exposure to bisphenol A[J]. Am J Pathology, 2013, 183(1):108-118.
[12] Jedeon K, Loiodice S, Marciano C, et al. Estrogen and bisphenol A affect male rat enamel formation and promote ameloblast proliferation[J]. Endocrinology, 2014, 155(9): 3365-3375.
[13] Weerheijm KL, Jälevik B, Alaluusua S. Molar-incisor hypomineralisation[J]. Caries Res, 2001, 35(5):390-391.
[14] Weerheijm K. The European academy of paediatric dentistry and molar incisor hypomineralisation[J]. Eur Arch Paediatr Dent, 2015, 16(3):233-234.
[15] Shekar C, Cheluvaiah MB, Namile D. Prevalence of dentalcaries and dental fuorosis among 12 and 15 years old school children in relation to fuoride concentration in drinking water in an endemic fuoride belt of Andhra Pradesh[J]. Indian J Public Health, 2012, 56(2):122-128.
[16] Sudhir KM, Prashant GM, Subba Reddy VV, et al. Prevalence and severity of dental fuorosis among 13- to 15-yearold school children of an area known for endemic fuorosis: Nalgonda district of Andhra Pradesh[J]. J Indian Soc Pedod Prev Dent, 2009, 27(4):190-196.
[17] Beltrán-Aguilar ED, Barker L, Dye BA. Prevalence and severity of dental fuorosis in the United States, 1999-2004 [J]. NCHS Data Brief, 2010(53):1-8.
[18] Khan A, Moola MH, Cleaton-Jones P. Global trends in dental fuorosis from 1980 to 2000: a systematic review[J]. SADJ, 2005, 60(10):418-421.
[19] Jedeon K, Houari S, Loiodice S, et al. Chronic exposure to bisphenol A exacerbates dental fuorosis in growing rats[J]. J Bone Miner Res, 2016, 31(11):1955-1966.
[20] Leite GA, Sawan RM, Teóflo JM, et al. Exposure to lead exacerbates dental fuorosis[J]. Arch Oral Biol, 2011, 56(7): 695-702.
[21] Salmela E, Lukinmaa PL, Partanen AM, et al. Combined effect of fuoride and 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin on mouse dental hard tissue formation in vitro[J]. Arch Toxicol, 2011, 85(8):953-963.
[22] Sahlberg C, Pavlic A, Ess A, et al. Combined effect of amoxicillin and sodium fuoride on the structure of developing mouse enamel in vitro[J]. Arch Oral Biol, 2013, 58(9):1155-1164.
[23] Via WF Jr, Churchill JA. Relationship of enamel hypoplasia to abnormal events of gestation and birth[J]. J Am Dent Assoc, 1959, 59:702-707.
[24] Norén JG. Microscopic study of enamel defects in deciduous teeth of infants of diabetic mothers[J]. Acta Odontol Scand, 1984, 42(3):153-156.
[25] Corrêa-Faria P, Martins-Júnior PA, Vieira-Andrade RG, et al. Developmental defects of enamel in primary teeth: prevalence and associated factors[J]. Int J Paediatr Dent, 2013, 23(3):173-179.
[26] Liu JF. Characteristics of premaxillary supernumerary teeth: a survey of 112 cases[J]. ASDC J Dent Child, 1995, 62(4): 262-265.
[27] Dyer S, Greenwood C. Gene-environment interaction in human disease-Journal of Psychiatric Research[J]. J Am Geriatr Soc, 2001, 49(4):494-496.
[28] 冯海兰. 先天性缺牙的口腔修复治疗Ⅰ. 先天性缺牙的分类、发病率及病因[J]. 中华口腔医学杂志, 2011, 46 (1):54-57. Feng HL. Prosthodontic treatment of congenital tooth agenesis Ⅰ. The classicfication, prevalence and etiology of congenital tooth agenesis[J]. Chin J Stomatol, 2011, 46(1): 54-57.
(本文编辑 杜冰)
Effect of maternal health and prenatal environmental exposure factors on tooth development
Wan Mian, Zhou Xue-dong, Zheng Liwei.
(State Key Laboratory of Oral Diseases, National Clinical Research Center for Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Odontogenesis is a consequence of a complex series of reciprocal signal interactions between odontogenic epithelium and neural crest-derived odontotgenic mesenchyme. These interactions result from a complex interplay of genetic and environmental factors. Given that a fetus develops in the mother, maternal health and environmental exposures have a great infuence on tooth development. In this review, we focused on the key issues in the developmental defects of teeth induced by various types of maternal environmental factors, including environmental endocrine disruptors, joint action of two or more chemical exposures, and maternal health status. This review also discussed the adverse effects of maternal environmental factors on tooth development. These effects include enamel developmental defects, molar incisor hypomineralization, dental fuorosis, hyperdontia and hypodontia. Overall, this review provides a theoretical basis for the prevention of tooth defects in early life, assessment of risks from developmental tooth defects, and advancement of pediatric oral health management.
odontogenesis; maternal health; environmental factors; environmental endocrine disruptors
R 780.2
A
10.7518/hxkq.2017.04.018
Supported by: National Natural Science Foundation of China, General Project (81470711, 81371136). Correspondence: Zheng Liwei, E-mail: liwei.zheng@scu.edu.cn.
2016-09-17;
2017-05-13
国家自然科学基金面上项目(81470711,81371136)
万冕,讲师,博士,E-mail:wan10167@hotmail.com
郑黎薇,教授,博士,E-mail:liwei.zheng@scu.edu.cn

