P-15肽促进间充质干细胞向软骨细胞分化的实验研究
张 郡,杨利丽,刘钦毅,孟宪荣,刘 睿,王瑞强,田海清,万 腾
(吉林大学第二医院,吉林 长春130041)
*通讯作者
P-15肽促进间充质干细胞向软骨细胞分化的实验研究
张 郡,杨利丽,刘钦毅,孟宪荣*,刘 睿,王瑞强,田海清,万 腾
(吉林大学第二医院,吉林 长春130041)
目的 本研究探讨P-15肽能否有效激活、促进软骨细胞向增殖分化。方法 在不同的培养基培养鼠间充质干细胞(mesenchymal stem cells,MSCs),培养细胞采用阿辛蓝染色和碱性磷酸酶染色,并行碱性磷酸酶定量;免疫组织化学及蛋白免疫印迹检测软骨形成特异性标记。结果 ①与对照组相比,P-15肽组呈现大量的碱性磷酸酶阳性细胞,蛋白聚糖的合成明显增加;②免疫组织化学检测提示P-15肽组collagen X (COLX)、Runt-related transcription factor 2(RUNX2)、matrix metallopeptidase 13(MMP13)明显高于对照组;③蛋白免疫印迹检测提示P-15肽组在RUNX2、MMP-13、Vascular endothelial growth factor(VEGF)、COLX几个因子表达明显升高(P<0.05)。结论 P-15肽能有效激活、促进间充质干细胞增殖和向软骨细胞分化。
P-15肽;软骨细胞;软骨内骨化;增殖;分化
(ChinJLabDiagn,2017,21:1425)
随着当今社会人口老龄化逐年呈上升趋势,由多种原因导致的骨折等疾病也日益增多。在骨折愈合过程当中,成骨速度是影响愈合速度及愈合率的关键因素[1-3]。影响成骨率的一个关键因素是相互作用间质细胞的表面细胞外基质[4,5],其中最主要的是I型胶原蛋白[6]。P-15肽为胶原蛋白Iα-1链的一段15个氨基酸序列,为人工合成的人类Ⅰ型胶原蛋白细胞结合域[7]。现已证明P-15肽通过α2β1亚基发挥作用,诱导骨细胞和成骨细胞发生粘附,迁移,增殖和分化[8,9]。P-15肽调节细胞数目和组织结构可能的机制是增强活性细胞的贴附和调节细胞的凋亡[10]。当前,P15肽作为增强剂吸附于无机骨基质促进脊柱融合手术中的骨化正在进行临床试验[11]。本研究旨在检测外源性P-15肽对间充质干细胞向软骨细胞形态分化、碱性磷酸酶水平以及对软骨细胞基因和蛋白表达的影响。
1 材料和方法
1.1 细胞培养及染色
该实验选用鼠间充质干细胞在DMEM培养基(Dulbecco’s Modified Eagle’s Medium)中在37度,5%CO2的孵箱内培养。将第6代细胞分为P-15肽组和空白对照组分别接种于均匀铺有P-15肽的培养皿和未做任何处理的培养皿中,制备软骨诱导分化培养基,每2天换液一次,培养12天,细胞培养的温度为37度,湿度95%,CO2浓度为5%。提取第6天的细胞进行染色分析,剩余细胞培养至12天进行下一步分析。
1.2 细胞团的培养及染色
将培养出的第6代细胞利用0.25%的胰酶消化,在无菌的琼脂糖溶液(42℃,2%W/v PBS)里重悬,最后细胞密度为20 000个/μl。在琼脂糖包裹之前用低聚甲醛将细胞固定作为阴性对照组,琼脂糖包裹后未做任何处理的作为阳性对照组,实验组分3组:BSA组、Ⅰ型胶原组、P-15肽组分别加入等重的牛血清蛋白(BSA)、Ⅰ型胶原、P-15肽。每组取10 μl混合液接种于24孔板,37度孵育2 h,在细胞周围添加软骨培养基,每2天换液一次,第12天取出细胞团用10%PBS冲洗1 h,然后70%乙醇固定、常规石蜡包埋、切片及碱性磷酸酶染色、定量。
1.3 免疫组织化学分析
将第6代细胞分为P-15肽组和空白对照组分别平铺在含有P-15肽和空白培养皿内,结束后用PBS洗涤2次,再用95%乙醇脱水固定5 min,再用PBS洗涤3次后计入封闭液2 h,然后分别加入1∶50浓度的一抗:COLx、MMP-13、RUNx2,4℃环境中过夜后吸出一抗,PBS洗涤3次,加入带有荧光标记的二抗室温孵育1 h。
1.4 蛋白免疫印迹分析
培养12天的细胞用冰PBS洗涤后,2 000 g离心5 min,弃上清,加入细胞裂解液300 μl,室温震荡20分钟,14 000 g离心15 min,取上清液进行蛋白免疫印迹分析。
1.5 统计方法
2 结果
2.1 细胞培养及染色结果MSCs进行阿辛蓝染色和碱性磷酸酶染色,如图1所示,与对照组相比实验组呈现大量碱性磷酸酶阳性细胞,蛋白聚糖的合成较对照组明显增加。
2.2 细胞团培养及染色结果
MSCs在琼脂糖或混有胶原或P-15肽的琼脂糖培养基中培养12天然后行碱性磷酸酶染色。结果如表1所示,实验组的细胞碱性磷酸酶染色较对照组明显升高(P<0.05)。
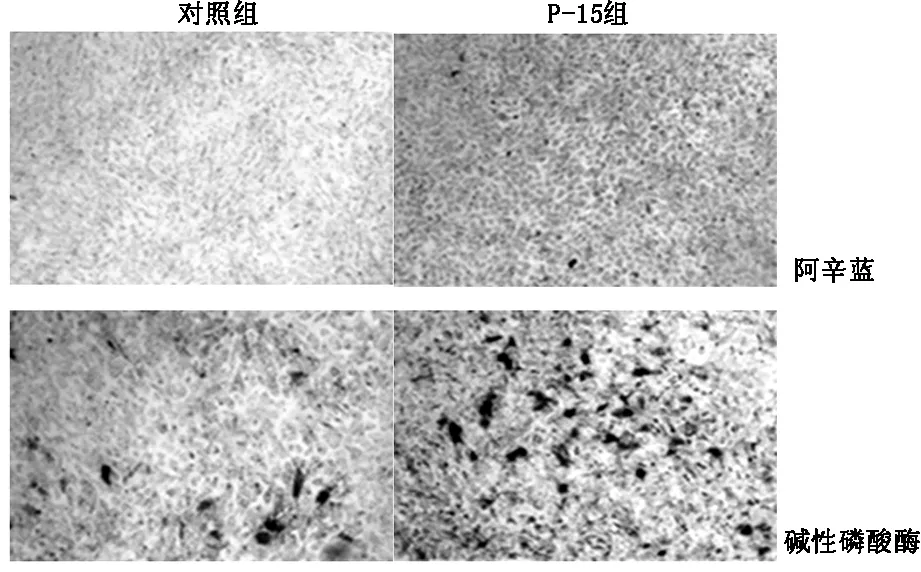
图1 MSCs阿辛蓝染色和碱性磷酸酶染色

表1 培养12天碱性磷酸酶定量(kDa)
P<0.05
2.3 免疫组织化学和蛋白免疫印迹
免疫组织化学结果如图2所示P-15肽组COLX、RUNX2、MMP-13荧光强度明显强于对照组。蛋白免疫印迹结果如表2所示,P-15肽组间充质细胞在成软骨培养基培养12天后的COL X,Runx2,VEGF和MMP13水平较对照组明显升高。
免疫组织化学和蛋白免疫印迹结果提示P-15肽能够增强MSC向软骨细胞的分化。
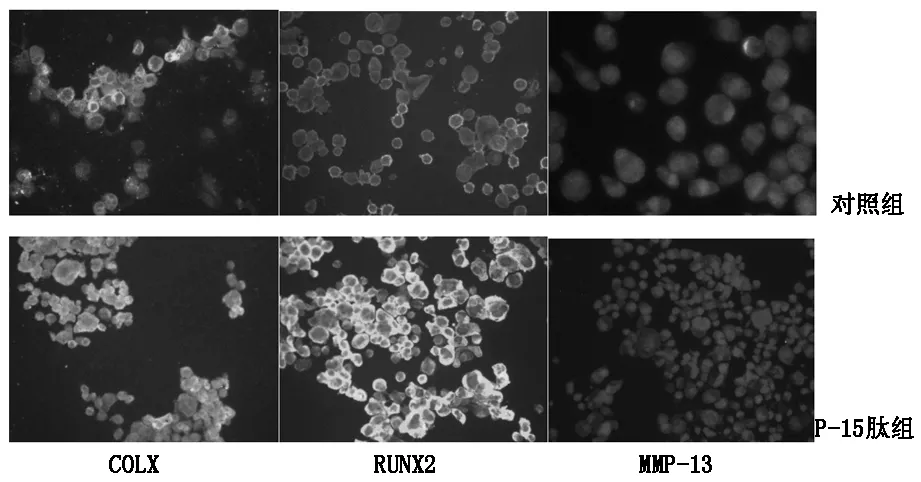
图2 Runx2,COL X和MMP13免疫组织化学染色

ColXRunx2VEGFMMp⁃13对照组810.887±73.425498.717±48.369400.686±18.480573.867±21.286P⁃15组1131.652±102.34832.472±64.136732.751±119.7841348.441±119.784
P<0.05
3 讨论
骨折愈合的过程也是骨的再生过程,骨折愈合期间软骨内骨化在骨折修复和成骨过程当中发挥着至关重要的作用[12,13]。在软骨内骨化成骨的过程中,软骨细胞不断增殖、分化成熟,肥大区软骨细胞退化死亡,软骨基质钙化并被骨组织取代,从而完成软骨内成骨的过程[14,15]。软骨细胞在细胞外基质中的增殖与分化,依赖于细胞外基质的信号转导[4,5]。
在细胞增殖与分化的过程中,人工合成的P-15肽被首次发现参与骨折修复与重塑过程当中[16]。有实验研究发现,相对于对照组P-15肽能明显增强钻孔缺陷的皮质骨形成[17]。P-15肽调节细胞数目和组织结构可能的机制是增强活性细胞的贴附和调节细胞的凋亡[10]。
软骨细胞的碱性磷酸酯酶水平是软骨细胞钙化的标志性酶,其活性和数量,可以被认为是软骨钙化程度高低的标志。蛋白聚糖是软骨细胞外基质的重要组成成分,维持着软骨的弹性和可塑性,蛋白聚糖的合成与分解代谢平衡能有效维持软骨外基质结构与功能[18]。本研究对P-15肽促进间充质干细胞的成熟以及向软骨细胞分化的假说进行验证,结果表明P-15肽干预的鼠间充质干细胞,呈现碱性磷酸酶、蛋白聚糖的合成较对照组明显增加,同时碱性磷酸酶定量结果也提示能明显促进碱性磷酸酶的增加(P<0.05),表明P-15肽可以显著促进间充质干细胞的增殖,同时向软骨细胞系转化和软骨内骨化。
[1]RK Siu,SS Lu,W Li,et al.Nell-1 protein promotes bone formation in a sheep spinal fusion model[J].Tissue Eng,Part A,2011,17 (7-8):1123.
[2]Reid J.J,JohnsonJ.S,and J.C.Wang.Challenges to bone formation in spinal fusion[J].J Biomech,2010,44(2):213.
[3]J Nerubay,B Marganit,JJ Bubis,et al.Stimulation of bone formation by electrical currenton spinal fusion[J].Spine,1986,11(2):167.
[4]Ching-Fang Chang,Ming-Wei Lee,PY Kuo,et al.Three-dimensional collagen fiber remodeling by mesenchymal stem cells requires the integrin-matrix interaction[J].J Biomed Mater ResA,2007,80(2):466.
[5]RT Franceschi,C Ge,G Xiao,etal.Transcriptional regulation of osteoblasts[J].Cells Tissues Organs,2009,189(1-4):144.
[6]Myllyharju,J.and K.I.Kivirikko,Collagens,modifyingenzymes and their mutations inhumans,flies and worms[J].TrendsGenet,2004,20(1):33.
[7]RS Bhatnagar,JJ Qian,A Wedrychowska,etal.Design of biomimetic habitats for tissue engineering with P-15,a synthetic peptide analogue of collagen.[J].Tissue Eng,1999,(5):53.
[8]Qinyi Liu,Worawat Limthongkul,G Sidhu,et al.Covalent attachment of P15 peptide to titanium surfaces enhances cell attachment,spreading,and osteogenic gene expression [J].J Orthop Res,2012,30(10):1623.
[9]Bhatnagar RS,Qian JJ,Gough CA.The role in cell binding of a beta-bendwithin the triple helical region in collagen alpha 1 (I) chain:structural and biological evidence for conformational tautomeric on fiber surface [J].J Biomol Struct Dyn,1997,(14):547
[10]Barboza EP,de Souza RO,Caula AL,et al.Bone regeneration of localized chronic alveolar defects utilizing cell binding peptide associated with anorganic bovine-derived bone mineral:a clinical and histological study[J].J Periodontol,2002,73(10):1153.
[11]Mobbs RJ,MaharajM,Rao PJ, Clinical outcomes and fusionrates following anterior lumbar interbody fusion with bone graftsubstitute i-FACTOR,an anorganic bone matrix/P-15 composite[J].J Neurosurg Spine,2014,21(6):867.
[12]ChaoE,InoueN.Biophysical stimulation of bone fracture repair,regeneration andremodeling [J].Eur Cell Mater,2003,(6):72.
[13]Barnes GL,Kostenuik PJ,Gerstenfeld LC,et al.Growthfactor regulation of fracture repair[J].J Bone Miner Res,1999,(14):1805.
[14]Koch H.Experimentally studien uber Knochenregeneration und knochencallusbildung [Experimental studies on bone regeneration and callus formation[J].Bruns Beitr Klin Chir,1924,(132):364.
[15]Mc Kibbin B.The biology of fracture healing in long bones[J].J Bone Joint Surg,1978,(60):150.
[16]Qian JJ,Bhatnagar RS.Enhanced cell attachment to anorganic bone mineral in the presence of a synthetic peptide related to collagen [J].J Biomed Mater Res,1996,31(4):545.
[17]Scarano A,Iezzi GPetrone G,Orsini G,et al.Cortical bone regeneration with a synthetic cell-binding peptide:a histologic and histomorphometric pilot study[J].Implant Dent,2003,12(4):318
[18]SL Carney,H Muir.The structure and function of cartilage proteoglycans[J].Physiological Reviews,1988,68(3) :858.
P15 peptide enhances Mesenchymal stem cells chondrocyte differentiation and formation:a experimental study in vitro
ZHANGJun,YANGLi-li,LIUQin-yi,etal.
(TheSecondHospitalofJilinUniversity,Changchun130041,China)
Objective The purpose of the experiment is to clarify whether SyntheticpeptideP15 can promotes chondrogenic differentiation and formation in vitro.Methods Mesenchymal stem cells (MSCs) was cultured in differentiation media.Alkalinephosphatase and alcian blue staining was performed.Chondrogenic markers were measured by Western blot and fluorescent immunohistochemistry.Results Compared with the uncoated controlplates the P15 peptide cultured cells showed intense alkalinephosphatase(P<0.05) and alcian blue staining.Immunofluorescent staining indicatedthat there was a significant increase in the levels ofrunt-relatedtranscription factor-2 (RUNX2),matrix metalloproteinase-13(MMP13),and collagen X (COLX) proteins.Increased expression of RUNX2,COLX,MMP13 and vascular endothelial growth factor (VEGF)was also confirmed byWestern blot analysis(P<0.05).Conclusion P15 peptide enhances chondrocyte differentiation and formation in vitro.
P-15peptide;chondrocyte;Cartilage ossification;proliferation ;differentiation
1007-4287(2017)08-1425-03
Q813
A
2016-09-26)

