不同调控因子下GUS基因在马铃薯块茎中瞬时表达的影响
舒 锐,姚甜甜,李 燕,臧传江,焦 健,兰成云,刘少军*
1.山东省轻工农副原料研究所,山东 高密 261500
2.山东农业大学 园艺科学与工程学院,山东 泰安 271018
不同调控因子下GUS基因在马铃薯块茎中瞬时表达的影响
舒 锐1,2,姚甜甜1,李 燕1,臧传江1,焦 健1,兰成云1,刘少军1*
1.山东省轻工农副原料研究所,山东 高密 261500
2.山东农业大学 园艺科学与工程学院,山东 泰安 271018
本文以马铃薯块茎为研究材料,采用根癌农杆菌介导的瞬时表达方法,通过组织化学染色法检测GUS基因的瞬时表达,并研究了乙酰丁香酮浓度、真空强度、浸染时间和共培养时间对GUS基因瞬时表达的影响。结果表明不同真空强度和共培养时间对GUS基因瞬时表达水平的影响差异极显著,且当真空强度为1 kPa、共培养时间为2 d时表达水平较高。
马铃薯;GUS;调控因子;瞬时表达
利用根癌农杆菌感染植物受伤组织,然后将质粒上的外源基因导入并整合到植物细胞的染色体上,在经过诱导分化产生转基因植株,这是目前马铃薯块茎最常用的遗传转化方法,但是通常具有遗传转化和再生效率低、外源基因表达不稳定、转化周期长和费用昂贵等问题。随着植物功能基因组学的发展,对外源基因在植物细胞内表达功能分析的快速性和高效性要求越来越高。1993年Rossi等创建了农杆菌介导的瞬时表达方法,通过真空抽滤将带有重组质粒的农杆菌渗透到植物细胞,然后根据目的基因瞬时表达来检测农杆菌介导的T-DNA的转化效率[1]。与传统的转化方法相比较,农杆菌介导的瞬时表达方法避免了传统转化方法中繁琐的组织培养过程,大大缩减了试验时间,方法更加简单快速,而且还具有表达效率高、安全性好等优点[2]。目前农杆菌介导的瞬时表达方法已经在烟草、拟南芥、莴苣、番茄、草莓、梨等多种植物中得到应用。李静等以莴苣作为研究材料,以GUS基因作为报告基因,利用农杆菌渗透法,采用正交实验设计,分析了培养的菌液浓度、诱导物乙酰丁香酮的浓度、真空抽滤时间和共培养时间等影响因子对莴苣的瞬时表达水平的影响,建立了较高表达水平的瞬时转化体系[3]。
GUS基因是目前应用最广泛的一种报告基因,GUS能与底物4-甲基伞形酮酰-β-D-葡萄糖醛酸苷(4-methylumbelliferyl-β-D-glucuronide,4-MUG)反应产生荧光物质4-甲基伞形酮(4-methylumbelliferone,4-MU),通过荧光分析可以进行GUS活性的定量检测,GUS作为报告基因来检测外源基因的转化效率方法简单,灵敏度高[4]。本研究以马铃薯块茎为研究材料,采用根癌农杆菌介导的瞬时表达方法[5],分析了不同的影响因子:乙酰丁香酮浓度、真空强度、浸染时间和共培养时间对马铃薯块茎GUS基因瞬时表达水平的影响,以用来研究影响马铃薯块茎中GUS报告基因瞬时表达的关键因素和最佳条件,对于将来建立马铃薯块茎高效瞬时表达体系提供依据。
1 材料和方法
1.1 植物材料和菌株
本研究采用鄂马铃薯(Solanum tuberosumL.)3号品种(E3)的块茎作为转化受体材料。根癌农杆菌(Agrobacterium tumefaciens)菌株为LBA4404,中间载体为pBI-121。
1.2 农杆菌的制备
取10mL低温保存的菌液,接种于10 mL液体YEB(内含50 mg/L Rif和50 mg/L Kan)培养基中,28℃,250 r/m培养20~24 h,再取1 mL菌液接入40 mL液体YEB培养基,28℃,250 r/min培养大约6 h。
将40 mL菌液在4℃5000 r/min离心10 min,去上清得到菌体。加入40 mL MS液体培养基重新悬浮,将菌液OD600值调整至约0.8,室温(22℃)静置1 h后备用。
1.3 影响因子的设置
以LBA4404[pBI-121]浸染马铃薯E3块茎,按照如下设置的处理进行实验。
将马铃薯E3块茎纵切成1~3 mm薄片,用蒸馏水洗净,在含不同诱导物乙酰丁香酮浓度(0、200、400 μmol/L)的菌悬液中以不同真空强度(1、10、101 kPa)浸染抽滤(10、20、30 min),然后将薯片用无菌水冲洗1次,放在用无菌水浸湿的滤纸的培养皿中暗培养(2、4、6 d)。培养后取薯片进行GUS组织化学染色,GUS定量检测。
设置4个影响因子(乙酰丁香酮浓度、真空强度、浸染时间、共培养时间),3个不同水平试验(表1),采用L9(34)正交表进行正交设计,试验重复3次。最后分析GUS定量检测结果。
1.4 GUS基因瞬时表达的检测
根癌农杆菌介导的实验材料培养完成后进行GUS组织化学染色[6],将薯片放入烧杯中,加入GUS 染色液(20 mmol/L X-Gluc,0.2 mmol/L Na2HPO4,0.2 mmol/L NaH2PO4,0.1%Triton X-100,10 mmol/L K3Fe(CN)6,180 mmol/L EDTA)将薯片浸泡,37℃染色9 h后倒掉染色液,加入75%(V/V)工业酒精进行脱色。荧光分析法测定GUS活性并记录实验数据。
试验所得数据用SAS统计分析软件进行方差分析,并对平均数用新复极差法进行多重比较。
2 结果与分析
2.1 不同影响因子处理的GUS表达情况
对4个影响因子设置的9种处理均获得了瞬时表达的马铃薯块茎,但不同处理组合的GUS活性不同,如表1所示。
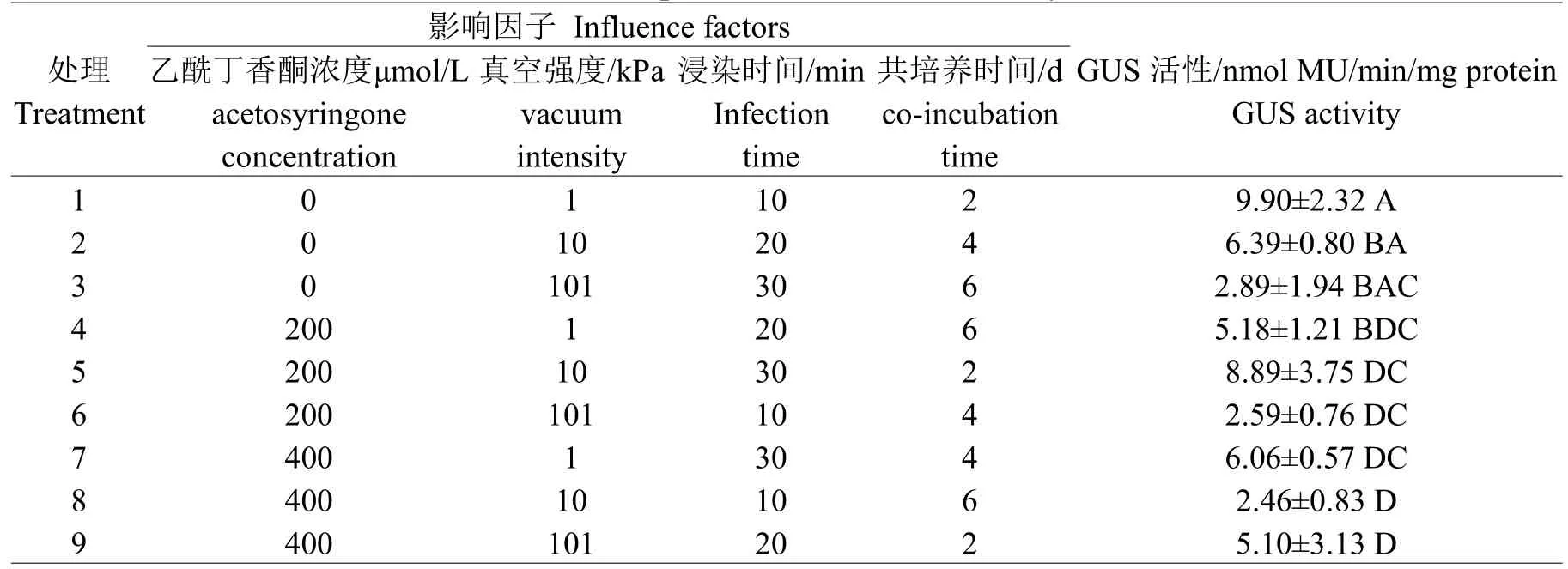
表1 不同影响因子处理的GUS表达情况Table 1 Expression level of GUS activity
2.2 不同影响因子对瞬时表达水平的影响
在农杆菌介导的瞬时表达试验中,不同处理组合对GUS基因瞬时表达水平产生了影响。通过对不同处理组合的GUS活性数据进行方差分析(见表2),可以看出,真空强度和共培养时间二因素对GUS基因瞬时表达水平的影响差异极显著,而乙酰丁香酮浓度和浸染时间则对GUS基因瞬时表达水平影响差异不显著。
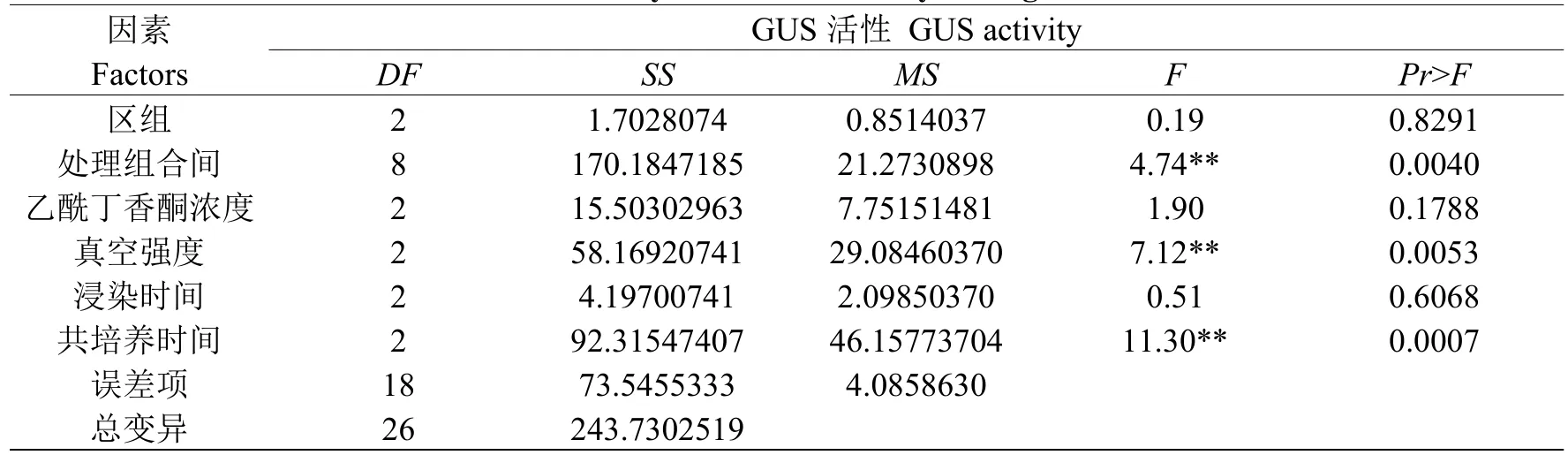
表2 GUS活性各组合间的方差分析Table 2 Variance analysis on GUS activity among combinations
进一步对真空强度和共培养时间各自的三个水平进行多重比较(见表3),可以看出,不同真空强度水平对GUS基因瞬时表达的影响差异极显著,其中真空强度为1 kPa时GUS活性最大,该真空强度与101 kPa之间的差异达到0.01显著水平,与10 kPa处理间无显著差异,10 kPa与101 kPa处理间差异显著。由表3还可以看出,不同共培养时间水平对GUS基因瞬时表达的影响差异极显著,共培养时间为2 d时GUS基因瞬时表达水平最大,其中,共培养时间为2 d时与共培养时间4 d、6 d之间的差异均达到0.01显著水平,而共培养时间4 d和6 d处理间差异不显著。
由上述分析可知当真空强度为1 kPa、共培养时间为2 d时GUS基因瞬时表达水平到达最优。
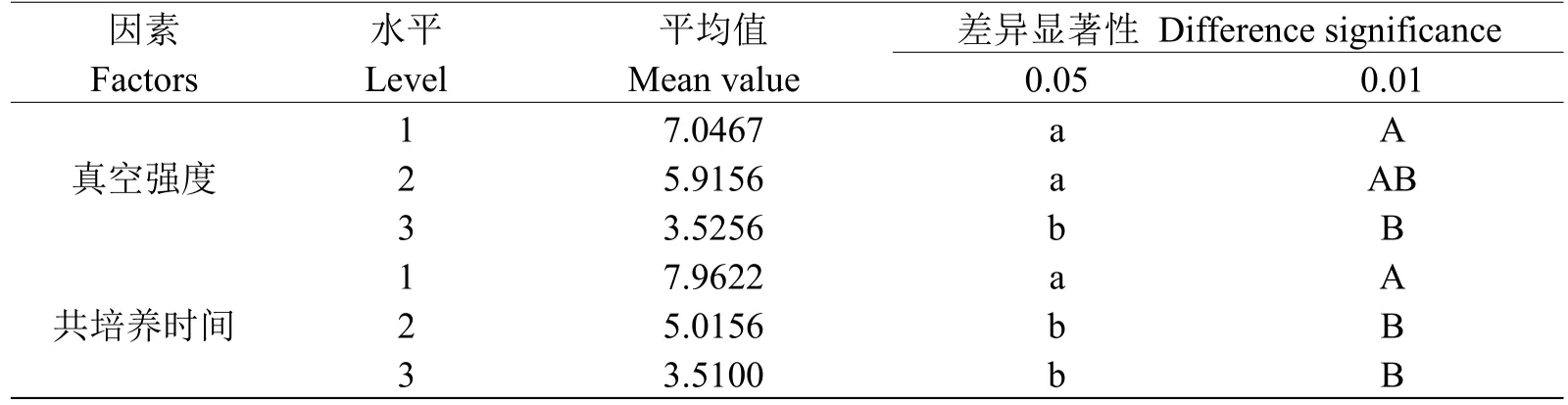
表3 真空强度、共培养时间对GUS活性影响的多重比较Table 3 Multiple comparisons of the effects of vacuum intensity and co culture time on GUS activity
3 讨论
共培养时间是影响马铃薯块茎瞬时表达水平的重要因素,因为农杆菌的附着、T-DNA的转移及整合都在共培养阶段完成。有研究表明共培养时间过长,则会因为农杆菌的过度生长导致植物细胞受毒害而死亡[7]。本试验过程中也发现,共培养时间为4 d时有的马铃薯块茎出现腐烂现象,共培养培养时间越长,腐烂现象越严重,因此培养时间越长反而不利于GUS基因的表达。适当的真空渗透处理可以增加农杆菌对植物细胞的附着,有利于基因的表达,但真空强度过大会对植物和农杆菌细胞造成伤害,从而降低瞬间表达效率[8],本试验发现当真空强度为1 kPa时马铃薯块茎的GUS基因瞬时表达水平最大,真空强度越大,表达水平越低。本试验中乙酰丁香酮浓度对GUS基因瞬时表达水平影响差异不显著,可能与马铃薯块茎切片自身就能分泌复合酚类化合物有关,这些酚类物质已经起到了活化vir基因的作用[9],所以加入乙酰丁香酮并不能明显提高马铃薯块茎GUS基因的表达。试验中农杆菌并没有随着浸染时间的增加而更多的侵入马铃薯块茎,这可能与马铃薯块茎致密的组织结构有关,致密的组织结构可以起到阻止农杆菌侵入的作用,因此可能仅切片表面获得GUS基因表达,增加浸染时间对GUS基因表达并无太大影响。
由于试验中采用了含有GUS基因的中间载体pBI-121,其可能在农杆菌中表达,因此进行试验分析排除其可能造成的干扰,结果表明GUS基因在农杆菌中的表达未对本试验结果造成影响,在此予以说明。
4 结论
本研究通过设置不同调控因子来研究GUS基因在马铃薯块茎中的瞬时表达情况,试验发现真空强度和共培养时间是影响马铃薯块茎GUS基因瞬时表达水平的关键因素,并且当真空强度为1 kPa、共培养时间为2 d时GUS基因瞬时表达水平最大,乙酰丁香酮浓度和浸染时间不是影响马铃薯块茎GUS基因瞬时表达水平的关键因素。
[1]宋 建,刘仲齐.农杆菌介导的基因瞬时表达技术及其应用[J].天津农业科学,2008,14(1):20-22
[2]邱 礽,陶 刚,李奇科,等.农杆菌渗入法介导的基因瞬时表达技术及应用[J].分子植物育种,2009,7(5):1032-1039
[3]李 静,陈 敏,刘现伟,等.莴苣高效瞬时表达体系的建立[J].园艺学报,2006,33(2):405-407
[4]袁思玮,黄锐之,罗红兵.GUS报告基因在植物功能基因研究中的应用[J].作物研究,2008,22(5):310-314
[5]舒 锐,刘少军,岳林旭,等.农杆菌介导的马铃薯块茎GUS基因瞬时表达研究[J].天津农业科学,2013,19(11):1-3
[6]JeffersonRA.AssayingChimericgenesinplantsthegusfusionsystem[J].PlantMolecularBiologyReporter,1987,5(4):387-405
[7]王关林,方宏筠.植物基因工程与技术[M].北京:科学出版社,1998:194-317
[8]于翠梅,刘 限,马莲菊,等.影响农杆菌渗入法瞬间表达重组蛋白系统的若干因素[J].生物技术通报,2007(1):45-49
[9]徐勤青,刘凤珍,万勇善.影响农杆菌介导花生遗传转化率主要因素的研究[J].山东农业大学学报:自然科学版,2008,39(2):161-165
TheEffectsofDifferentRegulatoryFactorsonTransientExpressionof GUSGeneinPotatoTubers
SHURui1,2,YAOTian-tian1,LIYan1,ZANGChuan-jiang1,JIAOJian1,LAN Cheng-yun1,LIUShao-jun1*
1.Shandong Light Industry Institute of Agricultural and Sideline Raw Materials,Gaomi261500,China
2.College of Horticulture Science and Engineering/Shandong Agricultural University,Tai’an271018,China
The GUS gene was transiently expressed in potato tubers by agrobacterium-mediated transformation and the expression the GUS was detected by histochemical staining.The effects of acetyligenone concentration,vacuum intensity,immersion time,and total culture time on the expression of GUS gene was investigated.The results show that the different vacuum strength and co-culture time exhibit the notable influence on GUS expression and the expression levels are higher when the vacuum intensity is 1kPa and the co-culture time is 2 days.
Potato;GUS;regulatory factors;transient expression
S532
A
1000-2324(2017)04-0545-04
2015-07-14
2015-12-07
舒 锐(1987-),男,硕士研究生,主要从事园艺植物栽培育种研究.E-mail:shrhero@163.com
*通讯作者:Author for correspondence.E-mail:wly459@sohu.com

