脓毒血症大鼠甲状腺素替代治疗研究
涂福泉, 林兴盛, 刘 青
1.福建医科大学附属协和医院,福建 福州 350001;2.福建省立医院金山分院,福建 福州 350001
·论 著·
脓毒血症大鼠甲状腺素替代治疗研究
涂福泉1, 林兴盛2, 刘 青1
1.福建医科大学附属协和医院,福建 福州 350001;2.福建省立医院金山分院,福建 福州 350001
目的 探讨脓毒血症大鼠甲状腺素替代治疗的预后及细胞超微结构的改变。方法 清洁级SD健康雄性大鼠40只,体质量180~220 g。采用随机数字表法将大鼠分为脓毒血症组(S组)及甲状腺素替代治疗组(T组),每组各20只。大鼠均采用盲肠结扎穿孔术建立脓毒血症模型。T组大鼠分别在模型建立后0、24、48、72 h皮下注射左甲状腺素钠(10 μg/100 g),S组给予同等剂量生理盐水。两组大鼠分别在术前、模型建立后24、48、72 h采血1.5 ml;然后,皮下注射生理盐1.5 ml/100 g补充失血;血液标本离心后,取血清用于检测甲功指标[游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)]及白细胞介素-6(IL-6)。观察两组大鼠96 h存活率。幸存大鼠处死后取甲状腺组织标本,用于超微结构观察。结果 模型建立后24、48、72 h,S组、T组大鼠的FT3水平均低于本组术前(P<0.05),且T组各时间点FT3水平均低于S组(P<0.01);S组大鼠FT4水平低于术前,T组FT4水平高于本组术前及S组(P<0.05);T组TSH水平低于本组术前及S组(P<0.05),S组TSH水平与术前比较,差异无统计学意义(P>0.05)。模型建立后24、48、72 h,两组IL-6水平均高于各组术前,且24、48 h时间点均高于72 h(P<0.05),但两组间IL-6水平比较,差异无统计学意义(P>0.05)。两组大鼠24、48、72 h时间点的FT3、FT4、TSH水平组内比较,差异均无统计学意义(P>0.05);24、48 h时间点IL-6水平高于72 h(P<0.05)。T组大鼠96 h存活率高于S组(P<0.05)。电镜下,S组及T组大鼠甲状腺滤泡上皮细胞均出现不同程度胞核固缩、胞质溶解、胞膜破裂,但T组甲状腺滤泡结构破坏相对轻微。结论 甲状腺素替代治疗可以增加盲肠结扎穿孔术制脓毒血症大鼠96 h内存活率,电子显微镜下可见甲状腺滤泡结构破坏相对减轻。
脓毒血症; 甲状腺激素替代治疗; 超微结构
目前,脓毒血症的发病率逐年增加[1-3]。脓毒血症可发展为多器官功能障碍综合征,包括肺、肝、肾,循环、凝血系统,甚至胰腺等[4]。而体内重要的内分泌器官甲状腺,在脓毒血症中也受到不同程度的影响[5],表现为甲状腺激素水平异常及器质性损害[6];而是否需要进行甲状腺素替代治疗,仍存在争议。本研究旨在探讨脓毒血症大鼠甲状腺素替代治疗的预后及甲状腺超微结构的改变。现报道如下。
1 对象与方法
1.1 实验动物 清洁级SD健康雄性大鼠40只(由福建医科大学实验动物中心提供),体质量180~220 g。采用随机数字法将大鼠随机分为脓毒血症组(S组)及左甲状腺素钠替代治疗组(T组),每组各20只。
1.2 仪器与试剂 采用放射免疫法检测甲功指标[游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)],分析药盒购自北京北方生物技术研究所(批号:20140723)。采用酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)法检测白细胞介素(IL-6)水平,试剂盒购自上海博谷生物科技有限公司(批号:REP055)。左甲状腺素钠购自Sigma公司(批号:32995)。超微结构观察采用PHILIPS(EM208型)透射电镜。操作严格按照各指标说明书进行。
1.3 动物模型及标本制备 本研究大鼠均采用盲肠结扎穿孔术[7]建立脓毒血症模型。大鼠术前禁食24 h,不禁水,腹腔注射水合氯醛(30 mg/100 g),麻醉下保留自主呼吸,剔除腹部毛发后,聚维酮碘棉球消毒,延腹部正中切开1.5 cm腹壁,显露盲肠,距末端1.0 cm处结扎盲肠,然后用0.7 mm内径穿刺针单次贯穿被结扎盲肠中点处,由穿刺孔挤出少许粪便进入腹腔,后将盲肠送回原位,双层缝合腹壁,皮下注射生理盐水3 ml/100 g,补充手术失水,并进行抗休克治疗。脓毒症模型成功标准:开腹后见被结扎盲肠发黑、肿胀,明显恶臭,腹腔内大量血性腹水。T组大鼠分别在模型建立后0、24、48、72 h皮下给予左甲状腺素钠(10 μg/100 g),S组给予同等剂量生理盐水。两组大鼠分别在术前、模型建立后24、48、72 h时间点剪尾及眼眶采血1.5 ml,采血后给予皮下注射生理盐水1.5 ml/100 g,补充失血,血液标本立即高速离心后取血清备用,观察两组大鼠96 h存活率。幸存大鼠于96 h成功腹腔麻醉后,分离气管周围组织,上至声门,下至第4~5气管软骨环离断气管,置于0℃盐水中,镊子小心分离甲状腺左右侧叶,固定于3.0%戊二醛+1.5%多聚甲醛,用于电子显微镜观察超微结构改变。以上操作在2 min内完成。实验过程中动物处置方法符合动物伦理学标准。

2 结果
2.1 两组各时间点甲状腺激素水平比较 模型建立后24、48、72 h,两组FT3水平均低于本组术前(P<0.05),且T组各时间点水平均低于S组(P<0.05);S组各时间点FT4水平均低于术前,T组高于术前,且T组各时间点水平均高于S组(P<0.05);S组TSH水平与本组术前比较,差异无统计学意义(P>0.05);T组各时间点与本组术前比较,差异有统计学意义(P<0.05);且S组各时间点水平均高于T组(P<0.05)。两组大鼠24、48、72 h时间点的FT3、FT4、TSH水平组内比较,差异均无统计学意义(P>0.05)。见表1。
2.2 两组各时间点IL-6值比较 模型建立后24、48、72 h,两组IL-6水平均较治疗前升高,两组间各时间点比较,差异无统计学意义(P>0.05),但各组内72 h时间点的IL-6水平均低于24、48 h时间点(P<0.05)。见表2。

表1 各组大鼠甲状腺激素水平比较
注:与本组术前比较,①P<0.05

表2 两组各时间点IL-6值比较[中位数(p25,p75)]
2.3 大鼠存活情况分析 观察截点为96 h,发现S组存活大鼠2只,存活率为10.0%;T组6只,存活率为30.0%;T组存活率显著高于S组,组间比较,差异有统计学意义(P<0.05)。见图1。
2.4 甲状腺组织电镜超微结构改变情况 电子显微镜下,S组大鼠多数甲状腺滤泡上皮细胞发生核固缩,染色不均匀加深,细胞结构完整性破坏,无细胞器结构,破碎的细胞质脱落于甲状腺滤泡中,残存的部分细胞质内可见大量空泡。而T组大鼠部分滤泡上皮细胞发生核固缩,染色不均匀加深,胞质内呈空泡化,无细胞器结构,细胞间隔模糊,但细胞膜尚完整;而相邻一甲状腺滤泡的上皮细胞结构完整,细胞器结构清晰,可见微绒毛向滤泡腔分泌。见图2。

图1 S组及T组大鼠造模后96 h内存活曲线
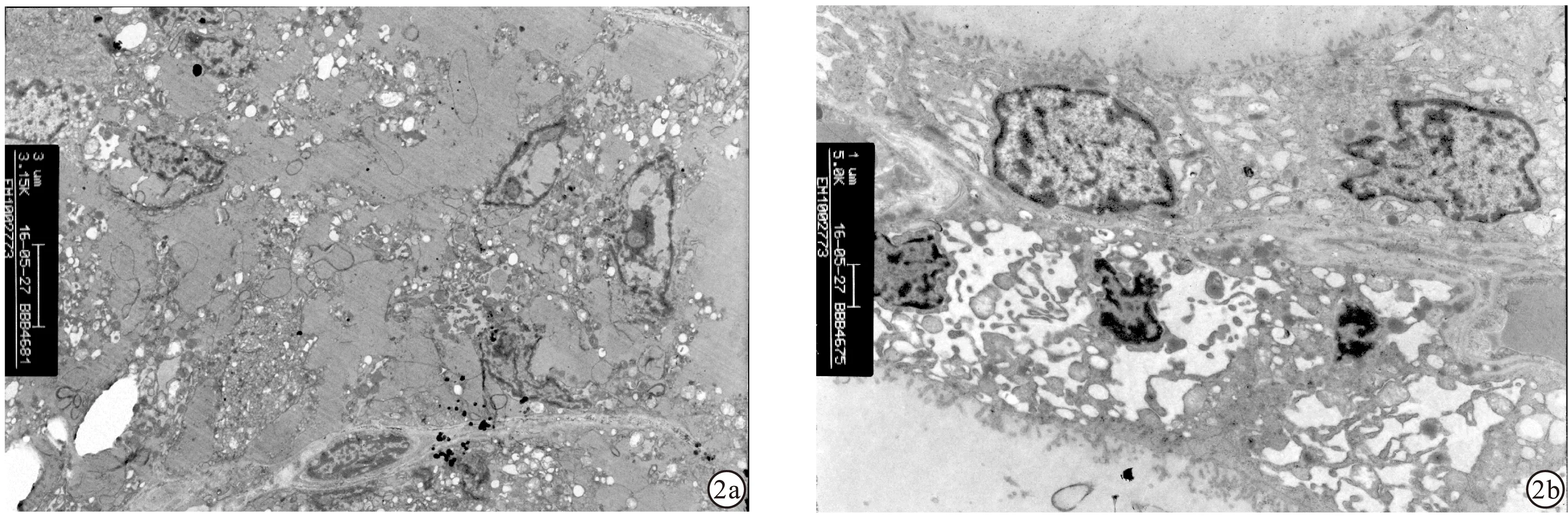
图2 大鼠甲状腺组织超微结构[a.S组(3 150倍);b.T组(6 300倍)])
3 讨论
脓毒血症可导致甲状腺病态综合征,表现为血清中甲状腺相关激素水平的变化[8]。脓毒血症后检测的最突出的血清中甲状腺激素水平变化为低FT3、FT4,而没有代偿性的高水平的TSH的情况,TSH往往保持正常或稍减低[9]。本研究中检测的脓毒血症S组大鼠FT3、FT4水平均较术前低,而TSH与术前比较,差异无统计学意义(P>0.05);且分别于模型建立后24 h、48 h及72 h时间点测得的甲状腺激素水平比较,差异也无统计学意义(P>0.05)。结果同于笔者研究生论文中甲状腺激素水平的变化[6],Meyer等[10]的研究中也有类似描述,但其中机制尚不明确。
针对脓毒血症甲状腺素替代治疗药物的剂型及剂量报道较少,因此,本研究参考甲状腺减退症的替代治疗[11],探索性采用左甲状腺素钠(10 μg/100 g)为替代治疗药物,发现替代治疗后FT4水平明显高于未治疗及术前,同时发现治疗后TSH及FT3均呈现不同程度相对降低,考虑可能与下丘脑-垂体-甲状腺轴的负反馈调节有关,Yaglova[12]提出病理状态下甲状腺激素调节轴的作用仍然显著。
IL-6是白细胞介素家族中的一员,同时具有抗炎及促炎功能的细胞因子,已有研究发现其具有良好的预后价值[13-14],Soong等[15]研究中提到IL-6是早期诊断脓毒血症的重要生物标记。故IL-6是评价脓毒血症严重程度的良好指标。本研究中,S组、T组均较术前明显升高,不同时间点数据对比发现,72 h的IL-6水平低于24 h及48 h,考虑可能与少数幸存盲肠结扎穿孔术后脓毒血症大鼠自身机体保护性免疫反应有关,使穿孔部位炎症局限形成包裹,进而病情改善[16]。
有研究表明,特别是脓毒血症中存在的大量细胞因子,如肿瘤坏死因子,会影响组织对甲状腺激素的敏感性,所以有学者提出能否采用甲状腺激素替代治疗[17]。以往有研究认为,甲状腺激素水平低下可能是一种适应性反应,从而可减少机体蛋白质分解及降低能量需求,帮助机体度过难关[18]。有动物实验发现,补充三碘甲状腺原氨酸(T3)可减弱脓毒血症降低体内抗凝血酶Ⅲ水平的作用,可减少出血及发生弥散性血管内凝血的风险[19];补充四碘甲腺原氨酸(T4)可以改善大鼠肺顺应性有所增加,从而改善呼吸衰竭情况[20]。也有临床研究表明,补充T4并不能够改变ICU患者总体病死率[21]。而本研究中发现,脓毒血症大鼠96 h病死率较高,尤其是在观察中期(模型建立后36~72 h),考虑与脓毒血症发展的初期的持续剧烈炎症反应有关,对机体循环、呼吸功能产生严重影响[1,22]。而在危重症患者中,T4可通过上调β-肾上腺素受体和增加心肌收缩力来发挥重要功效[23]。有研究证实,T4可减少血流动力学不稳定的患者对血管活性药物的需要量[24]。本研究发现,T组大鼠在脓毒血症模型建立后即予以左甲状腺素治疗可以降低96 h的病死率,其原因可能是甲状腺素可助于稳定脓毒血症引起的机体血流动力学不稳定,从而协助改善各器官脏器灌注,减少脏器损害,对甲状腺组织细胞的超微观察也证实左甲状腺素治疗后组织细胞结构破坏相对减轻,组织结构相对完整。
综上所述,脓毒血症大鼠在给予甲状腺激素替代治疗后可以改善其病死率,观察甲状腺组织细胞超微结构相对破坏减轻,但临床上使用甲状腺素替代治疗脓毒血症后甲状腺功能异常的疗效仍需进一步研究。
[1] Singer M,Deutschman CS,Seymour CW,et al.The third international consensus definitions for sepsis and septic shock(Sepsis-3)[J].JAMA,2016,315(8):801-810.
[2] 中华医学会重症医学分会.中国严重脓毒症/脓毒性休克治疗指南(2014)[J].全科医学临床与教育,2015,54(4):401-426.
[3] Danai P,Martin GS.Epidemiology of sepsis:recent advances[J].Curr Infect Dis Rep,2005,7(5):329-334.
[4] 石松菁,林兴盛,杨火保.多器官功能障碍综合征患者胰腺损害的探讨[J].中华急诊医学杂志,2013,22(8):846-849.
[5] Khardori R,Castillo D.Endocrine and metabolic changes during sepsis:an update[J].Med Clin North Am,2012,96(6):1095-1105.
[6] 涂福泉.脓毒血症大鼠甲状腺功能改变和Caspase-3蛋白表达及细胞凋亡的关系[D].福建医科大学,2014.
[7] Hubbard WJ,Choudhry M,Schwacha MG,et al.Cecal ligation and puncture[J].Shock,2005,24 Suppl 1:52-57.
[8] Warner MH,Beckett GJ.Mechanisms behind the non-thyroidal illness syndrome:an update[J].J Endocrinol,2010,205(1):1-13.
[9] Yaglova NV.Morphofunctional analysis of development of nonthyroid disease syndrome in experimental endotoxicosis[J].Bull Exp Biol Med,2009,148(5):829-833.
[10] Meyer S,Schuetz P,Wieland M,et al.Low triiodothyronine syndrome:a prognostic marker for outcome in sepsis[J].Endocrine,2011,39(2):167-174.
[11] 王 茜,杨会云,王建月,等.成年期甲状腺功能减退症大鼠额叶突触结合蛋白I表达及T4替代治疗作用[J].中华地方病学杂志,2010,29(3):239-242.
[12] Yaglova NV.Disorders in the secretory cycle of follicular thyrocytes and their correction with thyrotropic hormone in experimental non-thyroidal illness syndrome[J].Bull Exp Biol Med,2011,152(2):253-257.
[13] Haasper C,Kalmbach M,Dikos GD,et al.Prognostic value of procalcitonin(PCT)and/or interleukin-6(IL-6)plasma levels after multiple trauma for the development of multi organ dysfunction syndrome(MODS)or sepsis[J].Technol Health Care,2010,18(2):89-100.
[14] Jekarl DW,Lee SY,Lee J,et al.Procalcitonin as a diagnostic marker and IL-6 as a prognostic marker for sepsis[J].Diagn Microbiol Infect Dis,2013,75(4):342-347.
[15] Soong J,Soni N.Sepsis:recognition and treatment[J].Clin Med(Lond),2012,12(3):276-280.
[16] Otero-Anton E,Gonzalez-Quintela A,Lopez-Soto A,et al.Cecal ligation and puncture as a model of sepsis in the rat:influence of the puncture size on mortality,bacteremia,endotoxemia and tumor necrosis factor alpha levels[J].Eur Surg Res,2001,33(2):77-79.
[17] Nagaya T,Fujieda M,Otsuka G,et al.A potential role of activated NF-kappa B in the pathogenesis of euthyroid sick syndrome[J].J Clin Invest,2000,106(3):393-402.
[18] Joosten KF,de Kleijn ED,Westerterp M,et al.Endocrine and metabolic responses in children with meningoccocal sepsis:striking differences between survivors and nonsurvivors[J].J Clin Endocrinol Metab,2000,85(10):3746-3753.
[19] Chapital AD,Hendrick SR,Lloyd L,et al.The effects of triiodothyronine augmentation on antithrombin III levels in sepsis[J].Am Surg,2001,67(3):253-256.
[20] Inan M,Koyuncu A,Aydin C,et al.Thyroid hormone supplementation in sepsis:an experimental study[J].Surg Today,2003,33(1):24-29.
[21] Brent GA,Hershman JM.Thyroxine therapy in patients with severe nonthyroidal illnesses and low serum thyroxine concentration[J].J Clin Endocrinol Metab,1986,63(1):1-8.
[22] Levy MM,Fink MP,Marshall JC,et al.2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J].Crit Care Med,2003,31(4):1250-1256.
[23] Lodha R,Vivekanandhan S,Sarthi M,et al.Thyroid function in children with sepsis and septic shock[J].Acta Paediatr,2007,96(3):406-409.
[24] Zuppa AF,Nadkarni V,Davis L,et al.The effect of a thyroid hormone infusion on vasopressor support in critically ill children with cessation of neurologic function[J].Crit Care Med,2004,32(11):2318-2322.
A study of thyroxine replacement therapy in rats with sepsis
TU Fu-quan,LIN Xing-sheng,LIU Qing
(Fujian Medical University Union Hospital,Fuzhou 350001,China)
Objective To investigate the prognosis of septic rats for thyroxine replacement therapy and the change of ultrastructure in thyroid tissue.Methods A total of 40 pathogen-free male rats weighing 180 to 220 g were selected.Rats were randomly divided into the sepsis group(Group S)and thyroxine replacement therapy group(Group T),with 20 rats in each group.All rats were induced to septic modal by cecal ligation and puncture(CLP).The rats in Group T were administrated L-thyroxine(10 μg/100 g)by hypodermic injection per time in 0 hour,24 hours,48 hours and 72 hours after the CLP.The rats in Group S were given the same dose normal saline.All rats were taken each 1.5 ml blood before CLP,24 hours,48 hours and 72 hours after CLP.After each blood collection,rats were taken normal saline(10 μg/100 g)for blood loss replenished.After centrifugation,blood samples were used for detection of thyroid hormones(FT3,FT4and TSH)and interleukin-6(IL-6).The rats′ survival rate within 96 hours after CLP was recorded.The survival rats were executed and taken the thyroid tissue for observation of ultrastructure.Results After model establishment in 24 hours,48 hours and 72 hours,the FT3levels in Group S and Group T were lower(P<0.05),and the FT3level in Group T was lower than those at each time point in Group S(P<0.01).The FT4level in Group S was lower than that before surgery,and the FT4level in Group T was higher than that before surgery and in Group S(P<0.05).The TSH level in Group T was lower than that before surgery and in Group S(P<0.05).After model establishment in 24 hours,48 hours and 72 hours,the IL-6 levels in both groups were higher than those before surgery,and the level at 24 hours and 48 hours were higher than that in 72 hours;the IL-6 levels between the both groups had no statistical significance(P>0.05).The levels of FT3,FT4and TSH at 24 hours,48 hours and 72 hours had no statistical significance(P>0.05).IL-6 levels at 24 hours and 48 hours were higher than that at 72 hours(P<0.05).The survival rate in Group T was higher than that in Group S(P<0.05).Under electron microscope,a series of pathological changes were found in thyroid follicular epithelial cells,such as the nucleus became smaller and showed pyknosis,cytoplasm was replaced by a lot of vacuole,the cell membrane broke,and the thyroid follicle in Group T was more complete than that in Group S.Conclusion Thyroxine replacement therapy can raise the survival rate of septic rat within 96 hours after CLP,and under electron microscopy,the structural damage of the thyroid follicle is reduced.
Sepsis; Thyroxine replacement therapy; Ultrastructure
涂福泉(1989-),男,江西南昌人,医师,硕士
2095-5561(2017)04-0228-05 DOI∶10.16048/j.issn.2095-5561.2017.04.08
2017-05-29

