RNA干扰沉默claudin-4基因表达对子宫内膜癌细胞生物学行为的影响
冯翠平,张庆霞,赵 芳,李 忻,张 韫,潘晓玉⋆
(1.中日友好医院 妇产科,北京 100029;2.中日友好医院 临床医学研究所,北京 100029)
实验研究
RNA干扰沉默claudin-4基因表达对子宫内膜癌细胞生物学行为的影响
冯翠平1,张庆霞1,赵 芳1,李 忻2,张 韫2,潘晓玉1⋆
(1.中日友好医院 妇产科,北京 100029;2.中日友好医院 临床医学研究所,北京 100029)
目的:采用RNA干扰技术沉默claudin-4基因在子宫内膜癌细胞Ishikawa中的表达,探讨claudin-4表达下调对Ishikawa细胞增殖力和侵袭力的影响;比较RNA干扰前后差异表达的蛋白质,探讨claudin-4基因在子宫内膜癌发病机制中的作用。方法:设计靶向claudin-4的小干扰RNA (siRNA),转染人子宫内膜癌细胞Ishikawa。采用CCK分析法检测干扰前后细胞增殖能力的变化,Transwell小室实验检测干扰前后细胞侵袭能力的变化。应用双向凝胶电泳和质谱分析检测RNA干扰前后蛋白质表达的差异。结果:claudin-4基因沉默可以显著降低子宫内膜癌细胞的增殖能力和侵袭能力 (P<0.05)。应用蛋白质组学技术比较claudin-4 siRNA干扰前后蛋白质表达的差异,共鉴定出5种差异蛋白质。结论:claudin-4基因具有促进子宫内膜癌细胞增殖和细胞侵袭的作用,这种作用可能通过改变差异蛋白的表达得以实现。
子宫内膜癌;claudin-4;小干扰RNA;蛋白质组学
Author’s address Department of Obstetrics and Gynecology,China-Japan Friendship Hospital,Beijing 100029,China
子宫内膜癌是女性生殖道最常见的恶性肿瘤之一,随着精准医学和个体化靶向治疗的发展,从基因水平研究子宫内膜癌的确切发病机制成为时下的热点[1,2]。
紧密连接是正常上皮细胞稳态的关键结构,这种结构是肿瘤增长和侵润的屏障,紧密连接完整性的丢失直接影响癌细胞的营养摄取、细胞增殖和细胞侵润。claudin是构成紧密连接结构、维持紧密连接功能所必须的一类骨架蛋白,近年来研究发现,claudin-4在多种癌组织中表达异常。我们的前期研究发现:claudin-4在子宫内膜癌中的表达显著高于在正常子宫内膜中的表达,为了探讨claudin-4基因表达对子宫内膜癌细胞生物学行为的影响,我们采用RNA干扰和蛋白质组学技术进一步研究claudin-4在子宫内膜癌发病机制中的作用。
1 材料和方法
1.1 研究对象
人子宫内膜癌细胞株Ishikawa由北大人民医院魏丽惠教授惠赠,Ishikawa细胞呈claudin-4阳性表达。细胞接种于含10%胎牛血清的RPMI-1640培养液中,实验前24h更换无酚红培养基以避免潜在的性激素模拟效应。
1.2 实验方法
1.2.1 小干扰RNA (small interfering RNA,siRNA)的合成及细胞转染
根据人Claudin-4基因序列,选择Claudin-4-homo-1762位点设计siRNA,序列信息5'UUACAGUGAUGAAUAGCUCTT 3'。转染方法按Lipofectamine 2000产品说明书进行。转染细胞经Real-time PCR、Western blot检测,确定细胞转染效率>75%。实验设立Mock组(M,只加入相同剂量转染试剂组);阴性对照组(N,加入相同剂量的转染试剂及无关序列siRNA组)作为参照。
1.2.2 CCK-8实验检测转染前后Ishikawa细胞的增殖能力
转染前后Ishikawa细胞按3×105/孔接种于96孔板。分别于培养后24h、48h、72h和96h为检测点。每次检测前,在培养液中每孔加入10μl CCK-8试剂,37℃温箱孵育 2h,酶标仪检测450nm处吸光度值。吸光度代表细胞增殖情况。实验重复3次。
1.2.3 体外侵袭实验检测转染前后Ishikawa细胞的侵袭能力
将50mg/L Matrigel用无血清的RPMI 1640培养基按1:5比例稀释,包被Transwell小室底部膜的上室面,转染48h后的各组细胞以3×104/孔接种至Transwell上室,下室加入含10%胎牛血清的RPMI 1640培养基。培养72h后细胞结晶紫染色,显微镜下观察移至膜下层的细胞并计数。每个样本计数5个视野,取平均值,以穿膜细胞数的多少表示细胞侵袭能力。实验重复3次。

图1 claudin-4 siRNA干扰前后细胞的生长曲线
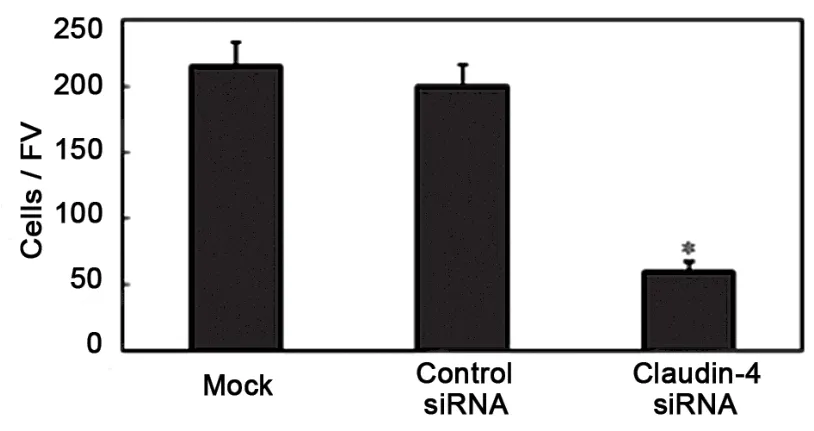
图2 claudin-4 siRNA干扰前后细胞侵袭力的变化

图3 claudin-4 siRNA干扰前后蛋白质表达差异图
1.2.4 双向凝胶电泳和质谱分析
收集约1×107的Ishikawa细胞,溶于400μl含1%蛋白酶抑制剂的样品裂解液(7mol/L尿素,2mol/L硫脲,4%CHAPS,1%DTT)中。将1mg蛋白与水化上样液 (终浓度:7mol/L尿素、2mol/L硫脲、4%CHAPS、50 mmol/L DTT、0.5%pH 3~10 IPG缓冲液以及痕量溴酚蓝)混匀,上样总体积为450μl。选用固相pH梯度干胶条(IPG,24cm,pH 3~10 NL)在等电聚焦仪上等电聚焦。第二向凝胶电泳通过Ettan DALT six垂直平板电泳系统进行。经考马斯亮蓝染色的凝胶经Image-Scanner Model PowerLook 2100XL扫描仪成像后,利用Image-Master 2D Platinum分析软件对获取的图像进行蛋白点检测、配对和统计分析。差异2倍和P<0.05的蛋白点认为差异显著。将差异显著的蛋白点经切胶、提取,进行MALDI-TOF/TOF MS分析,经MASCOT检索,确定差异蛋白质点。
1.3 统计学方法
应用SPSS13.0统计软件进行分析。率的比较采用χ2检验,多个样本均数的比较采用单因素方差分析。
2 结果
2.1 Ishikawa细胞claudin-4 siRNA干扰前后细胞增殖力的检测
Mock组、阴性对照组、claudin-4 siRNA干扰组细胞生长曲线见图1。各时间点Mock组与阴性对照组细胞增殖力无明显差异(P>0.05)。与其它2组比较,claudin-4 siRNA干扰组在 24h、48h、72h和96h细胞增殖力均显著下降(P<0.05)。
2.2 Ishikawa细胞claudin-4 siRNA干扰前后细胞侵袭力的检测
Mock组、阴性对照组、claudin-4 siRNA干扰组细胞培养48h时穿膜细胞数分别为 (215±18)、(200±16)和(60±7)个。Mock组与阴性对照组的穿膜细胞数无明显差异(P>0.05);与其它2组比较,claudin-4 siRNA干扰组的穿膜细胞数明显减少,细胞侵袭力显著下降(P<0.05)(图2)。
2.3 差异蛋白质组学分析
与未干扰组相比,claudin-4 siRNA干扰组出现5种蛋白表达差异(图3)。其中,泛素特异性蛋白酶 7 (ubiquitin specific processing protease 7,USP7) 和 酰 基 蛋 白 硫 酯 酶 1 (acyl protein thioesterase 1,APT1)表达升高,而LASP-1(LIM and SH3 domain protein 1,LASP-1)、内质网蛋白29 (endoplasmic reticulum protein 29,ERP29)和过氧化还原酶5(peroxiredoxin5,PRDX5)蛋白表达降低。
3 讨论
3.1 claudin-4与子宫内膜癌发病的关系
近年来研究发现,claudin-4在卵巢癌、前列腺癌、乳腺癌及多种肿瘤细胞系中均呈升高的表达[3],提示claudin-4的异常表达可能与恶性肿瘤的发生、发展密切相关。我们前期研究发现,claudin-4在子宫内膜样腺癌中的表达显著高于在正常子宫内膜中的表达[4],由此推测,claudin-4的异常升高表达可能与子宫内膜癌的发病相关。为了进一步探讨claudin-4与子宫内膜癌的关系,我们对高表达 claudin-4的子宫内膜癌细胞系Ishikawa进行了研究,发现孕激素处理Ishikawa细胞后,Ishikawa细胞中claudin-4的表达明显降低[5];以Ishikawa细胞制备子宫内膜癌动物模型,发现顺铂化疗后移植瘤中claudin-4的表达亦显著降低[6]。上述研究结果可以推论与正常子宫内膜相比,claudin-4在子宫内膜癌中表达显著升高,claudin-4的过度表达可能参与了子宫内膜癌的发病机制。
肿瘤的侵袭和转移严重影响着患者的预后,为了进一步探讨claudin-4与子宫内膜癌恶性行为的关系,我们对子宫内膜癌细胞系Ishikawa进行了深入的研究。当采用RNA干扰技术沉默claudin-4的表达后,发现Ishikawa细胞的增殖能力和侵袭能力均显著降低。表明claudin-4基因的表达参与了子宫内膜癌细胞的增殖和侵袭,并能促进肿瘤细胞的侵袭和转移。Hwang等[7]研究发现claudin-4基因可以促进胃癌细胞的侵袭和转移能力。Agarwal等[8]研究发现claudin-4在原发性卵巢癌中呈显著高表达,其升高表达的程度与卵巢癌组织分级和临床分期呈正相关。将claudin-4的野生型基因转染正常卵巢上皮细胞系,可以导致细胞侵袭力和细胞迁移力增加;用RNA干扰技术沉默claudin-4在卵巢癌细胞系的表达,细胞的侵袭力显著下降。claudin-4基因在多种肿瘤细胞中均呈现出与本研究类似的作用,说明claudin-4的升高表达可以显著增加细胞的侵袭力。但是,在Michl等[9]的研究中发现,将SUIT-2胰腺癌细胞过表达claudin-4会导致胰腺癌细胞的侵袭力和细胞增殖力下降。这种生物学行为的差异,可能是由于claudin-4属于高度细胞学依赖,不同细胞的生长环境决定了其组织功能间的差异表达。
3.2 claudin-4表达异常对子宫内膜癌细胞蛋白质表达的影响
claudin-4基因沉默可以显著降低子宫内膜癌细胞的增殖能力和侵袭能力,可能的机制为:claudin-4 siRNA通过结合目的DNA,在转录水平影响 claudin-4基因表达;claudin-4 siRNA与mRNA竞争影响其翻译过程,进而影响其下游与细胞增殖和转移有关的信号传导通路,抑制了claudin-4基因的表达。为了了解其潜在的作用机理,我们对claudin-4 siRNA前后的蛋白质表达谱进行了研究。发现RNA干扰后USP7和APT1蛋白表达升高,而LASPl、ERP29和PRDX5蛋白表达降低。
USP7是泛素特异性修饰酶家族的成员之一,是P53底物特异性去泛素化蛋白酶,USP7能使P53免于降解,稳定或者修复细胞内P53表达水平,从而起到抑制肿瘤生长的作用[10]。APT1是具有硫酯酶活性和磷脂酶活性的酶。一方面,APT1通过其硫酯酶活性参与蛋白质棕榈酰化修饰的调节,在细胞信号的传导中起着非常重要的作用。另一方面,APT1还通过其磷脂酶活性调节溶血磷脂水平,在细胞增殖以及肌动蛋白细胞骨架的重构过程中发挥关键调节作用[11]。LASPl蛋白是一种细胞迁移运动中特殊的肌动蛋白结合蛋白,在多种上皮组织呈差异性表达。已有文献证实LASP-1在肝癌和肾癌等多种恶性肿瘤中高表达,并和肿瘤的侵袭和转移密切相关[12]。ERP29是位于真核细胞内质网的可溶性蛋白,在内质网应激时表达显著增强,而内质网应激可以经细胞信号传导通路诱导细胞凋亡[13]。PRDX5是过氧化物酶家族蛋白的一种,主要定位于线粒体,能保护线粒体DNA免受过氧化氢的损伤,PRDX5通过控制活性氧水平负性调控氧化应激诱发的细胞凋亡[14]。可见,claudin-4 siRNA后对细胞增殖、凋亡、转移信号水平均产生影响,造成抑制子宫内膜癌细胞生物学行为的蛋白USP7和APT1表达升高,而增强子宫内膜癌细胞生物学行为的蛋白 LASP-1、ERP29和PRDX5表达降低。由于claudin-4的表达受多种信号传导通路的调节,RNA干扰Ishikawa细胞后具体引起了哪种信号传导通路的改变尚需进一步研究。
本研究结果表明,claudin-4是子宫内膜癌发生、发展过程中的一个促进因素,参与了子宫内膜癌细胞增殖、侵袭和转移等恶性生物学行为。随着对claudin-4研究的不断深入,将对探讨子宫内膜癌发病机制、治疗和判断预后产生深远意义。
[1] Sung CO,Sohn I.The expression pattern of 19 genes predicts the histology of endometrial carcinoma [J].Sci Rep-Uk,2014,4:5174.
[2] Tsukamoto O,Miura K,Mishima H,et al.Identification of endometrioid endometrial carcinoma-associated microRNAs in tissue and plasma[J].Gynecologic Oncology,2014,132:715-721.
[3] Morin PJ.Claudin proteins in human cancer:promising new targets for diagnosis and therapy[J].Cancer Res,2005,65(21):9603-9606.
[4]Pan XY,Wang B,Che YC,et al.Expression of claudin-3 and claudin-4 in normal,hyperplastic,and malignant endometrial tissue[J].Int J Gynecol Cancer,2007,17(1):233-241.
[5] 金妍,冯翠平,王雅楠,等.孕激素对子宫内膜癌Ishikawa细胞中claudin-4基因表达的调节作用 [J].中华妇产科杂志,2012,47(5):368-372.
[6] 潘晓玉,李雪,车艳辞,等.细胞紧密连接基因claudin4在子宫内膜癌发病和化疗中的作用 [J].中华妇产科杂志,2013,48(10):768-771.
[7] Hwang TL,Changchien TT,Wang CC,et al.Claudin-4 expression in gastric cancer cells enhances the invasion and is associated with the increased level of matrix metalloproteinase-2 and-9 expression [J].Oncology Letters,2014,8:1367-1371.
[8] Agarwal R,D'Souza T,Morin PJ.Claudin-3 and claudin-4 expression in ovarian epithelial cells enhances invasion and is associated with increased matrix metalloproteinase-2 activity[J].Cancer Res,2005,65(16):7378-7385.
[9] Michl P,Barth C,Buchholz M,et al.Claudin-4 expression decreases invasiveness and metastatic potential of pancreatic cancer[J].Cancer Res,2003,63(19):6265-6271.
[10] Khoronenkova SV,Dianova II,Parsons JL,et al.USP7/ HAUSP stimulates repair of oxidative DNA lesions[J].Nucleic Acids Res,2011,39:2604-2609.
[11] Dekker FJ,Rocks O,Vartak N,et al.Small-molecule inhibition of APT1 affects Ras localization and signaling[J].Nat Chem Biol,2010,6:449-456.
[12]Yang F,Zhou XC,Du SK,et al.LIM and SH3 Domain protein 1(LASP-1)overexpression was associated with aggressive henotype and poor prognosis in clear cell renal cell cancer[J].Plos One,2014,9(6):e100557.
[13] Shaohua Chen,Daohai Zhang.Friend or foe:Endoplasmic reticulum protein 29 (ERp29)in epithelialcancer[J].FEBS Open Bio,2015,5:91-98.
[14] Sabharwal SS,Waypa GB,Marks JD,et al.Peroxiredoxin-5 targeted to the mitochondrial intermembrane space attenuates hypoxia-induced reactive oxygen species signalling[J]. Biochem J,2013,456(3):337-346.
Effects of silencing claudin-4 gene expression by RNA interference on biological behavior of endometrial cancer cell
//
FENG Cui-ping,ZHANG Qing-xia,ZHAO Fang,et al//Journal of China-Japan Friendship Hospital,2017 Jun,31(3):167-170
Objective:To detect the efficacy of downgrading claudin-4 expression on cell proliferation and invasion of Ishikawa endometrial adenocarcinoma cell line in response to silence claudin-4 gene expression by RNA interference technique.To compare the difference of protein expression and to discuss the effect of claudin-4 gene on the pathogenesis of endometrial cancer.M ethods:Small interfering RNA (siRNA)was designed to target claudin-4 and transfected into human endometrial cancer cells-Ishikawa cells. The proliferation and invasion capability of Ishikawa cells before and after the interference were evaluated by CCK and transwell analysis.The difference of protein expression was also detected before and after the interference by 2D gel and mass spectrometry.Results:Effective knockdown of claudin-4 suppressed the proliferation and reduced the invasion capability of Ishikawa cells.Further proteomics analysis revealed that USP7 and APT1 were up-regulated while LASP1,ERP29 and PRDX5 were down-regulated by silence of claudin-4.Conclusion:Knockdown of claudin-4 suppressed cell proliferation and reduced the invasion capability of Ishikawa cells by down-regulation of key proteins involved in cell proliferation and invasion.
endometrial carcinoma;claudin-4;small interfering RNA;proteomics
R737.3
A
1001-002592017)03-0167-04
10.3969/j.issn.1001-0025.2017.03.011
国家自然科学基金(编号30901599)
1* 本文通讯作者。
冯翠平(1976-),女,主治医师,医学硕士。
2017-03-17
2017-04-19

