饲粮蛋氨酸水平对湖羊公羔营养物质消化、胃肠道pH及血清指标的影响
王 杰 崔 凯 王世琴 刁其玉 张乃锋
(中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京100081)
饲粮蛋氨酸水平对湖羊公羔营养物质消化、胃肠道pH及血清指标的影响
王 杰 崔 凯 王世琴 刁其玉 张乃锋*
(中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京100081)
本试验旨在研究饲粮蛋氨酸水平对湖羊公羔营养物质消化、胃肠道pH及血清指标的影响。选取12对7日龄断奶的湖羊双胞胎公羔,采用配对试验设计,分为对照(CON)组和低蛋氨酸(LM)组,1对双胞胎羔羊分别分到2个组中。试验分2个阶段进行,第1阶段(8~56日龄),CON组羔羊饲喂基础代乳粉和基础开食料;LM组羔羊饲喂的代乳粉和开食料在CON组基础上分别全部扣除(0.70%和0.40%)额外添加的蛋氨酸,其余营养水平保持一致。第2阶段(57~84日龄),2组羔羊停止饲喂代乳粉且饲粮均为基础开食料。分别在第1阶段结束前(46~55日龄)和第2阶段结束前(74~83日龄)随机选取4对双胞胎羔羊进行消化代谢试验。结果表明:1)56日龄,LM组羔羊对饲粮粗蛋白质、粗脂肪、中性洗涤纤维的表观消化率均显著低于CON组(P<0.05);84日龄,2组羔羊在营养物质表观消化率上均差异不显著(P>0.05)。2)56日龄,LM组羔羊胃肠道中除十二指肠pH显著低于CON组(P<0.05)外,其他胃肠道pH均差异不显著(P>0.05);84日龄,2组羔羊在胃肠道pH上均差异不显著(P>0.05)。3)除了56日龄LM组羔羊的生长激素和胰岛素浓度显著低于CON组(P<0.05)外,2组羔羊其他血清指标56和84日龄均无显著性差异(P>0.05)。由此可见,8~56日龄,饲粮低蛋氨酸水平可降低湖羊公羔营养物质表观消化率,以及抑制十二指肠pH和血清中生长激素、胰岛素浓度的增加;57~84日龄,提高饲粮蛋氨酸水平后,湖羊公羔的营养物质表观消化率、胃肠道pH及血清激素指标随之得到补偿。
蛋氨酸;羔羊;消化代谢;胃肠道pH;血清指标
蛋氨酸作为必需氨基酸中唯一的含硫氨基酸,对动物体内蛋白质合成具有重要作用。另外,由于动物机体本身不能合成必需氨基酸,必须从饲粮摄取以满足机体的营养需要[1]。然而,蛋氨酸在大豆饼粕等饲粮原料中又是易缺乏的一种氨基酸。对于新生羔羊,由于其胃肠道系统的发育不健全而极易受到营养调控的影响,改变其后期育肥性能的发挥。所以,饲粮合理的蛋氨酸水平对羔羊平稳地进行各项生命活动具有重要作用。
研究发现,对于早期断奶的羔羊,易受到饲粮组成和环境因素的影响产生较大的应激反应[2],进而影响断奶羔羊胃肠道功能[3-4],最终导致对营养物质消化吸收的能力降低[5-9]。Abdelrahman等[10]研究报道饲粮补充蛋氨酸不仅提高了羔羊对营养物质的利用率,还能提高羔羊的生长性能。另外,饲粮蛋氨酸限制同样会影响羔羊的正常生长发育。王杰等[11]研究发现限制饲粮蛋氨酸水平显著降低羔羊生长性能和屠宰性能。Abouheif等[12]研究发现限制育肥羊的采食量显著降低平均日增重及营养物质消化率,最终影响育肥羊的生长。湖羊作为世界著名的多胎绵羊品种之一,通常每胎可产2~3羔,这就使得母乳难以满足哺乳羔羊的营养需要从而影响其后期的生长,使哺乳期羔羊体况发育存在较大的个体差异,最终不利于集约化和规模化管理。目前,研究者多从饲粮单一添加或缺乏蛋氨酸方向研究对羔羊或育肥羊营养物质消化率的影响[13],而在饲粮低蛋氨酸的情况下,幼龄时期营养受限程度对其后期补偿生长影响的研究却尚未报道。动物生长发育是一个连续的过程,限制期营养缺乏与补偿期营养补充一定存在内在联系。因此,本试验从营养物质消化、胃肠道pH及血清指标角度探讨羔羊前期饲粮低蛋氨酸水平导致的营养物质消化率降低是否可以通过后期提高饲粮蛋氨酸水平使羔羊的胃肠道吸收能力得到提升,为我国早期湖羊双胞胎断奶羔羊合理科学饲养提供理论依据。
1 材料与方法
1.1 试验时间和地点
试验于2015年10月至2015年12月在山东省临清市润林牧业有限公司开展。
1.2 试验设计
试验选取7日龄断母乳、体重为(4.93±0.20) kg、发育正常的12对湖羊双胞胎公羔。采用配对试验设计,12对羔羊分为对照(control,CON)组和低蛋氨酸(low methionine level,LM)组,1对双胞胎羔羊分别分到2个组中。试验分2个阶段进行。第1阶段(8~56日龄),CON组羔羊饲喂基础代乳粉和基础开食料;LM组羔羊饲喂的代乳粉和开食料在CON组基础上分别全部扣除(0.70%和0.40%)额外添加的蛋氨酸,其余营养水平保持一致。第2阶段(57~84日龄),2组羔羊停止饲喂代乳粉且饲粮均为基础开食料。
1.3 试验饲粮
试验用蛋氨酸规格:DL-蛋氨酸含量≥99%;干燥减重≤0.5%;砷≤0.002‰;重金属≤0.02‰;硫酸盐≤0.30%;氯化物≤0.20%;灼烧残渣≤0.5%;亚硝基铁氰化钠试验合格;硫酸铜试验合格。
基础开食料和基础代乳粉的营养水平分别参考我国《肉羊饲养标准》(NY/T 816—2004)[14]及发明专利ZL 02128844.5[15]所设定;同时,蛋氨酸水平参考Patureau-Mirand等[16]和王波等[17]的试验结果设定。基础代乳粉营养水平、基础开食料组成及营养水平见表1。

表1 基础代乳粉营养水平、基础开食料组成及营养水平(干物质基础)
1)基础代乳粉为专利产品,专利编号ZL 02128844.5[17]。Basal milk replacer was patent product, and the patent No. was ZL 02128844.5[17].
2)复合氨基酸是由赖氨酸、色氨酸、苏氨酸、缬氨酸、组氨酸等多种氨基酸组成。Compound amino acids were composed of lysine, tryptophane, threonine, valine, threonine and other amino acids.
3)每千克预混料含有One kg of premix contained the following:Fe 4~30 g,Mn 2~25 g,Cu 0.8~20 g,Zn 4~25 g,Se 0.04~0.30 g,I 0.04~0.50 g,Co 0.03~0.05 g,VA 800 000~2 500 000 IU,VD3200 000~400 000 IU,VE 3 000~4 000 IU。
4)营养水平除代谢能外均为实测值。ME was a calculated value, while others were measured values.
1.4 饲养管理
试验开始之前,用强力消毒灵溶液对整个圈舍进行全面的消毒,之后每周对所有栏位重复消毒1次。同时,试验开始时所有试验羔羊均进行正常的免疫程序。
所有试验羔羊在出生到7日龄随母哺乳;8日龄断母乳,人工饲喂代乳粉至56日龄;从8日龄开始补饲开食料,直到84日龄试验结束。另外,饲喂代乳粉时,8~14日龄每天饲喂4次,15~28日龄每天饲喂3次,29~56日龄每天饲喂2次。代乳粉的饲喂参照王波等[17]的方法进行。同时,饲喂量还根据试验过程中羔羊的健康状况进行适当的调整,以保证羔羊的正常生长。整个试验期,保持CON组和LM组代乳粉和开食料的采食量相近。整个过程自由饮水。
1.5 消化代谢试验
整个试验期间,分别在46~55日龄和74~83日龄进行2次消化代谢试验。每次消化代谢试验时在每组中随机选择4只湖羊,并且2组中的4对羔羊均为双胞胎,做好标记并转移至独立的消化代谢笼。每组羔羊单独饲喂,自由饮水。消化代谢试验的试验期总共10 d,其中预试期5 d,正试期5 d,采用全收粪法和全收尿法进行。
1.6 测定指标和分析方法
1.6.1 羔羊营养物质表观消化率测定
消化代谢试验期间每天07:00和19:00收集粪样和尿样,记录每只羊每天的采食量、剩余量、排粪量和排尿量。按总粪样的10%取样后再按照每100 g鲜粪加入10%的硫酸10 mL用于固氮,-20 ℃冷冻保存待测。尿样收集前在收集尿容器中加入10%硫酸100 mL,手动混匀每只羔羊每天的尿液,按每日总量的1%取样,倒入尿样瓶中,-20 ℃冷冻保存待测。
试验结束后,代乳粉、开食料和粪、尿样中营养水平的测定方法:氨基酸含量使用A300全自动氨基酸分析仪测定;总能使用Parr-6400氧氮量热仪测定;干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、粗灰分、钙、磷和中性洗涤纤维(NDF)含量参考AOAC(1980)[18]测定方法进行。
1.6.2 羔羊胃肠道pH测定
分别在56和84日龄屠宰6对双胞胎羔羊,CON组和LM组各6只,屠宰前16 h需要禁食、禁水,经颈静脉放血致死后,剥皮后打开腹腔,解剖,将各胃肠道分割,然后分别取各胃室及肠道内容物样品,倾入30 mL离心管,立即用PHB-2型便携式pH计测定瘤胃、皱胃、十二指肠、空肠和回肠内容物的pH。
1.6.3 羔羊血清指标测定
分别于56和84日龄随机选取3对双胞胎羔羊,CON组和LM组各3只羔羊于前腔静脉采血10 mL,3 000 r/min离心20 min,分离血清,并于-20 ℃保存。血清指标包括:血清激素指标、血清免疫指标和血清生化指标。血清激素指标和血清免疫指标均采用酶联免疫吸附测定(ELISA)法测定,试剂盒购自北京华英生物技术研究所;血清生化指标中,乳酸浓度利用中和滴定法进行检测,其他指标均采用日立7020全自动生化分析仪进行检测。
1.7 数据处理
试验数据经过Excel 2010初步整理后,使用SAS 9.2统计软件Pairedt-test进行配对t检验,以P<0.05作为判断差异显著性的标准。
2 结果与分析
2.1 饲粮蛋氨酸水平对湖羊公羔营养物质表观消化率的影响
饲粮蛋氨酸水平对湖羊公羔营养物质表观消化率的影响见表2。56日龄,LM组羔羊对饲粮CP、EE、NDF的表观消化率均显著低于CON组(P<0.05);84日龄,2组羔羊在营养物质表观消化率上均差异不显著(P>0.05)。
2.2 饲粮蛋氨酸水平对湖羊公羔胃肠道pH的影响
饲粮蛋氨酸水平对湖羊公羔胃肠道pH的影响见表3。56日龄,LM组中除十二指肠pH显著低于CON组外(P<0.05),其他胃肠道pH均差异不显著(P>0.05);84日龄,2组羔羊胃肠道pH均差异不显著(P>0.05)。
2.3 饲粮蛋氨酸水平对湖羊公羔血清指标的影响
饲粮蛋氨酸水平对湖羊公羔血清指标的影响见表4、表5和表6。在血清指标中,除了56日龄LM组羔羊的生长激素(GH)和胰岛素(INS)浓度显著低于CON组(P<0.05)外,2组羔羊其他血清指标56和84日龄均无显著性差异(P>0.05)。

表2 饲粮蛋氨酸水平对湖羊公羔营养物质表观消化率的影响
同行数据肩标不同小写字母代表有显著性差异(P<0.05)。下表同。
In the same row values with different small letter superscripts mean significant difference (P<0.05). The same as below.

表3 饲粮蛋氨酸水平对湖羊公羔胃肠道pH的影响

表4 饲粮蛋氨酸水平对湖羊公羔血清生化指标的影响

续表4项目Items组别GroupsCONLMSEMP值P-value甘油三酯TG/(mmol/L)1.781.730.100.6390总胆固醇CHOL/(mmol/L)5.235.430.320.5478皮质醇COR/(ng/mL)88.7092.914.960.4357乳酸LA/(mg/L)159.03156.832.800.4667游离脂肪酸NEFA/(mmol/L)0.410.320.040.0512乳酸脱氢酶LDH/(U/L)143.37136.1410.920.537184日龄84daysofage尿素氮UN/(mmol/L)6.135.330.360.0792葡萄糖GLU/(mmol/L)3.613.980.360.3476甘油三酯TG/(mmol/L)1.791.900.060.1309总胆固醇CHOL/(mmol/L)5.015.220.400.6198皮质醇COR/(ng/mL)87.5985.328.870.8076乳酸LA/(mg/L)155.60159.807.390.5939游离脂肪酸NEFA/(mmol/L)0.410.380.030.3836乳酸脱氢酶LDH/(U/L)131.73146.4512.270.2838
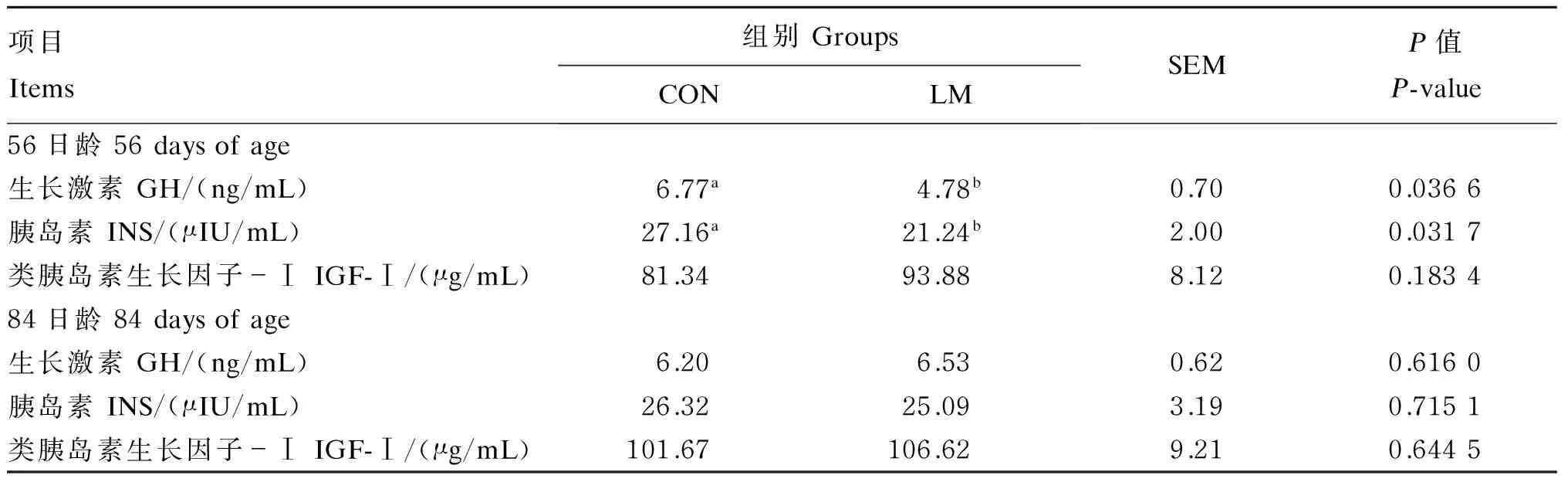
表5 饲粮蛋氨酸水平对湖羊公羔血清激素指标的影响
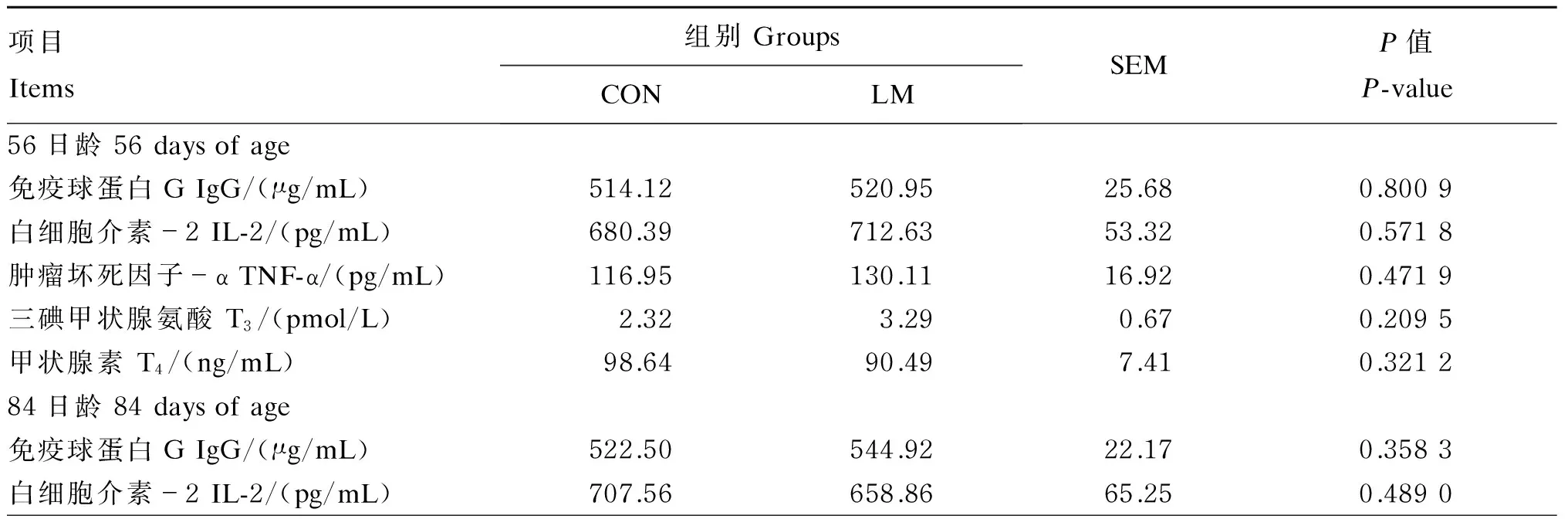
表6 饲粮蛋氨酸水平对湖羊公羔血清免疫指标的影响

续表6项目Items组别GroupsCONLMSEMP值P-value肿瘤坏死因子-αTNF-α/(pg/mL)101.28113.6811.110.3154三碘甲状腺氨酸T3/(pmol/L)3.362.690.650.3464甲状腺素T4/(ng/mL)140.99133.188.420.3967
3 讨 论
3.1 饲粮蛋氨酸水平对湖羊公羔营养物质表观消化率的影响
由于断奶前羔羊的消化代谢系统发育还不健全而具有潜在的可塑性,同时非反刍阶段羔羊的发育状况是确定其后期健康生长及育肥潜力的重要时期。所以,各营养水平的均衡性是断奶前羔羊进行新陈代谢的物质基础。而蛋氨酸作为反刍动物机体生长过程中蛋白质合成的主要限制性氨基酸,对提高动物生长性能和饲粮营养物质消化吸收具有重要作用[19]。另外,研究发现非反刍阶段每只羔羊每天蛋氨酸的最佳需要量为2 g,而对于育肥羊最适宜饲粮的蛋氨酸水平为0.64%[13,20]。本试验在8~56日龄阶段,LM和CON组羔羊每天蛋氨酸的采食量分别为0.47和1.75 g,显然LM组较CON组羔羊采食蛋氨酸的量降低73.14%。56日龄时发现,饲粮缺乏蛋氨酸,导致羔羊显著降低对饲粮CP、EE、NDF的表观消化率。同样,Zeng等[21]曾报道降低动物赖氨酸的饲喂量可显著降低GE、DM、CP和磷的表观消化率。Puchala等[22]对山羊进行营养限饲可显著降低DM、OM、CP和NDF的营养物质表观消化率。本试验中在羔羊非反刍阶段饲喂低蛋氨酸饲粮时,导致动物采食氮水平降低,从而使瘤胃内氨态氮(NH3-N)的浓度降低,瘤胃微生物合成及活力的降低,进而酶的分泌受到影响,最终导致营养物质的消化也受到影响[23-24]。另外,这种现象有可能由于蛋氨酸是启动酶合成的关键必需氨基酸,对消化酶的成分或活性影响有关[25]。
经过恢复蛋氨酸水平28 d后,2组羔羊在DM、OM、CP、EE、GE、NDF的表观消化率均无显著差异。Berthiaume等[26]研究报道,饲粮添加蛋氨酸可提高十二指肠中蛋氨酸的流动性,最终提高蛋氨酸在小肠中的表观消化率。这现象可能归因于随着后期蛋氨酸水平的增加,使瘤胃液NH3-N的浓度逐渐升高,以及消化道和肝脏在蛋氨酸缺乏期间被动用蛋白质的补偿性恢复,使瘤胃内微生物活力和消化道功能增强[27]。同样,李文华等[28]曾经报道营养限制期后的羔羊通过营养补偿,可恢复内脏器官的重量进而增加消化酶的分泌,最终导致营养物质消化率的提高。这种现象,也可能由于56日龄后羔羊瘤胃微生物消化代谢功能发育接近完全,此时进入小肠吸收的蛋氨酸主要来源于微生物蛋白质和瘤胃非降解蛋白质提供的蛋氨酸和内源蛋氨酸。
3.2 饲粮蛋氨酸水平对湖羊公羔胃肠道pH的影响
羔羊胃肠道内适宜酸度是维持消化系统正常功能不可或缺的重要因素,也是调节体内环境酸碱平衡、电解质平衡的基础条件[29]。一般来说,瘤胃液pH变动范围为5.0~7.5,但pH若低于6.5就不利于纤维素消化[30]。蛋氨酸进入瘤胃后,会在瘤胃微生物的作用下降解,产生氨和酮酸,酮酸在微生物的作用下进一步发酵生成挥发性脂肪酸。本试验中,56日龄时CON组和LM组羔羊瘤胃液pH分别为6.00、6.04,84日龄分别为5.28、5.55,在正常变动范围内,2组羔羊瘤胃液pH差异不显著。56日龄,相对于LM组,CON组蛋氨酸降解产生的酮酸可被微生物发酵产生挥发性脂肪酸,但其浓度相对于瘤胃内容物来说,不足以引起pH的显著变化。同样,Robinson等[31]研究证实饲粮添加蛋氨酸,对瘤胃液pH和挥发性脂肪酸浓度没有显著影响。另外,与56日龄相比较,84日龄时CON组和LM组羔羊瘤胃液pH分别降低了12.00%、8.11%。这可能是由于非反刍阶段瘤胃未起主导作用,而反刍阶段瘤胃作为主要的功能性胃产生较多挥发性脂肪酸以降低其pH,可能还存在其他的机制,有待进一步研究探讨。
一般来说,肠道具有一个相对稳定的内环境,具有一定的缓冲能力。如果pH太低,可能会使小肠腺体分泌的碱性肠液得到部分中和,而pH波动很大也会对消化酶活性产生很大影响。本试验中,56日龄时与CON组相比较,LM组低蛋氨酸可显著的降低十二指肠pH。这可能由于在十二指肠中,来自皱胃酸性较强的食糜尚未被胰液、胆汁和肠液中重碳酸盐等充分中和。
3.3 饲粮蛋氨酸水平对湖羊公羔血清指标的影响
动物的生长主要受下丘脑-垂体-肝脏构成的生长轴调控,GH和类胰岛素生长因子-Ⅰ(IGF-Ⅰ)在该生长轴中最能反映动物的营养和生长状况。GH是动物体出生后生长发育主要的调控因子,能够刺激肌肉蛋白质合成,促进动物生长。IGF-Ⅰ是一类多功能的细胞增殖调控因子,作为GH产生生理作用过程中必需的一种活性蛋白质多肽物质。INS可促进葡萄糖进入细胞,为细胞增强功能,促进糖原的合成,提高糖的利用和蛋白质的合成。本试验发现,低蛋氨酸可显著降低血清中GH和INS浓度。同样,张永翠[32]研究发现血清GH浓度随着饲粮蛋氨酸水平的提高呈现逐渐升高的趋势,并且以0.8%的蛋氨酸添加组血清中GH浓度最高。Smith等[33]曾报道犊牛血清中INS浓度随着营养物质摄入的增多而极显著增加。另外有研究表明,对于大多数物种(除了鼠),营养缺乏导致生长停滞,往往伴随着血浆GH浓度的增加而不是降低[34-35]。Buonomo等[36]关于猪的试验也证明了上述观点。而本试验的结果与上述结论有所不同,可能与GH分泌呈脉冲性释放有关,并且GH的浓度也受到IGF-Ⅰ浓度的影响。本试验发现饲粮低蛋氨酸水平对羔羊血清中IGF-Ⅰ浓度没有显著影响。同样,Carew等[37]研究发现,缺乏蛋氨酸的饲粮饲喂8~22日龄的雄性肉鸡,血清中IGF-Ⅰ浓度没有显著变化。
另外,血清免疫指标和生化指标均是反映机体是否健康的重要指标。孙菲菲等[38]曾报道过瘤胃蛋氨酸(RPM)可降低围产期奶牛血浆中总胆固醇、低密度脂蛋白胆固醇、极低密度脂蛋白浓度,但对血浆甘油三酯浓度无显著影响。毕晓华等[39]研究发现,在饲粮添加RPM后奶牛血浆中总蛋白、白蛋白、甘油三酯、葡萄糖、游离脂肪酸浓度升高,但均未达显著水平。本试验中,蛋氨酸缺乏阶段LM组血清中葡萄糖、甘油三酯、乳酸、游离脂肪酸浓度及乳酸脱氢酶活性较CON组分别降低了10.50%、2.81%、1.38%、21.95%和5.04%,但2组之间差异同样未达到显著水平。这种现象的出现,可能由于蛋氨酸缺乏时间、添加剂量及环境等因素共同造成的,具体机制有待进一步研究。
4 结 论
8~56日龄,饲粮低蛋氨酸水平可降低湖羊公羔营养物质表观消化率,以及抑制十二指肠pH和血清中GH、INS浓度的增加;57~84日龄,提高饲粮蛋氨酸水平后,湖羊公羔的营养物质表观消化率、胃肠道pH及血清激素指标随之得到补偿。
[1] SHEN B,LI C J,TARCZYNSKI M C.High free-methionine and decreased lignin content result from a mutation in theArabidopsisS-adenosyl-Lmethionine synthetase 3 gene[J].The Plant Journal,2002,29(3):371-380.
[2] GALINA M A,PALMA J M,PACHECO D,et al.Effect of goat milk,cow milk,cow milk replacer and partial substitution of the replacer mixture with whey on artificial feeding of female kids[J].Small Ruminant Research,1995,17(2):153-158.
[3] ZHAO J,HARPER A F,ESTIENNE M J,et al.Growth performance and intestinal morphology responses in early weaned pigs to supplementation of antibiotic-free diets with an organic copper complex and spray-dried plasma protein in sanitary and nonsanitary environments[J].Journal of Animal Science,2007,85(5):1302-1310.
[4] CORL B A,HARRELL R J,MOON H K,et al.Effect of animal plasma proteins on intestinal damage and recovery of neonatal pigs infected with rotavirus[J].The Journal of Nutritional Biochemistry,2007,18(12):778-784.
[5] MITCHELL M A,CARLISLE A J.The effects of chronic exposure to elevated environmental temperature on intestinal morphology and nutrient absorption in the domestic fowl (Gallusdomesticus)[J].Comparative Biochemistry and Physiology Part A:Physiology,1992,101(1):137-142.
[6] UNI Z,GAL-GARBER O,GEYRA A,et al.Changes in growth and function of chick small intestine epithelium due to early thermal conditioning[J].Poultry Science,2001,80(4):438-445.
[7] DUNSFORD B R,KNABE D A,HAENSLY W E.Effect of dietary soybean meal on the microscopic anatomy of the small intestine in the early-weaned pig[J].Journal of Animal Science,1989,67(7):1855-1863.
[8] PLUSKE J B.Morphological and functional changes in the small intestine of the newly-weaned pig[C]//PIV A A,BACH KNUDSEN K E,LINDBERG J E.Gut environment of pigs.Nottingham:Nottingham University Press,2001:1-27.
[9] HAMPSON D J.Alterations in piglet small intestinal structure at weaning[J].Research in Veterinary Science,1986,40(1):32-40.
[10] ABDELRAHMAN M M,HUNAITI D A.The effect of dietary yeast and protected methionine on performance and trace minerals status of growing Awassi lambs[J].Livestock Science, 2008,115(2/3):235-241.
[11] 王杰,崔凯,毕研亮,等.蛋氨酸限制与补偿对羔羊生长性能及内脏器官发育的影响[J].动物营养学报,2016,28(11):3669-3678.
[12] ABOUHEIF M,AL-OWAIMER A,KRAIDEES M,et al.Effect of restricted feeding and realimentation on feed performance and carcass characteristics of growing lambs[J].Revista Brasileira de Zootecnia,2013,42(2):95-101.
[13] EL-TAHAWY A S,ISMAEIL A M.Methionine-supplemented diet increases the general performance and value of Rahmani lambs[J].Iranian Journal of Applied Animal Science,2013,3(3):513-520.
[14] 中华人民共和国农业部.NY/T 816—2004 肉羊饲养标准[S].北京:中国农业出版社,2004.
[15] 刁其玉,屠焰.一种犊牛羔羊用代乳粉:中国,02128844.5[P].2004-05-12.
[16] PATUREAU-MIRAND P,THERIEZ M.Amino acid requirements of preruminant lambs[J].Annales de Zootechnie,1977,26(2):287.
[17] 王波,柴建民,王海超,等.蛋白质水平对湖羊双胞胎公羔生长发育及肉品质的影响[J].动物营养学报,2015,27(9):2724-2735.
[18] AOAC.Official methods of analysis[S].13th ed.Washington,D.C.:AOAC,1980.
[19] STORM E,ORSKOV E R.The nutritive value of rumen micro-organisms in ruminants.4.the limiting amino acids of microbial protein in growing sheep determined by a new approach[J].The British Journal of Nutrition,1984,52(3):613-620.
[20] ALBERT W W,GARRIGUS U S,FORBES R M,et al.The sulfur requirement of growing-fattening lambs in terms of methionine,sodium sulfate,and elemental sulfur[J].Journal of Animal Science,1956,15(2):559-569.
[21] ZENG P L,YAN H C,WANG X Q,et al.Effects of dietary lysine levels on apparent nutrient digestibility and serum amino acid absorption mode in growing pigs[J].Asian-Australasian Journal of Animal Sciences,2013,26(7):1003-1011.
[22] PUCHALA R,PATRA A K,ANIMUT G,et al.Effects of feed restriction and realimentation on mohair fiber growth and tissue gain by growing Angora goats[J].Livestock Science,2011,138(1/2/3):180-186.
[23] FLORES A,MENDOZA G,PINOS-RODRIGUEZ J M,et al.Effects of rumen-protected methionine on milk production of dairy goats[J].Italian Journal of Animal Science,2016,8(2):271-275.
[24] ZAIN M,SUTARDI T,SURYAHADI,et al.Effect of defaunation and supplementation methionine hydroxy analogue and branched chain amino acid in growing sheep diet based on palm press fiber ammoniated[J].Pakistan Journal of Nutrition,2008,7(6),813-816.
[25] STRYER L.Biochemistry[M].4th ed.New York:W.H. Freeman and Company,1998.
[26] BERTHIAUME R,DUBREUIL P,STEVENSON M,et al.Intestinal disappearance and mesenteric and portal appearance of amino acids in dairy cows fed ruminally protected methionine[J].Journal of Dairy Science,2001,84(1):194-203.
[27] NOLTE J E,FERREIRA A V.The effect of rumen degradable protein level and source on the duodenal essential amino acid profile of sheep[J].South African Journal of Animal Science,2007,35(3):162-171.
[28] 李文华,王安,赵庆枫,等.瘤胃添加DL-蛋氨酸对槐山羊瘤胃消化代谢的影响研究[J].中国畜牧兽医,2007,34(7):21-25.
[29] LI Z J,YI G F,YIN J D,et al.Effects of organic acids on growth performance,gastrointestinal pH,intestinal microbial populations and immune responses of weaned pigs[J].Asian Australasian Journal of Animal Sciences,2008,21(2):252-261.
[30] LEE G J.Changes in composition and pH of digesta along the gastrointestinal tract of sheep in relation to scouring induced by wheat engorgement[J].Australian Journal of Agricultural Research,1977,28(6):1075-1082.
[31] Robinson P H,Chalupa W,Sniffen C J,et al.Influence of ingredient reformulation to reduce diet crude protein level on productivity,and efficiency of dietary nitrogen use,in early lactation dairy cows[J].Animal Feed Science and Technology,2004,116(1/2):67-81.
[32] 张永翠.蛋氨酸对肉兔生长发育、免疫性能、血液生化指标及IGF-1 mRNA表达量的影响[D].硕士学位论文.泰安:山东农业大学,2008.
[33] SMITH J M,VAN AMBURGH M E,DAZ M C,et al.Effect of nutrient intake on the development of the somatotropic axis and its responsiveness to GH in Holstein bull calves[J].Journal of Animal Science,2002,80(6):1528-1537.
[34] SOLIMAN A T,HASSAN A E H,AREF M K,et al.Serum insulin-like growth factors Ⅰ and II concentrations and growth hormone and insulin responses to arginine infusion in children with protein-energy malnutrition before and after nutritional rehabilitation[J].Pediatric Research,1986,20(11):1122-1130.
[35] VANCE M L,HARTMAN M L,THORNER M O.Growth hormone and nutrition[J].Hormone Research,1992,38(1):85-88.
[36] BUONOMO F C,BAILE C A.Influence of nutritional deprivation on insulin-like growth factor I,somatotropin,and metabolic hormones in swine[J].Journal of Animal Science,1991,69(2):755-760.
[37] CAREW L B,MCMURTRY J P,ALSTER F A.Effects of methionine deficiencies on plasma levels of thyroid hormones,insulin-like growth factors-Ⅰ and -Ⅱ,liver and body weights,and feed intake in growing chickens[J].Poultry Science,2003,82(12):1932-1938.
[38] 孙菲菲,曹阳春,李生祥,等.胆碱和蛋氨酸对奶牛围产期脂质代谢、抗氧化能力和免疫功能的影响[C]//第七届中国饲料营养学术研讨会论文集.郑州:中国畜牧兽医学会动物营养学分会,2014.
[39] 毕晓华,张晓明.过瘤胃保护蛋氨酸对奶牛营养物质消化、瘤胃发酵和氮代谢的影响[J].饲料研究,2014(19):45-49.
*Corresponding author, associate professor, E-mail: zhangnaifeng@caas.cn
(责任编辑 王智航)
Effects of Dietary Level of Methionine on Nutrient Digestion, Gastrointestinal pH and Serum Indexes of MaleHuLambs
WANG Jie CUI Kai WANG Shiqin DIAO Qiyu ZHANG Naifeng*
(KeyLaboratoryofFeedBiotechnologyofMinistryofAgriculture,FeedResearchInstituteofChineseAcademyofAgriculturalSciences,Beijing100081,China)
The aim of this study was to assess the effects of dietary level of methionine on the nutrient digestion, gastrointestinal pH and serum indexes of maleHulambs. Twelve pairs of maleHutwin lambs weaned at 7 days old were selected and divided into two groups (control,CON; low methionine level,LM) with a matched-pairs design. During 8 to 56 days, lambs were fed with and basal starter in CON, while LM group ware fed the basal milk replacer and starter deducting 0.70% and 0.4% methionine compared on control group basis, respectively. During 57 to 84 days, all lambs were fed with basal starter. Two periods of were undertaken at 46 to 55 and 74 to 83 days of age using 4 pairs of twin lambs, respectively. Twelve pairs of maleHutwin lambs weaned at 7 days of age were selected and divided into two groups [control (CON) group and low methionine level (LM) group] with a matched-pairs design, and one pair of lambs were assigned to one of the groups. The experiment consisted of two stages. Stage 1 (8 to 56 days of age), lambs in CON group were fed basal milk replacer and basal starter, while those in LM group ware fed basal milk replacer and basal starter deducting 0.70% and 0.40% methionine on the basis of control group, respectively. Stage 2 (57 to 84 days of age), all lambs were stop feeding milk replacer and fed basal starter. Four twins were selected for digestion and metabolism trials at the end of stages 1 (46 to 55 days of age) and 2 (74 to 83 days of age), respectively. The results showed as follows: 1) at 56 days of age, apparent digestibility of crude protein, ether extract and neutral detergent fiber in LM group were significantly lower than those in CON group (P<0.05); at 84 days of age, no significant differences were observed in apparent digestibility of nutrients between groups (P>0.05). 2) At 56 days of age, no significant differences were observed in other gastrointestinal pH between groups (P>0.05) except duodenum pH, which was significantly lower in LM group than CON group (P<0.05); at 84 days of age, no significant differences were observed in gastrointestinal pH between groups (P>0.05). 3) No significant differences were observed in other serum indexes between groups at 56 and 84 days of age (P>0.05) except growth hormone (GH) and insulin (INS) concentrations at 56 days of age, which were significantly lower in LM group than CON group (P<0.05). In conclusion, at 8 to 56 days of age, low dietary methionine level not only decreases apparent digestibility of nutrients, but also decreases duodenum gastrointestinal pH, GH and INS concentrations of maleHulambs; at 57 to 84 days of age, subsequent recoveries of nutrient apparent digestibility, gastrointestinal pH and serum hormone indexes appear after the compensation of dietary methionine level.[ChineseJournalofAnimalNutrition, 2017, 29(8):3004-3013]
methionine; lamb; digestion and metabolism; gastrointestinal pH; serum index
10.3969/j.issn.1006-267x.2017.08.046
2017-02-08
国家公益性行业(农业)科研专项(201303143);国家肉羊产业技术体系建设专项(CARS-39)
王 杰(1989—),男,山东临沂人,硕士研究生,研究方向为动物营养与饲料科学。E-mail: nkywangjie@163.com
*通信作者:张乃锋,研究员,硕士生导师,E-mail: zhangnaifeng@caas.cn
S826
A
1006-267X(2017)08-3004-10

