苯污染胁迫下室内植物POD活性与MDA含量变化分析研究
鲁敏,高鹏,赵洁,张凌方,卢佳欢,崔琰
(1.山东建筑大学 学报编辑部,山东 济南250101;2.山东建筑大学 艺术学院,山东 济南250101;3.山东建筑大学 建筑城规学院,山东 济南250101)
苯污染胁迫下室内植物POD活性与MDA含量变化分析研究
鲁敏1,2,高鹏2,赵洁2,张凌方2,卢佳欢2,崔琰3
(1.山东建筑大学 学报编辑部,山东 济南250101;2.山东建筑大学 艺术学院,山东 济南250101;3.山东建筑大学 建筑城规学院,山东 济南250101)
当今环境污染问题愈加严峻,现代社会正处在以“室内化学污染”为标志的第三污染期。室内植物对室内苯污染具有吸收净化作用,对苯胁迫的抗性能力是决定植物是否能够长期在污染环境中正常生长发育并持续、有效发挥吸污能力的前提和基础。过氧化物酶(POD)活性和丙二醛(MDA)含量指标能够有效反映植物对室内苯污染胁迫抗性能力强弱。文章采用人工熏气实验,研究9种常见室内植物在不同浓度苯胁迫下的POD活性和MDA含量变化,评定不同植物在苯胁迫下的抗性能力。综合评定得出:9种常见室内耐阴观叶植物中,金边虎尾兰对苯污染胁迫的抗性能力最强,其次为鸟巢蕨,对苯污染胁迫抗性能力最弱的为皱叶薄荷。
苯污染;室内植物;过氧化物酶;丙二醛;抗性能力
0 引言
随着社会的发展和科学技术的进步,以及城市化进程的不断推进,环境污染问题日益严重。当今人类社会经历了“煤烟型”和“光化学烟雾型”污染期,并进入了以“室内化学污染”为标志的第三污染期[1]。经研究发现:室内污染物浓度平均高于室外数倍甚至数十倍之多[2]。苯不仅是室内化学污染挥发性有机物(VOCs)中的主要污染物,更是室内持久、难以降解的化学物质,对人体具强致癌、致畸形、致突变作用,被称为室内“三大隐形杀手”之一,并被世界卫生组织(WHO)确定为强致癌物[3-5]。室内植物不仅具有吸碳放氧等功能,而且对室内挥发性有机物等污染物具有很强的吸收、超量积累、降解、固定、转移污染物的特性和能力,并因主要依靠植物自身的代谢活动,具有安全、经济、可持续等特点,同时室内植物因其良好的观赏特性,对美化室内环境和陶冶情操具有重要作用。综上所述,室内植物吸收净化室内化学污染已成为治理室内化学污染的重要手段和污染净化领域的研究热点[6-8]。
室内植物对室内化学污染的抵抗能力即抗污能力的强弱是决定植物是否能够长期在污染环境中正常生长发育并持续、有效发挥吸污能力的前提和基础。目前,植物对于室内化学污染的抗性研究主要集中在植物受污染胁迫后形态学特征、内部生理生化指 标 和超微结 构 的 变 化 上[9-16]。过 氧 化物 酶(POD)和丙二醛(MDA)是衡量植物对胁迫抗性能力的重要生理指标。POD和MDA广泛分布于植物体内,其中POD的活性与植物光合作用、呼吸作用等植物基本生理活动有关,其能够促进植物木质化[17-18]。由于植物老化组织中POD的活性较高,常作为反映组织老化程度的生理指标,能够有效反映植物逆境抗性能力。MDA是膜脂过氧化最重要的产物之一,具有损害植物组织或器官的生物膜的功能和结构,对生物大分子如酶类、蛋白质、核酸等也有损伤作用[19]。通过对MDA含量的研究可以了解膜脂过氧化的程度,因此在植物衰老生理和抗性生理研究中MDA含量是一个常用指标[20-21]。植物受胁迫后,POD活性和MDA含量的变化,能够有效反映植物逆境抗性能力。
研究以9种常见室内植物为试材,通过对植物在不同浓度苯胁迫下的POD活性和MDA含量进行测定,分析植物苯污染胁迫后POD活性和MDA含量变化,对不同植物苯胁迫下的抗性能力进行判定,从而为筛选吸收、净化修复能力强的抗污、吸污室内植物提供实验数据支持和基础理论指导。
1 实验材料与方法
1.1 实验材料
(1)实 验 植 物 种 类:选用A1吊 兰(Chlorophytum comosum)、A2金 边 吊 兰(Chlorophytum comosum var.marginatum)、A3银心吊兰(Chlorophytum comosum var.mediopictum)、A4吊竹梅(Zebrina pendula)、A5绿 萝 (Scindapsus aureun)、A6皱叶薄荷(Melissa officinalis)、A7金边虎尾兰(Sansevieria trifasciata var.laurentii)、A8白鹤 芋 (Spathiphyllum floribundum)、A9鸟巢 蕨(Neottopteris antique)等9种常见室内观叶植物;植物提前一个月购买,并置于实验室以适应环境。
(2)实验植物规格:株型一致且均处于良好的生长状态;所用花盆规格一致,盆土量相当。
1.2 实验装置
1.2.1 实验装置设计
采用室内人工密闭熏气法进行实验,实验装置设计参照Wolverton的模拟封闭舱设计[22],人工密闭熏气箱采用尺寸为0.8 m×0.8 m×0.8 m的正方体造型,材质为厚度8mm普通玻璃。箱体顶盖可拆卸,用于取放实验植物,顶盖用密封海绵胶密封,并涂抹凡士林,防止漏气。密闭熏气箱内放置小风扇和温度计,用于加快箱内液态苯挥发和记录箱内的温度变化。
1.2.2 实验装置密封性测试
实验前需要进行人工熏气箱密闭性测试,熏气箱注入纯度99.9%苯液体20μL,密封玻璃熏气箱内不放植物,每过6 h测定一次密闭熏气箱内的苯浓度,共3次。结果表明箱内的浓度只降低了2%,基本保持不变,人工密闭熏气箱密闭性符合实验要求。
1.3 实验设计
室内苯浓度国家标准为0.11 mg/m3,实验采用高浓度苯胁迫研究植物苯污染胁迫下的POD活性和MDA含量变化,即实验设置15、30和60 mg/m3等3个浓度梯度,将9种实验植物随机区组,依次放入密闭熏气箱内进行24 h苯胁迫处理,胁迫处理后采集生长良好、位置一致的叶片,测定实验植物POD活性与MDA含量,进行3次重复实验。
1.4 实验统计分析方法
对实验测定POD活性和MDA含量等数据,通过SPSS软件进行方差分析、多重比较分析(LSD),对不同苯浓度胁迫下9种常见室内植物POD活性与MDA含量变化进行综合分析。
2 结果与分析
2.1 不同浓度苯胁迫下实验植物POD活性与MDA含量变化结果与分析
不同浓度苯胁迫24 h后,测量9种实验植物POD活性与MDA含量变化并对结果进行统计与分析,结果见表1、2。
表1、2结果表明,不同浓度苯胁迫后9种实验植物体内POD活性与MDA含量均出现不同程度的升高。继续对受不同浓度苯胁迫后实验植物的POD活性与MDA含量变化率进行双因素方差分析,实验植物种类与苯浓度作为两个控制因素,结果见表3、4。

表1 不同浓度苯胁迫下9种室内植物POD活性变化

表2 不同浓度苯胁迫下9种室内植物MDA含量变化

表3 不同浓度苯胁迫下9种室内植物POD变化率方差分析

表4 不同浓度苯胁迫下9种室内植物MDA变化率方差分析
表3、4结果显示,受不同浓度苯胁迫后,植物种类、苯浓度和两因素之间的交互作用对实验植物POD活性与MDA含量变化率的影响水平极为显著,其中苯浓度对受胁迫后植物POD活性和MDA含量变化影响相对植物种类来说更为显著。
2.2 实验植物POD活性与MDA含量在15 mg/m3苯胁迫下变化结果与分析
9种常见室内植物经过15 mg/m3苯胁迫24 h后,对植物体内POD活性与MDA含量进行测量,对植物POD活性与MDA含量变化率进行单因素方差分析,结果见表5、6。然后多重比较分析9种常见室内植物15 mg/m3苯胁迫24 h后POD活性和MDA含量变化率,结果见表7、8。

表5 15 mg/m3苯胁迫下9种室内植物POD活性变化率方差分析

表6 15 mg/m3苯胁迫下9种室内植物MDA活性变化率方差分析
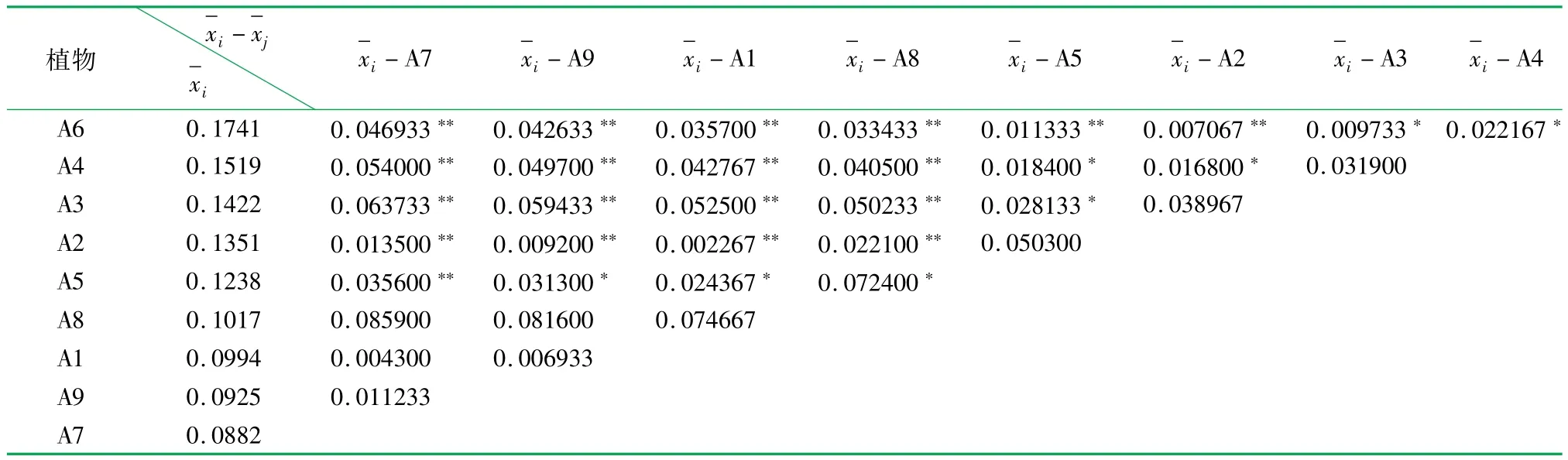
表7 15 mg/m3苯胁迫下9种室内植物POD活性变化率多重比较结果

表8 15 mg/m3苯胁迫下9种室内植物MDA含量变化率多重比较结果
根据方差分析结果如表5、6所示,植物种类对受胁迫后植物体内POD活性与MDA含量变化率产生极显著水平的影响;植物受15mg/m3苯胁迫24 h后体内POD活性与MDA含量变化率多重比较结果如表7、8所示,大多数植物种类间差异性显著甚至极为显著,实验植物受胁迫后体内POD活性和MDA含量均出现不同程度的升高。其中,金边虎尾兰(A7)的抗性能力最强,体内POD活性升高8.82%,上升幅度最小,MDA含量变化最小,升高4.88%;鸟巢蕨(A9)的抗性能力次之,POD活性升高9.25%,MDA含量升高5.21%;皱叶薄荷(A6)的POD活性升高17.41%,MDA含量升高11.38%,变化幅度最大,抗性能力最弱。
2.3 实验植物POD活性与MDA含量在30 mg/m3苯胁迫下变化结果与分析
实验植物受30 mg/m3苯胁迫后,对植物体内POD活性与MDA含量进行测量,对植物POD活性与MDA含量变化率进行单因素方差分析,结果见表9、10。继续多重比较分析9种常见室内植物30 mg/m3苯胁迫24 h后POD活性和MDA含量变化率,结果见表11、12。

表9 30 mg/m3苯胁迫下9种室内植物POD活性变化率方差分析

表10 30 mg/m3苯胁迫下9种室内植物MDA含量变化率方差分析

表11 30 mg/m3苯胁迫下9种室内植物POD活性变化率多重比较

表12 30 mg/m3苯胁迫下9种室内植物MDA含量变化率多重比较
根据方差分析结果如表9、10所示,植物种类对受胁迫后植物体内POD活性与MDA含量变化率产生极显著水平的影响;植物受30mg/m3苯胁迫24 h后体内POD活性与MDA含量变化率多重比较结果如表11、12所示,大多数植物种类间差异性显著甚至极为显著,实验植物受胁迫后体内POD活性和MDA含量均出现不同程度的升高。其中,金边虎尾兰(A7)的POD活性和MDA含量变化最小,POD活性升高15.58%,MDA含量升高11.93%,抗性能力最强;鸟巢蕨(A9)的抗性能力较金边虎尾兰次之,POD活性升高16.31%,MDA含量升高12.77%;皱叶薄荷(A6)的POD活性升高29.88%,变化最大,MDA含量升高18.43%,抗性能力最弱。
2.4 实验植物POD活性与MDA含量在60 mg/m3苯胁迫下变化结果与分析
实验植物受60 mg/m3苯胁迫后,对植物体内POD活性与MDA含量进行测量,对植物POD活性与MDA含量变化率进行单因素方差分析,结果见表13、14。然后多重比较分析9种实验植物的POD活性和MDA含量变化率,结果见表15、16。

表13 60 mg/m3苯胁迫下9种室内植物POD活性变化率方差分析

表14 60 mg/m3苯胁迫下9种室内植物MDA含量变化率方差分析

表15 60 mg/m3苯胁迫下9种室内植物POD变化率多重比较结果

表16 60 mg/m3苯胁迫下9种室内植物MDA变化率多重比较结果
根据方差分析结果如表13、14所示,植物种类对受胁迫后植物体内POD活性与MDA含量变化率产生极显著水平的影响;植物受60 mg/m3苯胁迫24 h后体内POD活性与MDA含量变化率多重比较结果如表15、16所示,大多数植物种类间差异性显著甚至极为显著,实验植物受胁迫后体内POD活性和MDA含量均出现不同程度的升高。其中,金边虎尾兰(A7)的POD活性升高35.70%,MDA含量升高35.07%,变化率最小,抗性能力最强;绿萝(A5)POD活性升高35.76%,变化率次小;鸟巢蕨(A9)MDA含量变化率次小,升高35.13%;皱叶薄荷(A6)的POD活性与MDA含量变化率最大,POD活性升高50.28%,MDA含量升高51.28%,抗性能力最弱。
3 结论
通过实验研究得出结论:
(1)不同植物种类、苯浓度及两因素间的交互作用,对9种实验植物的POD活性和MDA含量变化的影响差异达到极显著水平。其中,苯浓度对植物POD活性和MDA含量变化的影响更为显著。
(2)9种常见室内植物在不同浓度苯胁迫下,植物体内的POD活性与MDA含量均出现不同程度的上升;在浓度为15、30和60 mg/m3苯的胁迫下,金边虎尾兰(A7)体内POD活性与MDA含量变化率最小;鸟巢蕨(A9)受胁迫后体内POD活性与MDA含量变化率次小;皱叶薄荷(A6)体内POD活性与MDA含量变化率最大。
根据实验植物在不同浓度苯胁迫下POD活性与MDA含量变化分析,金边虎尾兰(A7)对苯污染抗性能力最强,其次为鸟巢蕨(A9),而皱叶薄荷(A6)对苯污染胁迫抗性能力最弱。
[1] 马亚梦.装修居室甲醛污染状况及功能植物的甲醛去除能力研究[D].长沙:中南大学,2012.
[2] 周茜茜,陈成广,陈碧,等.3种室内观赏植物对苯污染净化能力的研究[J].广东农业科学,2013,40(16):143-146.
[3] Schrader J.,Schilling M.,Holtmann D.,etal..Methanol-based industrial biotechnology:current status and future perspectives of methylotrophic bacteria[J].Trends Biotechnol,2009,27(2):107 -115.
[4] 苏海涛.长春市居民住宅空气中甲醛和苯污染现状调查与分析[D].长春:吉林大学,2013.
[5] 刘雅棋,李振海.城市住宅室内化学污染情况调查与分析[J].建筑节能,2013,41(1):33-37.
[6] 许桂芳.7种观赏植物对甲醛的净化效果及生理响应[J].中国农学通报,2012,28(19):266-269.
[7] 刘顺腾.室内化学污染监测植物选择与应用研究[D].济南:山东建筑大学,2013.
[8] 傅徽楠,周锡成,秦俊,等.绿化对室内环境及人的反应力的作用与影响[J].中国园林,2001,17(2):60-62.
[9] 裴翡翡.室内甲醛污染的植物生态修复技术研究[D].济南:山东建筑大学,2012.
[10]秦俊,傅徽楠,杨林.室内绿化对建筑综合症的缓解作用[J].福建林学院学报,2002,22(4):308-311.
[11]鲁敏,赵学明,赵洁,等.室内苯污染胁迫下植物抗性的研究进展[J].山东建筑大学学报,2013,28(5):457-463.
[12]孟国忠,季孔庶.室内空气污染的植物净化研究概述[J].林业科技开发,2013,27(4):1-6.
[13]刘栋,史宝胜,魏文欣.甲醛气体胁迫对3种观赏植物的形态及部分生理指标的影响[J].河北农业大学学报,2011,34(2): 66-70.
[14]鲁敏,闫红梅,冯兰东,等.室内植物受甲醛污染胁迫响应机制的研究进展[J].山东建筑大学学报,2014,29(3):263-268.
[15]张衡锋,韦庆翠,汤庚国,等.7种冬青对苯气体胁迫的生理响应[J].南京林业大学学报:自然科学版,2015,39(2):174-178.
[16]孟国忠.几种室内植物对苯和甲醛复合污染响应的研究[D].南京:南京林业大学,2013.
[17]赵聪,谢水波,李仕友,等.铀胁迫对香根草生理生化指标的影响[J].安全与环境学报,2015,15(4):386-390.
[18]王琰,陈建文,狄晓艳.水分胁迫下不同油松种源SOD、POD、MDA及可溶性蛋白比较研究[J].生态环境学报,2011,20 (10):1449-1453.
[19]勾晓华,王勋陵.氟化氢对植物叶片中的SOD酶活力和MDA含量的影响[J].西北植物学报,1995,15(2):36-39.
[20]Yurimoto H.,Kato N.,Sakai Y..Assimilation,dissimilation,and detoxification of formaldehyde,a central metabolic intermediate ofmethylotrophic metabolism[J].Chemical Record,2005,5(6):367-375.
[21]陈段芬,李宪松,邸葆,等.甲醛对5种花卉质膜透性和保护酶活性的影响[J].华北农学报,2007,22(3):84-87.
[22]Wolverton B.C.,Wolverton J.D..Plants and soilmicroorganisms: removal of formaldehyde,xylene,and ammonia from the indoor environment[J].Journal of the Mississippi Academy of Sciences,1993,38(2):11-15
(学科责编:康文凤)
Study on changes of peroxidase activity and malondialdehyde content in indoor plants under indoor benzene pollution
Lu Min1,2,Gao Peng2,Zhao Jie2,et al.
(1.Editorial Department of Journal of Shandong Jianzhu University,Jinan 250101,China;2.School of Art,Shandong Jianzhu University,Jinan 250101,China)
Nowadays,the problem of environmental pollution is becoming more and more serious.Modern society is in the third pollution period marked by“indoor chemical pollution”.Indoor plants have an effect on the absorption and purification of indoor benzene pollution,and the resistance of benzene stress is basis and premise of whether plants can keep long-term normal growth and developmentand play the continuous and effective role in absorbing pollution in polluted environment.Peroxidase(POD)activity and malondialdehyde(MDA)content can effectively reflect the resistance ability of plants to indoor benzene pollution stress.In this paper,the changes of peroxidase(POD)activity and malondialdehyde content of 9 common indoor shade tolerant plants under different concentrations of benzene stress are studied by artificial fumigationmethod.The physiological indexes of Sansevieriatrifasciata var.laurentii has the strongest resistance to benzene pollution,followed by Neottopteris antique,and the weakest is Melissa officinalis.
benzene pollution;indoor plants;peroxidase;malondialdehyde;resistance ability
X171.4,X173
A
1673-7644(2017)03-0205-07
2017-04-16
国家自然科学基金项目(20337010);住房和城乡建设部科技计划项目(2012-K6-5);山东省住房和城乡建设厅科技计划项目(2011YK046);山东省自然科学基金项目(ZR2015PE014)
鲁敏(1963-),女(满族),教授,博士,主要从事室内外污染气体和污水的植物净化与生态修复技术及吸污抗污植物的选择与应用等方面研究.E-mail:lumin@sdjzu.edu.cn

