重组质粒pcDNA3.1/C-sis对大鼠FHF的影响
蔡鹏程,元文峰,丁 浩△
(1.南昌大学第二附属医院消化内科,南昌 330006;2.乐安县人民医院内二科,江西抚州 344300)
重组质粒pcDNA3.1/C-sis对大鼠FHF的影响
蔡鹏程1,元文峰2,丁 浩1△
(1.南昌大学第二附属医院消化内科,南昌 330006;2.乐安县人民医院内二科,江西抚州 344300)
目的 探讨重组质粒pcDNA3.1/C-sis导入大鼠对暴发性肝功能衰竭(FHF)的影响。方法 利用流体力学的方法将重组质粒pcDNA3.1/C-sis导入大鼠肝脏,48 h后用内毒素(LPS)+D-半乳糖胺(D-GalN)诱导大鼠FHF;利用荧光定量PCR及蛋白质印迹法(Western blotting)检测C-sis表达;利用苏木精-伊红(HE)染色及测定半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)活性检测凋亡;利用Western Blotting检测Bcl-2和Bax的表达变化;计算大鼠24 h观察期内的死亡率。结果 FHF+C-sis质粒组的C-sis mRNA和蛋白表达水平较正常对照组和FHF+空载质粒组明显增加,差异均有统计学意义(P<0.01)。与正常对照组相比,FHF+林格液注射组和FHF+空载质粒组肝脏细胞凋亡增多;与FHF+空载质粒组相比,FHF+C-sis质粒组肝脏细胞凋亡减少。与正常对照组相比,FHF+林格液注射组大鼠肝脏组织中Caspase-3的表达增多(P<0.01);与FHF+空载质粒组相比,FHF+C-sis质粒组大鼠肝脏组织中Caspase-3的表达减少(P<0.05)。与正常对照组相比,FHF+林格液注射组大鼠肝脏组织中Bcl-2表达明显减少(P<0.01),Bax表达明显增多(P<0.01);而与FHF+空载质粒组相比,FHF+C-sis质粒组大鼠肝脏组织中Bcl-2表达增多(P<0.05),Bax表达减少(P<0.05)。在24 h观察期内,正常对照组大鼠均存活,FHF+林格液注射组及FHF+空载质粒组大鼠死亡率分别为70.0%和80.0%;而FHF+C-sis质粒组大鼠仅20.0%死亡。结论 C-sis基因可减弱LPS+D-GalN诱导的大鼠FHF。
原癌基因蛋白质C-sis;重组质粒;大鼠;肝功能衰竭,急性
原癌基因参与调控细胞的正常分裂、增殖、成熟及分化过程,以及组织稳态维持过程的调控[1]。因此,原癌基因对细胞的正常生长及组织修复具有关键性作用。而原癌基因C-sis是血小板源生长因子B链(platelet-derived growth factor B chain,PDGF-B)的编码基因[2],它具有促进细胞增殖及抑制细胞凋亡的作用,并能增强组织修复功能[3]。暴发性肝功能衰竭(fulminating hepatic failure,FHF)是以急性严重肝损伤为特征的一种临床综合征[4],缺乏有效的治疗手段,病死率很高。所以,需研究其他治疗FHF的有效方法。笔者假设C-sis能在受损肝脏组织的修复及FHF的治疗中发挥积极作用。为此,本研究将C-sis基因导入大鼠肝脏,并用内毒素(LPS)+D-半乳糖胺(D-GalN)诱导大鼠建立FHF模型,检测大鼠肝脏的凋亡情况,且计算大鼠死亡率,以探索C-sis是否可以成为FHF治疗的分子作用靶点,为治疗FHF提供新的思路或切入点。
1 材料与方法
1.1 材料 实验大鼠购自江苏常州凯文实验动物有限公司;空载质粒pcDNA3.1和重组质粒pcDNA3.1/C-sis由本实验室保存;总RNA快速提取试剂盒购自上海Generay生物;反转录试剂盒购自Thermo Scientific Fisher公司;引物购自上海Invitrogen生物公司;qPCR试剂盒购自Tiangen公司;GAPDH的Ⅰ抗购自Bioworld公司,C-sis的Ⅰ抗购自Abcam公司,Bcl-2和Bax的Ⅰ抗购自Santa Cruz公司;DNA相对分子质量标准及蛋白低相对分子质量标准购自上海捷瑞生物工程有限公司;苏木精购自Sigma公司;免疫组织化学半胱氨酸天冬氨酸蛋白酶(Caspase)-3抗体购自Abcam公司。
1.2 方法
1.2.1 实验动物及重组质粒的导入 质量(200±10)g的SD大鼠保持每只1笼,于室温24~25 ℃饲养,每12小时昼夜循环,并能自由获取食物及水。本研究获得南昌大学第二附属医院医学伦理委员会批准(编号:研临审[2013]第42号)。重组质粒pcDNA3.1/C-sis导入大鼠体内是通过流体动力学的方法[5-6]:即大鼠吸入乙醚麻醉后,溶于15 mL林格液的800 μg裸质粒在15 s内被快速注射进入大鼠尾静脉。
1.2.2 FHF的造模和分组 将大鼠分为4组,每组至少8只大鼠。其中1组设为正常对照组,其余3组大鼠均通过腹腔内注射溶于1 mL无菌生理盐水的相应质量的LPS和D-GalN(按50 μg/kg LPS+300 mg/kg D-GalN乘以大鼠体质量得出)诱导FHF[7],再分别用林格液、空载质粒pcDNA3.1和重组质粒pcDNA3.1/C-sis进行预处理(如前所述),即FHF+林格液注射组、FHF+空载质粒组、FHF+C-sis质粒组。于质粒注射后48 h腹腔内注射LPS+D-GalN。腹腔注射LPS+D-GalN 8 h后,提取肝组织和血液标本。另有40只大鼠如上所述分组,在腹腔注射LPS/D-GalN 24 h后计算动物死亡率。
1.2.3 荧光定量PCR 肝组织总RNA抽提及反转录参照说明书操作。C-sis的上游引物5′-ATG ACC CGA GCA CAT TCT GG-3′,下游引物5′-ACA CCT CTG TAC GCG TCT TG-3′;β-actin的上游引物5′-CCC ATC TAT GAG GGT TAC GC-3′,下游引物5′-TTT AAT GTC ACG CAC GAT TTC-3′。PCR反应体系:2×SuperReal premix plus 10 μL、10 μmol/L上下游引物各1 μL、cDNA(加去离子水稀释成一致浓度)8 μL。并按如下条件进行PCR扩增:95.0 ℃ 15 min,95.0 ℃ 10 s,60.0 ℃ 20 s,72.0 ℃ 20 s模板阅读,共39个循环,融合曲线70~95 ℃,增量0.5 ℃ 10 s模板阅读。最终使用荧光定量PCR分析软件即BIO-RAD CFX Manager实施计算及分析。
1.2.4 蛋白质印迹法(Western blotting) 用放射免疫沉淀试验(RIPA)提取总蛋白,二喹啉甲酸(BCA)法测定蛋白质水平,取100 μg获得的蛋白质进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质。蛋白质转印到硝酸纤维素膜(NC膜)上,NC膜用脱脂奶粉溶液4 ℃封闭过夜;再分别以相应比例稀释的Ⅰ抗孵育,4 ℃过夜,用Ⅱ抗孵育NC膜2 h,用二氨基联苯胺(DAB)显色照相。采用Quantity One 4.62软件进行分析,结果以目的条带/3-磷酸甘油醛脱氢酶(GAPDH)的灰度值表示。
1.2.5 苏木精-伊红(HE)染色检测 肝脏组织用10%甲醛溶液固定,石蜡包埋,然后按4 μm切片,并通过苏木精和伊红染色,最终用光学显微镜观察分析。
1.2.6 免疫组织化学检测Caspase-3活性 将肝脏组织固定,石蜡包埋、切片和脱蜡。切片用内源性过氧化物酶阻断和灭活后,用Caspase-3的Ⅰ抗(抗体工作浓度为1∶100)孵育,再用相应的Ⅱ抗孵育。切片用DAB染色,最后用苏木精复染。显微镜下观察,阳性表达呈棕黄色或棕褐色,每张免疫组织化学切片选择3个不同的视野(×200)观察,并判读阳性表达强度和阳性率。染色结果按试剂说明书进行,采用半定量分析方法:评分以染色强度结合阳性细胞数百分比进行乘积[8]。染色强度以多数细胞呈现的染色强度并减去背景着色计分:无明显着色记为0分,淡黄色或轻微黄色记为1分,深黄色或棕黄色记为2分,棕褐色或黑褐色记为3分。阳性细胞百分比即每张免疫组织化学切片选择5个不同的视野(×200)观察,每个视野计数100个细胞中阳性细胞数,计算阳性细胞平均数:≤5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。每个视野均进行染色强度计分与阳性细胞百分比乘积评分,以阳性细胞百分比与染色强度的乘积进行评分:0分判为阴性,1~6分判为弱阳性,7~12分判为强阳性。
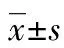
2 结 果
2.1 C-sis表达升高的鉴定 与正常对照组和FHF+空载质粒组比较,FHF+C-sis质粒组的C-sis mRNA(图1A)和蛋白质(图1B)表达水平升高,差异均有统计学意义(P<0.01)。
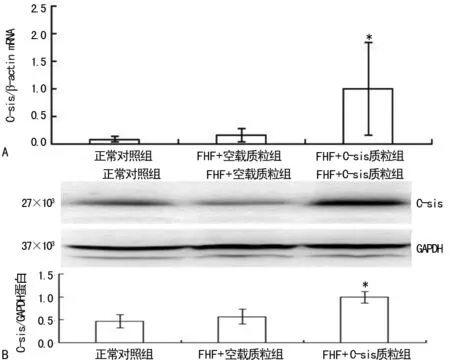
*:P<0.01,与正常对照组和FHF+空载质粒组比较
图1 荧光定量PCR和Western Blotting检测大鼠肝脏组织C-sis的表达
2.2 HE染色检测结果 正常对照组:大鼠肝组织肝细胞结构正常,肝细胞排列紧密,细胞核呈圆形,无脂滴、炎症、坏死等病变,肝小叶结构正常,肝细胞、血窦围绕中央静脉呈放射状排列;FHF+林格液注射组:可见炎性细胞浸润,细胞类型以中性粒细胞为主,9只大鼠肝组织内可见散在肝细胞凋亡,1只大鼠

A:正常对照组(n=8,×100);B:正常对照组(n=8,×200);C:FHF+林格液注射组(n=10,×100);D:FHF+林格液注射组(n=10,×200);E:FHF+空载质粒组(n=14,×100);F:FHF+空载质粒组(n=14,×200);G:FHF+C-sis质粒组(n=13,×100);H:FHF+C-sis质粒组(n=13,×200)
图2 HE染色检测结果
肝组织广泛性坏死,肝脏组织结构消失,肝窦内可见大量瘀血;FHF+空载质粒组:可见炎性细胞浸润,细胞类型与FHF+林格液注射组相同,其中12只大鼠肝组织内可见散在肝细胞凋亡,2只大鼠肝组织广泛性坏死,肝窦内可见大量瘀血;FHF+C-sis质粒组:肝组织内可见以中性粒细胞为主的小灶性炎,4只大鼠肝细胞凋亡,细胞核固缩,部分细胞结构破坏,1只大鼠肝组织广泛性坏死,肝窦内可见大量瘀血。具体结果见图2。
2.3 Caspase-3活性检测结果 与正常对照组比较,FHF+林格液注射组Caspase-3表达水平升高,差异有统计学意义(P<0.01);与FHF+空载质粒组比较,FHF+C-sis质粒组Caspase-3表达水平降低,差异亦有统计学意义(P<0.05),见表1、图3。
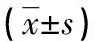
表1 大鼠肝脏组织中Caspase-3表达比较
*:P<0.01,与正常对照组比较;#:P<0.05,与FHF+空载质粒组比较

A:正常对照组;B:FHF+林格液注射组;C:FHF+空载质粒组;D:FHF+C-sis质粒组
图3 免疫组织化学法检测大鼠肝脏组织中Caspase-3的表达(×200)
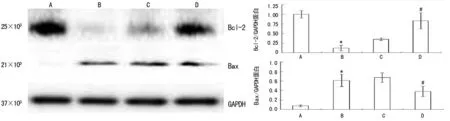
*:P<0.01,与正常对照组比较;#:P<0.05,与FHF+空载质粒组比较。A:正常对照组(n=8),B:FHF+林格液注射组(n=9),C:FHF+空载质粒组(n=9),D:FHF+C-sis质粒组(n=9)
图4 Western Blotting检测大鼠肝脏组织Bcl-2与Bax的表达
2.4 动物死亡率 24 h观察期内各组大鼠死亡情况见表2。正常对照组大鼠均存活,FHF+林格液注射组和FHF+空载质粒转染组24 h内大鼠死亡率分别为70.0%、80.0%;FHF+C-sis质粒组在24 h的观察期内仅2只大鼠死亡,死亡率为20.0%。
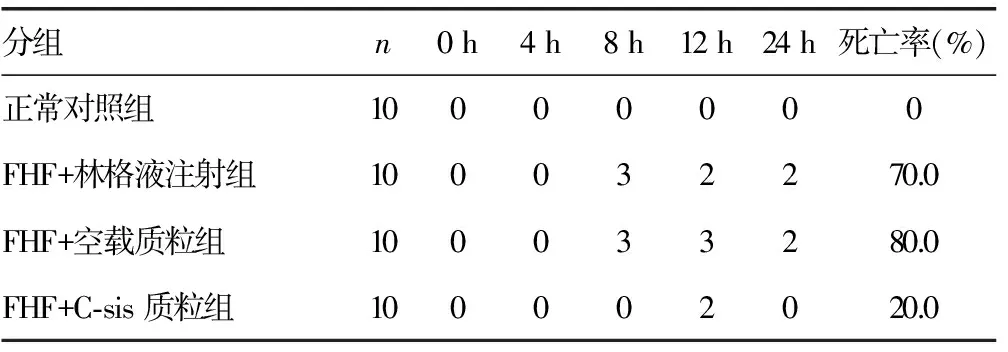
表2 观察时间内动物死亡情况
2.5 Bcl-2和Bax的表达 与正常对照组比较,FHF+林格液注射组的Bcl-2表达水平明显降低,Bax表达水平明显升高,差异均有统计学意义(P<0.01);与FHF+空载质粒组比较,FHF+C-sis质粒组Bcl-2表达水平升高,Bax表达水平降低,差异均有统计学意义(P<0.05),见图4。
3 讨 论
原癌基因能促进正常细胞和组织增殖,并抑制其凋亡,对细胞正常生长及组织修复起到了非常重要的作用。原癌基因C-sis的基本功能是诱导有丝分裂信号向细胞内转导且能诱导细胞的增殖[9-10]。C-sis编码蛋白PDGF-B是一种较强的化学诱导剂和促有丝分裂源,能诱导间叶组织来源细胞分裂及增殖,促进血管的再生及创伤愈合[11-12]。以上提示C-sis有诱导细胞增殖与抑制细胞凋亡,从而促进组织修复的功能。因此,笔者假设C-sis可能在受损的肝脏组织修复及针对FHF的治疗中起到积极作用。FHF是由多种病因引起的,突然出现大量肝细胞坏死和严重肝功能损伤,且在首发症状出现后的8周内发生肝性脑病的一种临床综合征。其临床特点为起病急、进展快,肝细胞广泛坏死,且病情危重、症状表现多样。病毒感染,尤其是乙型肝炎病毒感染为我国FHF最常见病因[13]。当前针对FHF缺乏有效的治疗手段,病死率高。所以,仍需研究其他治疗FHF的有效方法。本研究结果表明,LPS/D-GalN成功诱导大鼠发生FHF,导致大鼠急性死亡,而C-sis基因表达的上调能抑制FHF诱发的肝脏细胞凋亡,降低大鼠死亡率。这与预期的实验结果一致,即证实:C-sis基因具有抑制FHF的肝损伤作用。此外,用LPS/D-GalN处理后8 h大鼠才开始出现死亡,所以在LPS/D-GalN处理大鼠后8 h这个时间节点获取大鼠肝脏。
有研究发现,将人骨髓间充质干细胞移植进入FHF猪体内有助于FHF的恢复[14]。还有研究表明,人骨髓间充质干细胞导入猪的肝脏内,可用于治疗D-Gal诱发的FHF[15]。骨髓间充质干细胞及其分泌的分子能诱导FHF大鼠模型的肝细胞增殖并抑制其凋亡,下调巨噬细胞的浸润,将CD4+T淋巴细胞系统转换成抗炎状态,并促进肝星状细胞死亡,因此能改善FHF的肝损伤程度及肝硬化[16]。由此可见,目前针对FHF治疗的研究多数集中在干细胞对受损肝脏的修复方面。干细胞是人体中保留的未成熟细胞,具有分化形成其他细胞和组织器官的潜力,可将其运用于包括FHF在内的多种脏器疾病的治疗。然而,首先由于成体干细胞产量很低,难以应用于FHF的治疗[17];其次,当FHF发生时,干细胞的获取困难;此外,外来的干细胞输入体内后产生免疫排斥反应限制了干细胞的异体移植。而将C-sis应用于FHF的治疗没有上述问题的限制。
另外,C-sis编码的蛋白PDGF-B能诱导间叶组织来源细胞分裂和增殖,对于血管再生和创伤愈合具有良好的促进作用[11-12]。PDGFB能刺激人纤维细胞源性外质体释放,后者能加速糖尿病小鼠溃疡愈合[18]。有研究使用纳米技术制作生物可降解膜,该膜能释放重组人PDGF-B用于促进糖尿病并发的创面愈合[19]。PDGF-B能诱导血管平滑肌细胞的可溶性环氧化物水解酶表达水平升高,而后者被抑制可明显减弱大鼠大动脉损伤模型的新生血管形成[20]。以上提示C-sis具有促进上述组织或细胞增殖并抑制细胞凋亡的功能。但C-sis是否能促进肝脏组织或细胞的生长并抑制其凋亡,国内外鲜有相关报道。本研究发现,C-sis基因表达的上调能抑制LPS+D-GalN诱导的FHF大鼠发生肝细胞凋亡,并降低大鼠死亡率,表明C-sis基因具有抑制FHF的肝损伤作用。
综上所述,C-sis基因可能成为治疗FHF的分子作用靶点,为FHF的治疗提供了新的可能途径。而且本研究可为包括FHF在内的肝脏损伤的基因治疗提供理论和实践基础。
[1]Dunn S,Cowling VH.Myc and mRNA capping[J].Biochim Biophys Acta,2015,1849(5):501-505.
[2]Charbonneau M,Lavoie RR,Lauzier A,et al.Platelet-derived growth factor receptor activation promotes the prodestructive invadosome-forming phenotype of synoviocytes from patients with rheumatoid arthritis[J].J Immunol,2016,196(8):3264-3275.
[3]Chen W,Baylink DJ,Brier-Jones J,et al.PDGFB-based stem cell gene therapy increases bone strength in the mouse[J].Proc Natl Acad Sci U S A,2015,112(29):E3893-3900.
[4]高莉,石小枫.乙型肝炎相关慢加急性肝衰竭抗病毒治疗的研究进展[J].重庆医学,2016,45(7):980-982.
[5]Liu LM,Zhang JX,Wang XP,et al.Pim-3 protects against hepatic failure in D-galactosamine (D-GalN)-sensitized rats[J].Eur J Clin Invest,2010,40(2):127-138.
[6]Maruyama H,Higuchi N,Nishikawa Y,et al.High-level expression of naked DNA delivered to rat liver via tail vein injection[J].J Gene Med,2002,4(3):333-341.
[7]Sayed RH,Khalil WK,Salem HA,et al.Sulforaphane increases the survival rate in rats with fulminant hepatic failure induced by D-galactosamine and lipopolysaccharide[J].Nutr Res,2014,34(11):982-989.
[8]Kara S,Gencer B,Karaca T,et al.Protective effect of hesperetin and naringenin against apoptosis in ischemia/reperfusion-induced retinal injury in rats[J],Scientific World J,2014,2014:797824.
[9]Lee JY,Yun M,Paik JS,et al.PDGF-BB enhances the proliferation of cells in human orbital fibroblasts by suppressing PDCD4 expression via up-regulation of microRNA-21[J].Invest Ophthalmol Vis Sci,2016,57(3):908-913.[10]Sun Q,Liu L,Mandal J,et al.PDGF-BB induces PRMT1 expression through ERK1/2 dependent STAT1 activation and regulates remodeling in primary human lung fibroblasts[J].Cell Signal,2016,28(4):307-315.
[11]Takahashi J,Orcholski M,Yuan K,et al.PDGF-dependent β-catenin activation is associated with abnormal pulmonary artery smooth muscle cell proliferation in pulmonary arterial hypertension[J].FEBS Lett,2016,590(1):101-109.
[12]Jiang Z,Zhong G,Wen L,et al.The role of platelet-derived growth factor-B/platelet-derived growth factor receptor-β signaling in chronic atrial fibrillation[J].Cardiology,2016,133(4):242-256.
[13]陈勇,韩小勇.核苷类似物治疗乙型肝炎患者发生慢加急性肝衰竭短期预后的生存状况研究[J].重庆医学,2015,44(7):955-957.
[14]Xin J,Ding W,Hao S,et al.Human bone marrow mesenchymal stem cell-derived hepatocytes Express tissue inhibitor of metalloproteinases 4 and follistatin[J].Liver Int,2015,35(10):2301-2310.
[15]Shi D,Zhang J,Zhou Q,et al.Quantitative evaluation of human bone mesenchymal stem cells rescuingfulminant hepatic failure in pigs[J].Gut,2017,66(5):955-964.
[16]Huang B,Cheng X,Wang H,et al.Mesenchymal stem cells and their secreted molecules predominantly ameliorate fulminant hepatic failure and chronic liver fibrosis in mice respectively[J].J Transl Med,2016,14:45.
[17]Li J,Tao R,Wu W,et al.3D PLGA scaffolds improve differentiation and function of bone marrow mesenchymal stem Cell-Derived hepatocytes[J].Stem Cells Dev,2010,19(9):1427-1436.
[18]Geiger A,Walker A,Nissen E,et al.Human fibrocyte-derived exosomes accelerate wound healing in genetically diabetic mice[J].Biochem Biophys Res Commun,2015,467(2):303-309.
[19]Lee CH,Liu KS,Chang SH,et al.Promoting diabetic wound therapy using biodegradable rhPDGF-loaded nanofibrous membranes:CONSORT-compliant article[J].Medicine (Baltimore),2015,94(47):e1873.
[20]Wang Q,Huo L,He J,et al.Soluble epoxide hydrolase is involved in the development of atherosclerosis and arterial neointima formation by regulating smooth muscle cell migration[J].Am J Physiol Heart Circ Physiol,2015,309(11):H1894-1903.
The effect of the recombinant plasmid pcDNA3.1/C-sis on FHF of rats*
CaiPengcheng1,YuanWenfeng2,DingHao1△
(1.DepartmentofGastroenterology,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China;2.theSecondDepartmentofInternalMedicine,thePeople′sHospitalofLe′anCounty,Fuzhou,Jiangxi344300,China)
Objective To explore the effect of the recombinant plasmid pcDNA3.1/C-sis on fulminant hepatic failure (FHF) in rats.Methods 48 h after recombinant plasmid pcDNA3.1/C-sis being imported into rat liver by using the method of fluid mechanics,FHF in rats was induced by endotoxin (LPS)+D-galactosamine (D-GalN).With fluorescence quantitative PCR and Western blotting,C-sis expression was tested.The apoptosis of rat liver was detected by using HE staining and measuring Caspase-3 activity.The expression changes of Bcl-2 and Bax were examined through using Western blotting.The mortality rate of rats was calculated during 24 h observation period.Results Compared with the normal control group and FHF+empty plasmid group,C-sis mRNA and protein expression levels were increased significantly in the FHF+C-sis plasmid group,there were statistically significant differences(P<0.01).Compared with the normal control group,the apoptotic hepatocytes were increased in the FHF+Ringer′s solution injection group and FHF+empty plasmid group;compared with FHF+empty plasmid group,the apoptotic hepatocytes in the FHF+C-sis plasmid group were decreased.Compared with the normal control group,Caspase-3 expression level was increased in the FHF+Ringer′s solution injection group (P<0.01);compared with the FHF+empty plasmid group,Caspase-3 expression level in the FHF+C-sis plasmid group was decreased (P<0.05).Compared with the normal control group,Bcl-2 expression level was decreased significantly (P<0.01),and Bax expression level was increased significantly (P<0.01) in the FHF+Ringer′s solution injection group;compared with the FHF+empty plasmid group,the Bcl-2 expression level was increased (P<0.05),and Bax expression was decreased (P<0.05)in the FHF+C-sis plasmid group.During the 24 h observation period,all rats in the normal control group were alive;the mortality rates of the FHF+Ringer′s solution injection group and FHF+empty plasmid group were 70.0% and 80.0% respectively,while that of the FHF+C-sis plasmid group was only 20.0%.Conclusion C-sis gene could inhibit FHF in rats induced by LPS+D-GalN.
proto-oncogene proteins C-sis;recombinant plasmid;rats;liver failure,acute
��·基础研究
10.3969/j.issn.1671-8348.2017.19.004
国家自然科学基金资助项目(81300348);江西省青年科学基金资助项目(20151BAB215006);江西省教育厅科学技术研究项目(GJJ150259);江西省卫生计生委科技计划项目(20165199)。 作者简介:蔡鹏程(1990-),住院医师,本科,主要从事消化系疾病方面的研究。△
,E-mail:efydinghao@163.com。
R575.3
A
1671-8348(2017)19-2604-04
2017-02-07
2017-04-12)

