茧层丝胶蛋白组成与蚕茧解舒的关系
杜 鑫,陈玉银,王永强*
(1.浙江省农业科学院 蚕桑研究所,浙江 杭州310021; 2.浙江大学动物科学学院,浙江 杭州310012)
茧层丝胶蛋白组成与蚕茧解舒的关系
杜 鑫1,陈玉银2,王永强1*
(1.浙江省农业科学院 蚕桑研究所,浙江 杭州310021; 2.浙江大学动物科学学院,浙江 杭州310012)
丝胶蛋白的结构直接影响蚕茧解舒的优劣。丝胶突变系B84具有优良的蚕茧解舒性状,其茧层中含有特殊的Sericin2蛋白。本研究分析了3种主要丝胶蛋白的疏水性与二级结构,比较后发现,相比其他2种普遍存在于茧层的丝胶蛋白,Sericin2蛋白的亲水性更强、β片层结构含量更低,是B84蚕茧具有优良解舒性状的原因。
丝胶蛋白;解舒率;疏水性;二级结构
丝胶是茧层的主要成分之一,与茧丝质性状密切相关,其中与蚕茧解舒的关系最为直接。茧丝间丝胶粘合强度适中,离解易,不切断落绪或切断落绪相对较少时,蚕茧的解舒好,反之则解舒差。
丝胶突变系B84的蚕茧可以不经处理直接干茧抽丝,具有特殊的高解舒性状,其茧层中含有特殊的Sericin2蛋白[1]。虽然普通蚕品种的茧层中不含Sericin2蛋白,但其实该蛋白在普通品种的5龄蚕早期也会表达并储存于中部丝腺腺腔,只不过到5龄中期就停止表达,之后Sericin1、Sericin3蛋白大量表达[2],相比之下Sericin2蛋白含量极少,常规方法无法检测到。而在B845龄后期的中部丝腺中Sericin2蛋白继续表达并大量存在于茧层中,最终影响蚕茧的解舒。
本研究根据Sericin1、Sericin2和Sericin3蛋白序列对其疏水性及二级结构进行比较分析,寻找与B84蚕茧高解舒性状有关的证据,为进一步研究蚕茧解舒机理提供参考。
1材料与方法
以常规方法饲养B84、丰一至结茧,及时采茧并烘干。
干茧抽丝测试:各取10颗蚕茧,在干茧状态下,对丰一与B84的蚕茧进行抽丝测试。
温水处理缫丝测试:各取10颗蚕茧,温水浸泡后(45℃,30min)后进行单茧缫丝。
高温处理缫丝测试:各取10颗蚕茧,沸水浸泡1 min后在温水(45℃)过渡1 min,然后进行单茧缫丝。
丝胶蛋白的疏水性和二级结构预测通过GPMAW(v8.0)软件实现。
2结果与分析
2.1丝胶突变系B84与实用品种丰一的蚕茧解舒性状比较
在干茧状态下,丰一的蚕茧全都无法索绪抽丝,而B84的蚕茧可以进行连续抽丝。经温水处理后,丰一还是全都无法缫丝,而B84的10颗蚕茧的平均解舒率为22.10%(±6.89%)。经高温处理后,丰一、B84蚕茧的解舒率数据见表1,与干茧抽丝、温水缫丝的结果一致,B84蚕茧的解舒率明显高于丰一,10颗蚕茧中有2颗没有落绪,解舒率100%,有3颗落绪3次,解舒率25%,这就造成个体之间开差比较大,也是表1中B84标准差达到29.15的原因。

表1 丰一、B84的干茧经高温处理后的解舒率Table 1 Reeling ability of dried cocoons of Fengyi and B84 after high temperature treatment
2.2茧层丝胶的疏水性、二级结构与解舒性状的关系
有关丝胶与解舒性状的研究大多是以丝胶整体为对象[3],本文对茧层丝胶的主要成分Sericin1、Sericin3蛋白以及B84茧层中特有的Sericin2蛋白进行疏水性和二级结构预测,结果分别示于图1、图2和图3。
图1横线以上代表氨基酸残基表现疏水特性,越往上疏水性越强;横线以下代表氨基酸残基表现亲水特性,越往下亲水性越强。
图2横线以上表示该位置具有形成无规卷曲结构的倾向,越往上无规卷曲结构的倾向越大,反之则越小。
图3横线以上表示该位置具有形成β片层结构的倾向,越往上β片层结构的倾向越大,反之则越小。
从图1和图3中可以发现,Sericin2蛋白的疏水性是三种丝胶蛋白中是最强的,而从其氨基酸序列来看Sericin2蛋白中β片层结构可能是最低的。不过相比Sericin1和Sericin3蛋白,Sericin2蛋白形成无规卷曲结构的倾向不强。

图1 在丰一和B84茧层中鉴定得到的3种主要茧层丝胶蛋白的疏水性预测图Figure 1 Hydrophobicity calculation of three sericin proteins in cocoon shells of Fengyi and B84
3讨论
茧层丝胶蛋白的膨润溶解性及其二级结构与蚕茧解舒的关系一直是解舒机理研究的主要方向[4,5]。研究者通过实验结果结合实际生产情况分析后得出结论:家蚕幼虫在高湿度又不通风的环境中上蔟吐丝,丝胶在排出蚕体后开始由液态向固态转化,在这过程中丝胶内水分大量散失,而空气环境中的较多的水分将会使丝胶中的水分挥发速度变慢,如果此时的环境温度也较高,分子热运动加剧,使丝胶蛋白较易由原来的无规卷曲转变为β片层结构,结晶度变高,导致丝胶蛋白的溶解度降低,使丝胶的膨润、溶解和胶粘特性发生改变,解舒性能下降,难以缫丝;而在干燥通风环境下,丝胶蛋白质较易保持无规卷曲结构,水溶性强,易于解舒缫丝。
B84茧层中除了一般的Sericin1、Sericin3蛋白还含有特殊的丝胶蛋白成分Sericin2,在这之前这种丝胶蛋白只在茧衣中被发现,因为在5龄中期前Ser⁃icin2蛋白一直是家蚕分泌的最主要的丝胶蛋白,在五龄中期后,Sericin2蛋白停止分泌,Sericin1和Seri⁃cin3蛋白取而代之并成为茧层丝胶的主要成分,而Sericin2蛋白则出现在茧衣中[6]。三种丝胶蛋白疏水性比较的结果表明,Sericin2蛋白具有较强的亲水性,使其所在的B84茧层更容易吸水溶胀,在茧层丝胶提取试验中也发现B84的茧层较易泡胀溶解,有了Sericin2丝胶蛋白的存在,经过热水处理的B84蚕茧较易吸水溶胀,茧丝离解的阻力小,因此其解舒性能极为优异。此外,β片层和无规卷曲结构分别会对蚕茧解舒率产生负面和正面的影响[7],三种丝胶蛋白的二级结构预测结果表明,Sericin2蛋白的β片层结构最少,这种丝胶蛋白本身不容易形成致密有序的结晶化结构,尚不清楚Sericin2蛋白对于B84茧层丝胶整体属性会有多大的影响,但是可以肯定的是,含有大量Sericin2蛋白的B84茧层丝胶与普通品种的茧层丝胶相比,整体的β结构含量偏低,丝胶的粘合强度较弱,因此茧丝易于从茧层中被剥离出来,最终使B84蚕茧表现出优异的解舒性能。
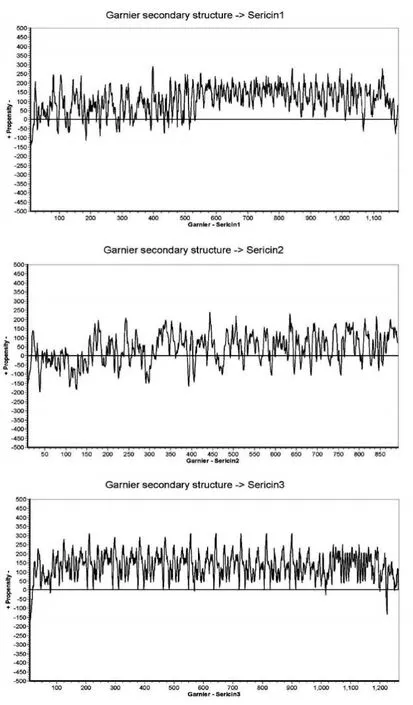
图2 从丰一和B84茧层中鉴定得到的3种主要丝胶蛋白的无规卷曲(random coil)预测图Figure 2 Random coil calculation of three sericin proteins in cocoon shells of Fengyi and B84
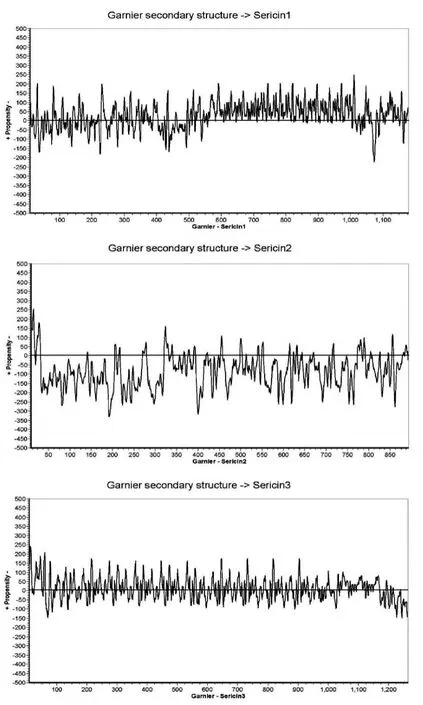
图3 从丰一和B84茧层中鉴定得到的3种主要丝胶蛋白的β片层(β-sheet)预测图Figure 3 β-sheet calculation of three sericin proteins in cocoon shells of Fengyi and B84
[1]DU X,LI J,CHEN Y Y.Proteomic analysis of sericin in Bombyx mori cocoons[J].Biotechnology and Bioprocess Engineering,2011,16(3):438-444.
[2]TAKASU Y,YAMADA H,TAMURA T,et al.Identifica⁃tion and characterization of a novel sericin gene ex⁃pressed in the anterior middle silk gland of the silkworm Bombyx mori[J].Insect Biochemistry and Molecular Biol⁃ogy,2007,37(11):1234-1240.
[3] 朱良均,姚菊明.家蚕茧解舒机理的研究[J].蚕业科学,1998,24(1):15-18.
[4] 朱良均,姚菊明.桑蚕茧解舒研究的进展(1)[J].丝绸,1998:44-46.
[5] 朱良均,姚菊明.桑蚕茧解舒研究的进展(2)[J].丝绸,1998:47-49.
[6]KLUDKIEWICZ B,TAKASU Y,FEDIC R,et al.Struc⁃ture and expression of the silk adhesive protein Ser2 in Bombyx mori[J].Insect Biochemistry and Molecular Biol⁃ogy,2009,39(12):938-946.
[7] 朱良均.家蚕茧解舒优劣的检测研究[J].纺织学报,2000,21(5):306-308.
Relationshipbetween the Sericin Protein Components of Cocoon Shell and Cocoon Reelability
Du Xin1,Chen Yu-Yin2,Wang Yong-Qiang1*
(1.Sericultural Research Institute,Zhejiang Academy of Agricultural Science,Hangzhou 310021,China;
2.College of Animal Sciences,Zhejiang University,Hangzhou 310029,China)
The structure of sericin protein directly influences the cocoon reelability.Sericin mutant strainB84 has excellent cocoon reelability with specific Sericin2 protein in its cocoon shell.In the research,we found that Sericin2 protein has stronger hydrophilicity and lower β structure content than Sericin1 and Sericin3 protein,which make the cocoon of B84 easier to unwind.
sericin protein;reelability;hydrophobicity;secondary structure
S886
A
0258-4069[2017]01-032-03
浙江省自然科学基金项目(Q13C170002)
杜鑫(1983-),男,浙江东阳人,助理研究员,主要从事家蚕遗传育种与分子生物学。E-mail:duxin1226@sina.com
王永强,男,研究员。E-mail:osan@sina.com

