GC-MS、RP-HPLC 法测定奇亚籽中脂溶性成分及氨基酸含量
李晓娇,何忠梅,*,郑京玉,祝洪艳,赵岩,张连学
(1.吉林农业大学中药材学院,吉林长春130118;2.吉林省人参工程技术创新中心,吉林长春130118)
GC-MS、RP-HPLC 法测定奇亚籽中脂溶性成分及氨基酸含量
李晓娇1,2,何忠梅1,2,*,郑京玉1,2,祝洪艳1,2,赵岩1,2,张连学1,2
(1.吉林农业大学中药材学院,吉林长春130118;2.吉林省人参工程技术创新中心,吉林长春130118)
分析奇亚籽中脂溶性成分并建立一种柱前衍生-反相高效液相色谱法检测奇亚籽中游离氨基酸及总氨基酸的含量。采用气质联用的方法对奇亚籽中脂溶性成分进行分析,采用高效液相色谱法,以异硫氰酸苯酯进行柱前衍生,采用梯度洗脱,于254 nm波长处检测21种氨基酸含量。挥发油中鉴定出化学成分14个,其中亚麻酸的含量最高可达83.41%。21种氨基酸在0.005 0 mmol/L~3.250 0 mmol/L内呈良好的线性关系(R2≥0.999 0)。21种游离氨基酸的平均加样回收率在93.68%~102.36%之间,RSD在0.91%~2.76%之间(n=6);水解氨基酸的平均加样回收率在94.86%~105.73%之间,RSD在0.75%~2.83%之间(n=6)。奇亚籽脂溶性成分主要为脂肪酸,其中含量最高的为O-mega3多不饱和脂肪酸α-亚麻酸,柱前衍生反向高效液相色谱法经方法学验证具有良好的重复性和稳定性,适用于奇亚籽中氨基酸含量的测定。
奇亚籽;气相色谱-质谱联用(GC-MS);反相高效液相色谱(RP-HPLC);脂溶性成分;氨基酸
近年来随着人们生活水平的不断提高,健康已经成为人类前进与发展的主要目标。真正的健康不是依靠药物来维持,而是通过科学的营养搭配来起到最主要的作用。而奇亚籽作为一种新型“超级食品”,越来越受到大家的关注。奇亚籽为唇形科鼠尾草属芡欧鼠尾草(Salvia Hispania L.)的种子,原产于墨西哥南部和瓜地马拉北部[1],食用历史可追溯到公元前3500年[2]。研究表明,奇亚籽富含的多不饱和脂肪酸、氨基酸、维生素、矿物质等营养成分在抗氧化、降血脂、改善心血管等方面起到了重要作用[3-4]。其中多不饱和脂肪酸是细胞膜的重要成分,具有促进脂类分解、提高机体免疫、预防心血管疾病等功能[5],另外氨基酸不仅是合成蛋白质的原料,还具有调控基因表达、调节组织生长发育及营养物质代谢等重要作用[6]。在2014年中华人民共和国国家卫生和计划生育委员会发布的第10号关于批准塔格糖等6种新食品原料的公告中,奇亚籽作为一种新型食品原料进入了国人的视线。为了确保其安全性和有效性,本文首次采用气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)对奇亚籽脂溶性成分进行分析并用柱前衍生反相高效液相色谱(reversed phase high performance liquid chromatography,RP-HPLC)法对奇亚籽中21种氨基酸的含量进行测定,旨在为奇亚籽在我国的进一步研究利用提供合理性依据。
1 材料
1.1 材料与试剂
奇亚籽:北京蔻奇亚国际贸易有限公司,经吉林农业大学张连学教授鉴定为芡欧鼠尾草(Salvia Hispania L.)的种子;21种氨基酸标准品:上海源叶生物科技有限公司;色谱乙腈:美国Fisher有限公司;水:娃哈哈纯净水。
1.2 仪器
1260高效液相色谱仪、气相色谱-质谱联用仪:美国安捷伦科技公司;BSA224S分析天平:德国赛多利斯公司;全新气流式超微粉机:欣镇企业有限公司;KQ-600KDB型高功率数控超声波清洗器:昆山市超声仪器有限公司;SHZ-D(Ⅲ)循环水式多用真空泵:巩义市英峪仪器厂;DK-98-Ⅱ电热恒温水浴锅:天津市泰斯特仪器有限公司;DZF6020真空干燥器:上海一恒科学仪器有限公司;氨基酸水解管:北京康农科技发展有限公司。
2 试验方法
2.1 脂溶性成分分析
2.1.1 奇亚籽脂溶性成分制备
将奇亚籽粉碎并过60目筛,取50 g奇亚籽粉末于烧杯中,加入石油醚500 mL,于35℃条件下超声提取两次,每次30 min,合并滤液于70℃水浴蒸干,得到黄色油状物,计算奇亚籽脂溶性成分含量为31.1%。取少量奇亚籽脂溶性成分于5 mL离心管,加入适量CaCl2,在65℃条件下放置1h,使其彻底干燥。在该样品中加入250 μL硅烷化试剂双(三甲基硅烷)三氟乙酰胺[Bis(trimethylsilyl)trifluoroacetamide,BSTFA],75℃衍生化1.5 h。
2.1.2 GC-MS分析条件
气相色谱条件:HP-35ms毛细管柱(30.0m×0.25mm× 0.25 μm);载气为He,流速为1 mL/min;进样量为1 μL;分流比60∶1。
测试条件:进样口温度280℃,柱温60℃,保持1 min,10℃/min升温至180℃,保持1min,再以20℃/min升温至280℃,保持5 min。
质谱条件:电子轰击(EI)源,电压70 eV;扫描范围20 amu~100 amu,质谱数据库N IST05。
2.2 氨基酸含量测定
2.2.1 色谱条件
采用 Ultimate Amino Acid氨基酸色谱专用柱(4.6 mm×250 mm,5 μm),柱温35℃,波长254 nm。流动相A:乙腈-水(80:20,体积比);流动相B:醋酸钠缓冲溶液(pH 6.5)-乙腈(93∶7,体积比)。线性梯度洗脱条件为:0 min,0%A;7 min,3.5%A;10 min,4.0%A;15 min,6.5%A;18 min,11.0%A;22 min,13.4%A;34 min,30%A;37 min,68%A;42 min,100%A;49 min,100%A;52 min,0%A。流速1.0 mL/min。
2.2.2 溶液的配制
2.2.2.1 衍生试剂配制
衍生试剂A:取三乙胺1.4 mL,加乙腈8.6 mL,混匀,4℃保存;衍生试剂B:取异硫氰酸苯酯100 μL,加乙腈8 mL,混匀,4℃保存。
2.2.2.2 对照品溶液的配制与衍生
称取一定质量的天冬氨酸(Asp)、谷氨酸(Glu)、天冬酰胺(Asn)、丝氨酸(Ser)、谷氨酰胺(Gln)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、半胱氨酸(Cys)、酪氨酸(Tyr)、缬氨酸(Val)、蛋氨酸(Met)、胱氨酸(Cys-Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、色氨酸(Trp)、赖氨酸(Lys),加0.1 mol/L盐酸超声溶解,配制成除天冬氨酸、谷氨酸和半胱氨酸质量浓度分别为3.25、3.11、3.24 mmol/L外,其他氨基酸浓度为2.5 mmol/L的混合氨基酸对照品溶液,4℃保存。
精确吸取混合氨基酸对照品溶液400 μL,置于5 mL离心管中,加入衍生试剂A和B各200 μL,摇匀,静置1 h,加入正己烷800 μL,振摇后放置10 min,取下层溶液,0.45 μm滤膜滤过,取6 μL进行色谱分析。
2.2.2.3 供试品溶液的配制与衍生
1)游离氨基酸供试品溶液的制备
精密称定奇亚籽样品粉末2.0 g,加入50%乙醇溶液200 mL,超声提取两次,每次30 min,合并滤液于80℃水浴挥至近干,用纯净水定容至10 mL。取1 mL提取液,置于5 mL离心管中,加入衍生试剂A 100 μL,衍生试剂B100μL,摇匀,静置1h,加入正己烷400μL,振摇后放置10 min,取下层溶液,0.45 μm滤膜滤过,取6 μL进行色谱分析。
2)总氨基酸供试品溶液的制备
精密称定奇亚籽样品粉末1.0 g,加入6 mol/L的盐酸水溶液10 mL、1%的苯酚1 mL,抽真空,重复3次,于110℃烘箱中水解24 h,过滤得水解液,水解液于80℃水浴挥干,加入适量纯净水超声溶解,并用3 mol/L的NaOH溶液调节溶液pH值近中性,最后用纯净水定容至10 mL。吸取奇亚籽样品定容液1 mL于5 mL离心管中,加入衍生试剂A 100 μL,衍生试剂B 100 μL,摇匀,静置1 h,加入正己烷400 μL,振摇后放置10 min,取下层溶液,0.45 μm滤膜滤过,取6 μL进行色谱分析。
2.2.3 线性关系考察
分别将“2.2.2.2”项下的混合氨基酸对照品溶液稀释为原来的1、3/4、1/2、1/4、1/8、1/20、1/50、1/100、1/500倍,并按操作方法进行衍生,取6μL进行色谱分析。以各氨基酸峰面积积分值(y)为纵坐标,浓度(x,mmol/L)为横坐标,进行线性回归,可得18种氨基酸的检测浓度在0.0050mmol/L~2.5000mmol/L范围内,天冬氨酸、谷氨酸和半胱氨酸的检测浓度分别在0.006 5 mmol/L~3.250 0 mmol/L、0.006 2 mmol/L~3.110 0 mmol/L、0.006 5 mmol/L~3.240 0 mmol/L范围内与各自峰面积积分值呈良好的线性关系。21种氨基酸的线性回归方程及R2值见表1。
2.2.4 精密度试验
取混合氨基酸对照品溶液400 μL,按“2.2.2.2”项下方法衍生后连续进样6次,测定峰面积。结果:21种氨基酸峰面积的RSD在0.26%~1.93%之间(n=6),表明仪器精密度良好。

表1 21种氨基酸的线性关系Table 1 Linear regression equation of the 21 kinds of amino acids
2.2.5 稳定性试验
取“2.2.2.3”项下奇亚籽供试品溶液1 mL,衍生后分别于0、2、4、8、12、24 h进样,测定峰面积。结果:奇亚籽中21种氨基酸峰面积的RSD为0.48%~2.02%(n=6);表明奇亚籽供试品溶液在24 h内比较稳定。
2.2.6 重复性试验
取同一批奇亚籽样品6份,按“2.2.2.3”项下方法制备游离氨基酸和总氨基酸的供试品溶液并衍生后,按上述色谱条件进样测定峰面积,计算氨基酸含量。结果:在奇亚籽中,21种游离氨基酸百分含量的RSD值在1.01%~2.33%之间(n=6),测定总氨基酸的21种氨基酸百分含量的RSD在0.59%~2.51%之间(n= 6)表明本方法具有良好的重复性。
2.2.7 加样回收率试验
2.2.7.1 游离氨基酸回收率试验
取样品1.0 g,精密称定,共取6份,分别加入混合氨基酸对照品适量(1 mL),按“2.2.2.3”项下1)游离氨基酸检测方法分别提取、衍生、进样,平行6次,计算各氨基酸的回收率。结果:21种游离氨基酸的平均回收率在93.68%~102.36%之间,RSD在0.91%~2.76%之间(n=6)。
2.2.7.2 总氨基酸回收率试验
取样品0.5 g,精密称定,共取6份,分别加入混合氨基酸对照品适量(2 mL),按照“2.2.2.3”项下2)总氨基酸检测方法分别提取、衍生、进样,平行6次,计算各氨基酸的回收率。结果:21种总氨基酸的平均回收率在94.86%~105.73%之间,RSD在0.68%~2.73%之间(n=6)。
2.3 样品测定结果
2.3.1 奇亚籽脂溶性成分测定结果
对奇亚籽脂溶性成分的检测结果见图1。
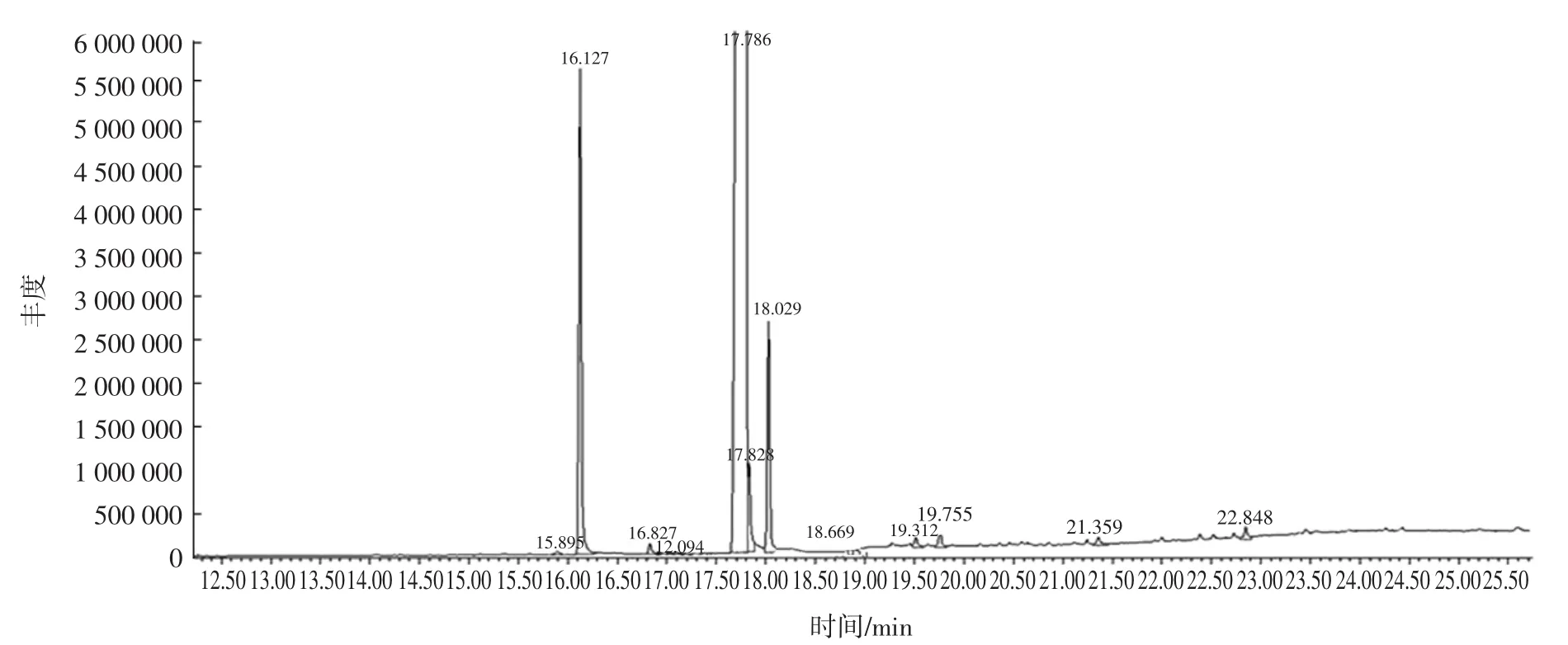
图1 奇亚籽脂溶性成分GC-MS分析结果Fig.1 Analysis of the liposoluble constituent of chia seeds by GC-MS
奇亚籽脂溶性成分组成见表2。
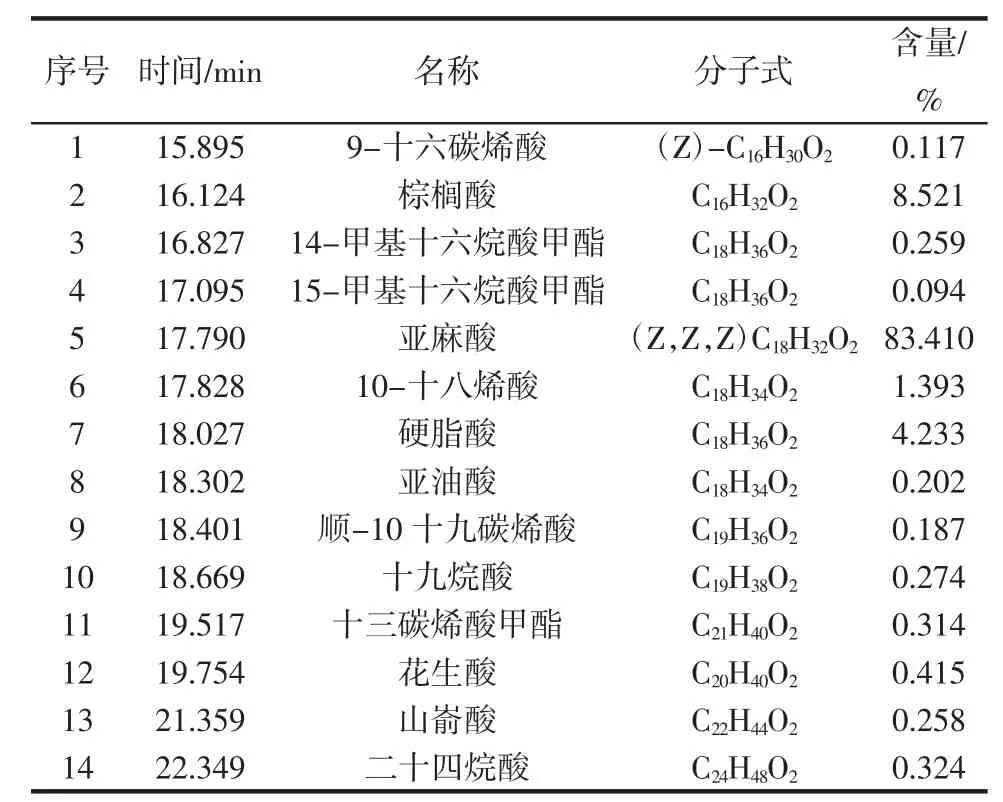
表2 奇亚籽脂溶性成分组成Table 2 The components of the liposoluble constituent of chia seeds by GC-MS
奇亚籽脂溶性成分测定结果如图1和表2所示,脂溶性成分主要为亚麻酸,含量最高可达83%。亚麻酸是一种ω-3系列多不饱和脂肪酸,目前研究主要存在于深海鱼油中。
2.3.2 奇亚籽种氨基酸检测结果
按“2.2”项下方法制备21种氨基酸混合对照品溶液、奇亚籽供试品溶液、空白溶液,取上述溶液各6 μL进样,分别测定并计算其游离氨基酸和总氨基酸含量,色谱图见图2。
奇亚籽中游离和水解氨基酸的种类和含量测定结果见表3。
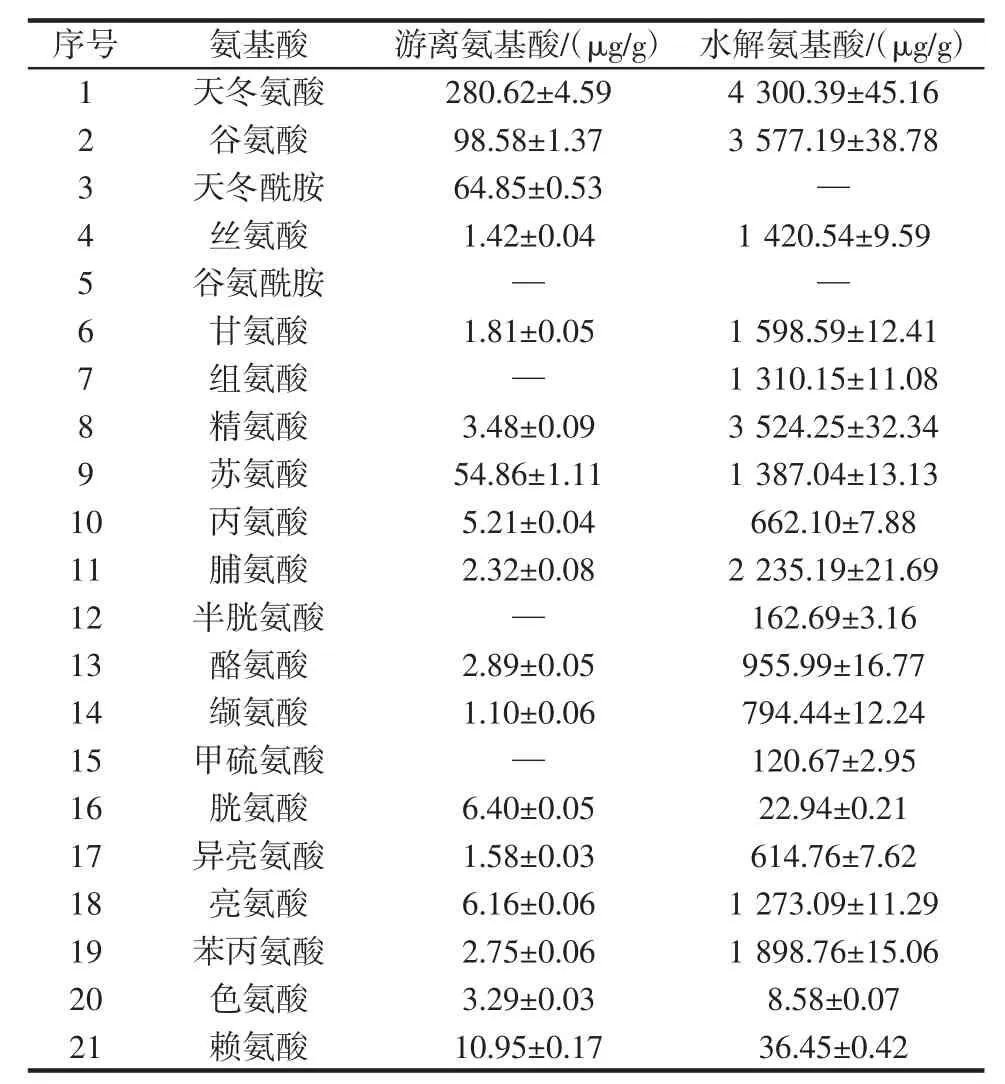
表3 奇亚籽中游离和水解氨基酸的种类和含量测定结果(x±s)Table 3 Species and content of the free amino acids and hydrolyzed amino acids in chia seeds
从表3中得出,奇亚籽中检测到的游离氨基酸总量为:548.27 μg/g;总氨基酸总量为:25 903.81 μg/g。奇亚籽中检测到游离氨基酸种类为17种,其中含7种人体必需氨基酸;总氨基酸种类为19种,其中含8种人体必需氨基酸。
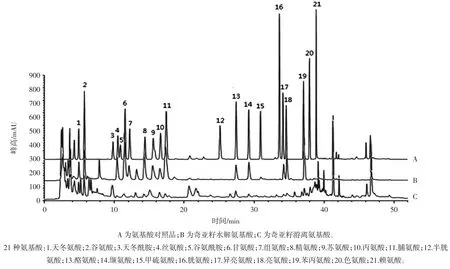
图2 奇亚籽氨基酸HPLC分析结果Fig.2 Analysis of the amino acids of chia seeds by HPLC
3 讨论
本文采用GC-MS法从奇亚籽脂溶性成分中共分析出14种成分,其中含量最高的为ω-3-亚麻酸,占脂溶性成分的84.41%。多项研究表明,经常食用或将ω-3多不饱和脂肪酸作为饮食补充剂可以带来许多健康益处,包括预防心血管疾病,高血压以及炎症性疾病等[7-8]。与亚麻酸相比,ω-6-亚油酸的来源更广泛。研究表明,摄入过多的ω-6系列多不饱和脂肪酸可能导致促进炎症的发生,并进一步降低机体免疫力[9]。奇亚籽中的亚麻酸可以提高饮食中ω-3/ω-6比例,且可以转化成二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)。DHA有脑黄金之称,是大脑发育必不可少的不饱和脂肪酸,目前DHA与EPA的来源主要是海藻和深海鱼油[10-11],但是这两种来源提炼成本高,而奇亚籽含有已知自然资源中最高比例的ω-3-亚麻酸[12]。目前氨基酸的测定主要包括氨基酸自动分析仪分析法、高效液相色谱法[13]、毛细管电泳法[14]和紫外检测法等,其中应用最广的就是高效液相色谱法。有研究报道通过氨基酸分析仪对奇亚籽18种氨基酸含量进行了测定,但是并未检测其游离氨基酸含量,无法全面地反映奇亚籽中氨基酸的含量[15]。本文通过RP-HPLC法测得奇亚籽中游离氨基酸含量为:548.27 μg/g、总氨基酸总量为:25 903.81 μg/g。其中含量最高的为天冬氨酸、谷氨酸和精氨酸。其中天冬氨酸和谷氨酸能够改善心肌缺血、促进有氧代谢的恢复,在心肌保护中起到了重要的作用[16]。精氨酸是目前发现的动物细胞内功能最多的氨基酸,其在细胞分裂、伤口复原和分泌激素等方面均起着重要的作用,而且能够提高机体免疫力并促进肌肉合成[17]。由此可得,奇亚籽有很大的营养价值,值得进一步开发与利用。
[1]Ayerza R.Oil content and fatty acid composition of chia(Salvia hispanica L.)from five northwestern locations in Argentina[J].Journal of the American Oil Chemists'Society,1995,72(9):1079-1081
[2]Steffolani E,Martinez M M,León A E,et al.Effect of pre-hydration of chia(Salvia hispanica L.),seeds and flour on the quality of wheat flour breads[J].LWT-Food Science and Technology,2015,61(2):401-406
[3]Ayerza R,Coates W.Composition of chia(Salvia hispanica)grown in six tropical and subtropical ecosystems of South America.[J].Tropical Science,2004,44(3):131-135
[4]Reyescaudillo E,Tecante A,Valdivialopez M A.Dietary fibre content and antioxidant activity of phenolic compounds present in Mex-ican chia(Salvia hispanica L.)seeds[J].Food Chemistry,2008,107 (2):656-663
[5]张永刚,印遇龙,黄瑞林,等.多不饱和脂肪酸的营养作用及其基因表达调控[J].食品科学,2006,27(1):273-277
[6]王洪荣,季昀.氨基酸的生物活性及其营养调控功能的研究进展[J].动物营养学报,2013,25(3):447-457
[7]Albert C M,Oh K,Whang W,et al.Dietary alpha-linolenic acid intake and risk of sudden cardiac death and coronary heart disease[J]. Circulation,2005,112(21):3232-3238
[8]Garg M L,Wood L G,Singh H,et al.Means of delivering recommended levels of long chain n-3 polyunsaturated fatty acids in human diets[J].Journal of Food Science,2006,71(5):66-71
[9]田雨,田玉玲,李俊霞,等.饮食多不饱和脂肪酸ω-3/ω-6比值对小鼠实验性结肠炎的影响[J].北京大学学报(医学版),2013,45 (2):227-232
[10]鲍建民.多不饱和脂肪酸的生理功能及安全性[J].中国食物与营dant potential of pomegranate after long-term storage at 2℃[J].A-gricultural and Food Chemistry,2010,58:6804-6808
[14]Nyanjage M O,Wainwright H,Bishop C F H.Effects of hot-water treatment and storage temperature on electrolyte leakage of mangoes (Mangifera indica Linn.)[J].Horticultural Science and Biotechnology,1999,74:566-572
[15]Ding Z S,Tiana S P,Zhenga X L,et al.Responses of reactive oxygen metabolism and quality in mango fruit to exogenous oxalic acid or salicylic acid under chilling temperature stress[J].Physiologia Plantarum,2007,130:112-121
[16]Zheng X,Tian S,Gidley M J,et al.Slowing the deterioration of mango fruit during cold storage by pre-storage application of oxalic acid [J].HorticulturalScienceandBiotechnology,2007,82:707-714
[17]Li X W,Jing P,Wang J,et al.1-Methylcyclopropene delays postharvest ripening and reduces decay in Hami melon[J].Journal of Food Quality,2011,34:119-125
[18]Tin O W,Varit S,Julian H,et al.Effects of different concentrations of 1-MCP on the yellowing of West Indian lime(Citrus aurantifolia, Swingle)fruit[J].Postharvest Biology Technology,2006,42:23-30养,2006(1):45-46
[11]黄俊辉,曾庆孝.南海海域数种海藻总脂质及脂肪酸含量的比较[J].湛江海洋大学学报,2001,21(2):23-29
[12]Coates W,Ayerza R.Production potential of chia in northwestern Argentina[J].Industrial Crops&Products,1996,5(3):229-233
[13]赵岩,侯莹莹,唐国胜,等.柱前衍生RP-HPLC测定淫羊藿中氨基酸含量[J].药物分析杂志,2014,34(8):1412-1416
[14]赵雅静.微波衍生毛细管电泳法测定金银花和奶粉中的氨基酸[D].长春:吉林大学,2013
[15]荣旭,陶宁萍,李玉琪,等.奇亚籽营养成分分析与评价[J].中国油脂,2015,40(9):89-93
[16]祝忠群.谷氨酸、天门冬氨酸与心肌保护[J].心血管病学进展, 1997,18(1):47-50
[17]彭瑛,蔡力创.精氨酸的保健作用及其调控研究进展[J].湖南理工学院学报(自然科学版),2011,24(1):59-62
收稿日期:2016-11-25
Determination the Contents of Liposoluble Constituent and Amino Acids in Chia Seeds by GC-MS,RP-HPLC Methods
LI Xiao-jiao1,2,HE Zhong-mei1,2,*,ZHENG Jing-yu1,2,ZHU Hong-yan1,2,ZHAO Yan1,2,ZHANG Lian-xue1,2
(1.College of Chinese Medicinal Materials,Jilin Agricultural University,Changchun 130118,Jilin,China;2.Technology Innovation Center of Jilin Ginseng Project,Changchun 130118,Jilin,China)
To investigate the liposoluble constituent and determinate the contents of 21 kinds of free and hydrolyzed amino acids in chia seeds by pre-column derivatization reversed phase high-performance liquid chromatography(RP-HPLC).The liposoluble constituent in samples were identified and determined by gas chromtography-mass spectrometry(GC-MS).The samples were derived with phenyl isothiocyanate and detected by RP-HPLC.The contents of 21 kinds of free and hydrolyzed amino acids in chia seeds were determined by gradient elution chromatography at the wavelength 254 nm.Fourteen compounds were separated in the liposoluble constituent of chia seeds,and the content of linolenic acid could up to 83.41%.There was a good linear relationship of the 21 kinds of amino acids in the range of 0.0050 mmol/L-3.2500 mmol/L(the coefficients of correlation were all over 0.9990).The average recoveries of 21 kinds of free amino acids were 93.68%-102.36%(RSD=0.91%-2.76%,n=6);while the average recoveries of 21 kinds of hydrolyzed amino acids were 94.86%-105.73%(RSD=0.75%-2.83%,n=6).The main component in the liposoluble constituent of chia seeds was unsaturated fatty acid,while the content of O-mega3-linolenic acid was hightest.The methodology validation showed that the method of pre-column derivatization RP-HPLC was suitable for determination of free and hydrolyzed amino acids in chia seeds.
chia seeds;gas chromatography-mass spectrometer(GC-MS);reversed phase high performance liquid chromatography(RP-HPLC);liposoluble constituent;amino acids
2016-11-20
李晓娇(1989—),女(汉),硕士,研究方向:植物成分分析及产品开发。
*通信作者:何忠梅,女,副教授,研究生导师,博士,主要从事植物药有效成分及其作用机制研究工作。
10.3969/j.issn.1005-6521.2017.16.036

