花果山云雾茶中多酚和多糖的超声同步提取工艺
郭雷,郭家才,郑洪伟
(1.江苏省海洋生物技术重点实验室,海洋生命与水产学院,淮海工学院,江苏连云港222005;2.江苏省海洋资源开发研究院,江苏连云港222004)
花果山云雾茶中多酚和多糖的超声同步提取工艺
郭雷1,2,郭家才1,郑洪伟1
(1.江苏省海洋生物技术重点实验室,海洋生命与水产学院,淮海工学院,江苏连云港222005;2.江苏省海洋资源开发研究院,江苏连云港222004)
研究花果山云雾茶中茶多酚和茶多糖的超声辅助同步提取工艺并评价提取物的抗氧化活性。在单因素试验的基础上,响应面分析法优化的提取工艺为:超声功率500 W,提取温度80℃,提取时间37 min,液料比62∶1(mL/g)。在优化的条件下,茶多酚和茶多糖的得率分别为(137.08±3.37)mg/g和(57.71±1.94)mg/g。固态提取物的得率为(2.51±0.27)%,其中茶多酚和茶多糖的含量分别为(548.31±13.48)mg/g和(227.28±6.44)mg/g。通过测定提取物的还原力、抗氧化力和对DPPH自由基、羟自由基及超氧阴离子自由基的清除能力评价其抗氧化活性,结果显示提取物具有较强的还原力和总抗氧化力及清除DPPH自由基、羟自由基和超氧阴离子自由基的活性。
花果山云雾茶;茶多酚;茶多糖;响应面分析法;抗氧化活性
antioxidant activity
茶是植物茶树(Camellia sinensis)的叶子,是全球消费量仅次于水的饮料。依据其发酵程度的不同,可将茶分为绿茶(未发酵),乌龙茶(部分发酵)和黑茶(发酵)[1-2]。其中,绿茶是在中国和日本最流行的种类[3]。中国绿茶来源于600多个茶树品种,具有丰富的种类,如龙井,碧螺春,毛峰,毛尖,雨花茶,云雾茶等。
绿茶含有丰富的活性成分如茶多酚(tea polyphenols,TPP),茶多糖(tea polysaccharides,TPS)和茶氨酸(theanine)等。茶多酚是茶叶中多酚类物质的总称,其中儿茶素是茶叶中含量最多的多酚类物质,被认为是绿茶中主要的活性成分之一[4]。体外和动物实验研究表明茶多酚具有多种生物活性,如抗氧化[5],抗炎[6],抗肿瘤[7],抗菌[8],抗病毒[9],抗辐射[10],提高免疫功能[11],降血脂[12],保护神经及其他药理活性[13-14]。茶多糖是绿茶中另一类主要活性成分。现代药理研究表明茶多糖具有广泛的生理活性,如降血糖[15],降血脂[16],抗氧化[17],抗凝集[18],提高免疫力和保护皮肤等[19-21]。基于此,茶多酚和茶多糖被认为是有前途的天然药物。
花果山云雾茶历史悠久,是我国名贵绿茶之一,因其生长在崇山峻岭之上,云雾缭绕之中,故称之为“云雾茶”。花果山属于云台山脉,而云台山自古就被称为“茶山”。迄今为止,有关花果山云雾茶中茶多酚和茶多糖的提取和生物活性的研究未见报道。本研究应用Box-Behnken试验设计和响应面分析法优化超声辅助同步提取花果山云雾茶中茶多酚和茶多糖的工艺,并评价了提取物的抗氧化活性,以期为花果山云雾茶的进一步研究提供依据。
1 材料与方法
1.1 材料与仪器
花果山云雾茶:购自江苏省连云港市当地茶叶经销部;总抗氧化力测定试剂盒:南京建成生物技术研究所;福林酚试剂:上海荔达生物科技有限公司;DPPH(1,1-二苯基-2-苦肼基)、没食子酸:美国Sigma公司;其它化学试剂均为分析级。
SK8210LHC型超声清洗仪(40 kHz):上海科导超声仪器有限公司;DHG-9240A型电热鼓风干燥箱:上海一恒科学仪器有限公司;QJ32W1000A型高速万能粉碎机:天津泰斯特仪器有限公司;BS 124S型电子分析天平:北京赛多利斯科学仪器有限公司;Synergy HT型多功能酶标仪:美国BioTek仪器有限公司;DDL-5M型离心机:上海卢湘仪离心机仪器有限公司。
1.2 方法
1.2.1 提取过程
茶叶粉碎后过40目筛,将茶叶粉与一定比例的蒸馏水加入100 mL具塞三角瓶中,置于超声清洗仪中进行超声辅助提取(将三角瓶固定于提取仪中央,加热水位能超过三角瓶水位线)。提取液于5 000 r/min离心10 min,抽滤,滤液用于测定茶多酚和茶多糖的含量。
1.2.2 超声辅助提取工艺优化
Box-Behnken(BB)试验设计和响应面分析法用于优化超声辅助同步提取花果山云雾茶中茶多酚和茶多糖的工艺,Design Expert 7.0.0软件用于分析数据和建立模型。提取温度(X1),提取时间(X2)和液料比(X3)用于三因素三水平共17个试验的BB试验设计,茶多酚和茶多糖的得率作为响应值。下列方程式用来解释所构建的模型:
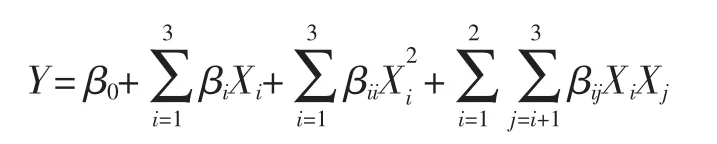
其中:Y代表响应变量;Xi和Xj是独立变量;β0、βi、βii和βij分别代表截距、线性、二次和交互回归系数。
1.2.3 多酚含量测定
茶多酚含量测定采用福林酚法,没食子酸为标准对照[22]。将1.0 mL待测液加入装有1.0 mL福林酚试剂(0.2mol/L)的试管内,振摇5min,然后加入2.0 mL 7.5% Na2CO3溶液,振摇,25℃下反应1 h后,吸取上清液200 μL于96孔板内,754 nm处测定吸光度。茶多酚含量以没食子酸当量表示(mg/g)。
1.2.4 多糖含量测定
茶多糖含量测定采用硫酸苯酚法,葡萄糖为标准对照[23]。将1.0 mL待测液与1.0 mL 5%苯酚相混匀,迅速加5.0 mL浓硫酸,室温放置30 min,吸取150 μL于96孔板内,于490 nm处测定吸收度。茶多糖含量以葡萄糖当量表示(mg/g)。
1.2.5 还原力测定
提取物的还原力测定参考文献[24]进行。将1.0 mL待测液加入10 mL EP离心管中,分别加入1.0 mL磷酸缓冲溶液(0.2 mol/L,pH6.6)及1.0 mL铁氰化钾水溶液(1%),50℃水浴20 min后取出快速冷却,加入1.0 mL三氯乙酸水溶液(10%),摇匀,5 000 r/min离心10 min。取1.0 mL上清液,依次加入1.0 mL蒸馏水,0.5 mL三氯化铁水溶液(0.1%),充分混匀,放置10 min后,吸取200 μL于96孔板内,测定其在700 nm处的吸光度值。吸光度越大,说明还原能力越强。
1.2.6 总抗氧化力测定
总抗氧化力测定采用试剂盒进行,一个单位的总抗氧化力定义为37℃时,每分钟每毫升待测样品液吸光度增加0.01。按标准操作规程加入相应试剂,混匀,放置10 min,取反应液200 μL加入96孔酶标板内,在520 nm处测定吸光度。总抗氧化力根据下面的公式计算得出:Y=(As-Ac)×Vt×Vs×C/(0.01×30)。
式中:As和Ac分别表示样品和对照的吸光度;Vt和Vs分别表示反应液和样品液的体积,mL;C表示样品的稀释倍数。
1.2.7 DPPH自由基清除活性测定
DPPH自由基清除活性测定参考文献[25]进行。将100 μL待测液加入96孔板中,再加入100 μL的0.2 mmol/L DPPH溶液,摇匀。20 min后在517 nm测定其吸光度Ai,同时测定100 μL蒸馏水与2×10-4mol/L DPPH溶液的吸光度Ac,以及待测液与等体积无水乙醇混合液的吸光度Aj。根据公式计算清除率:Y=(Ac-Ai+Aj)×100/Ac。
1.2.8 羟自由基清除活性测定
羟自由基活性测定参考文献[26]进行。将50 μL待测液,50 μL 9 mmol/L硫酸亚铁与50 μL 8.8 mmol/L H2O2于96孔酶标板充分混合后,分别加入50 μL 10 mmol/L水杨酸的乙醇溶液,摇匀,静置20 min,在508 nm处测定吸光度(Ai)。用蒸馏水代替样品液,测定得Ac。用蒸馏水代替H2O2溶液,测定得Aj。根据以下公式计算样品对羟自由基的清除活性:Y=(Ac-Ai+Aj)× 100/Ac。
1.2.9 超氧阴离子自由基清除活性测定
采用邻苯三酚自氧化方法测定提取物清除超氧阴离子自由基的活性[24]。取50 μL超纯水和100 μL 0.1 mol/L Tris-HCl缓冲液(pH7.3,内含2 mmol/L EDTA)加入96孔酶标板,充分混合后,于25℃保温 20 min后加入预热的50 μL 60 mmol/L邻苯三酚(以10 mmol/L HCl溶液配制),迅速摇匀,于319 nm波长处每隔50 s测定吸光度,测定启动后5 min内邻苯三酚自氧化的速率,记作ΔAc。以50 μL样品液代替超纯水,测定启动后5 min内样品抑制邻苯三酚自氧化的速率ΔAs。根据如下公式计算清除率:Y=(ΔAc-ΔAs)×100/ΔAc。
2 结果与分析
2.1 Box-Behnken试验设计优化提取工艺
单因素试验中,分别考察了超声功率(200 W~500 W)、提取温度(40℃~80℃)、提取时间(5 min~40 min)和液料比[20∶1(mL/g)~70∶1(mL/g)]对茶多酚和茶多糖得率的影响。基于单因素试验结果,固定超声功率500 W(100%),提取温度(X1),提取时间(X2)和液料比(X3)用于三因素三水平共17个试验的Box-Behnken(BB)试验设计来优化超声辅助同步提取花果山云雾茶中茶多酚和茶多糖的工艺,茶多酚(Y1)和茶多糖(Y2)的得率作为响应值(见表1)。
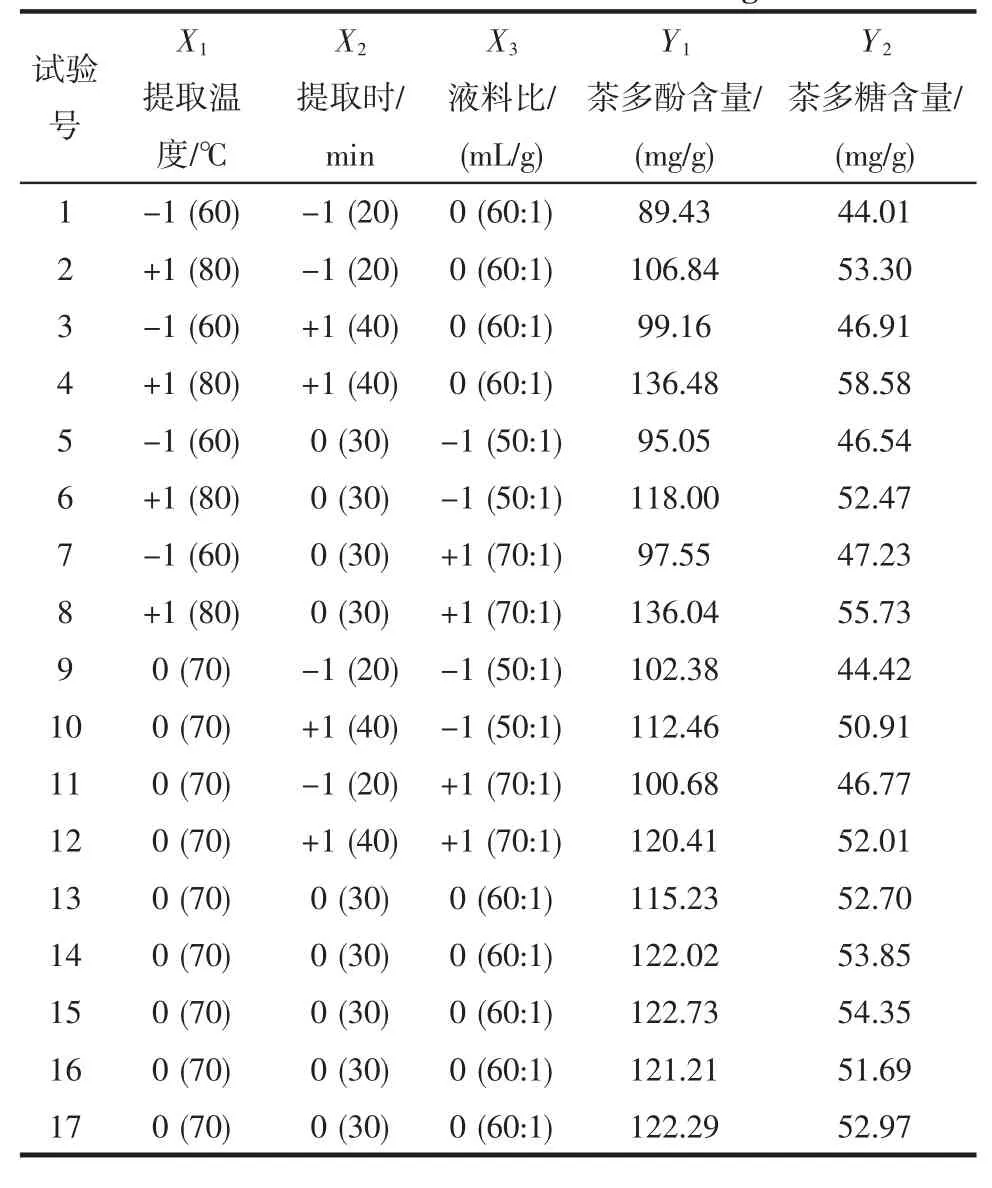
表1 Box-Behnken试验设计方案与结果Table 1 Coded(actual)levels of the operational parameters and observed values of Box-Behnken design
通过对试验数据进行多元回归分析,下列二阶多项式方程可以解释测试变量与响应变量之间的关系:
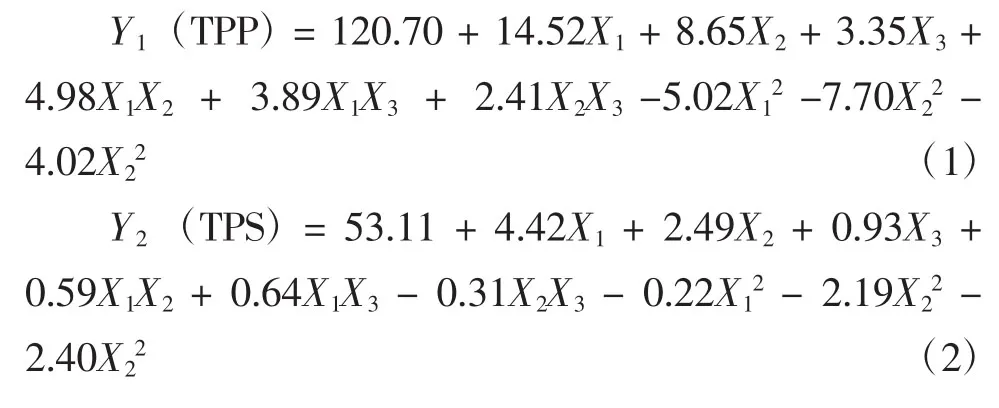
表2显示了BB试验设计数据的方差分析结果。从表2可以看出,模型的P值分别小于0.000 1(茶多酚)和等于0.0005(茶多糖),表明构建的2个模型均具有显著性。而2个模型的失拟项值均无显著性(P>0.05),说明所构建的2个模型能够用于变量优化的预测。2个模型的确定系数(R2)分别为0.973 9和0.959 2,显示模型可以充分呈现独立变量与相应变量之间的实际关系[25]。
模型的响应面图可以很好的考察变量对茶多酚和茶多糖得率的影响[27]。提取温度、提取时间、液料比和它们的相互作用对茶多酚和茶多糖得率的影响如图1所示。从表2和图1可以看出,提取温度对茶多酚和茶多糖得率具有显著的正向线性效应(P<0.000 1),随着提取温度的提高,茶多酚和茶多糖得率也随之增加。提取时间是另一个影响提取效率的重要因素。当
提取时间从20 min增加到37 min,茶多酚和茶多糖得率最高,随后茶多酚和茶多糖得率不再增加。此外,液料比对茶多酚的得率也有显著的影响(P=0.027 2),随着液料比从50∶1(mL/g)增加到62∶1(mL/g),茶多酚的得率达到最高值。液料比对茶多糖的得率影响不显著(P=0.077 7)。

表2 响应面分析试验方差分析结果Table 2 Analysis of variance for the quadratic response surface model
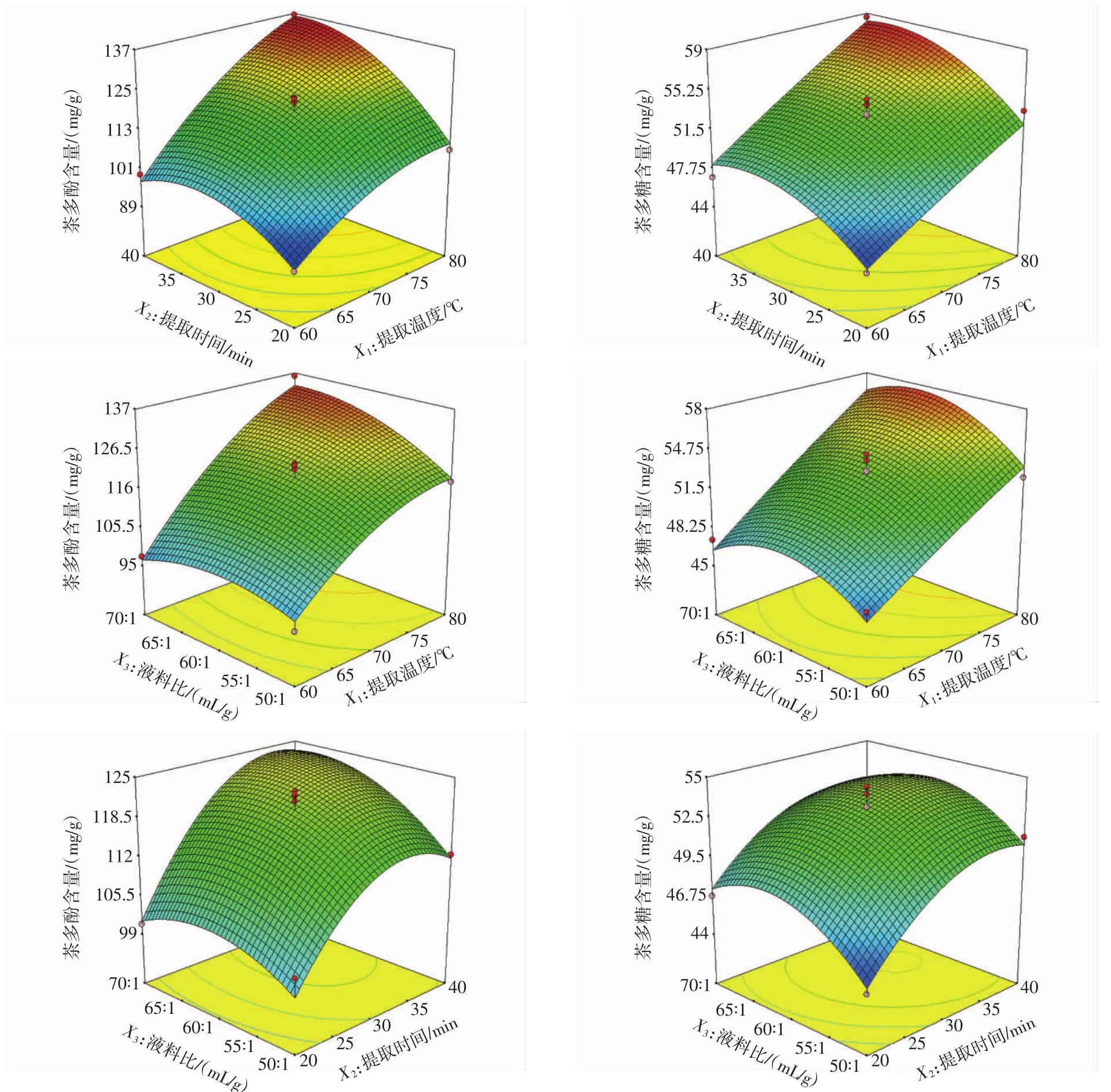
图1 提取温度与时间(a),温度与液料比(b),提取时间与液料比(c)交互作用影响茶多酚和茶多糖的响应曲面Fig.1 Response surface plots for the effects of temperature and time(a),temperature and liquid to material ratio(b),time and liquid to material ratio(c)on the yield of TPP and TPS missing value of in each plot kept at the center point
通过对方程(1)和(2)进行回归分析,模型预测的最佳提取工艺为:X1=80℃,X2=37min,X3=62∶1(mL/g),即超声功率500 W,提取温度80°C,提取时间37 min,液料比62∶1(mL/g),预测的茶多酚和茶多糖得率分别为137.81 mg/g和58.58 mg/g。在最佳提取条件下进行验证试验,茶多酚和茶多糖的实际得率分别为(137.08± 3.37)mg/g和(57.71±1.94)mg/g,与预测值没有显著差异,表明响应面分析法应用于优化超声辅助同步提取花果山云雾茶中茶多酚和茶多糖的工艺是可行的。
为评价超声辅助提取物的抗氧化活性,对利用上述优化工艺条件下获得的提取物进行减压浓缩蒸发和冷冻干燥,获得固态的超声辅助提取物(UAE),其得率为(2.51±0.27)%,其中茶多酚和茶多糖的含量分别为(548.31±13.48)mg/g和(227.28±6.44)mg/g UAE。进一步评价了固态的超声辅助提取物的抗氧化活性。
2.2 提取物的抗氧化活性
2.2.1 还原力和总抗氧化力
评价特定物质的抗氧化活性需要多个评价体系的试验结果,本研究通过还原力,总抗氧化力,对DPPH、羟基和超氧阴离子自由基的清除试验评价了提取物(UAE)的抗氧化活性。研究表明,物质的抗氧化能力与其还原力密切相关。在还原力测定试验中,抗氧化剂能够还原Fe3+成Fe2+,进而生成在700 nm波长处有最大吸收的普鲁士蓝复合物,吸光度越大,物质的还原力越强[28]。总抗氧化力测试试验中,Fe2+能与菲啉类物质形成在520 nm波长处有最大吸收的络合物,吸光度越大说明物质的总抗氧化能力越强。图2显示了花果山云雾茶提取物的还原力和总抗氧化力测试结果。从图2可以看出,随着提取物浓度的提高,其还原力和总抗氧化力也随之增加,但低于阳性对照维生素C。
2.2.2 DPPH自由基清除活性
DPPH自由基清除试验被广泛应用于抗氧化剂清除自由基活性的评价中[27]。本试验中,抗氧化剂清除DPPH自由基的能力取决于其作为氢供体的能力[29],花果山云雾茶提取物清除DPPH自由基的活性见图3。从图3可以看出,当浓度从0.031 25 mg/mL提高到0.5 mg/mL,提取物和维生素C对DPPH自由基的清除率分别从(69.54±2.12)%和(78.30±1.67)%增加到(78.30±1.67)%和(89.67±1.31)%,结果显示提取物具有显著的清除DPPH自由基的能力。
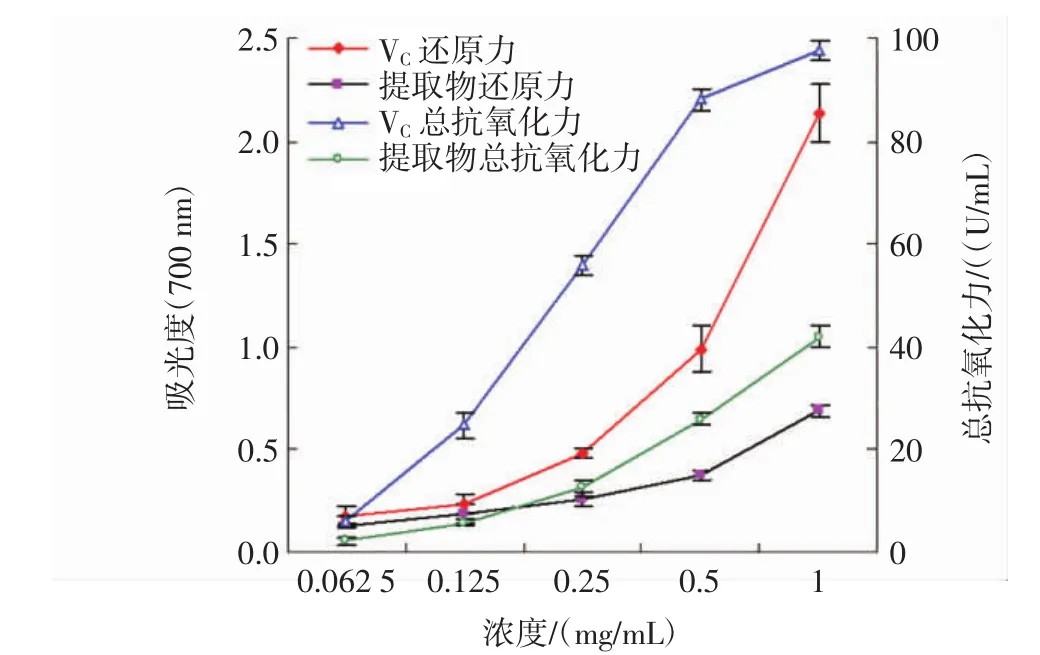
图2 花果山云雾茶提取物的还原力和总抗氧化力Fig.2 Reducing power and total antioxidant capability of UAE
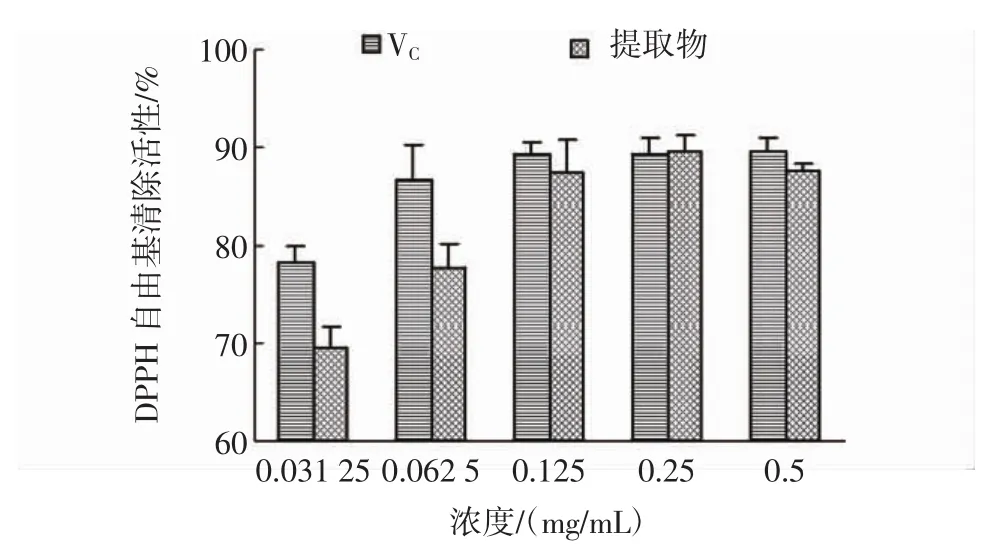
图3 花果山云雾茶提取物清除DPPH自由基的活性Fig.3 The DPPH free radical scavenging activity of UAE
2.2.3 羟自由基清除活性
羟自由基是生物体内最容易产生和最活跃的反应基团,能显著损伤几乎所有的生物大分子如蛋白质、糖类、脂类及核酸,从而导致机体的衰老和许多疾病的发生[30]。抗氧化剂能够通过螯合金属离子Fe2+和Cu2+来抑制羟自由基的产生,从而发挥其清除活性。羟自由基清除试验中,羟自由基能够通过Fe2+和H2O2反应而产生,抗氧化剂则通过螯合Fe2+降低了羟自由基的产生[25],花果山云雾茶提取物清除羟自由基的活性见图4。如图4所示,当提取物浓度从0.062 5 mg/mL增加到1.0 mg/mL,其清除羟自由基的活性从(10.96± 0.44)%提高到(56.21±0.75)%,显示提取物具有一定的羟自由基清除活性,但低于同浓度下维生素C的活性。
2.2.4 超氧阴离子自由基清除活性
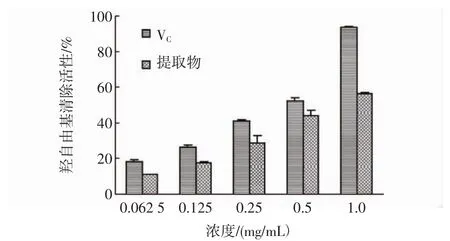
图4 花果山云雾茶提取物清除羟自由基的活性Fig.4 The hydroxyl free radical scavenging activity of UAE
超氧阴离子自由基是氧分子在氧化过程中呈单价还原而产生的中间代谢产物,是氧自由基连锁反应的启动者,诱导H2O2和羟自由基的产生,从而引发体内生物膜、激素及脂质过氧化,加速机体衰老,并可诱发疾病的发生[31]。花果山云雾茶提取物清除超氧阴离子自由基的活性见图5。如图5所示,当浓度从0.062 5 mg/mL增加到1.0 mg/mL,提取物和维生素C对超氧阴离子自由基的清除率分别从(14.45±1.21)%和(11.27±1.28)%增加到(57.07±3.23)%和(92.39± 2.31)%,结果显示提取物具有一定的清除超氧阴离子自由基的能力。
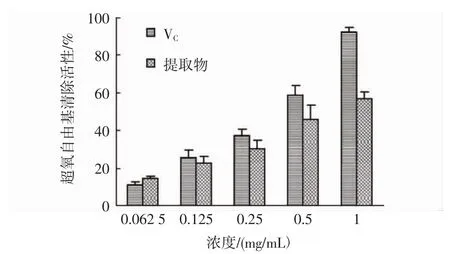
图5 花果山云雾茶提取物清除超氧阴离子自由基的活性Fig.5 The superoxide free radical scavenging activity of UAE
3 结论
Box-Behnken试验设计结合响应面分析法应用于花果山云雾茶中茶多酚和茶多糖的超声辅助同步提取工艺的研究是可行的,最佳的提取条件为:超声功率500 W,提取温度80℃,提取时间37 min,液料比62∶1(mL/g)。在优化的条件下,茶多酚和茶多糖的得率分别为(137.08±3.37)mg/g和(57.71±1.94)mg/g。进一步评价了提取物的抗氧化活性,结果表明提取物具有较强的还原力和总抗氧化力及清除DPPH自由基、羟自由基和超氧阴离子自由基的活性。本研究所获得的关于花果山云雾茶的研究结果为该资源的深入开发与应用提供了依据。
[1]SIDDIQUI I A,AFAQ F,ADHAMI V M,et al.Antioxidants of the beverage tea in promotion of human health[J].Antioxidants&Redox Signaling,2004,6(3):571-582
[2]CHENG T O.All teas are not created equal:the Chinese green tea and cardiovascular health[J].International Journal of Cardiology, 2006,108(3):301-308
[3]KHAN N,MUKHTAR H.Tea polyphenols for health promotion[J]. Life Sciences,2007,81(7):519-533
[4]NAROTZKI B,LEVY Y,AIZENBUD D,et al.Green tea and its major polyphenol EGCG increase the activity of oral peroxidases[J]. Advances in Experimental Medicine and Biology,2013,756:99-104
[5]YIANNAKOPOULOU E Ch.Targeting oxidative stress response by green tea polyphenols:clinical implications[J].Free Radical Research,2013,47(9):667-671
[6]THICHANPIANG P,WONGPRASERT K.Green tea polyphenol epigallocatechin-3-gallate attenuates TNF-α-induced intercellular adhesion molecule-1 expression and monocyte adhesion to retinal pigment epithelial cells[J].American Journal of Chinese Medicine, 2015,43(1):103-119
[7]AFZAL M,SAFER A M,MENON M.Green tea polyphenols and their potential role in health and disease[J].Inflammopharmacology, 2015,23(4):151-161
[8]BANDYOPADHYAY D,CHATTERJEE T K,DASGUPTA A,et al. In vitro and in vivo antimicrobial action of tea:the commonest beverage of Asia[J].Biological&Pharmacetical Bulletin,2005,28(11):2125-2127
[9]WILLIAMSON M P,MCCORMICK T G,Nance C L,et al.Epigallocatechin gallate,the main polyphenol in green tea,binds to the T-cell receptor,CD4:potential for HIV-1 therapy[J].Journal of Allergy and Clinical Immunology,2006,118(6):1369-1374
[10]RICHI B,KALE R K,TIKU A B.Radio-modulatory effects of green tea catechin EGCG on pBR322 plasmid DNA and murine splenocytes against gamma-radiation induced damage[J].Mutation Research,2012,747(1):62-70
[11]THAWONSUWAN J,KIRON V,SATOH S,et al.Epigallocatechin-3-gallate (EGCG)affects the antioxidant and immune defense of the rainbow trout,Oncorhynchus mykiss[J].Fish Physiology and Biochemistry,2010,36(3):687-697
[12]HUANG J,ZHANG Y,ZHOU Y,et al.Green tea polyphenols alleviate obesity in broiler chickens through the regulation of lipidmetabolism-related genes and transcription factor expression[J]. Journal of Agricultural and Food Chemistry,2013,61(36):8565-8572
[13]LI H,WU X,WU Q,et al.Green tea polyphenols protect against okadaic acid-induced acute learning and memory impairments in rats[J].Nutrition,2014,30(3):337-342
[14]GAN L,MENG Z J,XIONG R B,et al.Green tea polyphenol epigallocatechin-3-gallate ameliorates insulin resistance in non-alcoholic fatty liver disease mice[J].Acta Pharmacologica Sinica,2015,36(5):597-605
[15]XU P,CHEN H,WANG Y,et al.Oral administration of puerh teapolysaccharides lowers blood glucose levels and enhances antioxidant status in alloxan-induced diabetic mice[J].Journal of Food Sciecce,2012,77(11):H246-H252
[16]XU Y,ZHANG M,WU T,et al.The anti-obesity effect of green tea polysaccharides,polyphenols and caffeine in rats fed with a high-fat diet[J].Food&Function,2015,6(1):297-304
[17]YUAN C,LI Z,PENG F,et al.Combination of selenium-enriched green tea polysaccharides and Huo-ji polysaccharides synergistically enhances antioxidant and immune activity in mice[J].Journal of the Science of Food and Agriculture,2015,95(15):3211-3217
[18]CAI W,XIE L,CHEN Y,et al.Purification,characterization and anticoagulant activity of the polysaccharides from green tea[J].Carbohydrate Polymers,2013,92(2):1086-1090
[19]WEI X,LIU Y,XIAO J,et al.Protective effects of tea polysaccharides and polyphenols on skin[J].Journal of Agricultural and Food Chemistry,2009,57(17):7757-7762
[20]CAO H.Polysaccharides from Chinese tea:recent advance on bioactivity and function[J].International Journal of Biological Macromolecules,2013,62:76-79
[21]WANG D,ZHAO Y,SUN Y,et al.Protective effects of Ziyang tea polysaccharides on CCl4-induced oxidative liver damage in mice[J]. Food Chemistry,2014,143:371-378
[22]BASHI D S,MORTAZAVI S A,REZAEI K,et al.Optimization of ultrasound-assisted extraction of phenolic compounds from Yarrow (Achillea beibrestinii)by response surface methodology[J].Food Science and Biotechnology,2012,21(4):1005-1011
[23]郭雷,陈宇.响应面法优化超声辅助提取浒苔多糖的工艺[J].食品科学,2010,31(16):117-121
[24]郭雷,许福泉,樊欣桐,等.青蛤多糖的提取工艺优化及其抗氧化活性[J].食品研究与开发,2014,35(21):10-14
[25]GUO L,ZHU W C,LIU Y T,et al.Response surface optimized extraction of flavonoids from Mimenghua and its antioxidant activities in vitro[J].Food Science and Biotechnology,2013,22(5):1285-1292
[26]GUO L,ZHU W,XU F,et al.Optimized ultrasonic-assisted extraction of polysaccharides from Cyclina sinensis and evaluation of antioxidant activities in vitro[J].CyTA-Journal of Food,2014,12(1):32-39
[27]ZHANG G,He L,Hu M.Optimized ultrasonic-assisted extraction of flavonoids from Prunella vulgaris L.and evaluation of antioxidant activities in vitro[J].Innovative Food Science&Emerging Technologies,2011,12(1):18-25
[28]WANG Y,CHENG Z,MAO J,et al.Optimization of ultrasonic-assisted extraction process of Poria cocos polysaccharides by response surface methodology[J].Carbohydrate Polymers,2009,77(4):713-717
[29]CHEN Y,XIE M Y,NIE S P,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J].Food Chemistry,2008,107(1):231-241
[30]SIDDHURAJU P,BECKER K.The antioxidant and free radical scavenging activities of processed cowpea [Vigna unguiculata(L.) Walp.]seed extracts[J].Food Chemistry,2007,101(1):10-19
[31]LIOCHEV S I,FRIDOVICH I.The effects of superoxide dismutase on H2O2formation[J].Free Radical Biology and Medicine,2007,42 (10):1465-1469
Ultrasonic-assisted Synchronous Extraction Process of Tea Polyphenols and Polysaccharides from Huaguoshan Yunwu Tea
GUO Lei1,2,GUO Jia-cai1,ZHENG Hong-wei1
(1.Jiangsu Key Laboratory of Marine Biotechnology,School of Marine Life and Fisheries,Huaihai Institute of Technology,Lianyungang 222005,Jiangsu,China;2.Jiangsu Marine Resources Development Research Institute,Lianyungang 222004,Jiangsu,China)
The ultrasonic-assisted synchronous extraction conditions of tea polyphenols(TPP)and tea polysaccharides(TPS)from Huaguoshan Yunwu tea and antioxidant activities of the extracts were investigated.On the basis of single factor experiments,Box-Behnken design and response surface methodology were applied to optimize the extraction conditions.The optimal extraction conditions were as follows:ultrasonic power 500 W,extraction temperature 80℃,extraction time 37 min,liquid to material ratio 62∶1(mL/g).According to the optimal process conditions,the yield of TPP and TPS were(137.08±3.37)mg/g and(57.71±1.94)mg/g dry basis. The yield of solid ultrasonic-assisted extracts(UAE)was(2.51±0.27)%,the contents of TPP and TPS were(548.31±13.48)mg/g and(227.28±6.44)mg/g UAE respectively.The antioxidative activities of UAE were estimated by measuring reducing power and total antioxidant capacity,the scavenging activities on DPPH free radical,hydroxyl free radical and superoxide anion free radical.The results indicated that UAE had the strong reducing power and total antioxidant capability,as well as the high eliminating activities on DPPH free radical,hydroxyl free radical and superoxide anion free radical.
Huaguoshan Yunwu tea;tea polyphenols;tea polysaccharides;response surface methodology;
2016-11-18
江苏省自然科学基金项目(BK20151283);江苏省海洋生物技术重点实验室基金项目(2014HS006);连云港市521工程科研项目
郭雷(1977—),男(汉),副教授,硕士生导师,博士,研究方向:生物资源开发与利用。
10.3969/j.issn.1005-6521.2017.16.008

