奶牛乳腺细胞CXCR1基因在三种菌落刺激下的表达变化研究
王珍珍,陈仁金,杨章平,毛永江,冀德君
(1.徐州医科大学,徐州 212004;2.扬州大学动科学院,扬州 225009)
奶牛乳腺细胞CXCR1基因在三种菌落刺激下的表达变化研究
王珍珍1,陈仁金1,杨章平2,毛永江2,冀德君2
(1.徐州医科大学,徐州 212004;2.扬州大学动科学院,扬州 225009)
本研究旨在探索在不同菌落刺激下奶牛乳腺上皮细胞中CXCR1基因的表达变化。运用SYBR Green实时荧光定量PCR技术对CXCR1基因mRNA水平进行测定。结果发现CXCR1基因在细胞水平上对大肠杆菌、金黄色葡萄球菌、链球菌刺激较敏感,各个时段表达差异达显示水平。本研究为今后进一步研究CXCR1基因的表达机理以及奶牛乳房炎的防治奠定了基础。
CXCR1基因;实时定量PCR;奶牛乳腺上皮细胞
奶牛乳房炎是危害奶牛养殖的重要疾病。据报道美国每头奶牛每年因乳房炎造成的花费大约是200美元,每年对奶牛业造成的损失达20亿美元。我国每年因乳房炎造成的损失约150亿~450亿元。导致奶牛乳房炎的因素很多,但病原微生物是主要病因[1],其中以金黄色葡萄球菌、链球菌和大肠杆菌为主的病原微生物是导致发病的主要因素,约占发病因素的90%[2]。很多研究通过对不同地区牛场的奶牛乳房炎进行细菌分离与药敏试验发现,除以上三种主要病原菌是主要因素外,管理与环境因素也起到重要作用,并指出通过遗传育种与生物技术手段来预防和控制乳房炎是重要手段之一。
趋化因子及趋化因子受体在炎症发生时发挥重要作用。CXCR1作为趋化因子之一,在诱导中性粒细胞趋化物、白介素-8及生长相关基因等趋化物引起的炎症反应中发挥重要作用。研究表明,牛CXCR1是影响奶牛乳腺炎的重要候选基因,并具有丰富的多态性[3,4]。Legva-Baca等对CXCR1.5’侧翼区多态性进行了研究,共发现了3个突变位点,其中-1768(T/A)位点与体细胞评分达到极显著水平[5]。Youngerman等研究了娟珊牛的5个单核苷酸位点,777(G/C)引起谷氨酸到组氨酸的变化,且GG基因型奶牛患隐性乳房炎的几率显著低于CC基因型奶牛[6,7]。
CXCR2主要分布于中性粒细胞和髓样前体细胞系。CXCR1和CXCR2均具有介导活化中性粒细胞的作用,可促进中性粒细胞脱颗粒、释放贮存酶,增强中性粒细胞的吞噬功能,启动超氧离子释放,导致机体局部炎症反应,达到杀灭病原菌的目的[8,9]。本研究拟在细胞水平上对奶牛乳腺上皮细胞对三种菌落(大肠杆菌、金黄色葡萄球菌、链球菌)刺激的敏感性进行研究,以确定CXCR1的表达变化,为进一步研究CXCR1在奶牛乳房炎中的作用机理奠定基础。
1 材料与方法
1.1 细胞来源
奶牛乳腺上皮细胞系由哈佛大学孙有平教授惠赠。经复苏、传代与冻存,保存于本课题组。
1.2 引物设计
根据用于荧光定量的目的基因CXCR1基因的mRNA序列(GenBank:.NM_001105038)设计引物,内参基因β-actin引物亦根据mRNA序列(GenBank:AY141970)设计。引物由上海生工生物工程有限公司合成(具体见表1)。

表1 荧光定量PCR引物
1.3 奶牛乳腺细胞的感染
当细胞培养密度为60%左右时,分别加入灭活的三种菌落—大肠杆菌、金黄色葡萄球菌、链球菌,在0h、1h、6h、12h、24h检测CXCR1.mRNA水平。
1.4 RT-PCR
反转录体系为20µL(反应液在冰上配制):在0.2mL的PCR管中加入1µg的总RNA,Oligo.dT.引物. 1µL,5×PrimeScriptTM.Buffer.4µL,随机引物.1µL,PrimeScriptTM.RT.Enzyme.Mix.I.1µL,加Rnase.Free. dH2O至总体积为20µL。
将加好试剂的PCR管瞬时离心后放在PCR仪上进行反应。反转录条件如下:37℃、15min(反转录反应);85℃、5s(反转录酶的失活反应);所得产物即为cDNA,-20℃保存备用。
1.5 实时荧光定量PCR
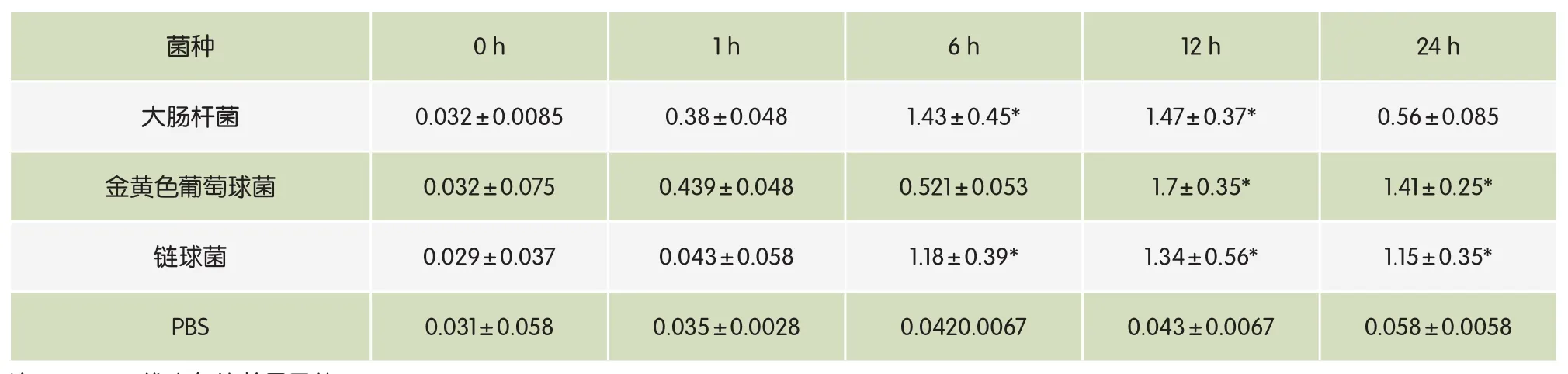
表2 CXCR1基因在三种菌种刺激下的相对定量值
采用SYBR.GreenⅠ染料法进行荧光定量,荧光定量PCR体系为20µL:SYBR.Premix.Ex.TaqTM(2×)10µL,上下游引物(10µM)各0.4µL,ROX.Reference. Dye.Ⅱ(50×)0.4µL,cDNA2µL,dH2O.6.8µL,以上步骤均为冰上操作,每个样本设三个重复。
荧光定量PCR扩增程序:95℃预变性1min;95℃变性30s,60℃退火15s,72℃延伸34s,40个循环;为分析扩增产物的特异性,PCR扩增结束后采集多个信息点进行溶解曲线分析,程序为:95℃.15s,60℃. 1min;95℃.15s,60℃.15s。
1.6 数据统计与分析
采用Excel、Primer.Premier.5.0、SPSS11.0,软件进行统计分析。数据以均数±标准差表示,多组间比较采用单因素方差分析(One-way.ANOVA),组间两两比较采用最小显著差(LSD)法,P<0.05表示差异有统计学意义;荧光定量计算采用2-△△CT方法[10].。
2 结果与分析
2.1 RNA提取
RNA提取结果见图1。由图1可见,总RNA经1%琼脂糖凝胶电泳检出3条亮带,从上到下分别为28s、18s和5s,说明提取的RNA完整性良好,无明显降解,其OD260/OD280在1.8左右,纯度较高,可用于后续试验。
图1 细胞中RNA的提取结果
2.2 CXCR1基因在三种菌落刺激下mRNA的表达变化
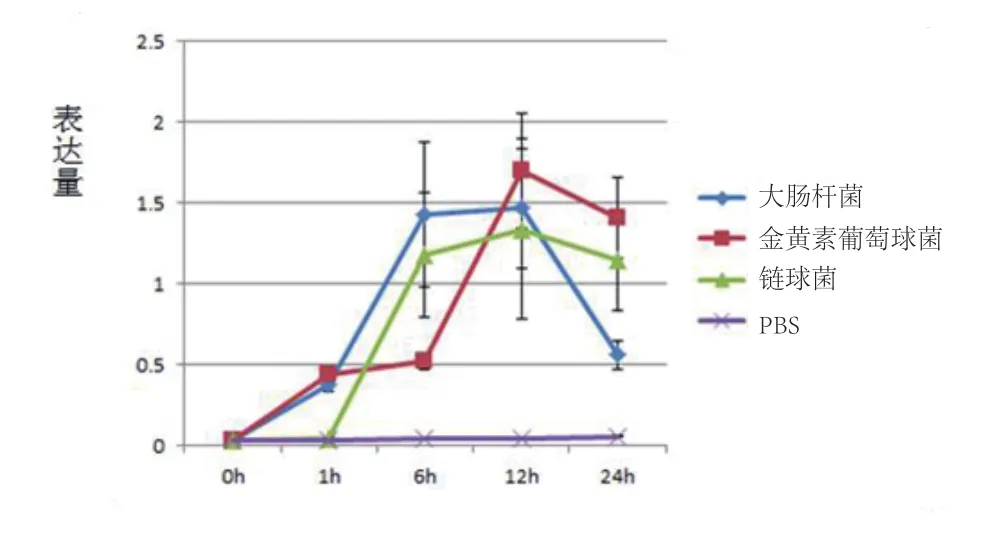
图2 在3种菌落的刺激下CXCR1基因的表达量
奶牛乳腺细胞的CXCR1基因mRNA表达在大肠杆菌刺激下6h、12h达到最高;在金黄色葡萄球菌刺激下12h后达到最高值,在链球菌刺激下12h后达到最高,然后迅速下降(表2,图2)。
3 讨论
病原微生物感染是奶牛乳房炎发病的主要原因,大肠杆菌、金黄色葡萄球菌与链球菌为主要致病菌。由于地域及气候的原因,各个地区奶牛乳房炎的发病率不同。然而从分子水平上发现,很多与奶牛乳房炎相关的基因与奶牛乳房炎的发生率密切相关,并发挥作用。
研究发现CXCR1信号通路在某种程度上可能促进炎性细胞及肿瘤的生长、侵袭和转移[11~13]。CXCR1是通过与其配体结合,激活下游信号通路来调控炎性及肿瘤细胞的生物学行为。IL-8是CXCR1/2的一个重要配体,研究显示MKN45细胞能自分泌IL-8。据报道,在一些肿瘤中IL-8的表达量能影响炎性及肿瘤的生长和侵袭[14,15]。研究显示在胃炎环境下,CXCR1及其配体在大多数的白细胞及胃黏膜细胞上均有表达,幽门螺杆菌(HP)感染会调节CXCR1与CXCR2的表达[16]。在急性炎症反应过程中,趋化因子在氨基葡聚糖作用下聚集至内皮细胞表面,通过与表达相应趋化因子受体的白细胞相结合改变白细胞表面的β2整合蛋白,与ICAM-1、ICAM-2等亲和,促进内皮细胞释放大量促炎细胞因子。以往的研究发现,CXCR1表达于中性粒细胞、单核细胞、肥大细胞、Th1细胞等,然而在奶牛乳腺上皮细胞上的表达尚未发现。本研究发现,奶牛乳腺细胞在三种菌落感染下,CXCR1.mRNA水平在6h后显著增加。趋化因子受体CXCR1作为奶牛乳房炎进程中的重要参与因素,日益引起重视,然而CXCR1在三种菌落刺激下奶牛乳腺细胞中的表达调控机理尚不清楚,有待进一步研究。
[1] 曹访, 唐修君, 陈丽, 等. 奶牛乳房炎研究进展[J].黑龙江动物繁殖, 2006,14(4):13-15.
[2] Gilbert FB, Fromageau A, Lamoureux J, et al. Evaluation of tandem repeats for MLVA typing of Streptococcus uberis isolated from bovine mastitis[J]. BMC Veterinary Research, 2006, 2:33.
[3] 徐敏, 平富强, 陈仕毅, 等. CXCR2基因多态性与奶牛乳房炎和乳品质的关联[J]. 遗传, 2008, 30:463-468.
[4] 官久强,王洪梅,王长法,等. 中国荷斯坦牛白介素8受体基因编码区多态性与乳腺炎的关联分析[J]. 中国农业科学, 2010, 43(5):1057-1065.
[5] Leyva-Baca I, Schenkel F, Martin J, et al. Polymorphisms in the 5' upstream region of the CXCR1 chemokine receptor gene, and their association with somatic cell score in Holstein cattle in Canada[J]. Journal of Dairy Science, 2008, 91(1):407-417.
[6] Youngerman SM, Saxton AM, Oliver SP, et al. Association of CXCR2 polymorphisms with subclinical and clinical mastitis in dairy cattle[J]. Journal of Dairy Science, 2004, 87(8):2442-2448.
[7] Youngerman SM, Saxton AM, Pighetti GM. Novel single nucleotide polymorphisms and haplotypes within the bovine CXCR2 gene[J]. Immunogenetics, 2004, 56(5):355-359.
[8] Wolf M, Delgado MB, Jones SA, et al. Granulocyte chemotactic protein 2 acts via both IL-8 receptors, CXCR1 and CXCR2[J]. Eur J Immunol, 1998, 28(1):164-170.
[9] Paape M, Mehrzad J, Zhao X, et al. Defense of the bovine mammary gland by polymorpho-nuclear neutrophil leukocytes [J]. J Mammary Gland Biol Neoplasia, 2002, 7(2):109-121.
[10] Watanabe A, Yagi Y, Shiono H, et al. Effects of intramammary infusions of interleukin-8 on milk protein composition and induction of acute-phase protein in cows during mammary involution[J]. Canadian Journal of Veterinary Research, 2008, 72(3):291-296.
[11] Murphy PM. The molecular biology of leukocyte chemoattractant receptors[J]. Annual Review of Immunology, 1994, 12: 593-633.
[12] Matsuo Y, Ochi N, Sawai H, et al. CXCL8/IL-8 and CXCL12/ SDF-1 alpha co-operatively promote invasiveness and angiogenesis in pancreatic cancer[J]. International Journal of Cancer, 2009, 124(4):853-861.
[13] Singh S, Sadanandam A, Vamey ML, et al. Small interfering RNA-mediated CXCRl or CXCR2 knock-down inhibits melanoma tumor growth and invasion[J]. Int J Cancer, 2010, 126(2):328-336.
[14] Waugh DJ,Wilson C. The interleukin-S pathway in cancer[J]. Clinical Cancer Research, 2008, 14(21):6735-6741.
[15] Backhed F,Torstensson E,Seguin D, et al. Helicobacter pylori infection induces interleukin-Sreceptor expression in the human gastric epitheliiim[J]. Infection and Immunity, 2003, 71(6):3357-3360.
[16] Schmausser B, Josenhans C, Endrich S, et al. Downregulation of CXCRl and CXCR2 expression on human neutrophils by Helicobacter pylori: a new pathomechanism in H. pylori mfection [J]. Infection and Immunity, 2004, 72(12):6773-6779.
Differentiation of mRNA Expression of CXCR1 Gene in Bovine Mammary Cells under Three Colonies Stimulation
WANG Zhen-zhen1, CHEN Ren-jin1, YANG Zhang-ping2, MAO Yong-jiang2, JI De-jun2
(1.Xuzhou Medical University, Xuzhou 212004; 2. Animal Science and Technology College, Yangzhou University, Yangzhou 225009)
This study was to explore expression changes of CXCR1 gene in bovine mammary gland cells under different colony stimulation. The mRNA level of CXCR1 gene was measured by SYBR Green Real-time PCR. The results showed that the mRNA expression of CXCR1 were sensitive to E.coli, S.aureus.and Streptoc. at the cellur level, and the expression levels were different in each time period. This study takes a foundation for further research on CXCR1 gene expression mechanism and prevention of mastitis in dairy cows.
CXCR1 gene; Real-time PCR; Bovine mammary epithelial cell
S823.3
A
1004-4264(2017)06-0027-04
10.19305/j.cnki.11-3009/s.2017.06.006
2016-12-06
国家自然科学基金(31172171,31372286);江苏省自然科学基金(BK20151151);江苏省博士后基金;中国博士后基金(2016M590506)。
王珍珍(1982-),女,汉,硕士,助理实验师,主要从事实验动物学研究。
杨章平,汉,教授,主要从事动物遗传资源评价、保护与利用。

