剩余污泥吸附痕量典型药物影响因素
曹达啟,王振,郝晓地,汪群慧
剩余污泥吸附痕量典型药物影响因素
曹达啟1,王振1,郝晓地1,汪群慧2
(1北京建筑大学城市雨水系统与水环境省部共建教育部重点实验室/中-荷未来污水处理技术研发中心,北京100044;2北京科技大学土木与环境工程学院,北京 100083)
传统的污水处理工艺不能完全去除药物和个人护理用品(PPCPs),可能通过吸附作用存在于剩余污泥中。当污泥经土地或农业利用,其中含有的PPCPs可能释放出来,污染水环境,因此,揭示PPCPs经污泥吸附去除的影响因素,对于预测或评估污泥中PPCPs含量尤其重要。以北京某污水处理厂剩余污泥为对象,利用高效液相色谱−质谱联用仪,研究了痕量浓度下3种典型药物在污泥中的赋存特性。随pH增大,环丙沙星与磺胺甲唑的吸附容量减小,而扑热息痛的吸附容量增加;主要是因为pH不仅改变药物在水中的存在形态,而且影响微生物细胞体的表面电位。胞外聚合物(EPS)对污泥吸附3种典型药物均有促进作用,且不依赖于pH;主要是因为EPS中含有的金属离子与有机物成分决定污泥吸附药物性能。
药品和个人护理用品;剩余污泥;吸附;胞外聚合物;金属离子;有机物
引 言
随着痕量污染物检测技术高速发展和人们环保意识的不断增强,环境中药物和个人护理用品(pharmaceutical and personal care products,PPCPs)引起了人们广泛的关注[1]。PPCPs在水环境中的浓度通常在ng·L-1到μg·L-1之间[2],由于PPCPs是与人类活动密切相关的一类化合物,随着人类的不断使用,大量PPCPs持续不断地进入环境中,给人类健康和生态环境安全带来潜在风险[3-6]。
污水处理厂点源排放是水环境中PPCPs的主要来源[6-7],其中,活性污泥法是污水处理厂中最主要的处理机制,除去少量经曝气等气体逸散形式排放大气外,大部分PPCPs的去除主要经过两种途径:生物化学降解和污泥吸附[8]。PPCPs大部分为人工合成物质,化学结构稳定,进入常规污水处理厂后难以生物化学降解[2,7,9],一部分PPCPs会残留在污水处理出水中而进入天然水体,而另一部分则通过吸附或溶解形式存在于剩余污泥中。例如,喹诺酮类抗生素主要通过污泥吸附去除,有研究表明,在污水处理过程中,污泥吸附环丙沙星占总去除率的83%±14%[10]。含PPCPs的剩余污泥,通过土壤利用以及施肥等农业生产活动进入环境,进而污染地表水环境,且经渗滤作用也会污染地下水[7,10-17]。
2015年4月国务院正式颁布了《水污染防治行动计划》,其中,明确规定了“污水处理设施产生的污泥应进行稳定化、无害化和资源化处理处置,禁止处理处置不达标的污泥进入耕地”。因此,探明PPCPs等微量有机污染物在污泥中的赋存状态变得尤其重要。目前,PPCPs在剩余污泥中赋存行为的影响因素及机理尚不太清楚。基于以下两点的分析:①构成剩余污泥的主要固形成分为微生物细胞体,其代谢过程中分泌的包裹在细胞壁外的多聚物(extracellular polymeric substances,EPS)主要由蛋白质、多糖、腐殖质、核酸等高分子聚合物构成[18-19],其中含有的氨基、羧基、羟基及疏水基团等官能团,将为药物的吸附提供吸附位点,从而决定胞体表面的吸附行为[20-21];②细胞体表面EPS中含有的钙、镁、铁等金属离子,通过阳离子架桥、阳离子交换以及络合作用,使细胞体吸附PPCPs[22-25]。并且,由于在市政污水中检出的PPCPs大部分为离子型有机物[3,25],本研究选取pa值差别较大的3种常见药物:环丙沙星[7,10,14,23,25]、磺胺甲唑[3,6-7,12-15,17,26]和扑热息痛[3,7,13,27],讨论溶液环境条件与EPS对药物在污泥中赋存行为的影响及作用机理。
1 材料与方法
1.1 化学试剂与样品
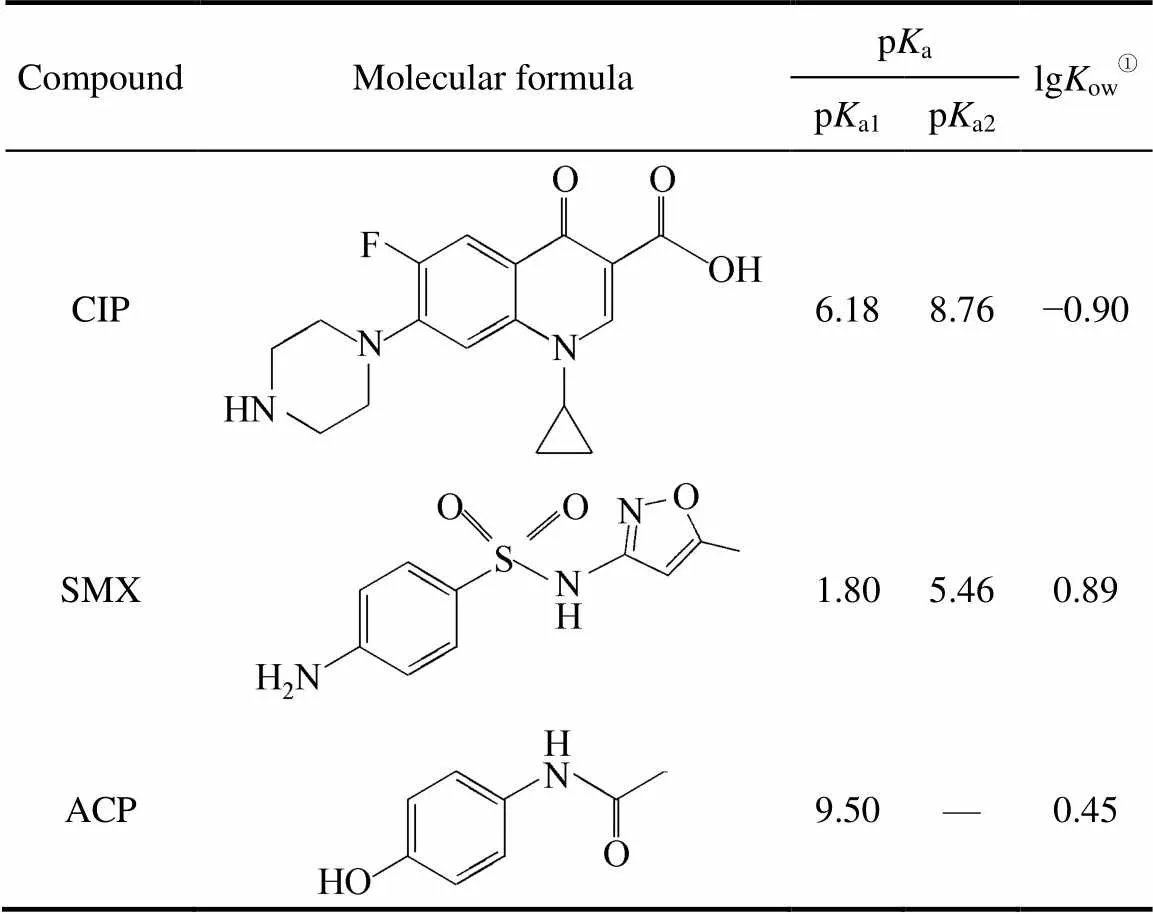
表1 CIP、SMX及ACP的分子结构与物理化学性质[23,26-27]
①Calculated by EPI SuiteTMdeveloped by USEPA.
1.2 实验设计
1.2.1 微生物胞体和EPS的制备 将污泥样品放入50 ml离心管中,设定温度为4℃、离心加速度为8000,离心10 min,去除上清液,超纯水清洗后,冷冻干燥后获得活性污泥微生物胞体(记为Biosolid)。采用阳离子树脂交换法(CER法)提取活性污泥中EPS[28],将活性污泥移至盛有阳离子交换树脂[60 g·(g VSS)-1]的烧杯中,加入适量的磷酸盐缓冲液(2 mmol·L-1Na3PO4,4 mmol·L-1NaH2PO4,9 mmol·L-1NaCl,1 mmol·L-1KCl,pH7),搅拌4 h后,将混合液在4℃、8000条件下离心15 min,含EPS的上清液过0.45 μm滤膜(Millipore)后,滤液经冷冻干燥制备EPS;再用超纯水清洗3次提取EPS后的污泥,冷冻干燥后获得不含EPS的活性污泥微生物胞体(记为BiosolidEPS free)。
1.2.2 固-液分配系数(d)的确定 用0.1 mol·L-1HEPES 缓冲液配制初始浓度为500 μg·L-1的药物超纯水溶液,以1 mol·L-1HNO3或1 mol·L-1NaOH调节pH至特定值。因调节pH所需酸或碱的量极低,故可忽略其对体系的影响。考虑到市政污水中的pH一般处于6~8,本研究选取pH5、7、9进行实验。称取一定质量吸附基质(Biosolid、BiosolidEPS free、EPS、SA、BSA),加入至500 μg·L-1的药物超纯水溶液,使吸附基质的质量浓度为1.0 g·L-1。室温(25℃)下,160 r·min-1搅拌180 min;混合液经0.22 μm滤膜(Millipore)过滤后,采用高效液相色谱−质谱联用仪,测定滤液中药物浓度。
实验完成时吸附达到平衡,干污泥、EPS或有机物中吸附的药物浓度由式(1)计算
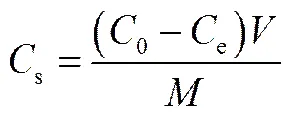
式中,s为实验结束(吸附平衡)时干污泥、EPS或有机物中吸附的药物浓度,mg·kg-1;0为水中药物初始浓度,mg·L-1,以pH调节后,吸附基质加入前测定的浓度计;e为实验结束(吸附平衡)时水中药物浓度,mg·L-1;为溶液体积,L;为干污泥、EPS或有机物的质量,kg。固-液分配系数d(L·kg-1)可由式(2)计算
(2)
药物经干污泥、EPS或有机物吸附的去除率可由式(3)计算[11]
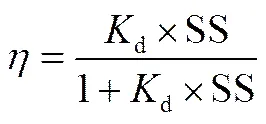
式中,SS为干污泥、EPS或有机物的质量浓度,kg·L-1。根据式(3),不同的吸附基质质量浓度下,药物的吸附去除率与固−液分配系数的关系如图1所示。
图1 各种吸附基质浓度SS下药物的去除率与的关系
Fig.1 Relationship between removal rate of pharmaceuticals, and for various concentrations of adsorbent substances, SS
1.2.3 金属离子影响药物在EPS中赋存特性 称取50 mg EPS,加入至盛有24.75 ml、pH7的HEPES缓冲液的烧杯中,室温下300 r·min-1搅拌1 h,再加入25 ml含金属离子的超纯水溶液,搅拌3 h后,再加入0.25 ml、100 mg·L-1药物(CIP、SMX、ACP)的超纯水溶液,室温下300 r·min-1搅拌3 h后,上清液过0.22 μm滤膜(Millipore),通过高效液相色谱−质谱联用仪测定滤液中对应药物的浓度。考察的浓度:EPS为1.0 g·L-1,Ca2+、Mg2+为0、0.01、0.1、1、10 mmol·L-1,Fe3+为0、0.00667、0.0667、0.667、6.67 mmol·L-1。
1.3 分析方法与仪器
采用EPA方法[29]分析3种典型药物(CIP、ACP、SMX),高效液相色谱-质谱联用仪(TSQ Quantum Access MAX系统,配有Hypersil GOLD 1.9 μm 100 mm×2.1 mm色谱柱,美国Thermo-Fisher公司)分析条件如表2所示,其中,流动相A为0.3%甲酸+0.1%甲酸铵,流动相B为甲醇,梯度洗脱条件:0~1.0 min,90% A,1.0~7.0 min,90%~10% A,7.0~8.0 min,10% A,8.0~8.1 min,10%~90% A,8.1~10.0 min,90% A。通过对目标药物的标样进行扫描,确定了目标药物的特征离子和定量离子,以及它们的出峰保留时间(3~7 min);进而对水样中的目标药物进行定量与定性分析。用超纯水配制浓度为0.1~500 μg·L-1的一系列药物标准溶液,通过待测样品中定量离子的峰面积,采用外标法定量。Biosolid与BiosolidEPS free的zeta电位测定方法如下:
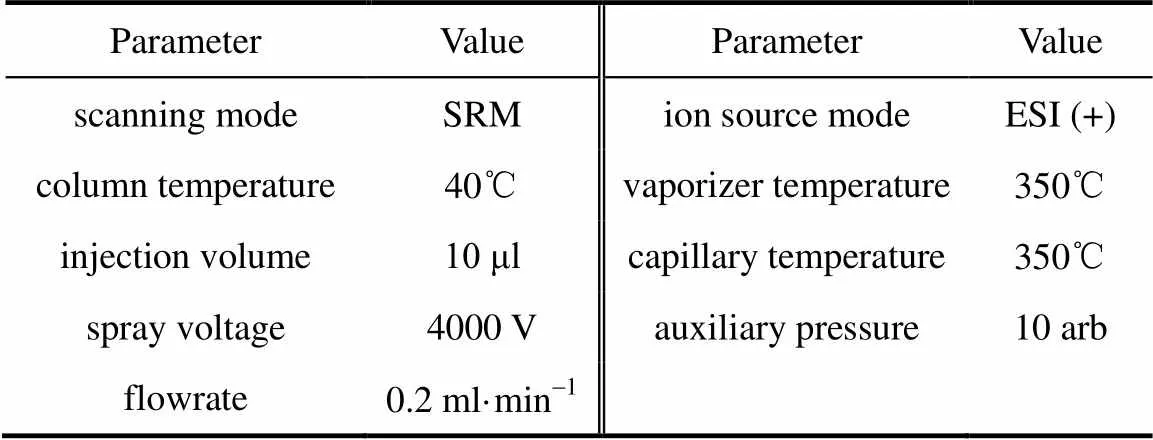
表2 CIP、ACP及SMX检测的液质联用仪条件
取50 mg Biosolid或BiosolidEPS free置于烧杯中,缓慢倒入50 ml超纯水,使用1.0 mol·L-1HNO3或NaOH调节pH至对应值(pH4~10),180 r·min-1搅拌3 h,再注入zeta电位分析仪(Zetasizer Nano ZS90,英国Malvern公司)的样品池进行测定。采用的其他实验仪器包括:等离子体发射光谱仪(ICAP 7000 SERIES ICP Spectrometer,美国Thermo-Fisher 公司)、傅里叶变换红外光谱仪(Nicolet iS5,美国Thermo-Fisher 公司)、冷冻干燥机(FD-1A-50,北京博医康)、十万分之一天平(MS105DU,瑞士Mettler-Toledo公司)、离心机(Sigma 3K15,德国Sigma公司)。
2 结果与分析
2.1 pH对药物d的影响
图2显示了3种药物(CIP、ACP、SMX)在提取EPS前后污泥微生物胞体(Biosolid与BiosolidEPS free)中的d。由图可知,对于同一药物,Biosolid与BiosolidEPS free的d不同,且均随pH变化而变化。对于CIP,pH为5、7、9时,Biosolid与BiosolidEPS free中d分别为115156.56与94078.81、34232.98与21267.30、378.96与135.16 L·kg-1;即随着pH的升高,d呈现指数型减小,减小1~2个数量级。基于图1中浓度为1.0 g·L-1时Biosolid与BiosolidEPS free的结果或代入式(3),可得药物去除率分别为99.14%与98.95%(pH5)、97.16%与95.51%(pH7)、27.48%与11.91%(pH9)。随着pH升高,由于CIP从阳离子态经两性态、分子态向阴离子态转变[图3(a)];并且,图4显示了不同pH下Biosolid与BiosolidEPS free的zeta电位,由图可知,微生物胞体表面的负电势不断降低。因此,微生物胞体经电性中和作用吸附CIP的量急剧减小,表现了d的指数型下降。
对于SMX,当pH = 5时,Biosolid与BiosolidEPS free中的d最大,分别为393.56与310.28 L·kg-1,且随pH的升高亦呈现下降趋势,但不如CIP显著;pH7时,其d为255.35与247.20 L·kg-1;pH9时,减小为118.69与70.42 L·kg-1。需说明的是,pH7时差异较小,可能是由于剩余污泥中极其复杂的未知组分造成的。同前计算方法,得到污泥吸附去除率分别为28.24%与23.68%(pH = 5)、20.34%与19.82%(pH7)、10.61%与6.58%(pH9)。原因可能为:其一,SMX的溶解度随pH升高而增大,从而降低污泥对SMX的吸附量[30-32]。其二,不同pH下,SMX形态分布不同,pH5时,SMX主要为分子态[图3(b)],可与细胞表面上有机物之间产生亲疏水性作用[21]与π-π EDA作用[33];pH7, 9时,SMX主要为阴离子态[图3(b)],亲疏水性作用减弱,同时,SMX中去质子化的基团吸引π电子的能力降低,导致与π电子供体之间的π-π EDA作用减弱,因此,d随pH增加不断减小。
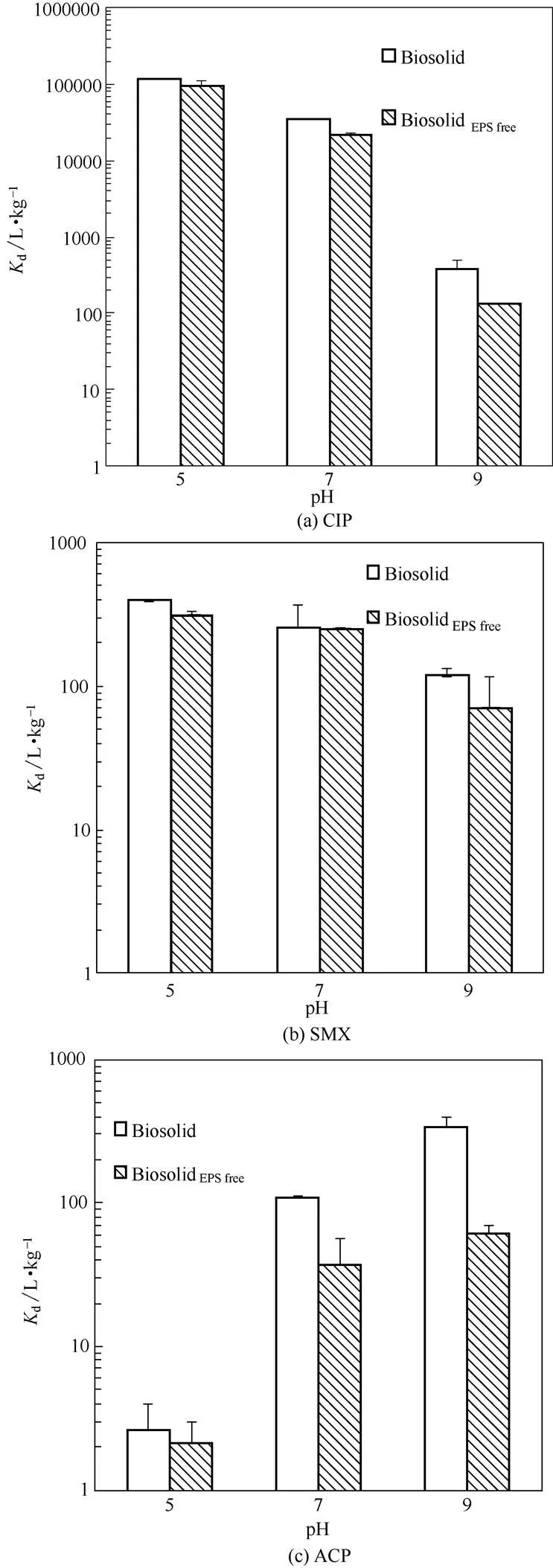
图2 不同pH下各药物在Biosolid与BiosolidEPS free中的固-液分配系数

图3 CIP、SMX及ACP依存于pH的形态分布
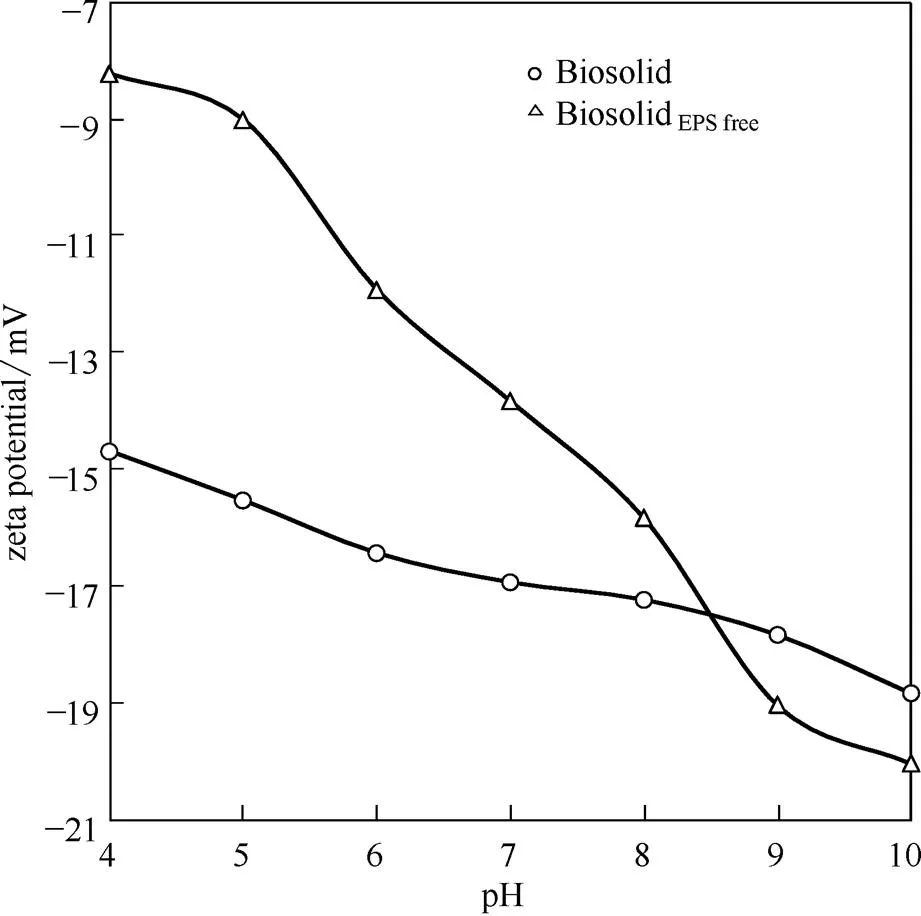
图4 Biosolid与BiosolidEPS free的zeta电位与pH的关系
相反地,对于ACP,无论Biosolid还是BiosolidEPS free,随pH升高,尽管d的绝对量较小,d值仍然不断增大。pH为5、7、9时,d分别为2.62与2.13、108.73与37.56、337.66与61.33 L·kg-1;污泥吸附去除率分别为0.26%与0.21%、9.81%与3.62%、25.24%与5.78%。由于Biosolid和BiosolidEPS free的电负性随pH升高不断增强(图4),并且,pH从5增至9,ACP由分子态转变为阴离子态[图3(c)];因此,可能因细胞表面上金属离子的架桥作用,即吸附作用从非静电力向静电力转变,促进ACP的吸附去除。
另外,不同药物的d也存在较大差异。当pH5,7时,d的顺序呈现为CIP>SMX>ACP;而pH9时,三者相差较小[图2(a)~(c)]。宏观上,污泥微生物胞体表面的负电性(图4)或许是CIP的d显著大于SMX和ACP的原因。pH为5、7时,CIP主要为阳离子态CIP(+)和两性态CIP(+/-),SMX主要为分子态SMX和阴离子态SMX(-),ACP主要为分子态ACP[图3(a)~(c)]。由于在带负电荷的污泥微生物胞体表面,阳离子型与两性药物比阴离子型与中性药物有更大的吸附可能性[34-35],故无论Biosolid还是BiosolidEPS free,d的大小顺序为CIP>SMX>ACP(pH5,7)。
值得注意的是,结果显示本研究的3种典型药物,不论pH的改变,提取EPS之后均较之前的活性污泥微生物胞体具有更小的固−液分配系数d[图2(a)~(c)]。这可能是由于经阳离子交换后,提取了EPS的活性污泥微生物胞体表面金属离子浓度降低,以及微生物胞体表面上多糖、蛋白质等有机物成分的变化。这一结果也暗示着,吸附了PPCPs的剩余污泥经土地或农业利用后,若环境条件改变使得EPS解离出来,PPCPs必将释放到环境中。
2.2 EPS中金属离子和有机物对药物d的影响
图5显示了Biosolid与EPS的红外光谱图。由图可知,两者几乎完全相同,具有相同的特征官能团。例如,有机物(蛋白质和多糖)对应的频段:氨基酸的酰胺Ⅰ的CO振动频率1654 cm-1和酰胺Ⅱ的CNH弯曲振动频率1541 cm-1,多糖的COC或COH伸缩振动频率1000~1150 cm-1。证实金属离子存在的频段:以盐形式存在的羧酸根COO-的振动频率1401 cm-1。因此,可以认为决定活性污泥微生物胞体对PPCPs的吸附去除作用的物质,其实是包裹在胞体表面上的EPS。

图5 EPS与Biosolid的红外光谱图
a—Biosolid; b—EPS
Biosolid、BiosolidEPS free以及EPS中3种常见金属(钙、镁、铁)离子[36]的测量结果如表3所示。根据表中数据,经物料衡算可知,本研究采用的CER法提取得到的EPS较实际吸附于Biosolid表面包裹的EPS含有的金属离子(Ca2+与Mg2+)减少了。故本研究获得EPS具有结合金属离子的能力。为研究EPS中金属离子对药物d的影响,不同金属离子添加浓度下,3种药物在EPS中d的实验结果如图6(a)~(c)所示。其中,横坐标为(1/2)i,表示以二价为基准等效的金属离子浓度,为金属离子带电数(Ca2+、Mg2+为2,Fe3+为3),i为金属离子的浓度,纵坐标为添加与未添加金属离子时d,i与d的比值。
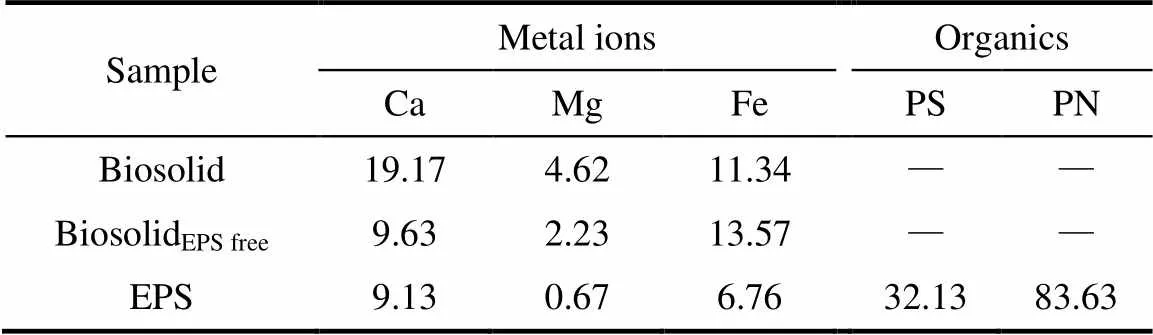
表3 Biosolid、BiosolidEPSfree、EPS中金属离子、蛋白质以及多糖含量
Note: PS—polysaccharides; PN—proteins; “—”no analyzed; EPS accounts for 21.7% (TS/TS) of Biosolid.

图6 Ca2+、Mg2+、Fe3+对EPS中药物Kd,i的影响(pH7)
对于ACP,金属离子的存在,几乎不影响ACP在EPS中的赋存行为[图6(c)];这可能是因为pH7时,ACP主要为分子态[图3(c)],EPS与ACP之间主要为亲疏水性作用,而且金属离子的种类与浓度不改变有机物的亲疏水性。
另外,不同的有机成分亦有可能影响药物在Biosolid与BiosolidEPS free中的d。表3中亦显示了EPS中的多糖和蛋白质的测量结果,证实了EPS中多糖和蛋白质的存在。如图7所示,显示了中性环境下,EPS、SA以及BSA与各种药物的d。对于3种药物,EPS基本均大于纯有机物SA与BSA中d,除了有机物成分差异外,也可能是EPS中含有金属离子所致。对于CIP,SA与BSA中d相差不大;而对于SMX与ACP,BSA中具有较大的d。

图7 药物在EPS、SA及BSA中的Kd(pH7)
3 结 论
(3)研究结果现实指导意义为:当吸附有PPCPs的剩余污泥经土地或农业利用,排放到环境中后,随着微生物细胞体表面EPS的脱附或者环境条件改变(如pH),PPCPs在污泥中的固-液分配系数将减小,致使PPCPs释放到环境中。
符 号 说 明

Ce——实验结束(吸附平衡)时水中药物浓度,mg·L-1 Ci——溶液中金属离子初始浓度(Ca2+、Mg2+、Fe3+),mmol·L-1 Cs——实验结束(吸附平衡)时干泥样、EPS或有机物中吸附的药物浓度,mg·kg-1 C0——水中药物初始浓度,mg·L-1 Kd——固−液分配系数,L·kg-1 Kd,i——添加金属离子(Ca2+、Mg2+、Fe3+)后的固−液分配系数,L·kg-1 M——干泥样、EPS或有机物的质量,kg N——金属离子带电数,Ca2+、Mg2+为2,Fe3+为3 SS——干污泥、EPS或有机物的质量浓度,kg·L-1 V——溶液体积,L η——药物经干污泥、EPS或有机物吸附的去除率,%
References
[1] DAUGHTON C G, TERNES T A. Pharmaceuticals and personal care products in the environment: agents of subtle change? [J]. Environmental Health Perspectives, 1999, 107 (Suppl. 6): 907-938.
[2] ALVARINO T, SUAREZ S, KATSOU E,. Removal of PPCPs from the sludge supernatant in a one stage nitritation/anammox process [J]. Water Research, 2015, 68: 701-709.
[3] MURRAY K E, THOMAS S M, BODOUR A A. Prioritizing research for trace pollutants and emerging contaminants in the freshwater environment [J]. Environmental Pollution, 2010, 158 (12): 3462-3471.
[4] 王丹, 隋倩, 赵文涛, 等. 中国地表水环境中药物和个人护理品的研究进展 [J]. 科学通报, 2014, 59 (9): 743-751. WANG D, SUI Q, ZHAO W T,. Pharmaceutical and personal care products in the surface water of China: a review [J]. Chinese Science Bulletin, 2014, 59 (9): 743-751.
[5] MARTINEZ GOMEZ D A, BACA S, WALSH E J. Lethal and sublethal effects of selected PPCPs on the freshwater rotifer,[J]. Environmental Toxicology and Chemistry, 2015, 34 (4): 913-922.
[6] WANG Z, ZHANG X H, HUANG Y,. Comprehensive evaluation of pharmaceuticals and personal care products (PPCPs) in typical highly urbanized regions across China [J]. Environmental Pollution, 2015, 204: 223-232.
[7] BLAIR B, NIKOLAUS A, HEDMAN C,. Evaluating the degradation, sorption, and negative mass balances of pharmaceuticals and personal care products during wastewater treatment [J]. Chemosphere, 2015, 134: 395-401.
[8] JOSS A, CARBALLA M, KREUZINGER N,. Wastewater treatment//TERNES T A, JOSS A. Human Pharmaceuticals, Hormones and Fragrances: The Challenge of Micropollutants in Urban Water Management [M]. London, UK: IWA Publishing, 2006: 243-292.
[9] KOSMA C I, LAMBROPOULOU D A, ALBANIS T A. Occurrence and removal of PPCPs in municipal and hospital wastewaters in Greece [J]. Journal of Hazardous Materials, 2010, 179 (1): 804-817.
[10] GOLET E M, XIFRA I, SIEGRIST H,. Environmental exposure assessment of fluoroquinolone antibacterial agents from sewage to soil [J]. Environmental Science & Technology, 2003, 37 (15): 3243-3249.
[11] TERNES T A, HERRMANN N, BONERZ M,. A rapid method to measure the solid-water distribution coefficient (d) for pharmaceuticals and musk fragrances in sewage sludge [J]. Water Research, 2004, 38 (19): 4075-4084.
[12] SUÁREZ S, CARBALLA M, OMIL F,. How are pharmaceutical and personal care products (PPCPs) removed from urban wastewaters? [J]. Reviews in Environmental Science and Bio/Technology, 2008, 7 (2): 125-138.
[13] RADJENOVIĆ J, PETROVIĆ M, BARCELÓ D. Fate and distribution of pharmaceuticals in wastewater and sewage sludge of the conventional activated sludge (CAS) and advanced membrane bioreactor (MBR) treatment [J]. Water Research, 2009, 43 (3): 831-841.
[14] McClellan K, Halden R U. Pharmaceuticals and personal care products in archived US biosolids from the 2001 EPA national sewage sludge survey [J]. Water Research, 2010, 44 (2): 658-668.
[15] 潘寻, 贲伟伟, 强志民. 高效液相色谱-质谱联用法同步测定城市污水处理厂活性污泥中的多类抗生素残留 [J]. 分析测试学报, 2011, 30 (4): 448-452. PAN X, BEN W W, QIANG Z M. Simultaneous determination of several classes of antibiotics in the activated sludge of municipal sewage treatment plants by high performance liquid chromatography-mass spectrometry [J]. Journal of Instrumental Analysis, 2011, 30 (4): 448-452.
[16] LIU J L, WONG M H. Pharmaceuticals and personal care products (PPCPs): a review on environmental contamination in China [J]. Environment international, 2013, 59: 208-224.
[17] 甘秀梅, 严清, 高旭, 等. 典型抗生素在中国西南地区某污水处理厂中的行为和归趋 [J]. 环境科学, 2014, 35 (5): 1817-1823.GAN X M, YAN Q, GAO X,. Occurrence and fate of typical antibiotics in a wastewater treatment plant in Southwest China [J]. Environmental Science, 2014, 35 (5): 1817-1823.
[18] URBAIN V, BLOCK J C, MANEM J. Bioflocculation in activated sludge: an analytic approach [J]. Water Research, 1993, 27 (5): 829-838.
[19] SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: a review [J]. Biotechnology Advances, 2010, 28 (6): 882-894.
[20] HA J, GÉLABERT A, SPORMANN A M,. Role of extracellular polymeric substances in metal ion complexation on: batch uptake, thermodynamic modeling, ATR-FTIR, and EXAFS study [J]. Geochimica et Cosmochimica Acta, 2010, 74 (1): 1-15.
[21] XU J, SHENG G P, MA Y,. Roles of extracellular polymeric substances (EPS) in the migration and removal of sulfamethazine in activated sludge system [J]. Water Research, 2013, 47 (14): 5298-5306.
[22] MACKAY A A, CANTERBURY B. Oxytetracycline sorption to organic matter by metal-bridging [J]. Journal of Environmental Quality, 2005, 34 (6): 1964-1971.
[23] VASUDEVAN D, BRULAND G L, TORRANCE B S,. pH-dependent ciprofloxacin sorption to soils: interaction mechanisms and soil factors influencing sorption [J]. Geoderma, 2009, 151 (3): 68-76.
[24] MACKAY A A, VASUDEVAN D. Polyfunctional ionogenic compound sorption: challenges and new approaches to advance predictive models [J]. Environmental Science & Technology, 2012, 46 (17): 9209-9223.
[25] POLESEL F, LEHNBERG K, DOTT W,. Factors influencing sorption of ciprofloxacin onto activated sludge: experimental assessment and modelling implications [J]. Chemosphere, 2015, 119: 105-111.
[26] YU X Q, ZHANG L P, LIANG M,. pH-dependent sulfonamides adsorption by carbon nanotubes with different surface oxygen contents [J]. Chemical Engineering Journal, 2015, 279: 363-371.
[27] BASTOS C A, DE OLIVEIRA M A L. Quantitative determination of acetaminophen, phenylephrine and carbinoxamine in tablets by high-performance liquid chromatography [J]. Química Nova, 2009, 32 (7): 1951-1955.
[28] FRØLUND B, PALMGREN R, KEIDING K,. Extraction of extracellular polymers from activated sludge using a cation exchange resin [J]. Water Research, 1996, 30 (8): 1749-1758.
[29] USEPA. Method 1694: pharmaceuticals and personal care products in water, soil, sediment, and biosolids by HPLC/MS/MS:EPA-821-R- 08-002 [S]. Washington, DC, 2007.
[30] CORNELISSEN G, GUSTAFSSON Ö, BUCHELI T D,Extensive sorption of organic compounds to black carbon, coal, and kerogen in sediments and soils: mechanisms and consequences for distribution, bioaccumulation, and biodegradation [J]. Environmental Science & Technology, 2005, 39 (18): 6881-6895.
[31] DAHLAN R, MCDONALD C, SUNDERLAND V B. Solubilities and intrinsic dissolution rates of sulfamethoxazole and trimethoprim [J]. Journal of Pharmacy and Pharmacology, 1987, 39 (4): 246-251.
[32] CHEN H, GAO B, LI H. Functionalization, pH, and ionic strength influenced sorption of sulfamethoxazole on graphene [J]. Journal of Environmental Chemical Engineering, 2014, 2 (1): 310-315.
[33] SCHWARZ J, THIELE-BRUHN S, ECKHARDT K U,. Sorption of sulfonamide antibiotics to soil organic sorbents: batch experiments with model compounds and computational chemistry [J]. International Scholarly Research Notices, 2012, 2012 (4): 1-10.
[34] URASE T, KIKUTA T. Separate estimation of adsorption and degradation of pharmaceutical substances and estrogens in the activated sludge process [J]. Water Research, 2005, 39 (7): 1289-1300.
[35] HÖRSING M, LEDIN A, GRABIC R,. Determination of sorption of seventy-five pharmaceuticals in sewage sludge [J]. Water Research, 2011, 45 (15): 4470-4482.
[36] WESTERHOFF P, LEE S, YANG Y,. Characterization, recovery opportunities, and valuation of metals in municipal sludges from US wastewater treatment plants nationwide [J]. Environmental Science & Technology, 2015, 49 (16): 9479-9488.
[37] CARMOSINI N, LEE L S. Ciprofloxacin sorption by dissolved organic carbon from reference and bio-waste materials [J]. Chemosphere, 2009, 77 (6): 813-820.
[38] PAN B, QIU M, WU M,. The opposite impacts of Cu and Mg cations on dissolved organic matter-ofloxacin interaction [J]. Environmental Pollution, 2012, 161: 76-82.
Controlling factors of excess sludge on adsorbing trace typical pharmaceuticals
CAO Daqi1, WANG Zhen1, HAO Xiaodi1, WANG Qunhui2
(1Sino-Dutch R&D Centre for Future Wastewater Treatment Technologies/Key Laboratory of Urban Stormwater System and Water Environment, Ministry of Education, Beijing University of Civil Engineering and Architecture, Beijing 100044, China;2School of Civil and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China)
Conventional biological systems in centralized wastewater treatment plants (WWTPs) are presently inefficient in the removal of pharmaceutical and personal care products (PPCPs), resulting in their ubiquitous presence in excess sludge by absorption. When the sludge is utilized in agricultural land, the absorbed PPCPs may be released and then water environment is contaminated. Therefore, it becomes a crucial issue to predict and assess the content of PPCPs in excess sludge, by revealing the controlling factors of PPCPs adsorption. The adsorption properties of three typical pharmaceuticals onto the sludge from a certain WWTP in Beijing, were investigated based on a trace concentration level using UPLC-MS-MS. The adsorption capacity of ciprofloxacin (CIP) and sulfamethoxazole (SMX) decreased, however, that of acetaminophen (ACP) increased with increasing pH; because the speciation of pharmaceuticals in aqueous solution and zeta potential of biosolid are as a function of pH. Extracellular polymeric substance (EPS) could enhance the adsorption of three typical pharmaceuticals onto the sludge, independent of pH; because the metal ions and organic substances contained in EPS determine the adsorption of pharmaceutical onto the sludge.
pharmaceutical and personal care products; excess sludge; adsorption; extracellular polymeric substance; metal ion; organic substance
10.11949/j.issn.0438-1157.20170137
X 523
A
0438—1157(2017)08—3266—09
郝晓地。第一作者:曹达啟(1988—),男,博士,讲师。
中国博士后科学基金项目(2015M580968);北京市博士后工作经费项目;北京市优秀人才培养项目;北京市教育委员会科技计划一般项目(SQKM201710016001)。
2017-02-13收到初稿,2017-04-12收到修改稿。
2017-02-13.
HAO Xiaodi, haoxiaodi@bucea.edu.cn
supported by the China Postdoctoral Science Foundation (2015M580968), the Beijing Postdoctoral Research Foundation, the Beijing Outstanding Talents Training and the Science and Technology Programs from Beijing Municipal Education Commission (SQKM201710016001).

