苏云金芽胞杆菌—开放的基因组与多种功能
王 奎, 束长龙, 李一梅, 张 杰*
(1. 中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室, 北京 100193; 2. 东北农业大学生命科学学院, 哈尔滨 150030)
苏云金芽胞杆菌—开放的基因组与多种功能
王 奎1,2, 束长龙1, 李一梅1, 张 杰1*
(1. 中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室, 北京 100193; 2. 东北农业大学生命科学学院, 哈尔滨 150030)
苏云金芽胞杆菌Bacillusthuringiensis(Bt)作为微生物杀虫剂,被广泛应用于农业、林业和卫生害虫的防治;而利用Bt杀虫基因研制的转基因植物,也在全球植物害虫防治中发挥了重要作用。近年来,随着科学技术的发展与社会需求的拓展,Bt新的功能被不断发掘出来。这些新的功能包括抗线虫、抗病杀菌、促进植物生长、环境修复等。本文从Bt的泛基因组结构及其遗传学特性分析入手,在详细介绍了近来Bt杀虫基因发掘进展的同时,分析了泛基因组与Bt新的功能之间可能存在的关系,旨在为我国Bt资源的研究与应用提供参考。
苏云金芽胞杆菌; 泛基因组; 杀虫基因; 抗菌作用; 促进植物生长; 环境修复
苏云金芽胞杆菌Bacillusthuringiensis(Bt)是革兰氏阳性的昆虫病原细菌[1],可产生芽胞及多种杀虫活性物质,在害虫防治方面的研究与应用一直是人们关注的热点。其产生的杀虫蛋白对多种昆虫都具有杀虫活性,例如鳞翅目、鞘翅目、双翅目昆虫[2-4]等。目前,Bt不仅作为微生物杀虫剂被广泛开发应用,其编码的杀虫蛋白基因还被成功地用作转基因抗虫植物开发[5-7],在虫害控制中发挥了巨大作用。因此,分离与鉴定Bt菌株是当前害虫防治领域的一项重要工作[8-9]。
随着研究的深入,除了杀虫活性之外,Bt的多种新功能特性也逐渐被关注和发现。这些新功能包括对植物和动物致病微生物的拮抗作用[10]、合成纳米杀虫材料[11]、抗癌细胞活性[12-13]、促植物生长活性[14]以及重金属和其他化学品污染的生物修复[15]等,虽然Bt的新功能研究起步较晚,相对较弱,但已经展示了良好的前景。本文结合比较基因组数据,探讨Bt功能性的遗传学基础对基因组结构、Bt杀虫蛋白以及近期探索的Bt的多种新功能的影响,旨在多角度对Bt及其潜在应用前景进行综述分析,为国内学者的科研与生产实践提供参考。
1 Bt具有开放型的泛基因组结构
新一代测序和组学技术,包括基因组学、转录组学、蛋白质组学和代谢组学的发展加深了我们对芽胞杆菌种群以及不同Bt亚种和菌株之间基因组多样性的认识与理解。到目前为止,GenBank中已登录了87个Bt菌株(包括35个完成基因组和52个草图基因组)的全部和部分基因组序列。
“泛基因组”(pan-genome) 是2005年Tettelin等人首次提出的可以用来描述菌株特征的概念,表示一个物种全部的基因组成,主要由三部分组成:核心基因(core gene)、非必需基因(dispensable gene)以及菌株特有基因(strain-specific gene)[16]。根据物种的泛基因组大小与菌株数目的关系,将物种的泛基因组分为开放型泛基因组(open)和闭合型泛基因组(close)。开放型泛基因组是指,随着测序的基因组数目的增加,物种的泛基因组大小也不断增加。闭合型的泛基因组是指,随着测序的基因组数目增加,物种的泛基因组大小增加到一定程度后不再增加[17]。
为了探索Bt的泛基因组特征,我们利用泛基因组自动化分析软件(pan-genome analysis pipeline,PGAP)[18]对NCBI中已有基因组完成图数据的14株Bt菌株的染色体和质粒分别进行泛基因组分析。通过GF(gene family)方法对这14株Bt菌株染色体上的76 480个功能基因进行鉴定,结果显示共鉴定出了10 498个基因家族,图1为不同保守程度的基因家族数量的比较结果,其中,特有基因家族共4 097个(图1,黄色图柱),占总基因家族数量的39.06%;菌株核心基因家族共3 114个(图1,红色图柱),占总基因家族数量的29.66%;非必需基因家族共3 287个(图1,绿色图柱),占总基因家族数量的31.31%。菌株特有基因通常是细菌进化过程中新产生的基因,而从图1中可以看出,Bt染色体基因组中特有基因所占比例最高。
进一步利用泛基因组数据分析软件(Pan-Genome Profile Analyze Tool,PanGP)分析泛基因组大小与菌株数目之间的关系。图2分别是14株Bt菌株质粒和染色体的泛基因组特征图。
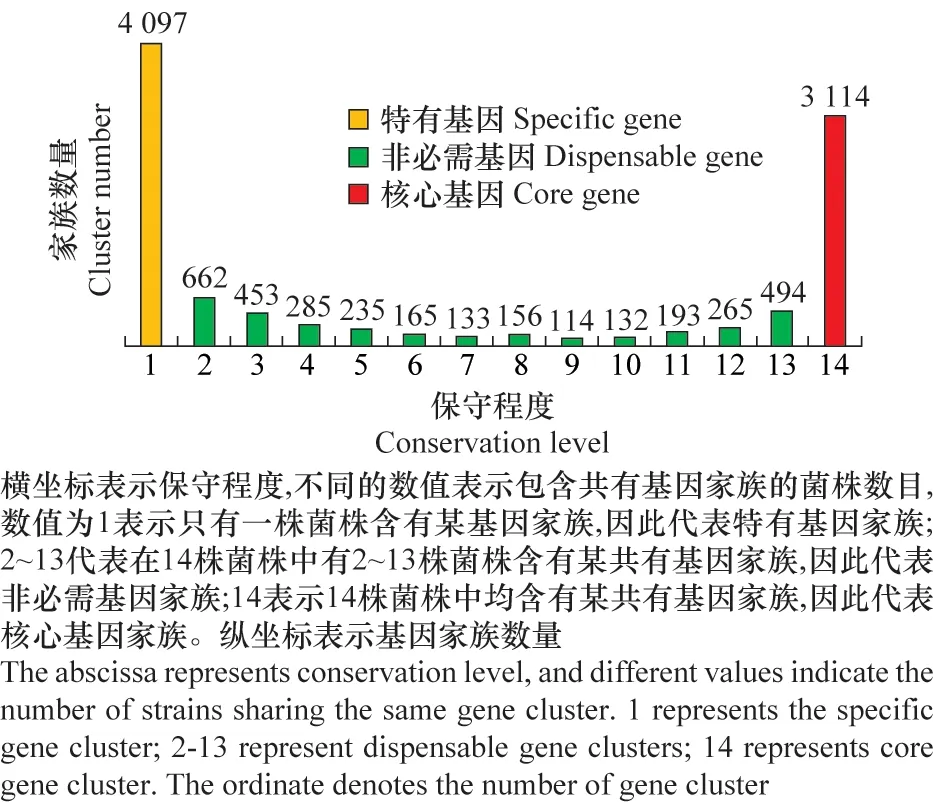
图1 不同保守程度家族数量比较Fig.1 The comparison of the numbers of gene families with different conservation levels
由于质粒被认为是细菌外源基因的重要来源,首先利用PanGP软件对质粒泛基因组及核心基因组大小与被测基因组数目的关系曲线进行非线性拟合分析(图2a),得到泛基因组大小与被测基因组数目的函数关系式为y=816.2x0.71-283.36(y表示质粒的泛基因组大小,x表示被测基因组数目),表明随着被测基因组数目的不断增加,泛基因组大小基本呈现线性增加的状态。而核心基因组大小与基因组数目的函数关系式为y=5 303.03e-2.26x+0.94(y表示质粒的核心基因组大小,x表示被测基因组数目),根据拟合的关系式发现,质粒上几乎不存在核心基因组。
染色体是细菌的主要遗传物质,进一步对Bt染色体上泛基因组及核心基因组大小与被测基因组数目的关系曲线进行非线性拟合分析(图2b),得到泛基因组大小与被测基因组数目的函数关系式是y=1 802.16x0.52+3 229.48(y表示染色体的泛基因组大小,x表示被测基因组数目),表明随着被测基因组数目的不断增加,泛基因组大小基本呈现线性增加的状态。而核心基因组大小与基因组数目的函数关系式为y=2 487.19e-0.4x+3 213.38(y表示染色体的核心基因组大小,x表示被测基因组数目),根据拟合的关系式发现,当被测菌株数目不断增加时,染色体上核心基因组数目会最终基本稳定在3 213个左右,鉴于Bt质粒上几乎不存在核心基因(图2a),说明Bt菌株共同包含的核心基因数目在3 213个左右。
综上所述,Bt的质粒和染色体基因组均不保守,具有开放性,而正是质粒和染色体的这种开放性引起了Bt菌株的功能多样性。目前研究主要集中在Bt杀虫相关的功能方面,而其他功能研究较少。泛基因组相关研究的结果显示了Bt在其他方面的潜能,因此进一步深入挖掘Bt新的功能,对充分发掘和利用Bt菌株资源具有重要的意义。
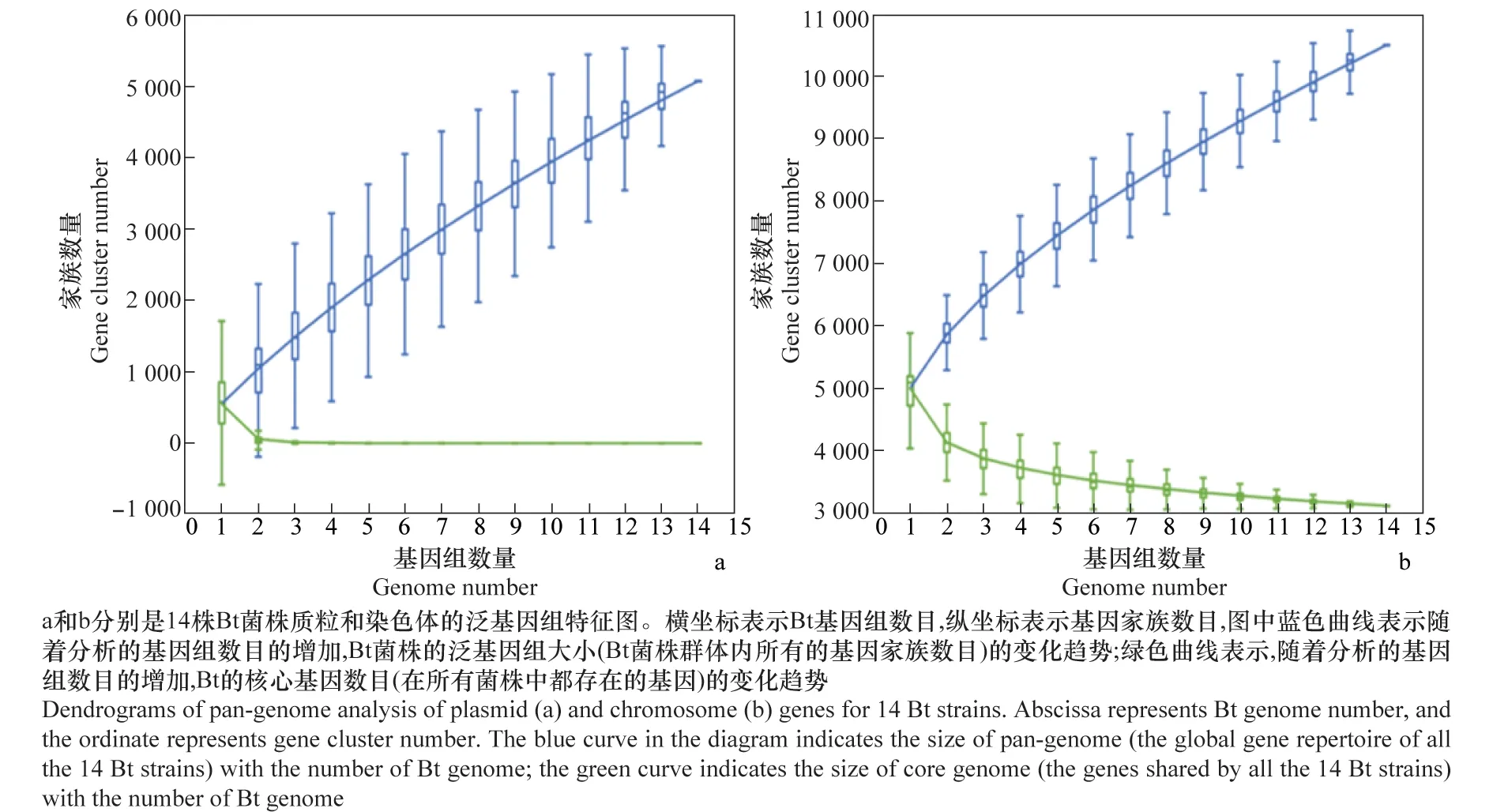
图2 14株Bt菌株质粒和染色体的泛基因组特征图Fig.2 Pan-genome analysis of plasmid and chromosome genes of 14 Bt strains
2 Bt抗虫功能的研究与应用
2.1 Bt杀虫基因
作为昆虫病原微生物,Bt的主要杀虫物质是在芽胞形成阶段产生的伴胞晶体,也称为δ-内毒素或杀虫晶体蛋白(insecticidal crystal proteins,ICPs),分为两个家族:Cry和Cyt蛋白[19]。另一类杀虫蛋白是在Bt营养生长期分泌的(vegetative insecticidal proteins,Vip)[20]。Crickmore等提出以杀虫蛋白编码的氨基酸序列相似性为规则对发现的各类杀虫蛋白进行命名(http://www.lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/)[21]。目前的命名规则将Cry蛋白分为4个等级,分别以45%、78%和95%的氨基酸序列一致性为分界。根据这个数据库最新更新的数据(2017年5月),目前在全球不同地区分离得到的Bt菌株中识别并命名的杀虫蛋白基因有975个,包括789个cry基因(cry1~cry74),38个cyt基因(cyt1~cyt3),以及142个vip基因(vip1~vip4)。
目前发现 Bt菌株对鳞翅目、双翅目、鞘翅目、膜翅目等害虫,甚至螨虫和线虫都具有毒杀活性[22-23]。这些杀虫活性是由杀虫蛋白决定的。不同杀虫蛋白的杀虫谱不同,例如Cry1蛋白家族分为14个亚族(Cry1A~N),包括280个蛋白,其中大部分对鳞翅目昆虫有活性[2,24],来自该家族的Cry1B和Cry1I蛋白也对鞘翅目昆虫有活性[25];Cry2蛋白家族分为2个亚族,包括85个蛋白,其中大部分对鳞翅目或双翅目有活性[3-4];Cry3蛋白家族分为3个亚族,包含19个蛋白,其中大部分对鞘翅目昆虫有活性[26]。此外,在过去20年间,有研究发现有一些Cry蛋白,例如Cry5、Cry6、Cry12、Cry13、Cry14、Cry21和Cry55会对植物和动物线虫有活性[27-28]。目前已经发现的38个不同的Cyt蛋白的活性主要针对双翅目昆虫,尤其是蚊子和蚋[29-30]。Vip1和Vip2活性主要针对某些鞘翅目昆虫[31-32],以及半翅目刺吸害虫棉蚜Aphisgossypii[33]。而Vip3主要对鳞翅目有活性[34]。此外,还有一类分泌期杀虫蛋白(secreted insecticidal protein,Sip)对某些鞘翅目昆虫有活性[35-36]。并且有部分Cry蛋白,也称抗癌晶体蛋白(parasporin,PS),具有特异地杀灭癌细胞的活性,在抗肿瘤方面表现出一定的潜力[12-13]。
目前,针对半翅目刺吸式昆虫的杀虫基因的筛选与克隆是杀虫基因研究的热点,目前研究人员已经证实了Cry15与Cry51类蛋白对盲蝽的杀虫活性[37-38],中国农业科学院植物保护研究所也筛选到对稻飞虱具有高活性的杀虫蛋白[39],相关研究对进一步筛选出对刺吸式害虫有效的Bt杀虫蛋白具有重要的指导意义。
2.2 Bt的杀线虫功能
迄今已有多项研究测试了Bt菌株对多种不同线虫的活性,包括自由生活线虫(Caenorhabditiselegans)[40-41];动物寄生线虫(Ascarissuum、Haemonchuscontortus、Trichostrongyluscolubriformis和Ostertagiacircumcincta)[27,42];植物寄生线虫(北方根结线虫Meloidogynehapla)[43-44]等。研究发现,有些Bt菌株可以感染线虫的消化系统,并且萌发和增殖[28]。此外,Bt产生的一些其他物质,如苏云金素[45],几丁质酶[46],金属蛋白酶[22],羊毛硫抗生素、肠毒素、溶血素以及一些由转录调节因子PlcR控制的蛋白酶等[28,47]也具有杀线虫活性。
在大多数对线虫高效Bt菌株报道中,对线虫表现出杀虫效果的Cry蛋白/芽胞的浓度均较低,这为将来Bt菌株应用为生物杀线虫剂带来了希望。然而,目前世界上还没有商业化的Bt杀线虫剂。Bt杀线虫产品剂型和使用技术的探索将是研究热点之一,这将为实现杀线虫Bt产品的登记和商业化奠定基础。
2.3 转基因抗虫作物
由于转基因作物在社会经济和生态环境方面的优势,在过去20年间,全球转基因作物的种植面积大幅增加,在2016年已达到1.851亿hm2[7]。其中抗除草剂和抗虫是应用最为广泛的两大性状,而抗虫性状的基因来源主要是Bt杀虫基因。2016年,Bt转基因作物的全球种植面积约为9 850万hm2(7 540万hm2重组Bt /抗除草剂作物和2 310万hm2Bt转基因作物),这些Bt转基因作物中包含一种或多种不同的抗鳞翅目和/或鞘翅目害虫的cry基因[7]。
自1996年以来,共有289种Bt转基因作物品系被批准用于商业化种植(ISAAA’s GM Approval Database 2017)。常用到的基因包括cry1A、cry1Ab、cry1A.105、cry1Ab-Ac、cry1Ac、cry1F、cry2Ab、cry1C、cry9C、cry2Ae、vip3A、cry3A、cry3Bb1、cry34Ab1和cry35Ab1这15种,其中cry1Ab、cry1F、cry2Ab、cry3A和cry34Ab1-cry35Ab1是最常用到的基因。有些Bt转基因作物中会包含多个cry或vip基因(2个或3个),这种基因叠加的方法可以延迟害虫对Bt转基因作物的抗性,这其中还有一些品系可以同时抗鳞翅目和鞘翅目害虫。
2.4 利用Bt合成杀虫纳米材料
金属纳米粒子(metal nanoparticals, NPs)由于其高级的理化特性及其在不同行业中的广泛应用而引起人们的深切关注。NPs可以通过各种生物系统,例如细菌、真菌、植物提取物和其他生物产品进行绿色合成[48]。这种利用微生物合成的NPs具有显著的优点,如清洁、无毒、环保等。
而近来的一些研究也已经证明Bt菌株具有产NPs的能力,如银[49]和钴[50]。2010年,Jain等首次报道了通过Bt胞晶混合物合成银纳米粒子的研究,显示出合成的高效性和绿色无污染的优势[49]。其合成的银纳米粒子平均粒径约为15 nm,具有混合(立方和六边形)结构,对多种多抗药性的人类病原菌具有高毒性,包括大肠杆菌Escherichiacoli、铜绿假单胞菌Pseudomonasaeruginosa和金黄色葡萄球菌Staphylococcusaureus。由于部分细菌含有将金属离子还原成纳米粒子的还原酶,人们推测Bt菌株可能也含有用于纳米粒子生物合成的还原酶。随后,Marimuthu等成功使用一株Bt菌株合成了钴纳米粒子,并探索了该合成产物对害虫的杀虫活性,例如,该钴纳米粒子对疟疾媒介亚相按蚊Anophelessubpictus和登革热媒介埃及伊蚊Aedesaegypti(双翅目:蚊科)幼虫具有高活性,LC50值分别为3.59 mg/L 和2.87 mg/L[50]。
Bt合成的NPs及其在杀虫活性方面的效果,为进一步提高Bt杀虫剂的功效提供了新的思路,进一步的研究工作可围绕NPs的合成工艺、成本及其对环境的影响方面开展。
3 Bt抗病功能的研究与应用
3.1 Bt的抗真菌功能
真菌是引起植物病害的一类重要病原物,会对农业生产造成巨大损失。目前,生物防治中通常是使用各种微生物合成的抗真菌化合物,例如抗生素、脂肽、铁载体、挥发性有机化合物、次级代谢产物和细胞壁降解酶等来控制真菌。
几丁质酶被认为是Bt菌株中检测到的最重要的抗真菌活性成分之一。卢伟等对995株Bt菌株的几丁质酶及其基因的检测结果证明几丁质酶普遍存在于Bt菌株中,同时筛选出了19株对小麦赤霉病菌效果较好的Bt菌株[51]。此后多项研究发现产几丁质酶的Bt菌株对多种真菌具有高活性,例如引起莴苣滴虫病的小核盘菌Sclerotiniaminor和核盘菌S.sclerotiorum[52],轮枝镰孢菌Fusariumverticillioides等[53]。
Bt还可以通过产生丰原素类环脂肽和挥发性化合物发挥抑菌功能。Bt-CMB26菌株中纯化出的一种脂肽对植物病原真菌胶孢炭疽菌Colletotrichumgloeosporioides、大肠杆菌E.coli和卷心菜粉蝶(纹白蝶Pierisrapaecrucivora)具有有效的活性[54]。而Bt-TB72菌株产生的挥发性化合物(包括2-壬酮、β-苯乙胺、2-癸酮和百里酚等)不仅可以分别抑制胶孢炭疽菌Colletotrichumgloeosporioides菌丝在PDA平板上的生长,还可以抑制对芒果的感染[55]。此外,Bt可以通过诱导植物系统抗性的方式提高植物的抗真菌能力,例如,Bt-199菌株可以通过增加植物总酚(1.7倍)和防御相关酶,包括多酚氧化酶(1.3倍)、苯丙氨酸裂解酶(1.8倍)和过氧物酶(1.4倍)的含量,诱导番茄对尖孢镰刀菌F.oxysporum产生抗性[10]。
在目前Bt的应用中,抗真菌的能力没有得到重视,相关产品也未见报道,Bt在抗真菌方面的应用潜力值得关注。
3.2 Bt的抗细菌功能
病原细菌可以引起动植物病害,影响人类的生产生活。有研究发现Bt可以通过降解N-酰基高丝氨酸内酯(AHL)来干扰细菌群体感应的信号[56]或以产生细菌素[57]的方式发挥抑菌活性。因此,抗细菌活性物质是Bt的又一重要资源。
Bt菌株产生的AHL降解酶(AiiA)可以抑制植物病原细菌的活性,例如欧文氏杆菌Erwiniacarotovora[56],进一步研究表明AiiA的抑菌活性是通过群体感应信号猝灭来实现的[58]。在应用研究上,Bt(营养细胞)与其他细菌(柠檬酸农杆菌Citrobacterfarmer和阿维链霉菌Streptomycesavermectinius)或真菌(宛氏拟青霉菌Paecilomycesvariotii、木霉TPJS-1TrichodermaparareeseiTPJ-S-1和绿色木霉TVJ-S-1T.virideTVJ-S-1)拮抗剂的混合使用能够显著提高它们对纳加辣椒[59]、番茄[60]和桉树[61]中青枯菌Ralstoniasolanacearum的活性。
细菌素是在稳定期通过核糖体合成的分子量在3~12 kDa之间的小型耐热抗菌肽,它们主要影响其他细菌的生长和(或)活力[62]。Bt产生的细菌素对不同植物病原细菌具有抑菌活性,例如灰霉菌Botrytiscinerea[57]等。此外,部分学者的研究结果表明Bt产生的细菌素可能成为人或动物病原菌的抗生素替代品与安全的食品防腐剂[62-63]。
4 Bt促进植物生长与环境修复功能
4.1 Bt的促生长功能
通常,对植物生长和发育具有有益影响的细菌被称为植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)[64]。有些Bt菌株能够在植物根系定殖,并在非生物胁迫条件下产生一些促进植物生长的代谢物,包括ACC脱氨酶、吲哚-3-乙酸(IAA)、脯氨酸和磷酸溶解酶等。目前研究结果显示Bt具有多种不同的促植物生长的机制,在农业生产中这些Bt菌株可以作为生物肥料单独使用或与其他微生物群体混合使用[65]。
Bai等证实当Bt-NEB17菌株与慢生型大豆根瘤菌Bradyrhizobiumjaponicum共同接种到大豆植株后,能显著提高大豆的结瘤数、生长速率和产量[66]。Mishra等证实与单独接种豆科根瘤菌-PR1Rhizobiumleguminosarum-PR1相比,其与产吲哚-3-乙酸(IAA)的Bt-KR1菌株的共接种可以显著促进红豌豆和小扁豆的生长[64]。
Armada等研究表明,当Bt单独使用或与丛枝菌根真菌(AMF)混合使用时,可显著提高苗的生长速度、生物量(超过20%)以及植物芽中的微量营养元素的含量,还可以通过增加抗氧化酶(超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶)的活性和降低植物脂质(丙二醛)的氧化性损伤来显著降低氧化胁迫[65]。此外,Bt和AMF的混合使用还可以通过增加营养物质含量和相对含水量,以及降低气孔导度、电解质渗出率、脯氨酸含量和抗坏血酸过氧化物酶的活性,从而显著提高干旱条件下白车轴草Trifoliumrepens缓解水分胁迫的能力[67]。Bt细菌素对Bt的促生长也很重要,在水分胁迫条件下,细菌素thuricin-17与B.japonicum-SB1的共使用可以显著提高植物生物量(17%)、根系生物量(37%)、根瘤生物量(55%)、根脱落酸含量(30%)和总氮量(17%)[14]。
上述研究结果显示Bt具有作为微生物肥料的巨大应用潜力,然而,目前在生物肥料市场上也没有商品化的Bt微生物肥料。与其他微生物肥料相比,Bt不仅促进植物生长,而且可以对土壤中线虫及地下害虫具有杀灭活性,具有多重功效,因此进一步探索Bt微生物肥料的应用对目前国家倡导的“减肥、减药”具有重要的意义。
4.2 Bt的环境修复功能
重金属、杀虫剂、除草剂和石油衍生物被认为是目前影响环境和人类健康的主要因素。这些化合物容易在食物链中累积,进而会对更高的营养级造成危害[68]。有研究显示,部分Bt菌株可以通过对有毒的重金属进行积聚、降解或矿化作用,从而有效地清除一些有毒污染物。目前已经有过基于Bt的针对砷、镉、铅、铜、镍、锌、铬、汞和铀等重金属的生物修复剂的报道。此外,Bt菌株还表现出在杀虫剂和除草剂方面的修复能力,例如毒死蜱[69]、三苯基锡(有机锡除草剂)、二苯锡和单苯锡[68]等。在石油污染物修复方面Bt也表现出较好的潜力,例如柴油[15]、有机废物(类黑精[70])以及塑化剂材料(邻苯二甲酸二甲酯[71])。
Bt在污染物修复方面的潜力对其研究与应用将有一定的促进作用,进一步要对Bt在实际环境中修复污染物的效率及影响因素等方面进行研究,为Bt进一步在环境修复方面的应用奠定基础。
5 展望
Bt杀虫剂及表达其杀虫蛋白的转基因作物在过去的几十年里已经为虫害的绿色防控发挥了重要作用。我国当前农业生产工作中,由于化学农药的过量使用面临着巨大的环境压力,“十三五”期间,我国启动了“化学肥料和农药减施增效综合技术研发”试点专项,围绕化学肥料和农药减施增效方面开展了系统的研究。Bt杀虫剂将围绕筛选、改造高毒杀虫微生物株系,优化生产工艺,并进一步深入研究Bt杀虫剂与化学杀虫剂的协同作用及其在延缓化学杀虫剂抗性方面的作用等方面,为国家“减肥减药”战略提供解决方案。
随着Bt在抗病杀菌、促植物生长以及环境修复方面作用的挖掘,Bt的研究领域进一步得到拓展,然而相关领域的研究尚未进入应用阶段。泛基因组分析表明,Bt属于开放型的泛基因组,具有强大的接受新基因的能力,不同菌株间的基因组成差别极大,这些遗传分析数据表明Bt在功能方面具有强大的多样性。因此进一步挖掘Bt新功能并探索推进其在新领域的应用,对促进Bt资源高效利用将有重要意义。
[1] Raymond B, Johnston P R, Nielsenleroux C, et al.Bacillusthuringiensis: An impotent pathogen?[J]. Trends in Microbiology, 2010, 18(5): 189-194.
[2] Song Fuping, Zhang Jie, Gu Aixing, et al. Identification ofcry1I-type genes fromBacillusthuringiensisstrains and characterization of a novelcry1I-type gene [J]. Applied and Environmental Microbiology, 2003, 69(9): 5207-5211.
[3] 李长友, 张杰, 宋福平, 等. 苏云金芽孢杆菌B-Pr-88菌株中cry2Ab4基因的表达和杀虫活性研究[J]. 生物工程学报, 2007, 23(4): 634-638.
[4] Shu Changlong, Zhang Jie, Chen Guihua, et al. Use of a pooled clone method to isolate a novelBacillusthuringiensis, Cry2A toxin with activity againstOstriniafurnacalis[J]. Journal of Invertebrate Pathology, 2013, 114(1): 31-33.
[5] Sanchis V. From microbial sprays to insect-resistant transgenic plants: History of the biopesticideBacillusthuringiensis[J]. Agronomy for Sustainable Development,2011,31(1):217-231.
[6] Bravo A, Likitvivatanavong S, Gill S S, et al.Bacillusthuringiensis: A story of a successful bioinsecticide [J]. Insect Biochemistry and Molecular Biology, 2011, 41(7): 423-431.
[7] James C. Global Status of Commercialized Biotech/GM Crops: 2016 ISAAA Brief No 52 [R]. ISAAA: Ithaca, NY, 2016.
[8] 束长龙,谷少华,窦黎明,等.对小地老虎具有杀虫毒力的苏云金芽孢杆菌菌株的分离及鉴定[J].植物保护,2007,33(5):41-44.
[9] 刘东明, 束长龙, 宋福平, 等. 北京植物园苏云金芽胞杆菌菌株的分离鉴定[J]. 植物保护, 2012, 38(1): 65-70.
[10]Akram W, Mahboob A, Javed A A.Bacillusthuringiensisstrain 199 can induce systemic resistance in tomato againstFusariumwilt [J].European Journal of Microbiology & Immunology,2013,3(4):275-280.
[11]Singh M, Kumar P, Patel S, et al. Production of polyhydroxyalkanoate co-polymer byBacillusthuringiensis[J]. Indian Journal of Microbiology, 2013, 53(1): 77-83.
[12]Katayama H, Yokota H, Akao T, et al. Parasporin-1, a novel cytotoxic protein to human cells from non-insecticidal parasporal inclusions ofBacillusthuringiensis[J]. Journal of Biochemistry, 2005, 137(1): 17-25.
[13]Brasseur K, Auger P, Asselin E, et al. Parasporin-2 from a newBacillusthuringiensis4R2 strain induces caspases activation and apoptosis in human cancer cells[J]. PLoS ONE, 2015, 10(8): e0135106.
[14]Prudent M, Salon C, Souleimanov A, et al. Soybean is less impacted by water stress usingBradyrhizobiumjaponicumand thuricin-17 fromBacillusthuringiensis[J]. Agronomy for Sustainable Development, 2015, 35(2): 1-9.
[15]Kebria D Y, Khodadadi A, Ganjidoust H, et al. Isolation and characterization of a novel nativeBacillusstrain capable of degrading diesel fuel [J]. International Journal of Environmental Science and Technology, 2009, 6(3): 435-442.
[16]Tettelin H, Masignani V, Cieslewicz M J, et al. Genome analysis of multiple pathogenic isolates ofStreptococcusagalactiae: Implications for the microbial ‘pan-genome’[J]. Proceedings of the National Academy of Sciences, 2005, 102(39): 13950-13955.
[17]Medini D, Donati C, Tettelin H, et al. The microbial pan-genome[J]. Current Opinion in Genetics and Development, 2005, 15(6): 589-594.
[18]Zhao Yongbin, Wu Jiayan, Yang Junhui, et al. PGAP: pan-genomes analysis pipeline [J]. Bioinformatics, 2012, 28(3): 416-418.
[19]Höfte H, Whiteley H. Insecticidal crystal proteins ofBacillusthuringiensis[J]. Microbiological Reviews,1989,53(2):242-255.
[20]Estruch J J, Warren G W, Mullins M A, et al. Vip3A, a novelBacillusthuringiensisvegetative insecticidal protein with a wide spectrum of activities against lepidopteran insects[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(11): 5389-5394.
[21]Crickmore N, Zeigler D R, Feitelson J, et al. Revision of the nomenclature for theBacillusthuringiensispesticidal crystal proteins[J]. Microbiology and Molecular Biology Reviews, 1998, 62(3): 807-813.
[22]Luo Xiaoxia, Chen Ling, Huang Qiong, et al.Bacillusthuringiensismetalloproteinase Bmp1 functions as a nematicidal virulence factor [J]. Applied and Environmental Microbiology, 2013, 79(2): 460-468.
[23]Dunstand-Guzmán E, Pea-Chora G, Hallal-Calleros C, et al. Acaricidal effect and histological damage induced byBacillusthuringiensis, protein extracts on the mitePsoroptescuniculi[J]. Parasites and Vectors, 2015, 8(1): 285-293.
[24]Xue Jing, Liang Gemei, Crickmore N, et al. Cloning and characterization of a novel Cry1A toxin fromBacillusthuringiensiswith high toxicity to the Asian corn borer and other lepidopteran insects [J]. FEMS Microbiology Letters,2008,280(1):95-101.
[25]Nazarian A, Jahangiri R, Jouzani G S, et al. Coleopteran-specific and putative novelcrygenes in Iranian nativeBacillusthuringiensiscollection [J]. Journal of Invertebrate Pathology, 2009, 102(2): 101-109.
[26]Sick A, Gaertner F, Wong A. Nucleotide sequence of a coleopteran-active toxin gene from a new isolate ofBacillusthuringiensissubsp.tolworthi[J]. Nucleic Acids Research, 1990, 18(5): 1305.
[27]Jr Urban J, Hu Yan, Miller M M, et al.Bacillusthuringiensis-derived Cry5B has potent anthelmintic activity againstAscarissuum[J]. PLoS Neglected Tropical Diseases, 2013, 7(6): e2263.
[28]Ruan Lifang, Crickmore N, Peng Donghai, et al. Are nematodes a missing link in the confounded ecology of the entomopathogenBacillusthuringiensis[J]. Trends in Microbiology, 2015, 23(6): 341-346.
[29]Bravo A, Gill S S, Soberón M. Mode of action ofBacillusthuringiensis, Cry and Cyt toxins and their potential for insect control [J]. Toxicon, 2007, 49(4): 423-435.
[30]Bendov E.Bacillusthuringiensissubsp.israelensisand its dipteran-specific toxins [J].Toxins,2014,6(4): 1222-1243.
[31]Warren G W, Koziel M G, Mullins M A, et al. Auxiliary proteins for enhancing the insecticidal activity of pesticidal proteins: US, US5770696 [P/OL]. 1998. http://xueshu.baidu.com/s?wd=paperuri%3A%28f5f4ce8e630c8551eb1d031432d4fdf1%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Fwww.freepatentsonline.com%2F5770696.html&ie=utf-8&sc_us=4790129465868586729.
[32]Bi Yang, Zhang Yanrui, Shu Changlong, et al. Genomic sequencing identifies novelBacillusthuringiensis, Vip1/Vip2 binary and Cry8 toxins that have high toxicity to Scarabaeoidea larvae [J]. Applied Microbiology and Biotechnology, 2015, 99(2): 753-760.
[33]Sattar S, Maiti M K. Molecular characterization of a novel vegetative insecticidal protein fromBacillusthuringiensiseffective against sap-sucking insect pest [J]. Journal of Microbiology and Biotechnology, 2011, 21(9): 937-946.
[34]Chakroun M, Ferré J.Invivoandinvitrobinding of Vip3Aa toSpodopterafrugiperdamidgut and characterization of binding sites using 125I-radiolabeling [J]. Applied and Environmental Microbiology, 2014, 80(20): 6258-6265.
[35]Donovan W, Engleman J, Donovan J, et al. Discovery and characterization of Sip1A: A novel secreted protein fromBacillusthuringiensiswith activity against coleopteran larvae [J]. Applied Microbiology and Biotechnology, 2006, 72(4): 713-719.
[36]张金波,李海涛,刘荣梅,等.Bt菌株DQ89的sip基因的克隆、表达及杀虫活性分析[J].中国生物防治学报,2015,31(4): 598-602.
[37]Baum J A, Sukuru U R, Penn S R, et al. Cotton plants expressing a hemipteran-activeBacillusthuringiensiscrystal protein impact the development and survival ofLygushesperus(Hemiptera: Miridae) nymphs [J]. Journal of Economic Entomology, 2012, 105(2): 616-624.
[38]张学雯, 束长龙, 陆宴辉, 等. 对绿盲蝽具有杀虫活性Bt菌株的筛选及Cry15Aa蛋白活性的研究[J]. 植物保护, 2016, 42(3): 56-62.
[39]刘永磊. 苏云金芽胞杆菌对灰飞虱高效杀虫新基因的挖掘与功能研究[D]. 南京: 南京农业大学, 2015.
[40]Iatsenko I, Boichenko I, Sommer R J.BacillusthuringiensisDB27 produces two novel protoxins, Cry21Fa1 and Cry21Ha1, which act synergistically against nematodes[J]. Applied & Environmental Microbiology, 2014, 80(10):3266-3275.
[41]Luo Hui, Xiong Jing, Zhou Qiaoni, et al. The effects ofBacillusthuringiensis, Cry6A on the survival, growth, reproduction, locomotion, and behavioral response ofCaenorhabditiselegans[J]. Applied Microbiology and Biotechnology, 2013, 97(23): 10135-10142.
[42]Kotze A C, O’Grady J, Gough J M, et al. Toxicity ofBacillusthuringiensisto parasitic and free-living life-stages of nematode parasites of livestock [J]. International Journal for Parasitology, 2005, 35(9): 1013-1022.
[43]Yu Ziquan, Xiong Jing, Zhou Qiaoni, et al. The diverse nematicidal properties and biocontrol efficacy ofBacillusthuringiensisCry6A against the root-knot nematodeMeloidogynehapla[J]. Journal of Invertebrate Pathology, 2015, 125: 73-80.
[44]Zhang Fengjuan, Peng Donghai, Ye Xiaobo, et al.Invitrouptake of 140 kDaBacillusthuringiensisnematicidal crystal proteins by the second stage juvenile ofMeloidogynehapla[J]. PLoS ONE, 2012, 7(6): e38534.
[45]Devidas P, Rehberger L A. The effects of exotoxin (Thuringiensin) fromBacillusthuringiensisonMeloidogyneincognitaandCaenorhabditiselegans[J]. Plant and Soil, 1992,145(1): 115-120.
[46]Vu K D, Yan S, Tyagi R D, et al. Induced production of chitinase to enhance entomotoxicity ofBacillusthuringiensisemploying starch industry wastewater as a substrate[J]. Bioresource Technology, 2009, 100(21): 5260-5269.
[47]Zhou Mengzhou, Yu Hai , Yin Xianhua, et al.LactobacilluszeaeprotectsCaenorhabditiselegansfrom enterotoxigenic escherichia coli-caused death by inhibiting enterotoxin gene expression of the pathogen [J]. PLoS ONE, 2014, 9(2): e89004.
[48]Juibari M, Abbasalizadeh S, Jouzani G, et al. Intensified biosynthesis of silver nanoparticles using a native extremophilicUreibacillusthermosphaericusstrain[J]. Materials Letters, 2011, 65(6): 1014-1017.
[49]Jain D, Kachhwaha S, Jain R, et al. Novel microbial route to synthesize silver nanoparticles using spore crystal mixture ofBacillusthuringiensis[J]. Indian Journal of Experimental Biology, 2010, 48(11): 1152-1156.
[50]Marimuthu S, Rahuman A A, Kirthi A V, et al. Eco-friendly microbial route to synthesize cobalt nanoparticles usingBacillusthuringiensisagainst malaria and dengue vectors [J]. Parasitology Research, 2013, 112(12): 4105-4112.
[51]卢伟, 赵秋敏, 陈艳玲, 等. 几丁质酶在苏云金芽胞杆菌中的分布及抑小麦赤霉菌菌株的筛选[J]. 南开大学学报(自然科学版), 2007,40(3): 97-101.
[52]Shrestha A, Sultana R, Chae J C, et al.Bacillusthuringiensis, C25 which is rich in cell wall degrading enzymes efficiently controls lettuce drop caused bySclerotiniaminor[J]. European Journal of Plant Pathology, 2015, 142(3): 577-589.
[53]Rocha L O, Tralamazza S M, Reis G M, et al. Correction: Multi-method approach for characterizing the interaction betweenFusariumverticillioidesandBacillusthuringiensissubsp.Kurstaki[J]. PLoS ONE, 2015, 10(10): e92189.
[54]Kim P I, Bai H, Bai D, et al. Purification and characterization of a lipopeptide produced byBacillusthuringiensisCMB26 [J]. Journal of Applied Microbiology, 2004, 97(5): 942-949.
[55]Zheng Min, Shi Jingying, Shi Jian, et al. Antimicrobial effects of volatiles produced by two antagonisticBacillus, strains on the anthracnose pathogen in postharvest mangos [J]. Biological Control, 2013, 65(2): 200-206.
[56]Dong Yihu, Zhang Xifen, Xu Jinling, et al. InsecticidalBacillusthuringiensissilencesErwiniacarotovoravirulence by a new form of microbial antagonism, signal interference [J]. Applied and Environmental Microbiology, 2004, 70(2): 954-960.
[57]Chi E H, Jo S H, Ju Y M, et al. Isolation of novel leaf-inhabiting endophytic bacteria inArabidopsisthaliana, and their antagonistic effects on phytopathogens [J]. Plant Biotechnology Reports, 2015, 9(6): 451-458.
[58]Park S J, Park S Y, Ryu C M, et al. The role of AiiA, a quorum-quenching enzyme fromBacillusthuringiensis, on the rhizosphere competence [J]. Journal of Microbiology and Biotechnology, 2008, 18(9): 1518-1521.
[59]Bora L C, Kataki L, Talukdar K, et al. Molecular characterizations of microbial antagonists and development of bioformulations for management of bacterial wilt of Naga chilli (CapsicumchinensJacq.) in Assam [J]. Journal of Experimental Biology and Agricultural Sciences, 2015, 3(2): 109-122.
[60]Elsharkawy M M, Mai N, Nishimura M, et al. Control of tomato bacterial wilt and root-knot diseases byBacillusthuringiensisCR-371 andStreptomycesavermectiniusNBRC14893[J]. Acta Agriculturae Scandinavica, 2015, 65(6): 575-580.
[61]Santiago T R, Grabowski C, Rossato M, et al. Biological control of eucalyptus bacterial wilt with rhizobacteria [J]. Biological Control, 2015, 80: 14-22.
[62]Nm F S, Casadosvázquez L E, Barbozacorona J E. Bacteriocins ofBacillusthuringiensis can expand the potential of this bacterium to other areas rather than limit its use only as microbial insecticide [J]. Canadian Journal of Microbiology, 2013, 59(8): 515-522.
[63]Barbozacorona J E, De l F N, Alvamurillo N, et al. Activity of bacteriocins synthesized byBacillusthuringiensisagainstStaphylococcusaureusisolates associated to bovine mastitis[J]. Veterinary Microbiology, 2009, 138 : 179-183.
[64]Mishra P K, Mishra S, Selvakumar G, et al. Coinoculation ofBacillusthuringiensis-KR1 withRhizobiumleguminosarumenhances plant growth and nodulation of pea (PisumsativumL.) and lentil (LensculinarisL.)[J]. World Journal of Microbiology and Biotechnology, 2009, 25(5): 753-761.
[65]Armada E, Probanza A, Roldán A, et al. Native plant growth promoting bacteriaBacillusthuringiensis, and mixed or individual mycorrhizal species improved drought tolerance and oxidative metabolism inLavanduladentataplants [J]. Journal of Plant Physiology, 2016, 192: 1-12.
[66]Bai Yuming, Zhou Xiaomin, Smith D L. Enhanced soybean plant growth resulting from coinoculation ofBacillusstrains withBradyrhizobiumjaponicum[J]. Crop Science, 2003,43(5): 1774-1781.
[67]Ortiz N, Armada E, Duque E, et al. Contribution of arbuscular mycorrhizal fungi and/or bacteria to enhancing plant drought tolerance under natural soil conditions: effectiveness of autochthonous or allochthonous strains [J]. Journal of Plant Physiology, 2015, 174: 87-96.
[68]Huang Jie, Ye Jinshao, Ma Jiawen, et al. Triphenyltin biosorption, dephenylation pathway and cellular responses during triphenyltin biodegradation byBacillusthuringiensisand tea saponin [J]. Chemical Engineering Journal, 2014, 249: 167-173.
[69]Aceves-Diez A E, Estrada-Castaeda K J, Castaeda-Sandoval L M, Use ofBacillusthuringiensissupernatant from a fermentation process to improve bioremediation of chlorpyrifos in contaminated soils [J]. Journal of Environmental Management, 2015, 157: 213-219.
[70]Kumar P, Chandra R. Decolourisation and detoxification of synthetic molasses melanoidins by individual and mixed cultures ofBacillusspp.[J]. Bioresource Technology, 2006, 97(16): 2096-2102.
[71]Brar S K, Verma M, Tyagi R D, et al. Concurrent degradation of dimethyl phthalate (DMP) during production ofBacillusthuringiensisbased biopesticides [J]. Journal of Hazardous Materials, 2009, 171: 1016-1023.
(责任编辑:田 喆)
Bacillusthuringiensis—Open pan-genome and various functions
Wang Kui1,2, Shu Changlong1, Li Yimei1, Zhang Jie1
(1.StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China; 2.CollegeofLifeScience,NortheastAgriculturalUniversity,Harbin150030,China)
As an important biological insecticide,Bacillusthuringiensishas been widely used to control agricultural, forest and medical insect pests. Bt toxin genes have also been extensively used as gene source in genetically modified crops. In recent years, with the development of science, technology and social demands, some other new functions of Bt have been explored, including resistance to nematodes, antagonistic effects against plant pathogenic fungi and bacteria, plant growth-promoting activities, and environmental bioremediation. Based on the pan-genome analysis and genetic peculiarity of Bt, we reviewed recent advances in Bt insecticidal genes, and analyzed the relationship between pan-genome and various new functions of Bt, in order to provide a guide for the research and application of Bt in China.
Bacillusthuringiensis; pan-genome; insecticidal gene; antagonistic effect; plant growth-promoting rhizobacteria (PGPR); environmental bioremediation

特约稿件InvitedPaper
2017-06-16
2017-06-19
国家重点研发计划重点专项(SQ2017ZY060066-04)
Q 939.9
A
10.3969/j.issn.0529-1542.2017.04.001
* 通信作者 E-mail: jzhang@ippcaas.cn

