河岸林土壤好氧反硝化菌的分离及活性初探
韩晓丽,聂园军,黄春国,郭晋平
(1.山西农业大学 林学院,山西 太谷 030801; 2.山西省农业科学院 农业资源与经济研究所, 山西 太原 030031;3.山西农业大学 农学院,山西 太谷 030801; 4.山西农业大学 城乡建设学院,山西 太谷 030801)
河岸林土壤好氧反硝化菌的分离及活性初探
韩晓丽1,聂园军2,黄春国3,郭晋平4*
(1.山西农业大学 林学院,山西 太谷 030801; 2.山西省农业科学院 农业资源与经济研究所, 山西 太原 030031;3.山西农业大学 农学院,山西 太谷 030801; 4.山西农业大学 城乡建设学院,山西 太谷 030801)
[目的]好氧反硝化菌可在有氧条件下,将硝酸盐还原,释放N2O,减少富氮对土壤的危害。本研究旨在探明河岸林土壤中是否存有好氧反硝化菌。[方法]以文峪河上游毗邻农田河岸林土壤为材料,采用土壤稀释、涂布划线、滴加格利斯及二苯胺试剂显色等方法分离筛选菌株,采用16S rDNA基因序列同源性分析鉴定;在灭菌土壤中接种筛选所得菌株培养,并测定硝态氮、铵态氮、亚硝态氮含量变化来分析其活性。[结果]获得3株反硝化菌(编号:df3、df7、df14),鉴定命名为Psueadomonassp.DF3,Alicaligenessp.DF7,Klebsiellasp.DF14。活性分析显示:接种3株菌土壤硝态氮明显减少,且接种df3和df7土壤中具亚硝态氮。[结论]样品土壤中存在好氧反硝化活性菌株,具有重要科学研究意义。
河岸林; 好氧反硝化细菌; 筛选; 反硝化活性
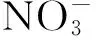
1 材料与方法
1.1 材料来源
1.1.1 试验所用土样
样地选择在文峪河上游毗邻农田河岸林,坐标为111°27′54″E,37°51′8″N,采集时间2014年7月8日。共设置3个20 m×20 m样方,每样方内随机采集5个点,取新鲜土样充分混匀后放入冰盒带回实验室。
1.1.2 培养基及试剂
(1)牛肉膏蛋白胨硝酸盐培养基:5 g牛肉膏,10 g蛋白胨,1 g KNO3,5 g NaCl,20 g琼脂,1 000 mL蒸馏水,pH7.2~7.4。
(2)硝酸盐葡萄糖反硝化液体培养基:5 g葡萄糖,2 g KNO3,1 g KH2PO4,1 g K2HPO4,0.20 g MgSO4·7H2O,1 000 mL去离子水,pH 7.2~7.5。
(3)格利斯试剂:Ⅰ液:磺胺酸0.5 g溶于150 mL 30%醋酸溶液,棕色瓶储存备用;Ⅱ液:0.5 gα-萘胺溶于50 mL蒸馏水,煮沸后缓慢与150 mL 30%醋酸溶液混匀,棕色瓶储存备用。
(4)二苯胺试剂:1 g二苯胺溶于20 mL蒸馏水,并缓慢加入浓硫酸100 mL混匀,棕色瓶储存备用。
1.2 试验方法
1.2.1 好氧反硝化细菌的分离
采用土壤稀释法将供试土样制成不同稀释度的土壤溶液[16]。并分别取少量涂布于牛肉膏蛋白胨硝酸盐固体培养基上,置于30 ℃培养箱中培养1~2 d。
1.2.2 好氧反硝化细菌的筛选
(1)扩大培养:挑取菌落接种于硝酸盐葡萄糖反硝化液体培养基中,30 ℃、120 r·min-1振荡培养7 d。
(2)筛选:向上述菌液中滴加格利斯试剂和二苯胺试剂筛选反硝化菌株,原理和方法见文献[16]。
(3)纯化:对筛选出的菌株编号,采用划线法转至牛肉膏蛋白胨硝酸盐固体培养基上培养,转接3次及以上,经镜检获得纯菌株后转接到牛肉膏蛋白胨硝酸盐固体培养基试管斜面上,并于4 ℃冰箱中保存备用。
1.2.3 好氧反硝化细菌的分子生物学鉴定
基因组DNA提取:摇床30 ℃培养至对数期,采用离心柱DNA试剂盒提取DNA[17]。引物:16S rDNA的PCR反应引物,序列正向为:5′-AGAG TTTGATCCTGGCTCAG-3′,反向为:5′-GGTTACTTGTTACGACTT-3′。
PCR扩增:采用50 μL反应体系: 10×buffer 1/10 voL,MgCl22.5 mM,dNTP 0.2 mM,Taq酶 2.5 U,模板1 μL。
PCR反应程序:循环数30,94 ℃预变性5 min;94 ℃变性 40 s,55 ℃退火 40 s,72 ℃ 延伸2 min;72 ℃整理10 min。1%琼脂糖凝胶电泳检测。扩增产物的测序由派森诺生物公司完成。
将测得的序列在NCBI网站的GeneBank核酸数据库中进行Blastn比对,下载相似度高的相关序列,然后用mega软件进行1 000次bootstrap统计学检验,构建系统发育树。
1.2.4 好氧反硝化细菌的活性测定
(1)纯化菌种的扩大培养
挑取纯化菌株接种于100 mL硝酸盐葡萄糖反硝化液体培养基中,30 ℃、120 r·min-1恒温振荡器中培养48 h后备用。
(2)好氧反硝化菌反硝化活性试验
采集样土风干磨细后过20目筛备用。供试土壤pH 6.35,有机质5.83 g·kg-1,全氮3.3 g·kg-1,硝态氮为5.65 mg·kg-1,铵态氮9.63 mg·kg-1。称取10 g经30 min、121 ℃高压灭菌的样土分装于100 mL纱布封口的塑料瓶中,并分别加入纯化菌液0.5 mL和1.5 g·L-1的KNO3溶液1 mL,确保样土起始硝态氮含量约为200 mg·kg-1,静置于暗处培养8 d;设置空白对照是加入0.5 mL灭活菌液。培养过程中,前4 d每隔12 h取样一次,5~8 d每隔24 h定时取样,每次取样量为0.5 g,用浓度为2 mol·L-1的KCl溶液5 mL浸提,采用easychem全自动离子分析仪测定浸提液中硝态氮、亚硝态氮、铵态氮的浓度。试验中所有取样均设置3个重复。测定数据采用Excel 2013软件进行统计分析。
2 结果分析
2.1 反硝化细菌的分离筛选
经分离筛选试验获得3株具反硝化功能的菌株,编号为:df3、df7、df14,并在10×100倍光学显微镜下观察镜检。其中df3菌体细胞呈球状,直径1~1.5 μm;df7菌体细胞呈杆状,长1.5~2 μm,宽0.5~0.7 μm;df14杆状,长1.7~3 μm,宽0.8~1 μm。同时,经平板培养3 d后发现,df3菌落3~5 mm左右,圆形,隆起,淡黄色,边缘整齐,革兰氏阴性;df7菌落2.5~3 mm左右呈圆形,淡黄色,边缘整齐,革兰氏阴性;df14菌落1 mm左右,呈圆形有隆起,乳白色,边缘整齐,革兰氏阴性。
2.2 反硝化细菌的分子生物学鉴定
通过16S rDNA基因序列同源性分析鉴定结果可见(图1~图3):菌株df3聚在Psueadomonas分支上,与genebank中KT695813,KR088657及HQ224651序列相似度达99%,菌株df7聚在Alicaligenes分支上,与genebank中FJ415749序列相似度达98%,菌株df14聚在Klebsiella分支上,与genebank中NR119277,AJ871858及JN102560相似度达99%。

图1 菌株df3及相似菌株16S rDNA的系统树Fig.1 Phylogenetic tree of df3 bacterial isolate and their GeneBank allies’ 16S rDNA sequences
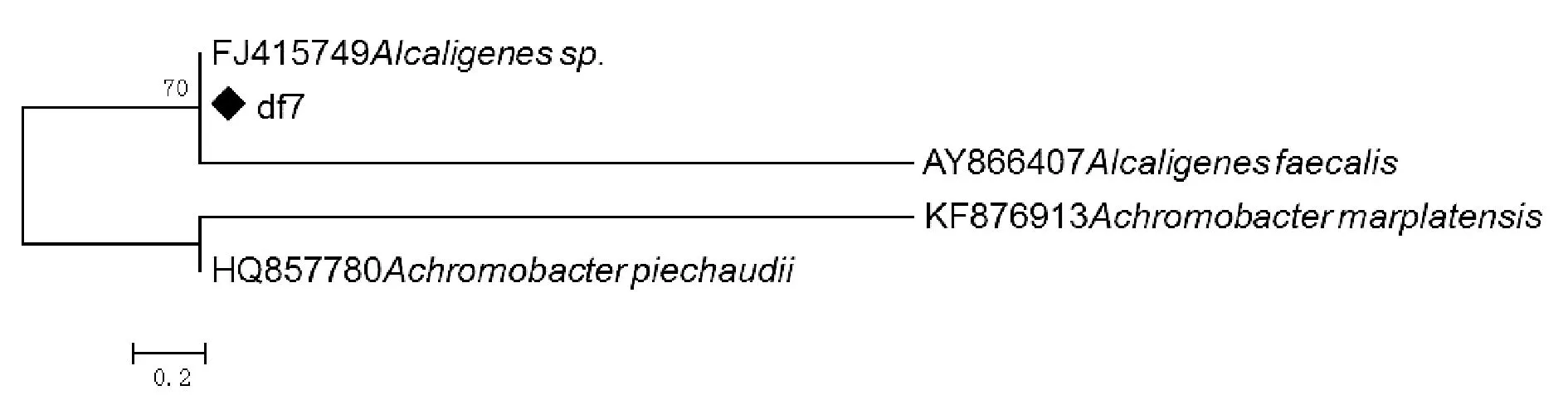
图2 菌株df7及相似菌株16S rDNA的系统树Fig.2 Phylogenetic tree of df7 bacterial isolate and their GeneBank allies’ 16S rDNA sequences

图3 菌株df14及相似菌株16S rDNA的系统树Fig.3 Phylogenetic tree of df14 bacterial isolate and their GeneBank allies’ 16S rDNA sequences
结合菌株群落及显微特征,鉴定并命名菌株df3为Psueadomonassp.DF3;菌株df7为Alicaligenessp.DF7;菌株df14为Klebsiellasp.DF14。
2.3 好氧反硝化细菌反硝化活性测定
经过反硝化活性试验可知:与对照相比,接种3株反硝化细菌的土壤中硝态氮含量发生明显减少(图4),其中接种df3和df14土壤中硝态氮含量在第3 d时降至最低值,分别为126.8 mg·kg-1和158.4 mg·kg-1,减少率达36.6%和20.8%;接种df7土壤中硝态氮含量在第4 d时降至最低值115.6 mg·kg-1,减少率为42.2%。之后随着培养时间的延长,土壤中硝态氮含量无明显变化,均保持在最低值附近。表明试验分离筛选得到的3株好氧反硝化菌Psueadomonassp.DF3,Alicaligenessp.DF7,Klebsiellasp.DF14均具有明显的反硝化作用,可以将土壤中含量充足的硝态氮明显降低。与接种df3和df14菌株相比,接种df7菌株的土壤中硝态氮含量降低幅度最大,表明在相同处理条件下,df7菌株的反硝化活性较强。
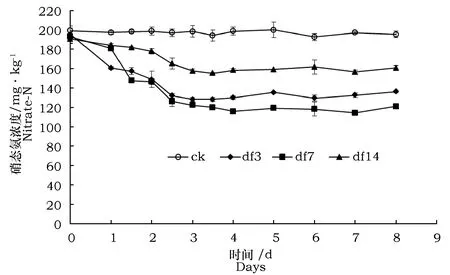
图4 接种3株菌后土壤硝态氮的变化Fig.4 Dynamics of nitrate-N in the soil inoculated with 3 strains
由图5可见,接种3种菌株的土壤中铵态氮含量与对照中铵态氮含量变化趋势一致,无明显升高或积累,均在初始值附近上下浮动。表明土壤在接种3株反硝化菌的培养中,其反硝化作用对土壤氮素转化的过程中并未伴有铵态氮的产生。
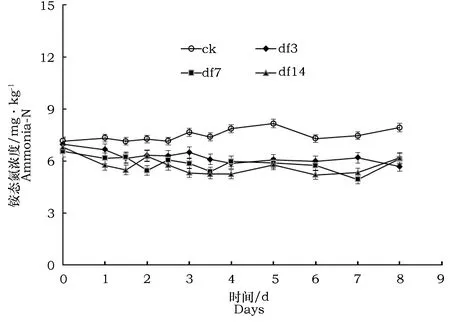
图5 接种三株菌后土壤铵态氮的变化Fig.5 Dynamics of ammonia-N in the soil inoculated with 3 strains
由图6可见,空白对照和接种df14土壤中表现为亚硝态氮没有积累;而接种df3的土壤中第3 d时亚硝态氮积累量达到最高35.6 mg·kg-1;接种df7的土壤中第3.5 d亚硝态氮的积累量达到最高42.9 mg·kg-1,随后均逐渐下降,到第8 d亚硝态氮降低到最低值。结合图5所示的土壤铵态氮没有产生和积累,表明菌株df3和df7的反硝化过程表现为由硝酸盐先产生亚硝酸盐,而后以气态氮形式释放,菌株df14的反硝化过程是由硝酸盐直接产生气态氮。
3 结论与讨论
(1)本试验选择文峪河上游毗邻农田河岸林为样地,最终筛选出3株好氧反硝化菌株,分别编号为:df3、df7和df14,验证了文峪河上游毗邻农田河岸林土壤中存在好氧反硝化细菌。在有氧条件下,好氧反硝化菌将土壤中富余的硝酸盐转化,降低由毗邻农田人工施用硝态氮肥对河岸林土壤及水体的危害,也为当地开展土壤脱氮研究提供了菌种资源保证。
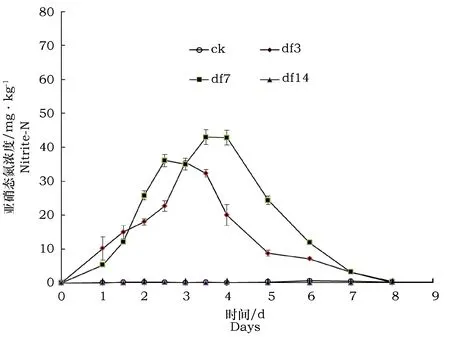
图6 接种三株菌后土壤亚硝态氮的变化Fig.6 Dynamics of nitrite-N in the soil inoculated with 3 strains
(2)经对筛选所得3株反硝化菌株的分子生物学鉴定可知,3种菌株分别属于为Psueadomonas,Alicaligenes和Klebsiella3个属。表明文峪河上游毗邻农田河岸林土壤中存在的反硝化功能菌具有多样性,为进一步开展菌株反硝化功能基因研究奠定了基础。
(3)通过土壤反硝化活性试验表明:3株菌都具有明显的反硝化活性。在相同处理条件下,菌株df7反硝化活性最强。本试验所得菌株有望在下一步土壤脱氮试验过程中得到应用。
[1]Fowler D, Steadman C E, Stevenson D, et al. Effects of global change during the 21st century on the nitrogen cycle[J]. Atmospheric Chemistry and Physics, 2015, 15(24):1747-1868.
[2]Van D G, Bouwman A F, Knoop J M, et al. Global pollution of surface waters from point and nonpoint sources of nitrogen[J]. Scientific World Journal, 2001, 1(Suppl 2):632-641.
[3]Conley D J, Likens G E. Ecology-Controlling eutrophication: nitrogen and phosphorus [J]. Science, 2009, 323(5917):1014-1015.
[4]郭二辉,孙然好,陈利顶.河岸植被缓冲带主要生态服务功能研究的现状与展望[J]. 生态学杂志, 2011, 30(8):1830-1837.
[5]Alexander R B, Johnes P J, Boyer E W, et al. A comparison of models for estimating the riverine export of nitrogen from large watersheds [J]. Biogeochemistry, 2002, 57-58(1):295-339.
[6]Seitzinger S, Harrison J A, Böhlke J K, et al. Denitrification across landscapes and waterscapes: a synthesis[J]. Ecological Applications, 2007, 16(6):2064-2090.
[7]王庆成,于红丽,姚琴,等.河岸带对陆地水体氮素输入的截留转化作用[J].应用生态学报,2007,18(11):2611-2617.
[8]Verhoeven J T, Arheimer B, Yin C, et al. Regional and global concerns over wetlands and water quality[J]. Trends in Ecology and Evolution, 2006, 21(2):96-103.
[9]Kbenjamin W, Christines F, Caroll C, et al. Nitrate removal, denitrification and nitrous oxide production in the riparian zone of an ephemeral stream [J]. Soil Biology and Biochemistry, 2009, 41(4):671-680.
[10]Codispoti L A, Richards F A. An Analysis of the Horizontal Regime of Denitrification in the Eastern Tropical North Pacific [J]. Limnology and Oceanography, 1976, 21(3):379-388.
[11]夏超, 祝贵兵,邹雨璇,等.厌氧氨氧化细菌和反硝化厌氧甲烷氧化细菌在岸边带土壤中的分布规律[J]. 环境科学学报, 2015, 35(12):3965-3975.
[12]Jorgensen K S, Tiedje J M. Survival of denitrifies in nitrate-free, anaerobic environments [J]. Applied and Environmental Microbiology, 1993, 59(10):3297-3305.
[13]周立祥,黄峰源, 王世梅.好氧反硝化菌的分离及其在土壤氮素转化过程中的作用[J]. 土壤学报, 2006, 43(3):430-435.
[14]Ding A, Jiamo F U, Sheng G. Experimental evidence for aerobic bio-denitrification [J]. Science Bulletin, 2000, 45(1):86-89.
[15]Patureau D, Zumstein E, Delgenes J P, et al. Aerobic Denitrifiers Isolated from Diverse Natural and Managed Ecosystems [J]. Microbial Ecology, 2000, 39(2):145-152.
[16]王有乐,雷兴龙,陈连军,等.土壤中好氧反硝化菌的分离及脱氮特性研究[J]. 环境工程学报, 2011, 5(8):1902-1906.
[17]汪安云,黄琼.一株降低烟草中特有亚硝胺细菌的分离鉴定及特性研究[J]. 环境科学学报, 2006, 26(11):1914-1920.
(编辑:梁文俊)
Study on isolation and denitrification activity of aerobic denitrifiers from a riparian forest
Han Xiaoli1, Nie Yuanjun2, Huang Chunguo3, Guo Jinping4*
(1.CollegeofForestry,ShanxiAgriculturalUniversity,Taigu030801,China; 2.InstituteofAgriculturalResources,ShanxiAcademyofAgriculturalSciences,Taiyuan030031,China; 3.CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China; 4.SchoolofUrbanandRuralConstruction,Taigu030801,China)
[Objective]Aerobic denitrifiers could decrease nitrate and release N2O, and reduce the harm of rich nitrogen soil under aerobic conditions. The study was conducted to verify the existence of aerobic denitrifiers in riparian forest soil.[Methods]In this study, the soil of riparian forest adjacent to farmland from the upper reaches of Wenyu River was taken as material, using soil dilution, plate streak, adding griess and diphenylamine colorimetric reactionmethod for strain screening, 16S rDNA analysis for identification and determination. The denitrificative activity was analyzed by determination the nitrate, ammonium, and nitrite content in sterilized soil inoculated with the strains.[Result]3 strains of denitrifiers were isolated and screened, which was coded df3, df7and df14, were respectively identified and named asPsueadomonassp.DF3,Alicaligenessp.DF7, andKlebsiellasp.DF14. Denitrification activity analysis showed that the soil nitrate was obviously decreased, and the soil nitrite was produced inoculation of df3 and df7.[Conclusion]There were aerobic denitrifiers in the soil samples. It has important scientific significance of the study.
Riparian forest, Aerobic denitrifying bacteria, Screening, Denitrification activity
2017-04-10
2017-06-01
韩晓丽(1983-),女(汉),山西霍州人,讲师,博士研究生,研究方向:森林土壤微生物功能及多样性
*通信作者:郭晋平,教授,博士生导师,Tel:13935406926;E-mail:jinpguo@sohu.com
山西农业大学科技创新基金(20132-14)
Q939.96
A
1671-8151(2017)08-0570-05

