壳聚糖衍生物手性固定相的制备及其分离性能
梁 爽,宾 琴,柏正武,陈 伟
武汉工程大学化学与环境工程学院,湖北 武汉 430205
壳聚糖衍生物手性固定相的制备及其分离性能
梁 爽,宾 琴,柏正武,陈 伟*
武汉工程大学化学与环境工程学院,湖北 武汉 430205
为研制新的手性分离材料,分别合成了壳聚糖-二(3,5-二甲基苯基氨基甲酸酯)-(苯甲酰胺)和壳聚糖-二(4-甲基苯基氨基甲酸酯)-(苯甲酰胺)两个衍生物.发现在壳聚糖的苯甲酰化中,当酸酐用量为壳聚糖结构单元摩尔数的6倍时,能制得完全苯甲酰化壳聚糖.将这两个壳聚糖衍生物涂覆于氨丙基硅胶表面制得两种手性固定相.以12个手性化合物为分析物在正己烷∕异丙醇,正己烷∕乙醇,正己烷∕甲醇∕乙醇流动相条件下,用高效液相色谱对两种手性固定相的分离性能进行了评价,分离结果表明,这两种手性固定相对所用的分析物有较好的手性识别性能.同时根据分离结果探讨了流动相组成对手性分离的影响.
壳聚糖;苯甲酰化;手性分离材料;高效液相色谱;手性识别
以手性固定相(chiral stationary phase,CSP)为基础的高效液相色谱法(high-performance liquid chromatography,HPLC)目前是拆分手性化合物对映体最有效的方法之一.其不仅能用于对映体含量的检测,还能用于制备级的分离[1-3].涂覆型多糖类固定相的手性分离能力强、负载量高,因而成为应用最广泛的手性分离材料[1].其中由Okamoto等研制的纤维素和直链淀粉衍生物涂覆型固定相被公认为具有最好的分离性能[4-6].但因纤维素和直链淀粉衍生物在乙酸乙酯、氯仿、四氢呋喃等有机溶剂中易溶解或高度溶胀,这类涂覆型手性固定相不能在含上述有机溶剂的流动相中使用,因此其在手性分离中的应用受到较大程度的限制[7-9].甲壳素与纤维素的结构十分相似,都是由β-D-葡萄糖通过1,4-β糖苷键连接而成,其高分子链均形成规整的螺旋结构[7].经脱乙酰后,甲壳素可转化为壳聚糖.据文献报道,甲壳素及壳聚糖衍生物在有机溶剂中的溶胀率小,难溶于有机溶剂,况且有些衍生物也有很好的手性识别能力,所以近年来,一些课题组相继报道了新的壳聚糖衍生物及其固定相,并且这些固定相在流动相中有很好的耐受性[10-13].在手性分离材料的研究领域中,仍需解决的问题是研制分离性能好且对有机溶剂有较强耐受性的手性选择体(chiral selector,CS),并阐明其手性识别的机制.
本文使用超高脱乙酰度壳聚糖为原料,合成了两种新的壳聚糖衍生物,即壳聚糖-二(3,5-二甲基苯基氨基甲酸酯)-(苯甲酰胺)和壳聚糖-二(4-甲基苯基氨基甲酸酯)-(苯甲酰胺),分别将其涂覆于氨丙基硅胶表面,制备成手性固定相,使用一系列手性化合物评价其手性分离性能,并根据分离结果探讨了流动相组分对手性分离的影响(见图1).

图1 N-苯甲酰壳聚糖衍生物手性固定相的制备Fig.1 Preparation scheme of CSPs of N-benzoylated chitosan derivatives
1 实验部分
1.1 仪器与材料
Alltech 1666色谱柱填充泵(美国Alltech公司);Vario EL III CHNOS元素分析仪(德国Ele⁃mentar公司);不锈钢空色谱柱250 mm×4.6 mm(美国热电集团);Agilent DD2 400 MHz核磁共振仪(美国安捷伦公司);Nicolet 5DX FT-IR红外光谱仪(美国尼高力公司);高效液相色谱仪系统(美国Waters公司).7 μm球形大孔硅胶(日本Daiso公司);甲壳素(潍坊海之源生物制品有限公司,工业级);苯甲酸酐(阿拉丁试剂有限公司,质量分数97%);正戊醇、硼氢化钠、N,N-二甲基乙酰胺、N,N-二甲基甲酰胺、甲苯、三乙胺、丙酮、甲醇、无水氯化锂、氢氧化钠等均为分析纯,与用作色谱流动相的有机溶剂均购自国药集团化学试剂有限公司;3-氨丙基三乙氧基硅烷(百灵威科技有限公司,分析纯);异氰酸酯(濮阳市宏达圣导新材料有限公司,质量分数99%).
1.2 手性选择体的制备
按 m(甲壳素)∕m(NaOH)∕m(正戊醇)=1∕5∕11(质量比)的比例将20.20 g干燥甲壳素置于500 mL三口瓶中,加入101 g NaOH和222.2 g正戊醇,加热至150℃,机械搅拌,回流3 h,过滤,洗至中性,烘干得14.25 g脱乙酰化的壳聚糖,产率:89%,参照文献[14],测得粘均分子量为 2.8×105;1H NMR(CF3COOD,δ∕化学位移):3.50~5.20(m,壳聚糖骨架H),2.25(CH3CO-);EA%:Calcd(C6H11NO4·0.5H2O)nC:43.57,H:6.99,N:8.41;Found C:43.20,H:7.18,N:7.70.脱乙酰度(degree of deacetylation,DD)为98%.
取1 g苯甲酸和30 g蒸馏水于250 mL的三口烧瓶中,加热搅拌至苯甲酸完全溶解,称取1.50 g壳聚糖于苯甲酸水溶液中,待其溶解.溶解后,边搅拌边加入80 mL甲醇,最后在25℃下加入19.45 g苯甲酸酐和70 mL甲醇,7 h后,反应结束,将所得反应液倾入500 mL的28.05 g∕L KOH-乙醇溶液中,搅拌2 h,静置过夜,过滤.用乙醇将产物洗至中性,干燥得2.25 g N-苯甲酰壳聚糖,产率:91%;1H NMR(CF3COOD,δ∕化学位移):7.56~7.85(t,5H,Ph-H),3.86-5.10(m,7H,壳聚糖骨架H);EA%:Calcd(C13H15NO5·1.0H2O)nC:54.94,H:6.06,N:4.97;Found C:54.89,H:6.32,N:5.19.
称取1.20 g干燥的LiCl和15 mL干燥的DMAc加于100 mL三口烧瓶中,加热至80℃使LiCl完全溶解,再加入1.0 g干燥的N-苯甲酰壳聚糖(3.9 mmol),溶解过夜.最后加入催化量的DMAP及 2.4 mL(20.0 mmol)4-甲基苯基异氰酸酯,于87℃下反应30 h.反应结束后,趁热逐滴加入至200 mL甲醇中得到沉淀物,过滤,干燥.将粗产物溶于15 mL DMF中,再在200 mL甲醇中进行重沉淀.如此重复操作4次,至滤液经薄层色谱检测不到有机物为止.干燥至恒重,得1.76 g壳聚糖-二(4-甲基苯基氨基甲酸酯)-(苯甲酰胺),即CS1,产率为:93%;IR(KBr,cm-1)υ:3 292~3 417(-NH),2857(-CH3),1732(-CO2-),1659(-CONH-),3 014~3 081,1 607(-Ph),1 524(-CONH-,- Ph);EA% :Calcd(C29H29N3O7·1.25H2O)nC:62.78,H:5.74,N:7.60;Found C:62.94,H:5.94,N:7.70.
以3,5-二甲基苯基异氰酸酯代替4-甲基苯基异氰酸酯,按上述方法制得壳聚糖-二(3,5-二甲基苯基氨基甲酸酯)-(苯甲酰胺),即CS2,产率:88%;IR(KBr,cm-1)υ:3 401(-NH),2 860(-CH3),1720(-CO2-),1649(-CONH-),3 052~3 103,1 614(-Ph),1 540(-CONH-,-Ph);EA%:Calcd(C31H33N3O7·0.5H2O)nC:65.41,H:6.04,N:7.41;Found C:65.70,H:6.27,N:7.22.
1.3 手性固定相的制备和填装
参照文献中的方法制备氨丙基硅胶[11].将CS1或CS2涂覆于氨丙基硅胶表面,干燥至恒重,即为CSP1或CSP2,涂敷量为16%.所得CSP1和CSP2均采用匀浆法装柱,顶替液为正己烷.
在25 ℃下,以V(正己烷)∕V(异丙醇)(90∕10,体积比)为流动相,流速为1 mL∕min的条件下分别使用联苯和1,3,5-三(叔丁基)苯为检测物,测定柱效和死时间(t0).容量因子 k=(tR-t0)∕t0,其中,tR为样品组分的保留时间,t0为1,3,5-三叔丁基苯的保留时间;分配因子α=k2∕k1,k1和 k2分别为两个对映体的容量因子,当α>1,即为手性识别;Rs=2(tR2-tR1)∕(w1+w2),其中tR为对映体色谱峰的保留时间,w为色谱峰的峰底宽,当RS≥1.50,两个对映体达到了基线分离.
2 结果与讨论
2.1 N-苯甲酰壳聚糖的制备
一般认为脱乙酰度为95%以上的壳聚糖为超高脱乙酰度壳聚糖[15].本文基于壳聚糖核磁共振氢谱上的积分面积比计算壳聚糖的脱乙酰度,计算结果显示D.D.约为98%.根据壳聚糖的脱乙酰度为98%计算出其元素分析的理论值.考虑到壳聚糖分子容易与水形成氢键从而吸附水分子,其元素分析计算结果实际上是加上水分子后的拟合值,在计算苯甲酰化壳聚糖和壳聚糖-二(甲基苯基氨基甲酸酯)-(本甲酰胺)元素分析的理论值时,也有相同的情况,即壳聚糖的D.D.为98%,每个结构单元结合了一定数量的水分子.其实D.D.为98%的壳聚糖和D.D.为100%的壳聚糖元素分析理论值非常接近,如前者的元素分析理论值分别是:C:43.57,H:6.99,N:8.41.而后者的则是 C:44.72,H:6.88,N:8.69.所以,在壳聚糖及其衍生物的表征中,元素分析的理论值是基于壳聚糖脱乙酰度为100%情况下的计算结果。
图2 是不同取代度的N-苯甲酰壳聚糖的1H NMR谱图.出当酸酐按照与壳聚糖结构单元等摩尔量投料时,所制备得到N-苯甲酰壳聚糖的1H NMR谱图如图2a所示,壳聚糖骨架氢质子个数与苯基质子个数的理论值之比应为7∕5,所以由图2a可知,苯甲酰基的实际取代度大约只有50%.当酸酐按照壳聚糖结构单元摩尔个数的6倍投料时,所制备的N-苯甲酰壳聚糖的1H NMR谱图如图2b所示,取代度达到100%,壳聚糖的氨基全部被苯甲酰化.而观察苯甲酰化壳聚糖的红外光谱图,发现没有明显的酯基峰,表明壳聚糖上的氨基被选择性地苯甲酰化,而羟基则没有被苯甲酰化生成相应的酯.
2.2 CSP1和CSP2的手性分离性能评价
使用联苯在V(正己烷)∕V(异丙醇)(90∕10,体积比)中测得CSP1的柱效为3.8×104理论塔板数,相应色谱峰的对称因子为1.07;CSP2的柱效为3.4×104,色谱峰的对称因子为1.09.
CSP1和CSP2的柱效都较为理想,均适用于色谱分离.图3为本文所使用的12个手性样品结构式,CSP1和CSP2对这些手性化合物的分离结果如表1所示.从表1可知,CSP1和CSP2对本文中选用手性样品都有较好的手性识别能力,两种固定相都识别了10个手性化合物,其中CSP1基线分离了3个,CSP2基线分离了5个.相对而言,CSP2的手性分离性能更好.此外,从表1中的数据还可以看出,CSP1和CSP2在一定程度上能起到互补的作用.如5号和8号样品均被CSP2识别而未被CSP1识别,在三种流动相条件下2号样品在CSP1上只能识别,而在CSP2上均能被基线分离;相反地,4号和10号样品只被CSP1识别,且10号样品在CSP1上能被基线分离.
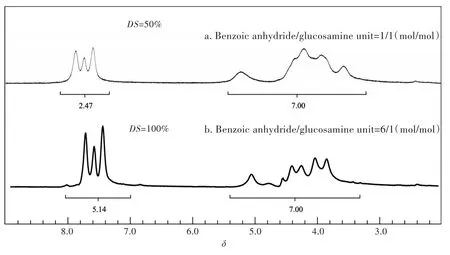
图2 不同投料比制备的N-苯甲酰壳聚糖的1H NMR谱图Fig.2 1H NMR spectra of N-benzoylated chitosans prepared by various fed ratios of benzoic anhydride
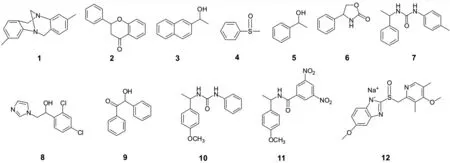
图3 手性分析物的结构式Fig.3 Structures of chiral analytes
2.3 流动相组成对手性分离性能的影响
从表1中的分离结果可以得出,CSP1和CSP2均在正己烷∕异丙醇这类流动相中能识别最多的手性样品,都能识别9个手性化合物,且保留时间最长.而在正己烷∕甲醇∕乙醇流动相中识别样品的数目均最少,CSP1只能识别5个,CSP2能识别8个.这可能是由于流动相中几种醇的极性和黏度的不同,使得手性样品在不同的流动相中的保留时间和扩散系数不同,从而导致同一手性样品在不同流动相组分中分离度不同[10].且醇中烃基的大小对手性选择体与手性样品之间的相互作用会有一定的影响,从而导致同一样品在相同CSP上的识别情况不同.如在CSP1上,4号样品只在正己烷∕异丙醇中被识别,而在CSP2上,6号样品只在正己烷∕甲醇∕乙醇中被识别.总而言之,对于CSP1和CSP2来说,由正己烷∕异丙醇组成的混液是最适合的流动相.

表1 CSP1及CSP2的手性分离比较Tab.1 Comparison of CSP1 and CSP2 in enanoseparation
3 结 语
本文将壳聚糖2-位上的氨基选择性地苯甲酰化,再用两种不同异氰酸酯修饰苯甲酰化壳聚糖上的羟基,分别制得壳聚糖-二(4-甲基苯基氨基甲酸酯)-(苯甲酰胺)和壳聚糖-二(3,5-二甲基苯基氨基甲酸酯)-(苯甲酰胺)两种衍生物.探索了苯甲酰化反应中酸酐的用量对产物取代度的影响,发现当酸酐的用量为壳聚糖结构单元摩尔数的6倍时,能制得完全苯甲酰基化的壳聚糖.将上述两种壳聚糖衍生物涂覆于氨丙基硅胶表面,得到两种手性固定相CSP1和CSP2.分离结果表明,CSP1和CSP12能识别相同数量的手性样品对映体,而CSP1能基线分离更多的手性样品.再则,这两种固定相在手性分离方面能起到相互补充的作用.通过比较这两种CSP在不同组分流动相中的分离结果可以发现,由正己烷和异丙醇组成的混合液是这两种固定相的最适流动相,而在由正己烷、甲醇和乙醇组成的流动相中,这两种固定相的手性识别性能则相对较差.
[1]CAVAZZINI A,PASTI L,MASSI A,et al.Recent applications in chiral high performance liquid chromatography: areview [J]. Analytica Chimica Acta,2011,706:205-222.
[2]OKAMOTO Y, IKAI T, SHEN J.Controlled immobilization of polysaccharide derivatives for efficient chiral separation[J]. Israel Journal of Chemistry,2011,51:1096-1106.
[3]魏文娟,张君毅,尹传奇,等.两种聚合物型手性固定相的分离特性[J].武汉工程大学学报,2008(3):1-3.WEIW J, ZHANG JY, YIN C Q, etal.Enantioseparation properties of two polymer type chiral stationary phases[J].Journal of Wuhan Institute of Technology,2008(3):1-3.
[4]OKAMOTO Y.Helical polymers for efficient enantiomer separation[J].Advances in Polymer Science,2013,261:391-414.
[5]KURKA O,KUCERA L,BEDNAR P.Analytical and semipreparative chiral separation of cis-itraconazole on cellulose stationary phases by high-performance liquid chromatography[J].Journal of Separation Science,2016,39:2736-2745.
[6]翁西伦,鲍宗必,罗飞,等.纤维素类手性色谱固定相的制备及其应用[J]. 化学进展,2014,26( 2 ∕3):415-423.WENG X L,BAO Z B,LUO F,et al.Preparation and application ofimmobilized chiralstationary phase bonded cellulose[J].Progress in Chemistry,2014,26(2 ∕3):415-423.
[7]IKAI T,YAMAMOTO C,KAMIGAITO M,et al.Immobilized-type chiral packing materials for HPLC based on polysaccharide derivatives[J].Journal of Chromatography B,2008,875:2-11.
[8]狄斌,赵敬丹,冯芳,等.键合型纤维素手性固定相的制备及应用[J]. 中国医科大学学报,2009,40(5):431-434.DI B,ZHAO J D,FENG F,et al.Preparation and application ofimmobilized chiralstationary phase bonded cellulos[J].Journal of China Pharmaceutical University,2009,40(5):431-434.
[9]涂鸿盛,范军,谭艺,等.新型键合纤维素手性固定相的制备及其拆分性能评价[J].色谱,2014,32(5):452-457.TU H S,FAN J,TAN Y,et al.Preparetion of new immobilized cellulose-based chiral stationry phase and its enantioseparation behaviors[J].Chinese Journal of Chromatography,2014,32(5):452-457.
[10]王晓晨.甲壳素及壳聚糖衍生物手性固定相的制备与性能[D].武汉:武汉工程大学,2015.
[11]WANG J,HUANG S H,CHEN W,et al.Eluent tolerance and enantioseparation recovery of chiral packing materials based on chitosan bis(phenylcarbamate) -(n-octyl urea) s for high performance liquid chromatography[J].Molecules,2016,21:1528-1541.
[12]TANG S,BIN Q,CHEN W,et al.Chiral stationary phases based on chitosan bis(methylphenylcarbamate) - (isobutyrylamide) for high-performance liquid chromatography[J].Jounal of Chromatography A,2016,1440:112-122.
[13]罗迎彬,王晓晨,陈伟,等.壳聚糖苯甲酰化衍生物固定相的制备及其手性识别[J].高分子学报,2014(8):1103-1109.LUO Y B,WANG X C,CHEN W,et al.Preparation and chiral recognition of chiral stationary phases derived from Benzoylated Chitosan[J].Acta Polymerica Sinica,2014(8):1103-1109.
[14]柏正武,付克勤,宾琴,等.不同分子量超高限度壳聚糖的制备[J]. 武汉工程大学学报,2014,36(8):16-19.BAI Z W,FU K Q,BIN Q,et al.Preparation of chitosan with various molecular weight and ultra-high degree of deacetylation[J].Journal of Wuhan Institute of Technology,2014,36(8):16-19.
[15]蒋挺大.壳聚糖[M].北京:化学工业出版社,2006.
本文编辑:张 瑞
Preparation and Enantioseparation Performance of Chiral Stationary Phases Derived from Chitosan Derivatives
LIANG Shuang,BIN Qing,BAI Zhengwu,CHEN Wei*
School of Chemistry and Environmental Engineering,Wuhan Institute of Technology,Wuhan 430205,China
To develop new materials for enantioseparation,chitosan bis(3,5-dimethylphenylcarbamate)-(benzamide) and chitosan bis(4-methylphenylcarbamate)-(benzamide) were prepared.With regard to the benzoylation of chitosan,the complete benzoylation was achieved when benzoic anhydride was fed at six equivalences of the glucosamine.The two chitosan derivatives were coated on the surface of aminopropyl silica gel,then the corresponding chiral stationary phases were obtained.The enantioseparation performance of the two chiral stationary phases was evaluated with 12 chiral compounds by high performance liquid chromatography in the mobile phases of n-hexane∕isopropanol,n-hexane∕ethanol and n-hexane∕methanol∕ethanol.The results show that the chiral stationary phases possess good chiral recognition capability towards the analytes.Meanwhile,the influence of the composition of the mobile phase on enantioseparation was discussed according to the separation results.
chitosan;benzoylation;chiral separation material;high performance liquid chromatography;chiral recognition
O636.9
A
10.3969∕j.issn.1674⁃2869.2017.04.003
2017-05-09
国家自然科学基金(51373127)
梁 爽,硕士研究生.E-mail:398520795@qq.com
*通讯作者:陈 伟,博士,副教授,硕士研究生导师.E-mail:50261295@qq.com
梁爽,宾琴,柏正武,等.壳聚糖衍生物手性固定相的制备及其分离性能[J].武汉工程大学学报,2017,39(4):320-325.
LIANG S,BIN Q,BAI Z W,et al.Preparation and enantioseparation capability of chiral stationary phases derived from chitosan derivatives[J].Journal of Wuhan Institute of Technology,2017,39(4):320-325.
1674-2869(2017)04-0320-06

